- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Этилен презентация
Содержание
- 1. Этилен
- 2. Содержание презентации
- 3. Содержание презентации 2
- 4. Содержание презентации 3 Получение
- 5. Содержание презентации 4 Выдув полиэтиленовой
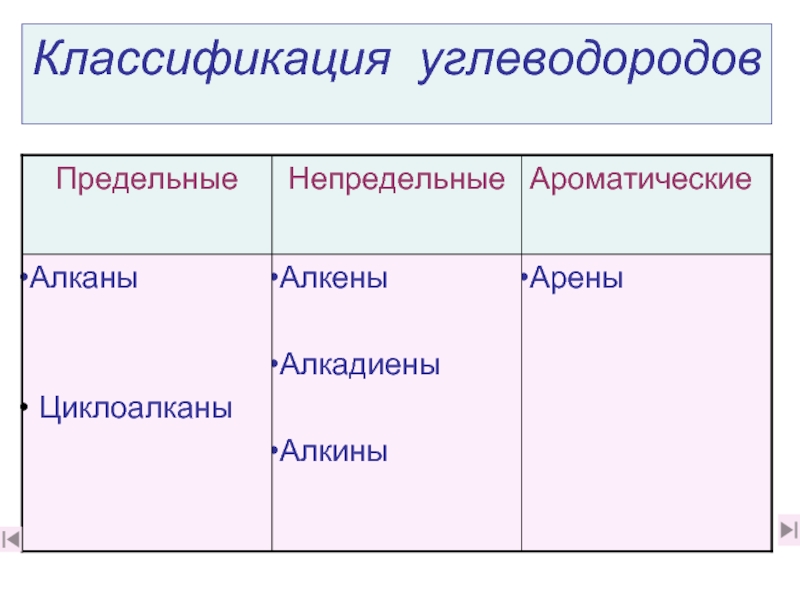
- 6. Классификация углеводородов
- 7. Этилен - непредельный углеводород
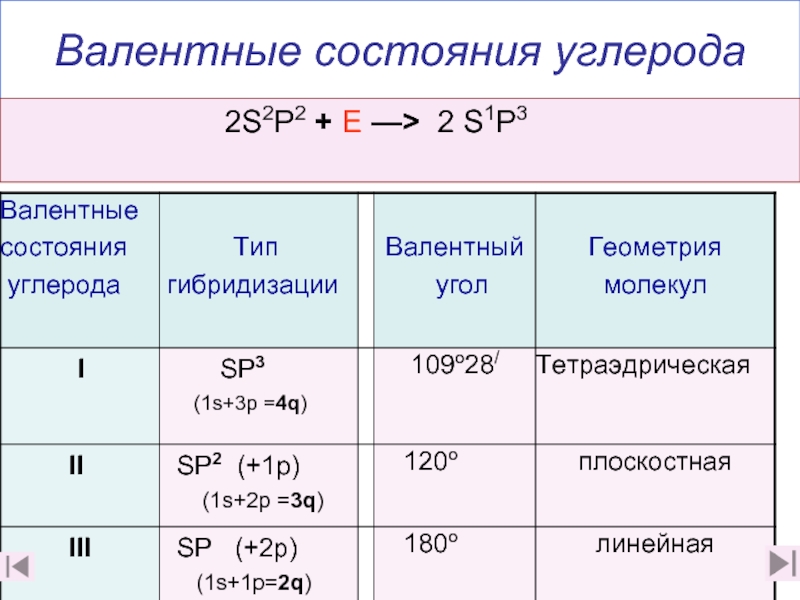
- 8. Валентные состояния углерода
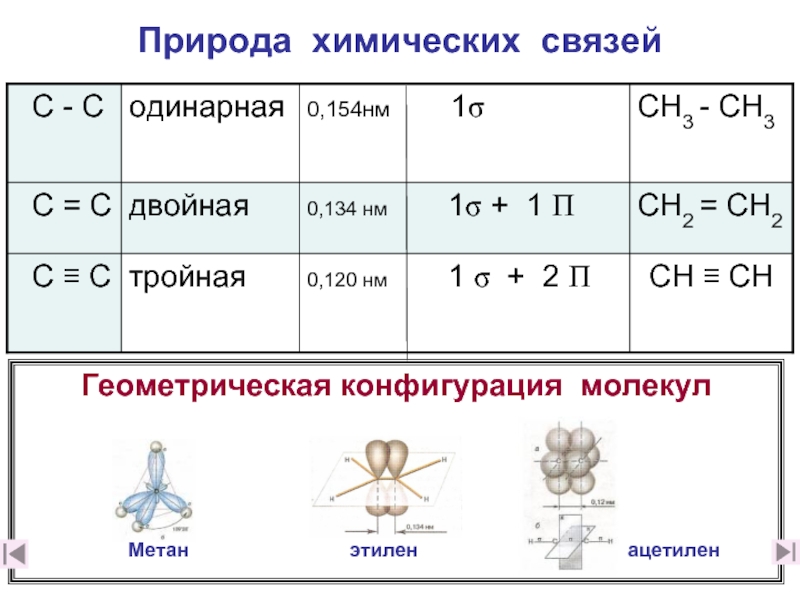
- 9. Природа химических связей
- 10. Модели молекулы этилена Масштабная модель (полусферическая) Шаростержневая модель
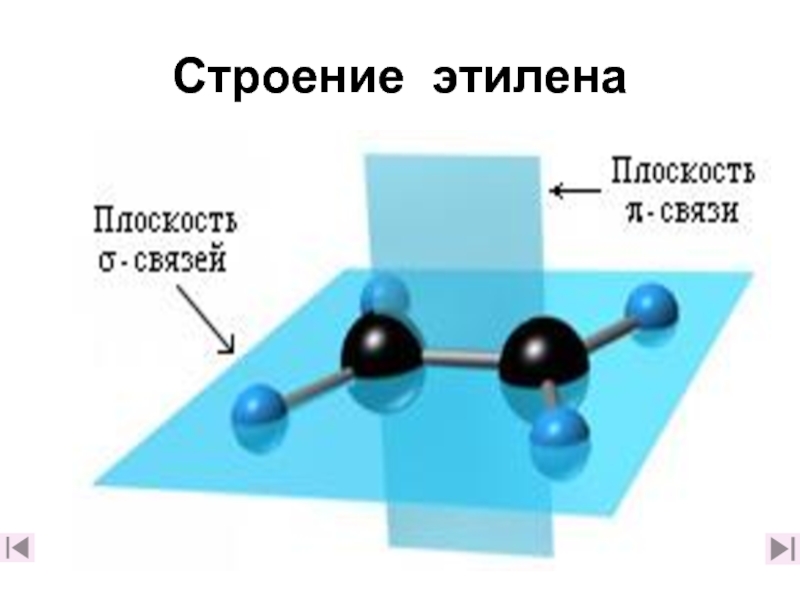
- 11. Строение этилена
- 12. Схемы образования химических связей в этилене Схема
- 13. π– связь в молекуле этилена
- 14. Образование двойной связи C = C
- 15. Атомно – орбитальная модель этилена
- 16. Двойная связь является сочетанием σ- и
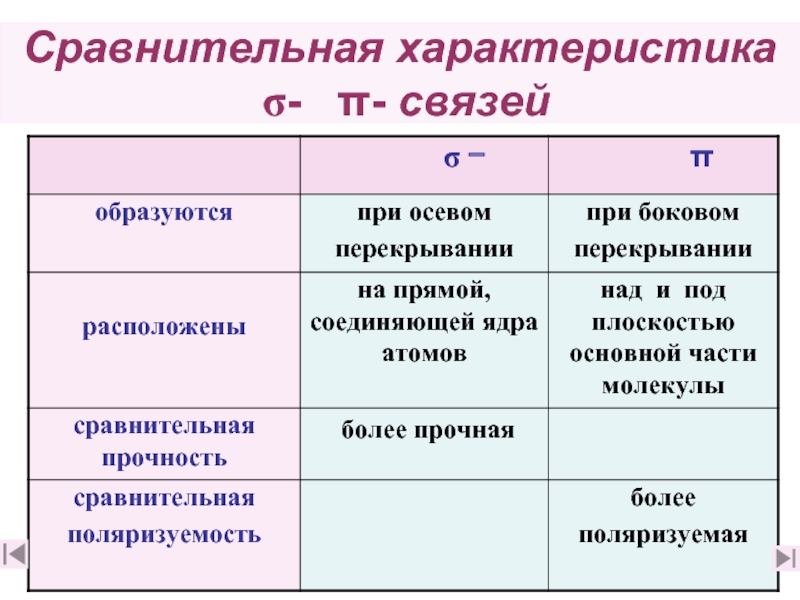
- 17. Сравнительная характеристика σ- π- связей
- 18. Описание электронного строения молекулы этилена Валентное состояние
- 19. Физические свойства
- 20. Знаете ли вы, что… этилен содержится в
- 22. Химические свойства этилена
- 23. К ним относятся,
- 24. Уравнения реакций присоединения СН2 = СН2
- 25. Ионный механизм реакции галогенирования этилена
- 26. Ионный механизм реакции гидрогалогенирования этилена
- 27. *Присоединение по правилу Марковникова ( для некоторых
- 28. 3) Реакции частичного окисления А. раствором КМnО4
- 29. Качественные реакции на π -
- 30. 4) Реакции частичного окисления Б.
- 31. Получение этилена в лаборатории Из спиртов (
- 32. Прибор для получения этилена из спирта в лаборатории
- 33. Практическая работа «Получение этилена и опыты с
- 34. Оформление практической работы Нарисуйте прибор для
- 35. Техника безопасности при проведении практической работы
- 36. Получение этилена
- 37. Взаимодействие этилена с перманганатом калия CН2 =
- 38. Горение этилена C2Н4 + 3О2 ═>
- 40. Промышленные синтезы на основе этилена
- 41. Получение этилена
- 42. Завод по производству этилена мощностью 300 тыс. т/год
- 43. Комплекс производства этилена и его производных на
- 44. Установка производства этилена ОАО "Нижнекамскнефтехим"
- 45. Установка производства этилена и полиэтилена ООО “Ново – Уренгойский” ГХК
- 46. Завод по производству этилена Завод «Этилен» является
- 47. Сферические газгольдеры - наземное газовое хранилище
- 48. Применение этилена и его соединений Используется
- 49. А.М. Бутлеров (1828 – 1886) открыл реакцию
- 50. n СН2 = СН2 ══> (
- 51. Продукт полимеризации этилена- твердое, белое вещество – полиэтилен
- 52. Выдув полиэтиленовой пленки
- 53. Производство ПЭ - труб
- 54. ПЭ - трубы для подземных систем водоотведения
- 55. ПЭ – трубы под землей
- 56. Теплицы из ПЭ
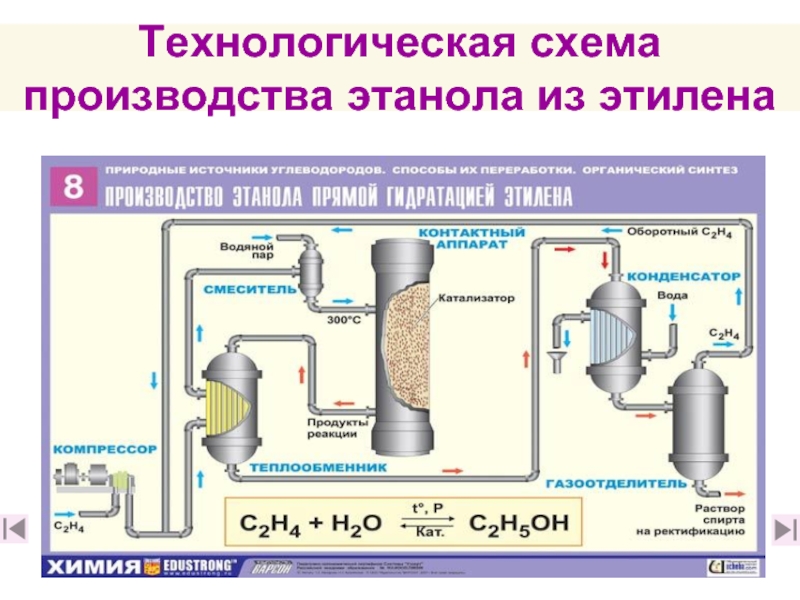
- 58. Технологическая схема производства этанола из этилена
- 59. Цех по гидратации этилена 16 октября
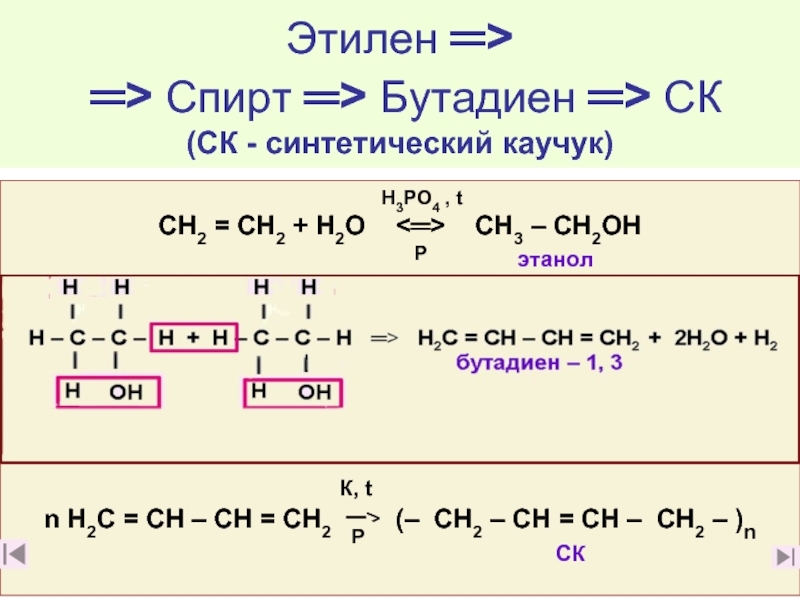
- 60. Этилен ═> ═> Спирт ═>
- 61. Сумгаитский завод синтетического каучука
- 62. Новочеркасский завод синтетических продуктов
- 63. Бутадиеновые каучуки и изделия из них
- 64. Синтетический каучук, называемый резиной
- 65. Антифриз (от греч. ἀντι- —
- 66. Завод по производству окиси этилена Г. Дзержинск ( Горьковская область)
- 67. Окись этилена ══>
- 68. Антифризы
- 69. Приложение «Вопросник» 1. Какова молекулярная
- 70. Автор работы Беляева Галина
Слайд 2 Содержание презентации 1
Классификация углеводородов
Этилен - непредельный
Валентные состояния углерода
Природа химических связей в этилена
Модели молекулы этилена
Строение этилена
Схемы образования химических связей в этилене
π – связь в молекуле этилена
Образование двойной связи C = C
Строение двойной связи С = С
Сравнительная характеристика s- π- связей
АтомноАтомно– орбитальная модель этилена
Описание электронного строения молекулы этилена
Физические свойства
Знаете ли вы, что…
Этилен в овощехранилище
Слайд 3 Содержание презентации 2
Химические свойства этилена
О реакциях присоединения
Уравнения
Ионный механизм реакции галогенирования этилена
Ионный механизм реакции гидрогалогенирования этилена
Присоединение по правилу Марковникова
Реакции частичного окисления этилена раствором перманганата калия
Качественные реакции на π – связь
Каталитическое окисление этилена кислородом воздуха
Получение этилена в лаборатории
Прибор для получения этилена из спирта в лаборатории
Практическая работа «Получение этилена и опыты с ним»
Оформление практической работы
Техника безопасности при проведении практической работы
Опыт «Получение этилена. Взаимодействие этилена с бромной водой»
Опыт «Взаимодействие этилена с раствором перманганата калия»
Опыт «Горение этилена»
Большая химия: этилен
Промышленные синтезы на основе этилена
Слайд 4 Содержание презентации 3
Получение этилена в промышленности
Завод по производству этилена
Комплекс производства этилена и его производных на базе углеводородного сырья ( фото)
Установка производства этилена и полиэтилена ООО “Ново – Уренгойский” ГХК (фото)
Установка производства этилена ОАО "Нижнекамскнефтехим" (фото)
Завод по производству этилена ОАО «Казань - оргсинтез» (фото)
Газгольдеры (фото)
Применение этилена и его соединений
Полиэтилен из этилена
О полиэтилене
Полиэтилен (фото)
Слайд 5 Содержание презентации 4
Выдув полиэтиленовой пленки (фото)
Производство ПЭ – труб
ПЭ - трубы для подземных систем водоотведения (фото)
ПЭ – трубы под землей (рисунок)
Теплицы из полиэтилена ( фото)
Спирт из этилена
Технологическая схема производства этанола из этилена
Цех по гидратации этилена(фото)
Как можно получить синтетический каучук из этилена
Сумгаитский Сумгаитский завод синтетического каучука (фото)
НовочеркасскийНовочеркасский завод синтетических продуктов (фото)
Бутадиеновые каучуки и изделия из них
Синтетический каучук, называемый резиной (фото)
Что такое антифриз
Завод по производству окиси этилена (фото)
Получение этиленгликоля из окиси этилена
Антифризы в продаже – «Прайд» и другие препараты (фото)
Приложение «Вопросник»
Автор работы
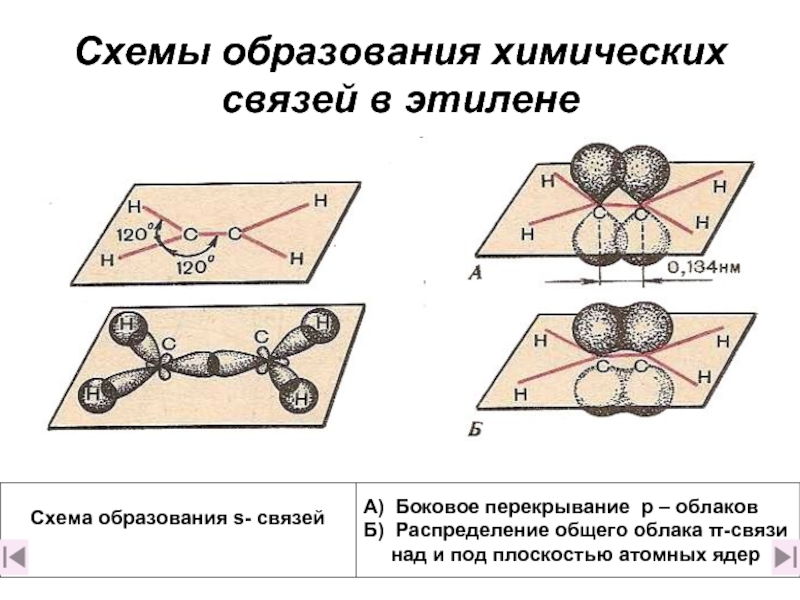
Слайд 12Схемы образования химических связей в этилене
Схема образования s- связей
А) Боковое перекрывание
Б) Распределение общего облака π-связи
над и под плоскостью атомных ядер
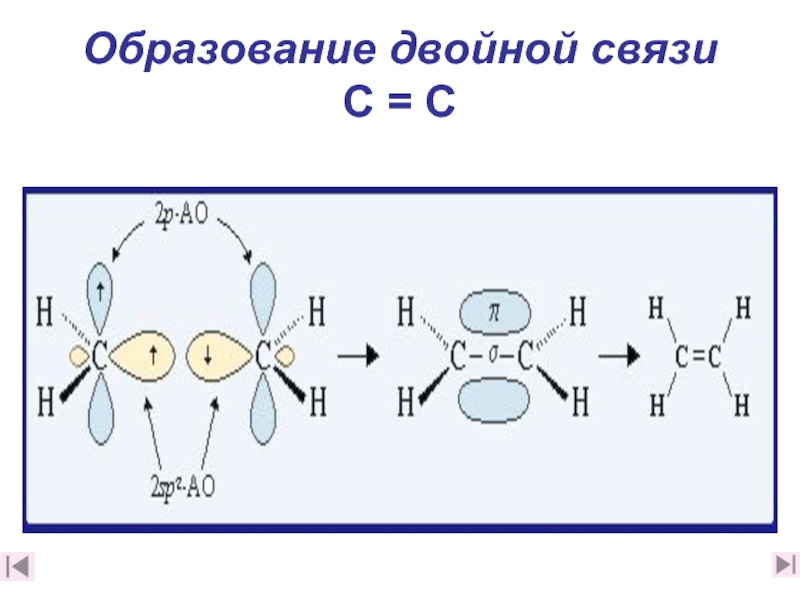
Слайд 16
Двойная связь является сочетанием σ- и π-связей (хотя она изображается двумя
Образование связей в молекуле этилена можно изобразить следующей схемой:
С = С ( σ- + π-связь )
σ-связь (перекрывание 2sp2-2sp2) и π-связь (2рz-2рz)
С – Н ( σ-связь )
σ-связь (перекрывание 2sp2-АО углерода и 1s-АО водорода)
Строение двойной связи С = С
Слайд 18Описание электронного строения молекулы этилена
Валентное состояние углерода – II
Тип гибридизации – sp2
Валентный угол - 1200
Геометрия молекулы - плоскостная
Особенности строения - наличие двойной связи
Природа двойной связи - (1σ + 1π)
Длина химической связи С = С - 0,134 нм
Слайд 19Физические свойства
газ ( при об. усл.)
Мr = 28
ρ = 1, 25 г /л ( при н.у.)
немного легче воздуха
tкип = - 103,7 0С
имеет слабый запах
малорастворим в воде
Этилен С2Н4
Слайд 20Знаете ли вы, что…
этилен содержится в коксовом газе (3 – 5
этилен образуется в незначительных
количествах в тканях растений и животных как промежуточный продукт обмена веществ; ингибирует биосинтез и функционирование регуляторов роста растений (ауксинов)
этилен используют для ускорения созревания
плодов, дефолиации растений, снижения преждевременного опадения плодов
Слайд 22Химические свойства
этилена
C2Н4 + 3О2 ═> 2СО2 + 2Н2О + Q
Этилен горит светящимся пламенем из - за
повышенного содержания углерода в нем
Светимость пламени вызывают
раскаленные частички угля, образующиеся
при распаде молекул этилена от нагревания
Раскаленные частицы угля полностью
сгорают в наружной части пламени
Слайд 23
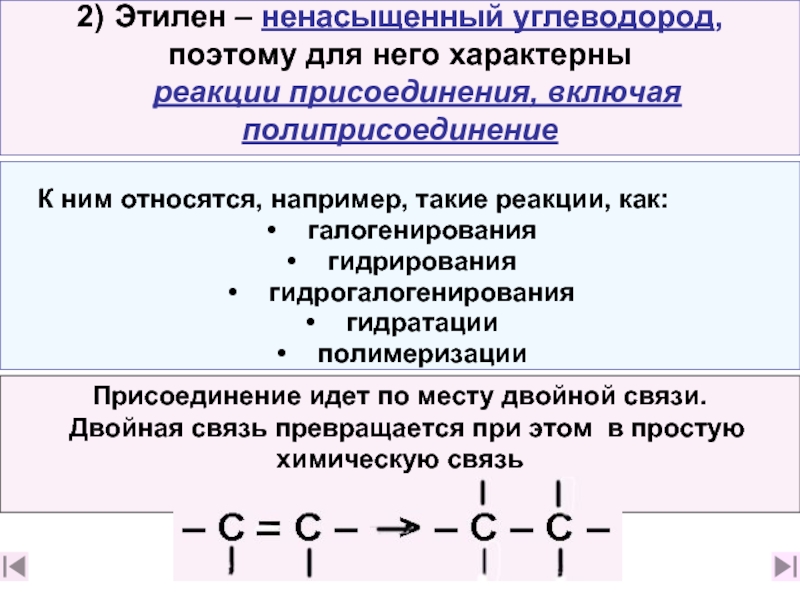
К ним относятся, например, такие реакции, как:
галогенирования
гидрогалогенирования
гидратации
полимеризации
2) Этилен – ненасыщенный углеводород,
поэтому для него характерны
реакции присоединения, включая полиприсоединение
Присоединение идет по месту двойной связи.
Двойная связь превращается при этом в простую химическую связь
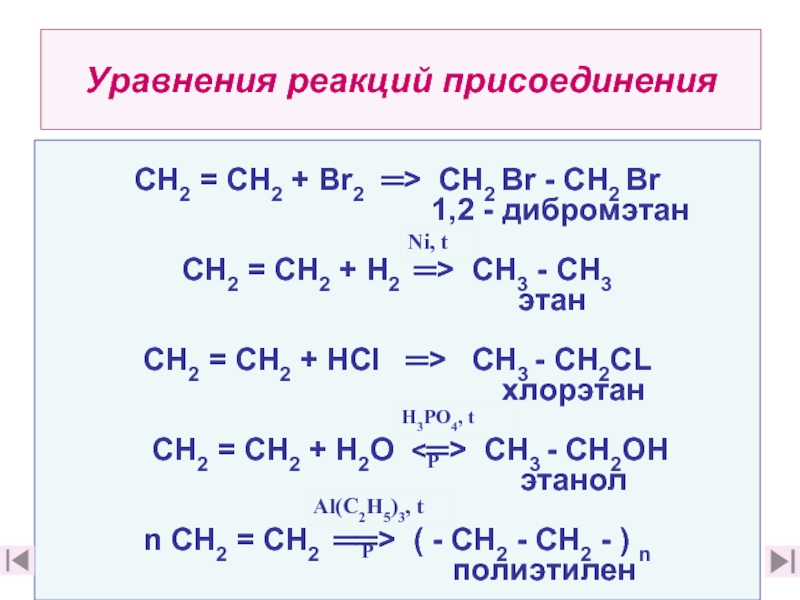
Слайд 24Уравнения реакций присоединения
СН2 = СН2 + Вr2 ═> СН2 Вr -
1,2 - дибромэтан
СН2 = СН2 + Н2 ═> СН3 - СН3
этан
СН2 = СН2 + НСl ═> СН3 - СН2CL
хлорэтан
СН2 = СН2 + Н2О <═> СН3 - СН2ОН
этанол
n СН2 = СН2 ══> ( - СН2 - СН2 - ) n
полиэтилен
Ni, t
P
Н3РО4, t
P
Al(C2H5)3, t
Слайд 25
Ионный механизм реакции
галогенирования этилена
СН2 = СН2 + Вr2 ═>
I стадия. Образование ионов
СН2 = СН2 + Вr | : Br ═> СН2 Вr - СН2 + Вr
II стадия. Взаимодействие ионов
СН2 Вr - СН2 + Вr ═> СН2 Вr - СН2 Вr
+
-
карбокатион
+
-
Слайд 26Ионный механизм реакции гидрогалогенирования этилена
I стадия. Образование ионов
СН2 = СН2 + Н | : Br ═> СН3 - СН2 + Вr
II стадия. Взаимодействие ионов
СН3 - СН2 + Вr ═> СН3 - СН2 Вr
+
-
карбокатион
+
-
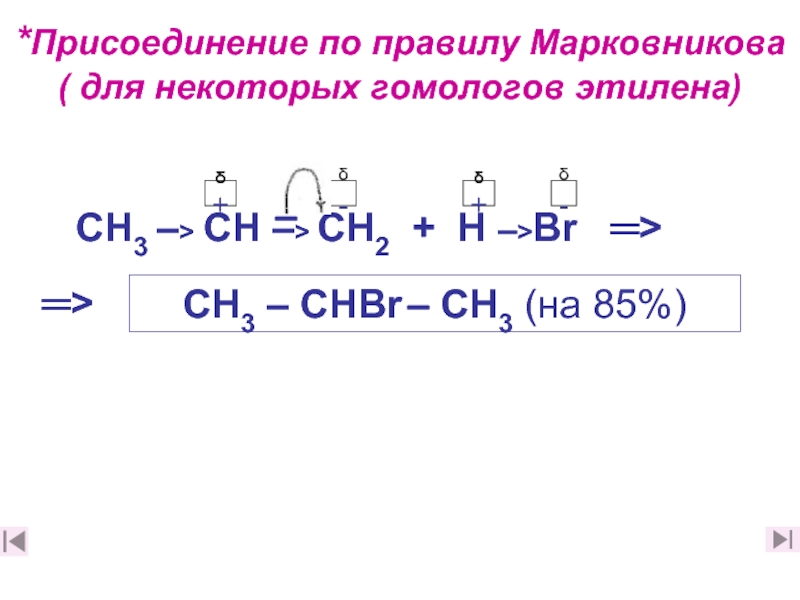
Слайд 27*Присоединение по правилу Марковникова
( для некоторых гомологов этилена)
СН3 –>
δ+
СН3 – СНВr – СН3 (на 85%)
δ+
δ-
–
δ-
═>
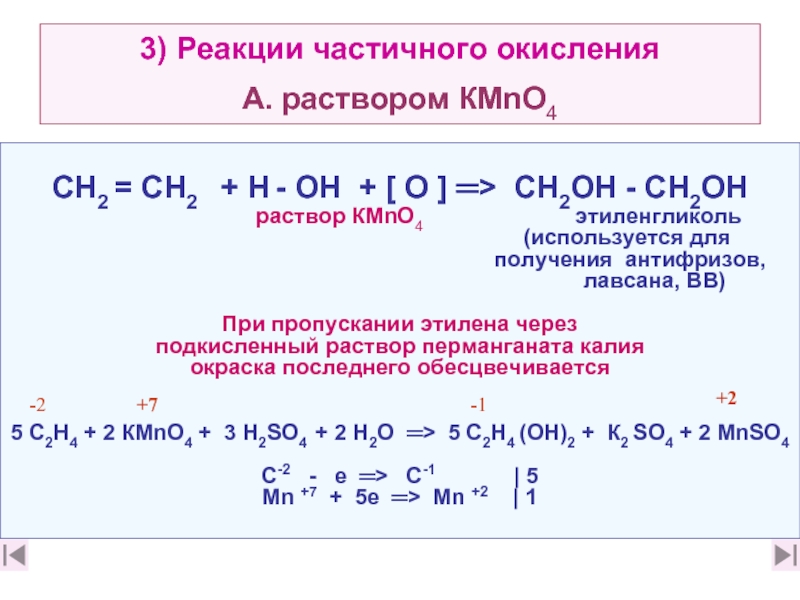
Слайд 283) Реакции частичного окисления
А. раствором КМnО4
CН2 = CН2 +
раствор КМnО4 этиленгликоль
(используется для
получения антифризов,
лавсана, ВВ)
При пропускании этилена через
подкисленный раствор перманганата калия
окраска последнего обесцвечивается
5 C2Н4 + 2 КМnO4 + 3 Н2SO4 + 2 Н2О ═> 5 С2Н4 (ОН)2 + К2 SO4 + 2 МnSО4
C-2 - е ═> С-1 | 5
Мn +7 + 5е ═> Мn +2 | 1
-2
+7
-1
+2
Слайд 29Качественные реакции на
π - связь
Непредельность характера углеводорода (наличие
с помощью следующих реакций
реакции бромирования (по обесцвечиванию бромной воды)
(см. слайд №36)
реакции окисления раствором КМnO4
(по обесцвечиванию
раствора перманганата калия)
π - связи при этом разрушаются
(см. слайд №37)
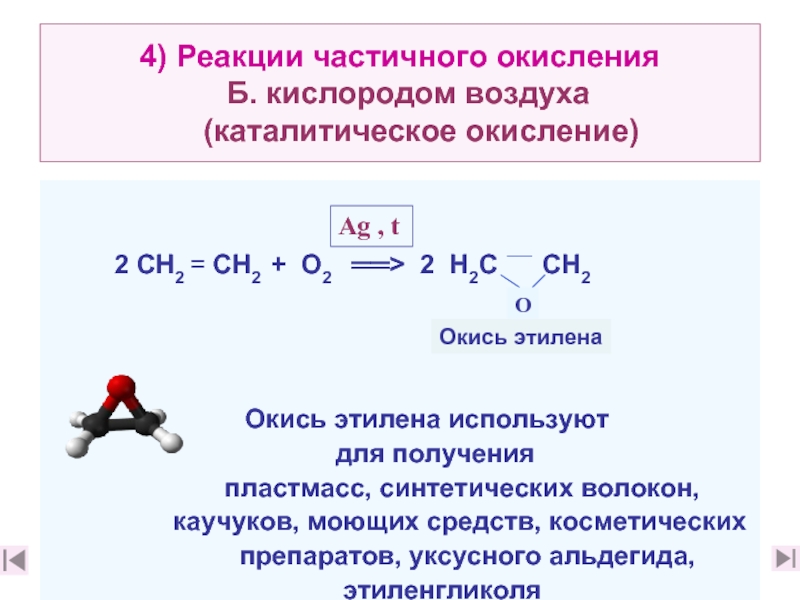
Слайд 304) Реакции частичного окисления Б. кислородом воздуха (каталитическое
2 CН2 = CН2 + О2 ══> 2 Н2С СН2
Окись этилена используют
для получения
пластмасс, синтетических волокон,
каучуков, моющих средств, косметических
препаратов, уксусного альдегида,
этиленгликоля
Аg , t
О
Окись этилена
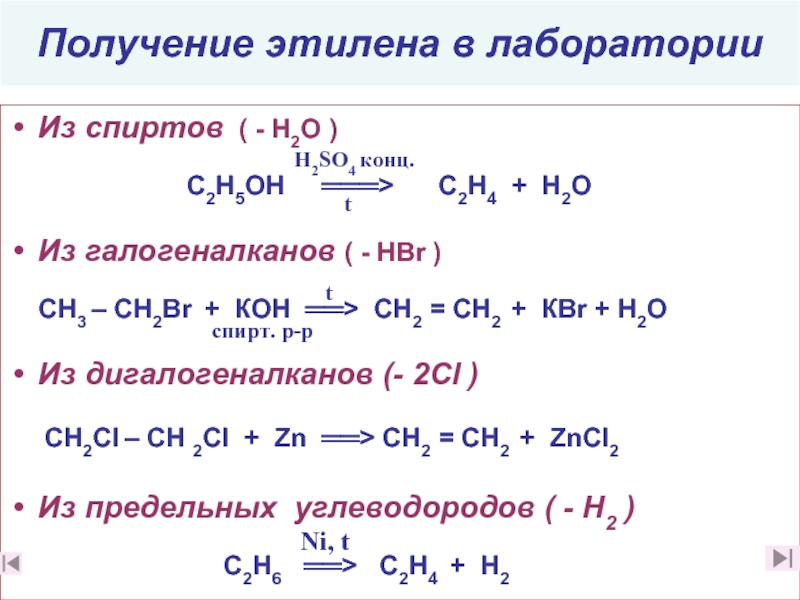
Слайд 31Получение этилена в лаборатории
Из спиртов ( - Н2О )
С2Н5ОН ═══> C2Н4 + Н2О
Из галогеналканов ( - НBr )
СН3 – СН2Br + КОН ══> СН2 = СН2 + КВr + Н2О
Из дигалогеналканов (- 2Cl )
СН2Сl – СН 2Cl + Zn ══> СН2 = СН2 + ZnCl2
Из предельных углеводородов ( - Н2 )
С2Н6 ══> С2Н4 + Н2
Н2SO4 конц.
Ni, t
t
t
спирт. р-р
Слайд 33Практическая работа «Получение этилена и опыты с ним»
Получения этилена
Взаимодействия этилена с бромной водой
Взаимодействия этилена с подкисленным раствором перманганата калия
Горения этилена
Техника эксперимента:
В одну пробирку всыпьте немного прокаленного кварцевого песка или пемзы, налейте 1 мл этилового спирта и осторожно добавьте 3 мл концентрированной серной кислоты. Закройте пробирку пробкой с газоотводной трубкой, закрепите ее в штативе и осторожно нагрейте
В другую пробирку налейте 2-3 мл бромной воды.
Опустите газоотводную трубку до дна пробирки с бромной водой и пропустите через нее выделяющийся газ. Следите при этом, чтобы нагревание смеси не прекращалось, иначе жидкость из пробирки перебросится в прибор
В третью пробирку налейте 2-3 мл разбавленного раствора перманганата калия, подкисленного серной кислотой, и пропустите через него газ
Подожгите выделяющийся газ. Для этого извлеките газоотводную трубку из раствора, измените положение газоотводной трубки, повернув ее отверстием кверху, подожгите выделяющийся газ
Потушите горелку. Выделение этилена постепенно прекратится
Слайд 34 Оформление практической работы
Нарисуйте прибор для получения этилена. Сделайте поясняющие надписи
Составьте
Какие химические свойства этилена вы исследовали на уроке? Запишите уравнения соответствующих реакций. Каким пламенем горит этилен? Отметьте признаки других химических реакций, которые вы наблюдали. Объясните все наблюдаемые вами явления.
Сделайте вывод о химическом характере этилена. Какие реакции, из проведенных вами, вы можете предложить для распознавания этилена и почему?
Слайд 35Техника безопасности
при проведении практической работы
Практическую работу выполняйте в халате. Обязательно используйте
Соблюдайте правила работы со спиртовкой. Помните, что этиловый спирт – ЛВЖ (легковоспламеняющаяся жидкость)!
Помните, что серная кислота – вещество «Едкое»! При попадании кислоты на кожу рук, необходимо сразу об этом сообщить учителю и многократно промыть обожженный участок водой, затем 3% раствором питьевой соды и вновь водой.
Во избежание получения термических и химических ожогов рабочую смесь нагревайте осторожно ! (нагрев умеренный!)
Рабочая смесь = этиловый спирт + серная кислота (концентрированная!)
Чтобы избежать толчков кипящей жидкой смеси, либо выбросов ее из реакционной пробирки прибора, изначально к рабочей смеси добавьте прокаленного кварцевого песка или пемзы
Извлекайте газоотводную трубку из раствора и направляйте ее отверстием кверху осторожно, не прекращая умеренного нагревания рабочей смеси
( конец газоотводной трубки должен быть соединен с основной ее частью гибкой резиновой трубкой!)
Поджигайте выделяющийся этилен сбоку струи газа, во избежание задувания пламени!
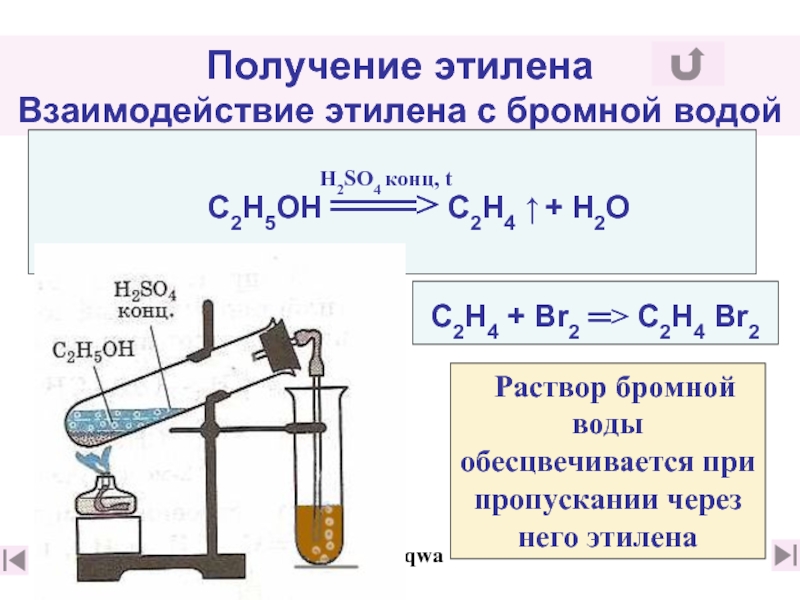
Слайд 36Получение этилена
С2Н4 + Вr2 ═> С2Н4 Вr2
С2Н5ОН ═══> C2Н4 ↑ + Н2О
Раствор бромной воды обесцвечивается при пропускании через него этилена
Н2SO4 конц, t
Вr2 aqwa
Слайд 37Взаимодействие этилена с перманганатом калия
CН2 = CН2 + Н -
Раствор перманганата калия обесцвечивается при пропускании через него этилена
р-р КМnО4
Подкисленный р-р КМnО4
Слайд 38Горение этилена
C2Н4 + 3О2 ═> 2СО2 + 2Н2О + Q
В
этилен горит светящимся
пламенем, что
обуславливается
повышенным содержанием
углерода
Слайд 40Промышленные синтезы
на основе этилена
Из этилена в промышленности
полиэтилен
сополимеры ( например, с пропиленом)
окись этилена
этанол
этилбензол
ацетальдегид
винилхлорид
винилацетат
дихлорэтан
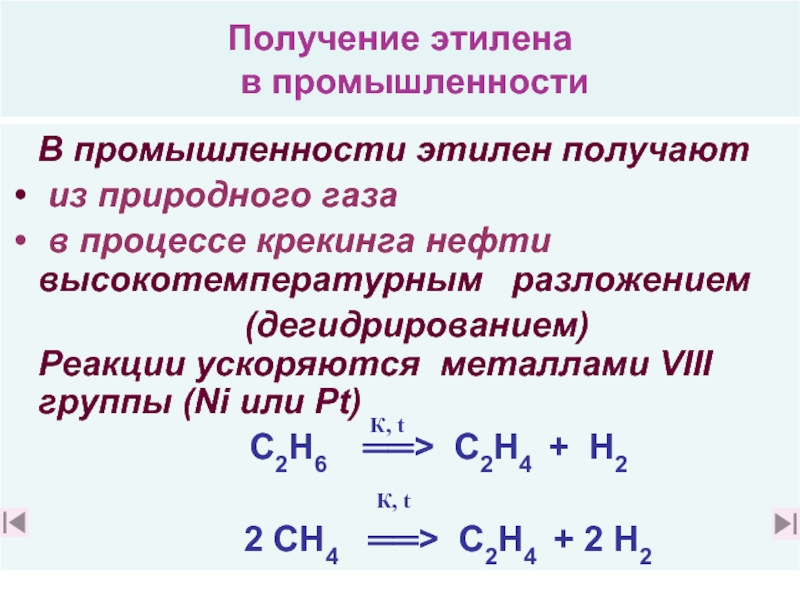
Слайд 41Получение этилена
В промышленности этилен получают
из природного газа
в процессе крекинга нефти высокотемпературным разложением
(дегидрированием) Реакции ускоряются металлами VIII группы (Ni или Pt)
С2Н6 ══> С2Н4 + Н2
2 СН4 ══> С2Н4 + 2 Н2
К, t
К, t
Слайд 43Комплекс производства этилена и его производных на базе углеводородного сырья
Комплекс
Слайд 44Установка производства этилена
ОАО "Нижнекамскнефтехим"
Мощность:
Дата ввода в эксплуатацию: 2008 год
Слайд 46Завод по производству этилена
Завод «Этилен» является первым в технологической цепочке ОАО
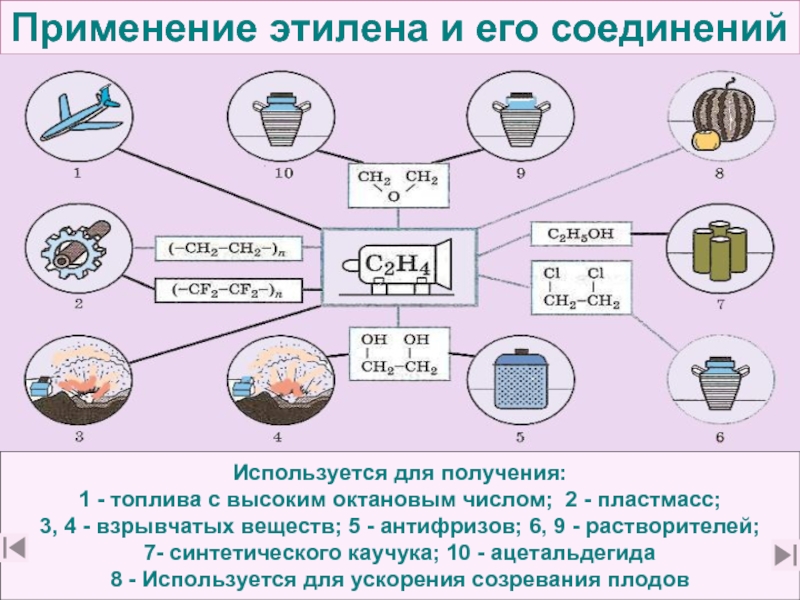
Слайд 48Применение этилена и его соединений
Используется для получения:
1 - топлива с высоким
3, 4 - взрывчатых веществ; 5 - антифризов; 6, 9 - растворителей;
7- синтетического каучука; 10 - ацетальдегида
8 - Используется для ускорения созревания плодов
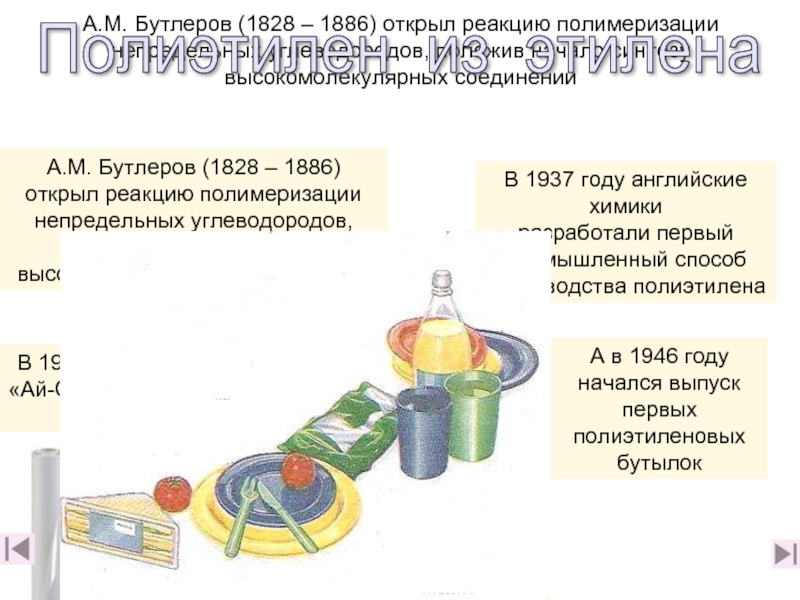
Слайд 49А.М. Бутлеров (1828 – 1886) открыл реакцию полимеризации непредельных углеводородов, положив
А.М. Бутлеров (1828 – 1886) открыл реакцию полимеризации непредельных углеводородов, положив начало синтезу высокомолекулярных соединений
В 1937 году английские химики
разработали первый промышленный способ производства полиэтилена
А в 1946 году начался выпуск
первых полиэтиленовых бутылок
Полиэтилен из этилена
В 1933 году на фирме
«Ай-Си-Ай» был открыт
полиэтилен
Слайд 50
n СН2 = СН2 ══> ( - СН2 - СН2 -
этилен полиэтилен
В настоящее время полиэтилен – один из самых распространенных синтетических полимеров. Это и всем известная полиэтиленовая пленка – прекрасный упаковочный материал, и неподдающиеся коррозии полиэтиленовые трубы, и легкая, удобная в обращении посуда
n СН2 = СН2 ══> ( - СН2 - СН2 - )
этилен полиэтилен
При высоком давлении образуется полиэтилен низкой плотности и прочности, а при низком - наоборот
Слайд 57
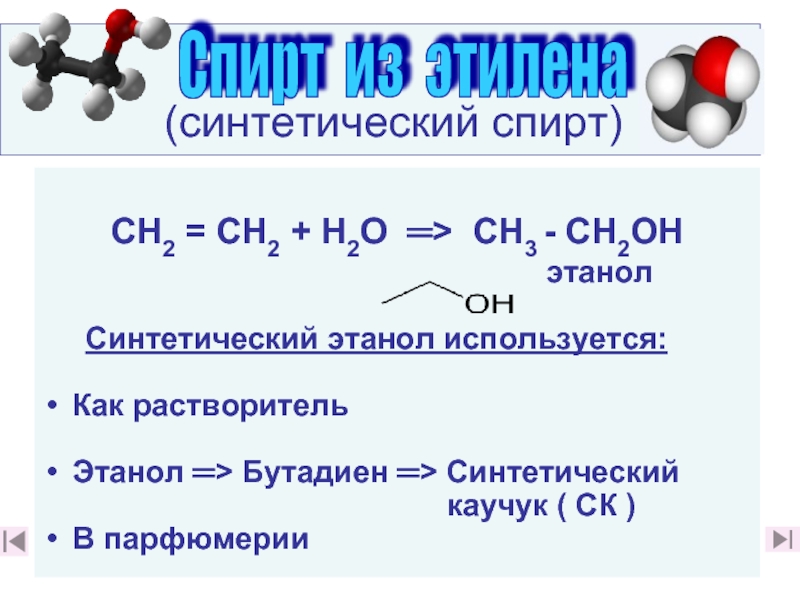
СН2 = СН2 + Н2О ═> СН3 - СН2ОН
этанол
Синтетический этанол используется:
Как растворитель
Этанол ═> Бутадиен ═> Синтетический
каучук ( СК )
В парфюмерии
Спирт из этилена
Слайд 59Цех по гидратации этилена
16 октября 1956 года первенец башкирской нефтехимии -
Слайд 60Этилен ═> ═> Спирт ═> Бутадиен ═> СК (СК - синтетический
Н3РО4 , t
СН2 = СН2 + Н2О <═> СН3 – СН2ОН
этанол
n H2С = СН – СН = СН2 ═> (– СН2 – СН = СН – СН2 – )n
СК
Р
К, t
Р
К, t
Слайд 65 Антифриз (от греч. ἀντι- — против и англ. freeze — замерзать) —
Антифриз
Раствор, содержащий
25% этиленгликоля, замерзает при - 120С
55% этиленгликоля, замерзает при - 400С
Слайд 67
Окись этилена ══> этиленгликоль
В промышленности этиленгликоль получают некаталитической
Другой метод: реакция окиси этилена и CO2
с промежуточным получением этиленкарбоната (температура 80—120 °C и давление 2—5 МПа) и его последующий гидролиз с декарбоксилированием
Слайд 69Приложение «Вопросник»
1. Какова молекулярная формула этилена? К какой группе углеводородов
2. Каковы особенности строения этилена? (слайды 7-10,2. Каковы особенности строения этилена? (слайды 7-10,182. Каковы особенности строения этилена? (слайды 7-10,18)
3. Какую геометрическую форму имеет этилен и почему? (слайд 9)
4. Какова природа двойной связи? (слайды 11-16)
5. Чем отличаются σ– и π– связи? (слайд 17)
6. Какая связь прочнее: а) одинарная или б) двойная и почему? (слайд 17)
7. Дайте краткое описание электронного строения этилена (слайд 18)
8. Перечислите физические свойства этилена (слайд 19)
9. Что вам известно о распространенности этилена в природе? ( слайды 209. Что вам известно о распространенности этилена в природе? ( слайды 20, 219. Что вам известно о распространенности этилена в природе? ( слайды 20, 21)
10. Перечислите химические свойства этилена (слайд 22)
11. Какие типы реакций отвечают особенностям строения этилена, почему? (слайд 11. Какие типы реакций отвечают особенностям строения этилена, почему? (слайд 23)
12. Приведите примеры химических реакций, характерных для этилена ( слайды 23, 24, 12. Приведите примеры химических реакций, характерных для этилена ( слайды 23, 24, 2812. Приведите примеры химических реакций, характерных для этилена ( слайды 23, 24, 28,30)
13. Какие реакции можно использовать для подтверждения непредельного
характера этилена? Каковы признаки этих реакций? (слайды 28 характера этилена? Каковы признаки этих реакций? (слайды 28, 29, характера этилена? Каковы признаки этих реакций? (слайды 28, 29, 36, 37)
14. По какому механизму протекают реакции бромирования и гидрогалогенирования
этилена и его некоторых гомологов? (слайды 25 этилена и его некоторых гомологов? (слайды 25, этилена и его некоторых гомологов? (слайды 25, 26 этилена и его некоторых гомологов? (слайды 25, 26, 27)
15. Из каких веществ и в ходе каких реакций можно получить этилен в лаборатории?
(слайды 31 (слайды 31, 32)
16. Какие безопасные опыты с этиленом можно провести в лаборатории? (слайды 33 - 38)
17. Почему этилен относят к веществам «Большой химии»? (слайды 3917. Почему этилен относят к веществам «Большой химии»? (слайды 39, 40)
18. Какое сырье можно использовать для промышленного получения этилена
и какие реакции лежат в основе его получения? (слайд 41)
19. Какой мощности заводы по производству этилена функционируют в России? (слайды 42 19. Какой мощности заводы по производству этилена функционируют в России? (слайды 42 -4419. Какой мощности заводы по производству этилена функционируют в России? (слайды 42 -44- 46)
20. Какие производства на основе этилена известны вам? (слайд 40)
21. Какие химические производства на основе этилена и его соединений вы считаете наиболее
важными важными для народного хозяйства и почему? (слайды 48 - 68)
Слайд 70
Автор работы
Беляева
Галина Брониславовна
учитель химии
ГОУ СОШ №1212
с углубленным изучением





















![Взаимодействие этилена с перманганатом калияCН2 = CН2 + Н - ОН + [ О ]](/img/tmb/2/178883/f336001f878d19fce88cfbe5c8c00551-800x.jpg)