- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Проектная работа: Периодическая система химических элементов в Power Point Выполнила: выпускница 11 класса Орлова Ольга Сергеевна Руководитель: учитель химии Бочкарёва Алла Александровна презентация
Содержание
- 1. Проектная работа: Периодическая система химических элементов в Power Point Выполнила: выпускница 11 класса Орлова Ольга Сергеевна Руководитель: учитель химии Бочкарёва Алла Александровна
- 2. 09/06/2018 Орлова Ольга Сергеевна
- 3. 09/06/2018 Орлова Ольга Сергеевна 3 3
- 4. 09/06/2018 Орлова Ольга Сергеевна
- 5. 09/06/2018 Орлова Ольга Сергеевна 1. Электронное
- 6. 09/06/2018 Орлова Ольга Сергеевна 2.Физические свойства
- 7. 09/06/2018 Орлова Ольга Сергеевна 2.Физические свойства
- 8. 09/06/2018 Орлова Ольга Сергеевна 3.Химические свойства
- 9. 09/06/2018 Орлова Ольга Сергеевна 3.Химические свойства
- 10. 09/06/2018 Орлова Ольга Сергеевна 3.Химические свойства
- 11. 09/06/2018 Орлова Ольга Сергеевна 3.Химические свойства
- 12. 09/06/2018 Орлова Ольга Сергеевна 3.Химические свойства
- 13. 09/06/2018 Орлова Ольга Сергеевна 4.Применение Магний
- 14. 09/06/2018 Орлова Ольга Сергеевна 5. Проверка
Слайд 109/06/2018
Орлова Ольга Сергеевна
Ленинградская область. Киришский район.
МОУ Пчевжинская СОШ.
Периодическая система химических элементов в Power Point
Выполнила:
выпускница 11 класса Орлова Ольга Сергеевна
Руководитель:
учитель химии
Бочкарёва Алла Александровна
Слайд 309/06/2018
Орлова Ольга Сергеевна
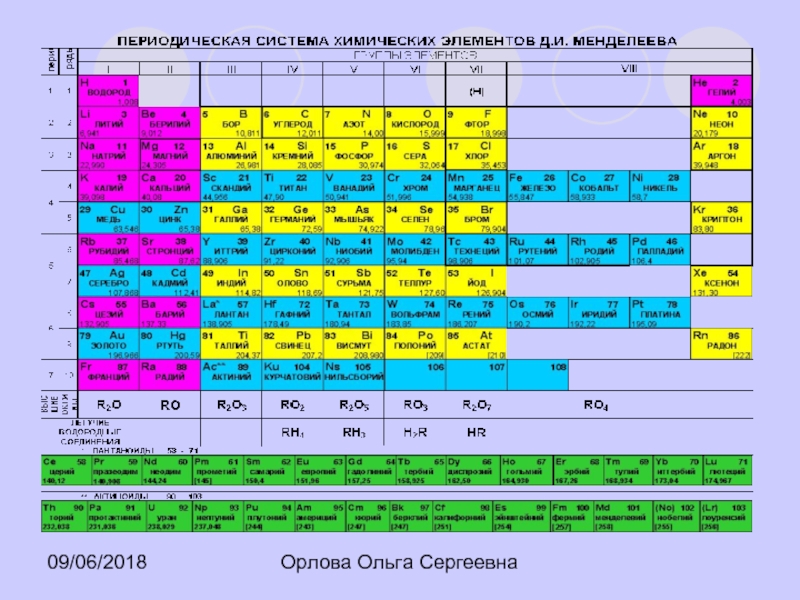
3
3
I
II
III
IV
Группы элементов
1
1
2
V
VI
VII
VIII
2
Периоды
Ряды
4
5
6
7
4
5
6
7
8
9
10
Mg
+12
24
0
Слайд 409/06/2018
Орлова Ольга Сергеевна
1. Электронное строение
2. Физические свойства
3. Химические свойства
4. Применение
5. Проверка
Магний
Слайд 509/06/2018
Орлова Ольга Сергеевна
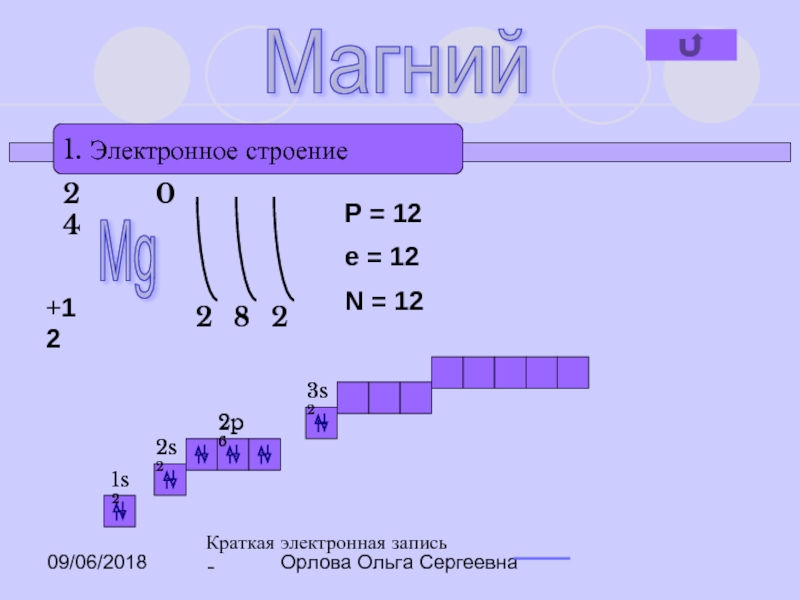
1. Электронное строение
Mg
+12
24
0
2
8
2
P = 12
e = 12
N =
1s2
2s2
2p6
3s2
Краткая электронная запись -
1s2
2s2
2p6
3s2
Магний
Слайд 609/06/2018
Орлова Ольга Сергеевна
2.Физические свойства
Магний
мягкий
пластичный
ковкий.
В 1,5 раза легче алюминия
Слайд 709/06/2018
Орлова Ольга Сергеевна
2.Физические свойства
Магний
Магний – серебристо-белый блестящий металл, сравнительно мягкий, пластичный
Слайд 809/06/2018
Орлова Ольга Сергеевна
3.Химические свойства
Магний
2Mg(к) + O2(г) = 2MgO(к)
3Mg(к) + N2(т) =
Mg + 2H2O = Mg(OH)2 + H2
2Mg + CO2 = 2MgO + C
Mg + 2NH4Cl = MgCl2 + 2NH3– + H2
Mg + 2H3O+ = Mg2+ + H2 + 2H2O
Mg + Br2 = MgBr2
Mg + S = MgS
Слайд 909/06/2018
Орлова Ольга Сергеевна
3.Химические свойства
Магний
В обычных условиях магний устойчив к окислению за
2Mg(к) + O2(г) = 2MgO(к)
3Mg(к) + N2(т) = Mg3N2(к)
Слайд 1009/06/2018
Орлова Ольга Сергеевна
3.Химические свойства
Магний
При действии водорода под давлением 200 атм при
Mg + 2H2O = Mg(OH)2 + H2
Если ленту магния поджечь и опустить в стакан с водой, то горение металла продолжается. При этом выделяющийся при взаимодействии магния с водой водород немедленно загорается на воздухе. Горение магния продолжается и в атмосфере углекислого газа:
2Mg + CO2 = 2MgO + C
Слайд 1109/06/2018
Орлова Ольга Сергеевна
3.Химические свойства
Магний
Оксидная пленка на поверхности магния не устойчива в
Mg + 2NH4Cl = MgCl2 + 2NH3– + H2
При действии водяного пара продуктами являются оксид или гидроксид магния и водород.
Магний легко реагирует с кислотами, давая соответствующие соли:
Mg + 2H3O+ = Mg2+ + H2 + 2H2O
Слайд 1209/06/2018
Орлова Ольга Сергеевна
3.Химические свойства
Магний
Холодные концентрированные азотная и серная кислоты пассивируют магний.
Mg + Br2 = MgBr2
При нагревании магний вступает во взаимодействие с серой, давая сульфид магния:
Mg + S = MgS
Слайд 1309/06/2018
Орлова Ольга Сергеевна
4.Применение
Магний
Особенно широко применяют сплавы магния с алюминием, цинком и
Слайд 1409/06/2018
Орлова Ольга Сергеевна
5. Проверка знаний
А
Б
В
Г
Вопрос 1
Вопрос 2
Вопрос 3
Вопрос 4
Вопрос 5
Спасибо за
Магний