- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Стукурная организация белка презентация
Содержание
- 1. Стукурная организация белка
- 2. История изучения Белки были выделены в отдельный
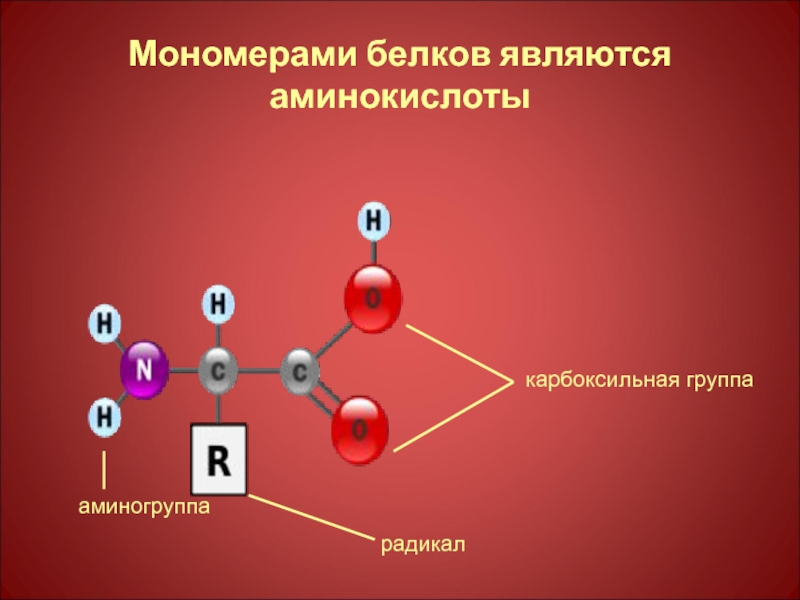
- 3. Мономерами белков являются аминокислоты карбоксильная группа радикал аминогруппа
- 4. Олигопептиды содержат до 20 амк (среди них
- 5. Образование пептидной связи Схематическое изображение образования пептидной
- 6. Свойства белков
- 7. - Амфотерность - Способность к ионизации в
- 8. Классификация белков По химическому строению простые; сложные;
- 9. Классификация белков По молекулярной массе низкомолекулярные высокомолекулярные
- 10. Классификация белков По молекулярной массе низкомолекулярные Высокомолекулярные
- 11. Классификация белков По возможности адаптативно регулировать
- 12. Особенности первичной структуры В остове полипептидной цепи
- 13. Пептидная связь – образуется при взаимодействии аминогруппы
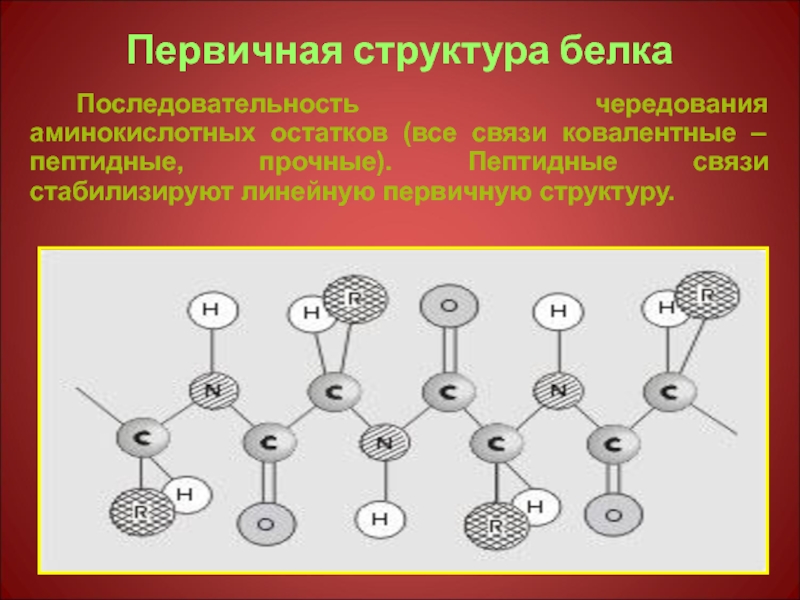
- 14. Первичная структура белка Последовательность чередования аминокислотных остатков
- 15. Особенности первичной структуры В остове полипептидной цепи
- 16. Особенности пептидной связи Компланарность – все атомы,
- 17. Последовательность изучения первичной структуры белков. Расщепление полипептидной
- 18. К слабым взаимодействиям относят: Водородные связи –
- 19. Вторичная структура Вторичная структура это пространственная
- 20. α спирализация – это закручивание полипептидно остова
- 21. ά-спираль Водородные связи формируют трехмерную вторичную структуру
- 22. Спираль-клубочек Содержание ά-спирали в белках неодинаково и
- 23. Основные особенности ά-спирали Спиральная конфигурация полипептидной цепи
- 24. Некоторые фибриллярные белки образуют конформацию β –
- 25. β-структура – Складчатого типа, водородные связи
- 27. β – структура
- 29. Связи, поддерживающие вторичную структуру: водородные электростатические гидрофобные ван-дер-ваальсовые
- 30. Водородные: 1) N
- 31. Домены Это более сложные уровни организации
- 32. Доменная организация характерна для многих белков. В
- 33. Третичная структура- Третичная структура- это способ укладки полипептидной цепи в определенном объеме пространства.
- 34. Третичная структура поддерживается большим числом слабых связей,
- 35. Третичная структура белка Это реальная трехмерная конфигурация,
- 36. Связи, стабилизирующие третичную структуру белка Ковалентные -
- 37. 2. Полярные – слабые: водородные – между
- 38. Особенности организации третичной структуры. Конформация третичной структуры
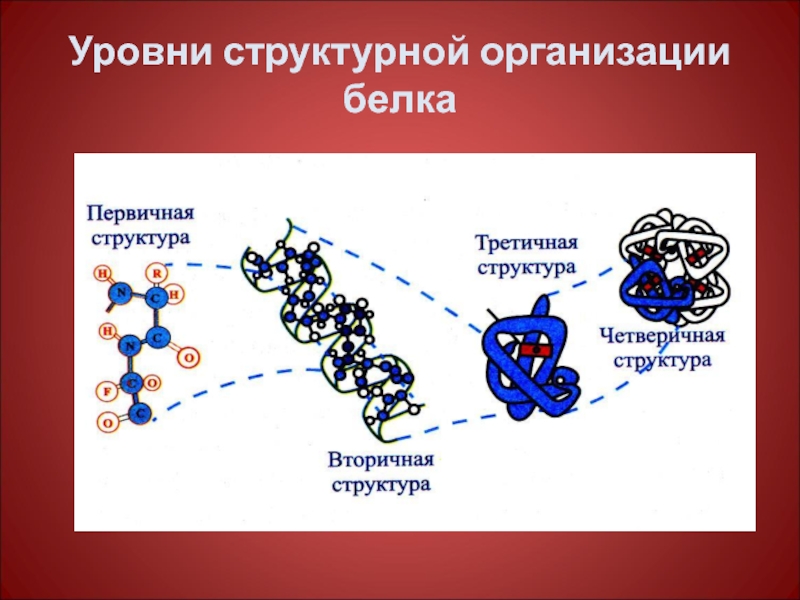
- 39. Уровни структурной организации белка
- 40. Четвертичная структура Четвертичная структура – это способ
- 41. Стабилизация четвертичной структуры белков. В стабилизации четвертичной
- 43. Структура белка Кроме последовательности аминокислот полипептида (первичной
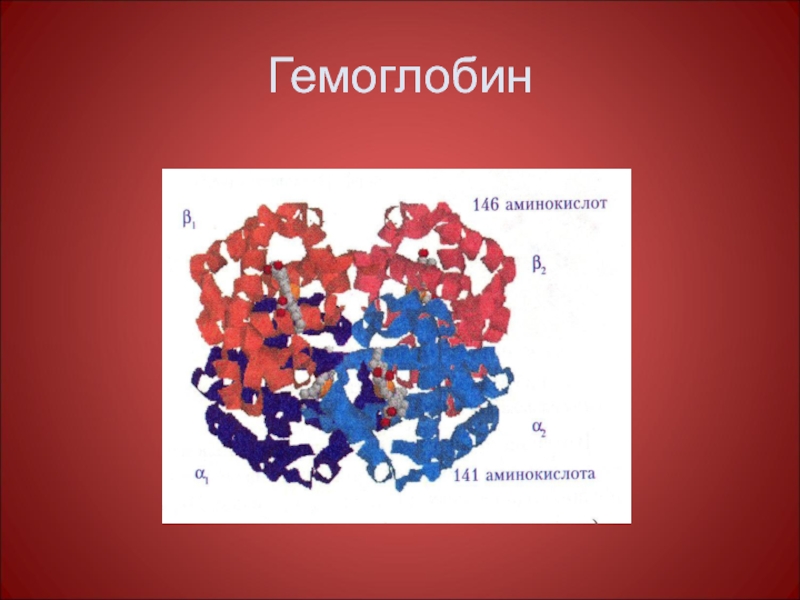
- 44. Гемоглобин
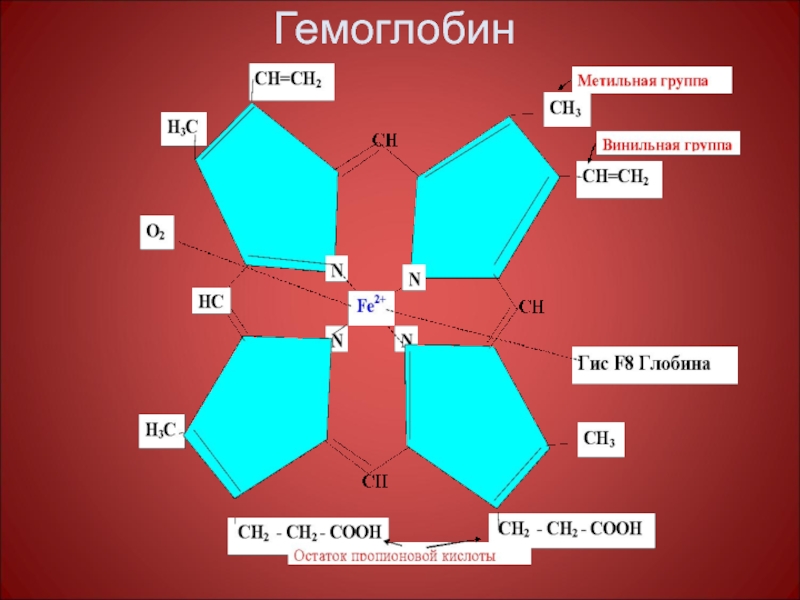
- 45. Гемоглобин
- 46. Кооперативные изменения конформации протомеров О2 связывается с
- 47. Кооперативные изменения конформации протомеров Нв при присоединении
- 48. Гем присоединяется к неполярным радикалам активного
- 49. Эмбриональный и фетальный гемоглобин Эмбриональный гемоглобин синтезируется
- 50. Формы гемоглобина Оксигемоглобин (НвО2) – полностью оксигенированный
- 51. Строение протомеров гемоглобина Аллостерический центр Каждая субъединица
- 52. Таким образом: 1. в центре тетрамерной
- 53. 2,3-Бисфосоглицерат (БФГ) – вещество, синтезируемое в Эр
- 54. Изменение концентрации БФГ – как механизм адаптации
- 55. Аллостерическими регуляторами активности Нв, которые присоединяются к
- 56. Перенос Н+ и СО2 из тканей в
- 57. Оксигенирование дезоксигемоглобина в легких, образование и выделение
- 59. Конформационные изменения гемоглобина при присоединении кислорода
- 60. Изменение конформации гемоглобина в результате связывания с кислородом
- 61. Кривая насыщения гемоглобина кислородом
- 62. Виды гемоглобина человека Гемоглобин А (НвА) -
- 63. Благодарю за внимание!
Слайд 2История изучения
Белки были выделены в отдельный класс биологических молекулБелки были выделены
Антуан Франсуа де Фуркруа,
основоположник изучения белков
Слайд 4Олигопептиды содержат до 20 амк (среди них различают ди-, три-, тетра-
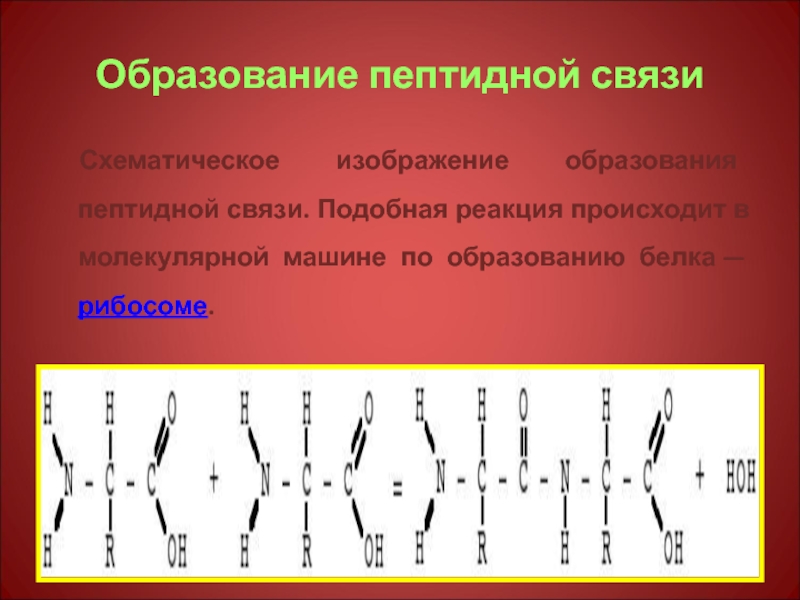
Слайд 5Образование пептидной связи
Схематическое изображение образования пептидной связи. Подобная реакция происходит в
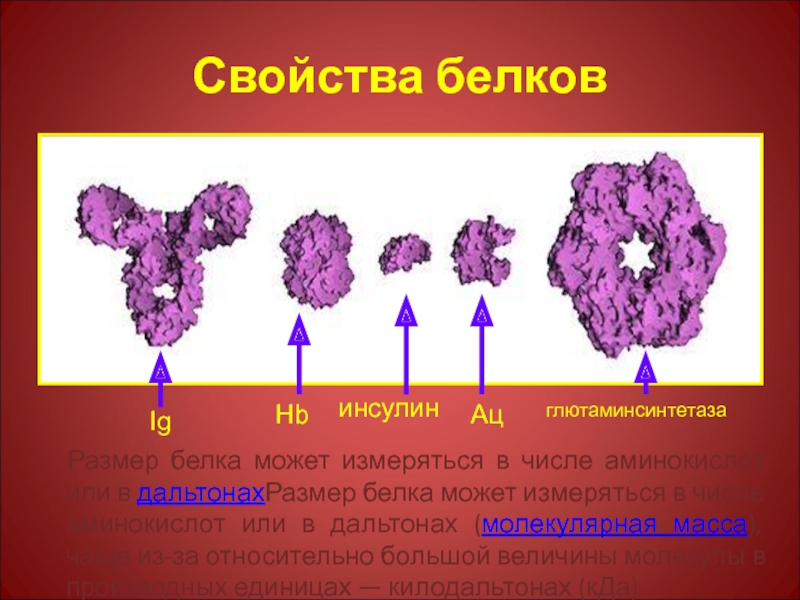
Слайд 6Свойства белков
Размер белка может измеряться в числе аминокислот или в дальтонахРазмер
Ig
Hb
инсулин
Ац
глютаминсинтетаза
Слайд 7- Амфотерность - Способность к ионизации в растворе - Характерной константой белков является
Слайд 8Классификация белков
По химическому строению
простые;
сложные;
По выполняемой функции
белки-ферменты
белки-гормоны
белки-рецепторы
структурные белки
защитные белки
сократительные белки
По форме
глобулярные
фибриллярные
Слайд 9Классификация белков
По молекулярной массе
низкомолекулярные
высокомолекулярные
По локализации в клетке
цитоплазматические
лизосомальные
ядерные и т.д.
По локализации в
белки крови
белки печени
белки сердца и т.д.
Слайд 10Классификация белков
По молекулярной массе
низкомолекулярные
Высокомолекулярные
По локализации в клетке
цитоплазматические
лизосомальные
ядерные и т.д.
По локализации в
белки крови
белки печени
белки сердца и т.д.
Слайд 11Классификация белков
По возможности адаптативно регулировать количество данных белков
белки, синтезирующиеся с
белки, синтез которых может усиливаться при воздействии факторов внешней среды (индуцибельные)
По продолжительности жизни
очень быстро обновляющиеся
очень медленно обновляющиеся
По схожим участкам первичной структуры и родственным функциям
- семейства белков
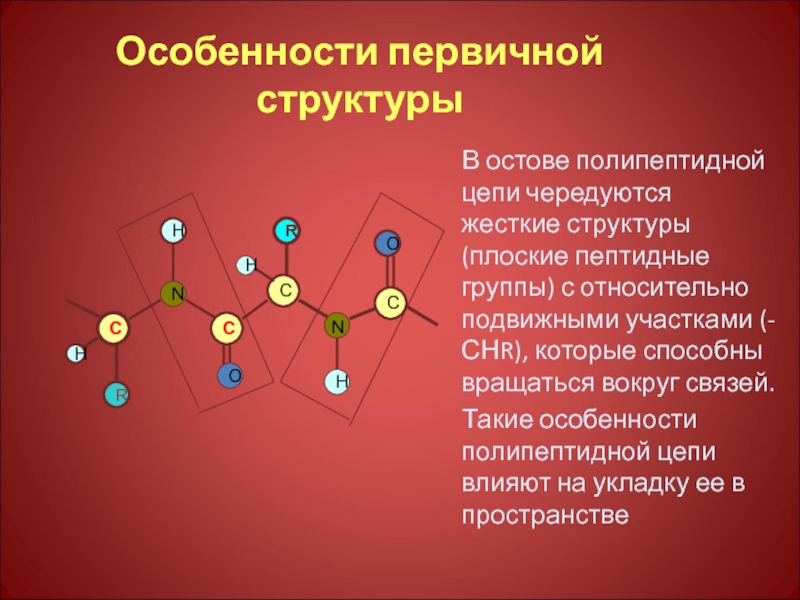
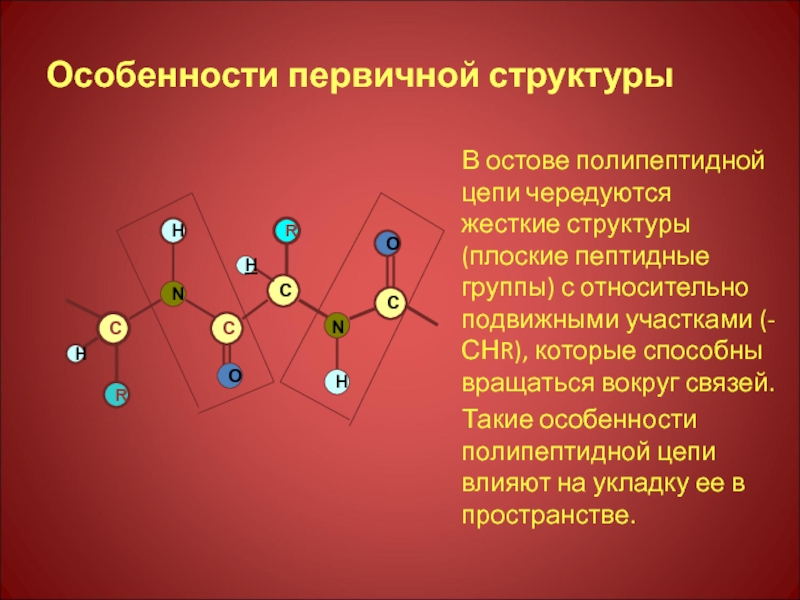
Слайд 12Особенности первичной структуры
В остове полипептидной цепи чередуются жесткие структуры (плоские пептидные
Такие особенности полипептидной цепи влияют на укладку ее в пространстве.
C
H
R
N
H
C
C
O
C
H
R
N
H
C
O
Слайд 13Пептидная связь – образуется при взаимодействии аминогруппы одной аминокислоты с карбоксильной
CH3 CH2 - OH
I I - H2O
H2N – CH – COOH + H2N – CH – COOH
аланин серин
CH3 CH2 – OH
I I
H2N – CH – CO - NH – CH – COOH
аланилсерин
Слайд 14Первичная структура белка
Последовательность чередования аминокислотных остатков (все связи ковалентные – пептидные,
Слайд 15Особенности первичной структуры
В остове полипептидной цепи чередуются жесткие структуры (плоские пептидные
Такие особенности полипептидной цепи влияют на укладку ее в пространстве.
C
H
R
N
H
C
C
O
C
H
R
N
H
C
O
Слайд 16Особенности пептидной связи
Компланарность – все атомы, входящие в пептидную группу находятся
Способность существовать в 2-х резонансных формах (кето- или енольной форме);
Транс-положение заместителей по отношению к С-N-связи;
Способность к образованию водородных связей, причем каждая из пептидных групп может образовывать 2 водородные связи с др.группами, в т.ч. и пептидными.
Исключение составляют пептидные группы пролина и гидроксипролина. Они способны образовать только 1 пептидную связь. Это сказывается на формировании вторичной структуры белка. В местах нахождения данных амк полипептидная цепь легко изгибается, т.к. не удерживается, как обычно, водородной связью.
Слайд 17Последовательность изучения первичной структуры белков.
Расщепление полипептидной цепи белка на более короткие
Установление порядка чередования амк в полученных фрагментах-пептидах;
Определение расположения пепдитов с известной амк последовательностью в белковой молекуле.
Самой начальной процедурой является определение числа полипептидных нитей в белковой молекуле - протомеров
Слайд 18К слабым взаимодействиям относят:
Водородные связи – внутри-и межмолекулярные (эти связи формируют
Ионные связи – образуют полярные (заряженные) радикалы;
Ван-дер-Ваальсовы силы – гидрофобные силы притяжения;
Гидрофобные взаимодействия – образуют гидрофобные радикалы;
Дисульфидные связи – образуются при сближении 2-х радикалов цистеина
Слайд 19Вторичная структура
Вторичная структура это пространственная конфигурация полипептидных цепей, которые стремятся
Различаем α -спирализацию и β – структуру, беспорядочный клубок.
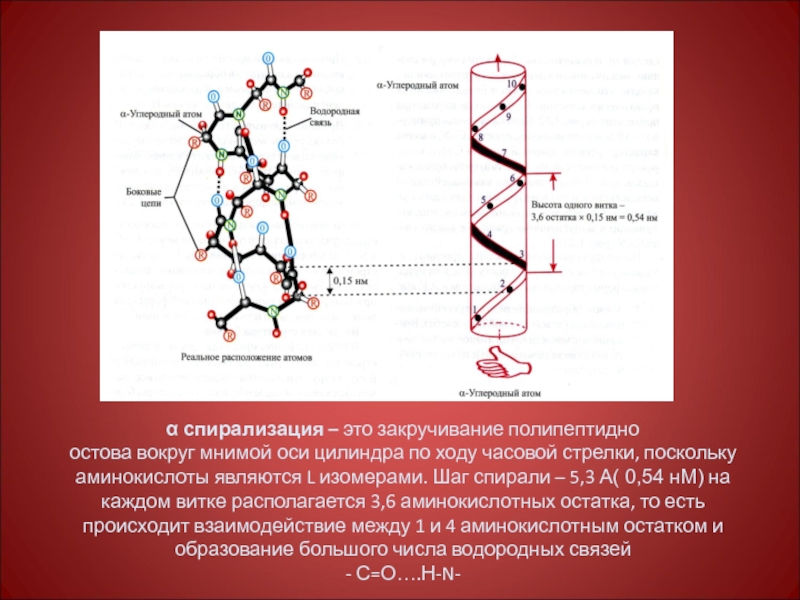
Слайд 20α спирализация – это закручивание полипептидно
остова вокруг мнимой оси цилиндра по
- С=О….Н-N-
Слайд 21ά-спираль
Водородные связи формируют трехмерную вторичную структуру белка и образуются между карбонильной
ά-Спираль представляет собой самый жесткий тип вторичной структуры и преобладает во многих белках.
Пролин и амк с длинными радикалами нарушают спиралевидную укладку.
Слайд 22Спираль-клубочек
Содержание ά-спирали в белках неодинаково и является индивидуальной особенностью каждой белковой
Слайд 23Основные особенности ά-спирали
Спиральная конфигурация полипептидной цепи имеет винтовую симметрию (напоминает растянутую
Образование водородных связей между пептидными группами каждого первого и четвертого амк остатков;
Регулярность витка спирали;
Равнозначность всех амк остатков не зависимо от строения их боковых радикалов;
Боковые радикалы амк не участвуют в образовании ά-спирали.
Период регулярности ά-спирали равен 5 виткам или 18 амк остаткам; длина одного периода составляет 2,7 нм.
Слайд 24Некоторые фибриллярные белки образуют конформацию β – структуры- структуры складчатого листа,
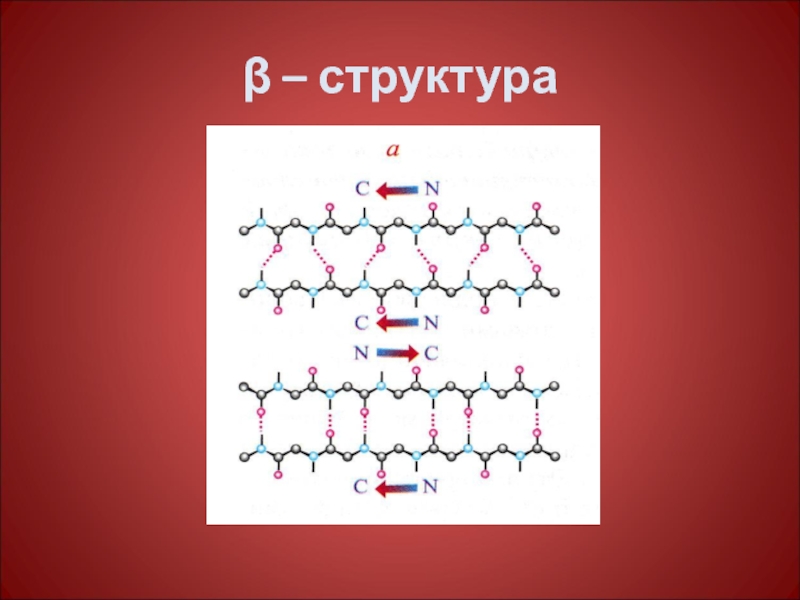
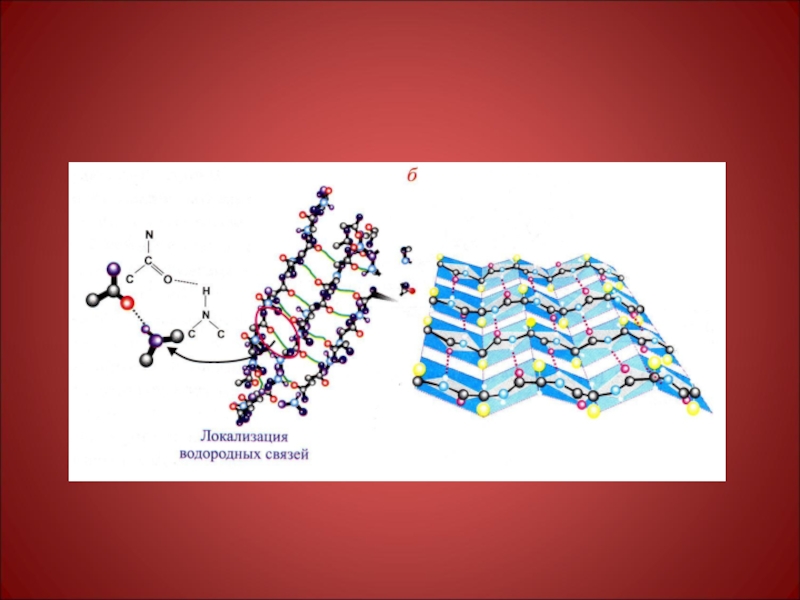
Слайд 25β-структура –
Складчатого типа, водородные связи образуются менее системно, формируя гофрированную
β-структура встречается реже, чем ά-спираль. На схемах изображается в виде широкой плоской стрелки, отмечающей направление от N- к С-концу цепи. Расстояние
между соседними амк остатками по оси составляет 0,35 нм., т.е. в 3 раза больше, чем в ά-спирали, число остатков на виток равно 2. В отрезке полипептидной цепи, образующей β-структуру, находится от 3 до 7 амк остатков, а сама β-структура состоит из 2-6 цепей, хотя их число может быть и большим. Поверхность β-структуры может быть плоской или левозакрученной таким образом, чтобы угол между отдельными отрезками цепи составлял 20-250.
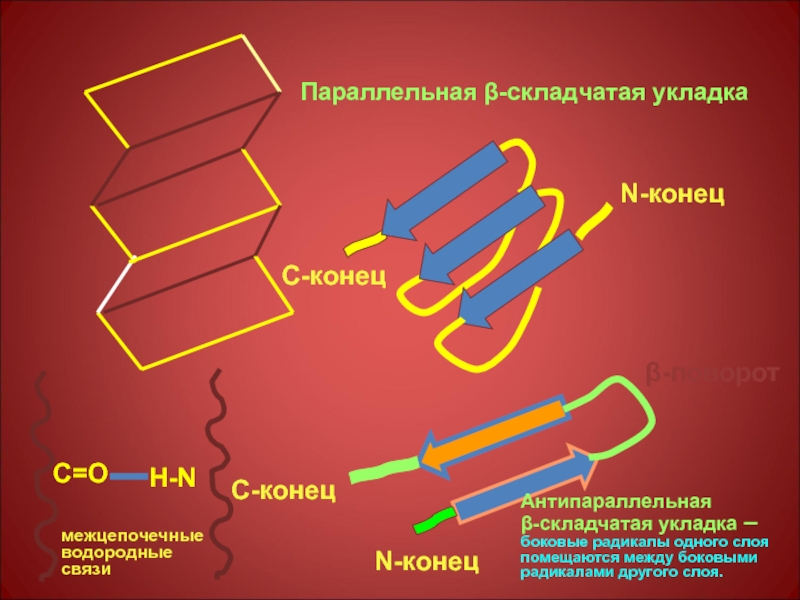
Слайд 26
N-конец
С-конец
Параллельная β-складчатая укладка
β-поворот
N-конец
С-конец
Антипараллельная
β-складчатая укладка – боковые радикалы одного слоя помещаются
С=О
Н-N
межцепочечные
водородные
связи
Слайд 29Связи, поддерживающие
вторичную структуру:
водородные
электростатические
гидрофобные
ван-дер-ваальсовые
Слайд 30Водородные:
1) N - H
R – C - H C=O
C=O …. H - N
H – N H - C - R
O
2) R – C
O- …. H-O-
3) R-CH2-O …. Н N - С =О
н
4) R-C- O …. H-O-C-R
H
Слайд 31Домены
Это более сложные уровни организации вторичной структуры. Они представляют собой
Доменом называют часть молекулы по структуре напоминающей самостоятельный глобулярный белок.
Супервторичная структура типа бочонка.
а — триозофосфатизомераза; б — домен пируваткиназы
Слайд 32Доменная организация характерна для многих белков. В этих белках находится, как
Слайд 33Третичная структура-
Третичная структура- это способ укладки полипептидной цепи в определенном объеме
Слайд 34Третичная структура поддерживается большим числом слабых связей, энергия которых мала от
Связи: а) ионная связь
б) водородная связь
в) гидрофобное взаимодействие
г) дисульфидная связь.
Слайд 35Третичная структура белка
Это реальная трехмерная конфигурация, которую принимает в пространстве закрученная
По форме третичной структуры белки делятся на глобулярные (ά-структура) и фибриллярные (β-структура). Однако конфигурация третичной структуры не дает основания думать, что фибриллярные белки имеют только β-структуру, а глобулярные – ά-спираль.
Слайд 36Связи, стабилизирующие третичную структуру белка
Ковалентные - сильные:
дисульфидные (-S-S-боковые радикалы цис);
изопептидные или
эфирные (редко встречающиеся) – между СООН-группами дикарбоновых амк (асп, глу) и ОН-группой гидроксиаминокислот (сер, тре)
Слайд 372. Полярные – слабые: водородные – между группой –NH2, -OH,-SH бокового радикала
Слайд 38Особенности организации третичной структуры.
Конформация третичной структуры полипептидной цепи определяется свойствами боковых
Слайд 40Четвертичная структура
Четвертичная структура – это способ укладки в пространстве отдельных полипептидных
Эту способность белок приобретает при определенном способе пространственного объединения входящих в его состав протомеров образовавшуюся молекулу называемая мультимером, (построены из четного числа протомеров от 2 до 4, реже от 6 до 10,12…).
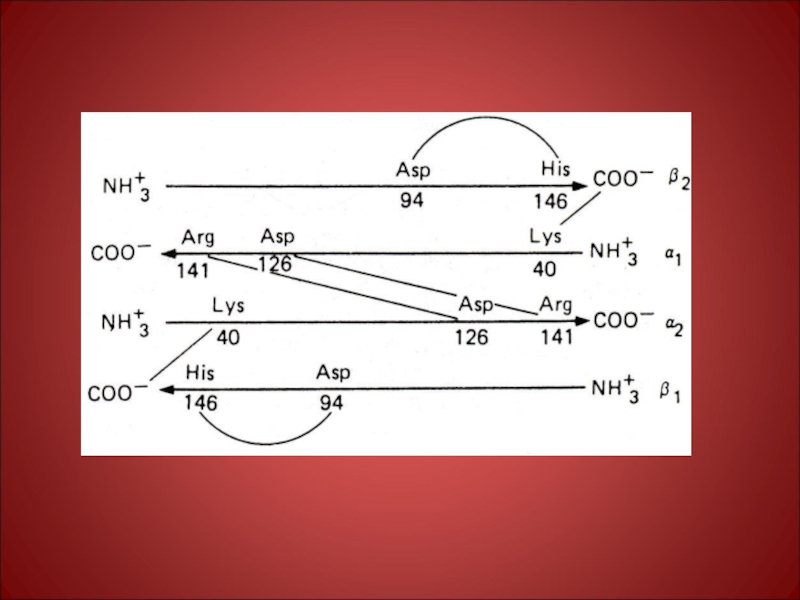
Субъединица – функционально активная часть молекулы мультимерного белка. Молекула гемоглобина состоит из α -, и β – субчастиц, каждая из которых состоит из 2-х одинаковых α -, и β –полипептидных цепей т.е. молекула гемоглобина состоит из 4-х полипептидных цепей, каждая из которых окружает группу гема.
Слайд 41Стабилизация четвертичной структуры белков.
В стабилизации четвертичной структуры принимают участие те же
Между их полярными группами образуются многочисленные ионные, водородные и дисульфидные связи, которые прочно удерживают субъединицы в виде организованного комплекса.
Слайд 43Структура белка
Кроме последовательности аминокислот полипептида (первичной структуры), крайне важна трёхмерная структура
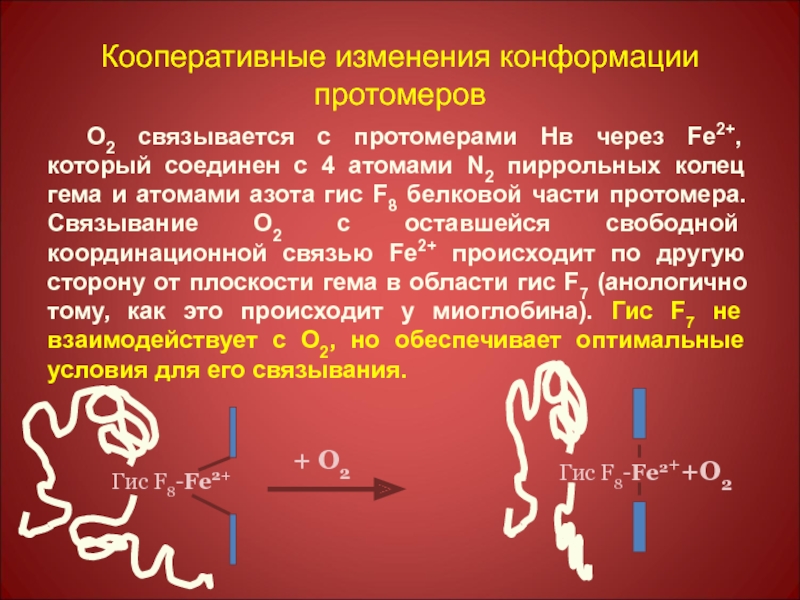
Слайд 46Кооперативные изменения конформации протомеров
О2 связывается с протомерами Нв через Fe2+, который
Гис F8-Fe2+
+ О2
Гис F8-Fe2++О2
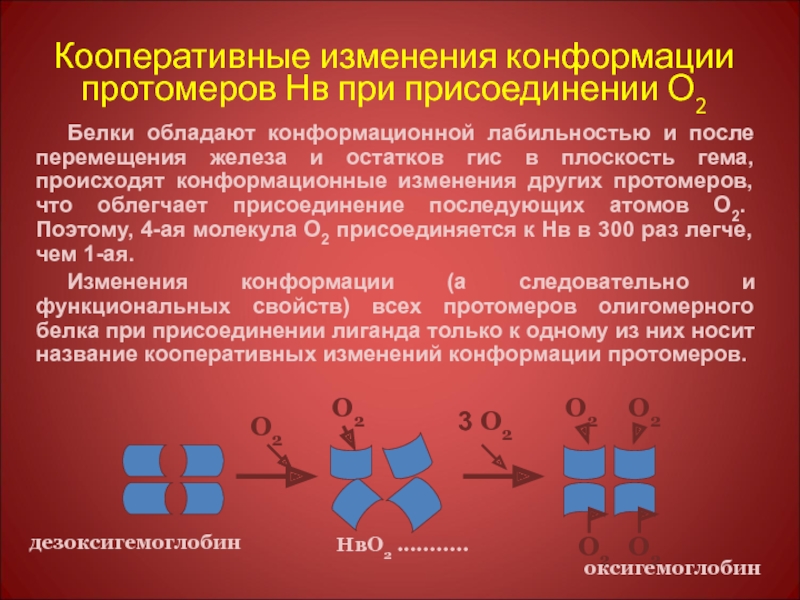
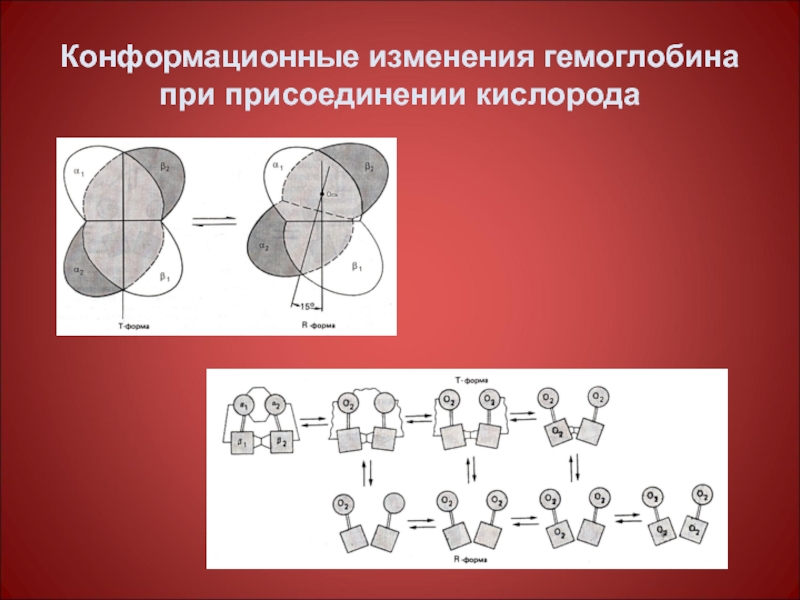
Слайд 47Кооперативные изменения конформации протомеров Нв при присоединении О2
Белки обладают конформационной лабильностью
Изменения конформации (а следовательно и функциональных свойств) всех протомеров олигомерного белка при присоединении лиганда только к одному из них носит название кооперативных изменений конформации протомеров.
О2
О2
3 О2
О2
О2
О2
О2
дезоксигемоглобин
НвО2 ...........
оксигемоглобин
Слайд 48 Гем присоединяется к неполярным радикалам активного центра своими пиррольными циклами, а
Слайд 49Эмбриональный и фетальный гемоглобин
Эмбриональный гемоглобин синтезируется в эмбриональном желточном мешке через
Слайд 50Формы гемоглобина
Оксигемоглобин (НвО2) – полностью оксигенированный Нв;
Дезоксигемоглобин (Нв) – незамещенная 6
Карбаминогемоглобин - связывание СО2 с Нв. СО2 связывает только N-концевые ά-аминогруппы. Реакция легко обратима. Образование карбаминогемоглобина определяется парциальным давлением СО2 и имеет прямое отношение к транспорту СО2 кровью;
Карбоксигемоглобин (НвСО) – для образования НвСО требуется в 200 раз более низкое парциальное давление СО. Смерть наступает при связывании 70% Нв угарным газом;
Метгемоглобин (met-Нв) – образуется при окислении Fe2+ до Fe3+; не способен присоединять ни О2, ни СО; имеет коричневый цвет.
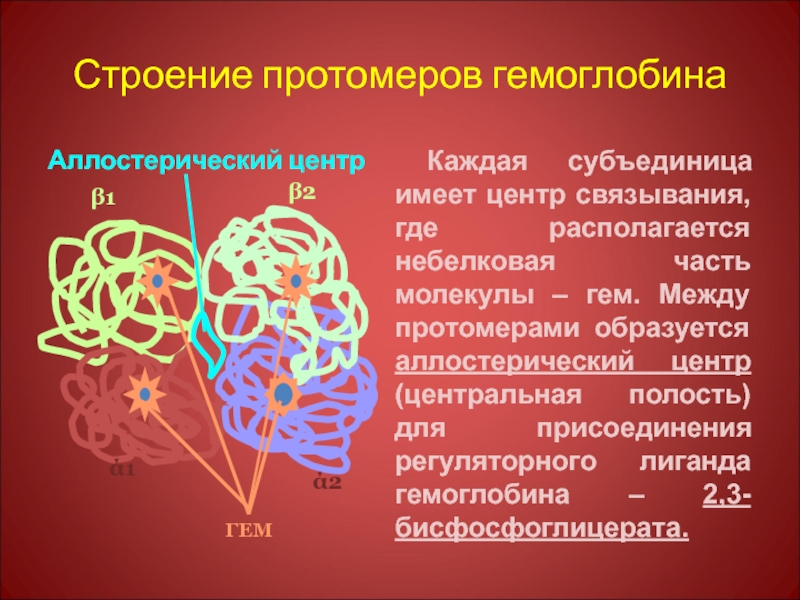
Слайд 51Строение протомеров гемоглобина
Аллостерический центр
Каждая субъединица имеет центр связывания, где располагается небелковая
ГЕМ
ά1
ά2
β1
β2
Слайд 52Таким образом: 1. в центре тетрамерной молекулы Нв находится полость, которую
Слайд 532,3-Бисфосоглицерат (БФГ) – вещество, синтезируемое в Эр из промежуточного продукта окисления
Изменение функциональной активности белка при взаимодействии с другими лигандами вследствие конформационных изменений называется аллостерической регуляцией, а соединения-регуляторы – аллостерическими лигандами.
С
О
О-
С
С
О
Р
О
О
О-
Н
Н
О
Р
О-
О-
О
Н
Слайд 54Изменение концентрации БФГ – как механизм адаптации организма к гипоксии.
Концентрация БФГ
Такую же адаптацию можно наблюдать у больных с заболеваниями легких, при которых развивается общая гипоксия тканей: при снижении парциального давления от 100 до 50 мм.рт.ст., в Эр усиливается выработка БФГ также в 2 раза, что повышает доставку О2 в ткани.
Слайд 55Аллостерическими регуляторами активности Нв, которые присоединяются к аллостерическим центрам (пространственно удаленным
Способность к аллостерической регуляции характерна для олигомерных белков, т.е. необходимо взаимодействие протомеров.
Концентрация аллостерических лигандов снижает сродство Нв к О2.
Слайд 56Перенос Н+ и СО2 из тканей в легкие с помощью гемоглобина.
Увеличение освобождения О2 Нв в зависимости от концентрации Н+ называют эффектом Бора
Образовавшийся в тканях СО2 переносится в Эр, где происходит образование из СО2 под действием фермента карбангидразы Н2СО3. при переходе окси-Нв к дезокси-Нв, специфические участки Нв приобретают большое сродство к Н+ - в результате изменения амк окружения этих участков СОО-. Присоединение 3 пар Н+ к Нв уменьшает его сродство к О2 и усиливает транспорт О2 в ткани, нуждающиеся в нем.
Клетки тканей
Капилляры
тканей
эритроцит
СО2
СО2
СО2
Н2СО3
Н+
О2
Н2О
Н2О
НСО3-
Нв О2
Н+Нв
О2
О2
Слайд 57Оксигенирование дезоксигемоглобина в легких, образование и выделение СО2.
Увеличение концентрации протонов в
В капиллярах легких высокое парциальное давление О2 приводит к оксигенированию Нв и удалению 6 протонов. Образующийся СО2 выделяется в альвеолярное пространство и удаляется с выдыхаемым воздухом.
Следовательно, молекула Нв в ходе эволюции приобрела способность воспринимать и реагировать на информацию, получаемую из окружающей среды.
Альвеолярный воздух
Капилляры легких
эритроцит
СО2
СО2
СО2
О2
О2
О2
Н+Нв
Нв(О2)
Н+
Н2СО3
НСО3-
Н2О
Н2О
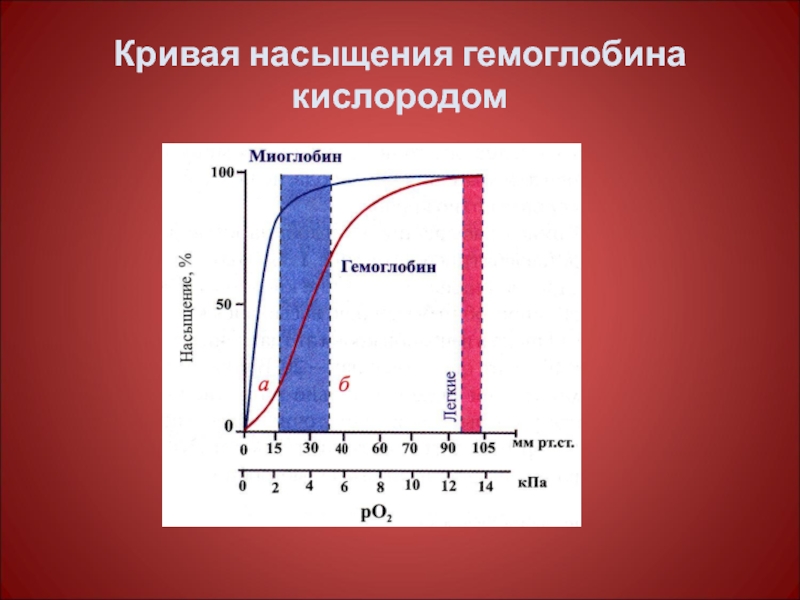
Слайд 62Виды гемоглобина человека
Гемоглобин А (НвА) - α 2β2 - основной тип
Гемоглобин А2 (НвА 2) - α 2δ2 - минорный тип гемоглобина у взрослых
Гемоглобин F (НвF) - α 2γ2 - основной тип гемоглобина у плода