- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Строение альфа и альфа-β белков презентация
Содержание
- 1. Строение альфа и альфа-β белков
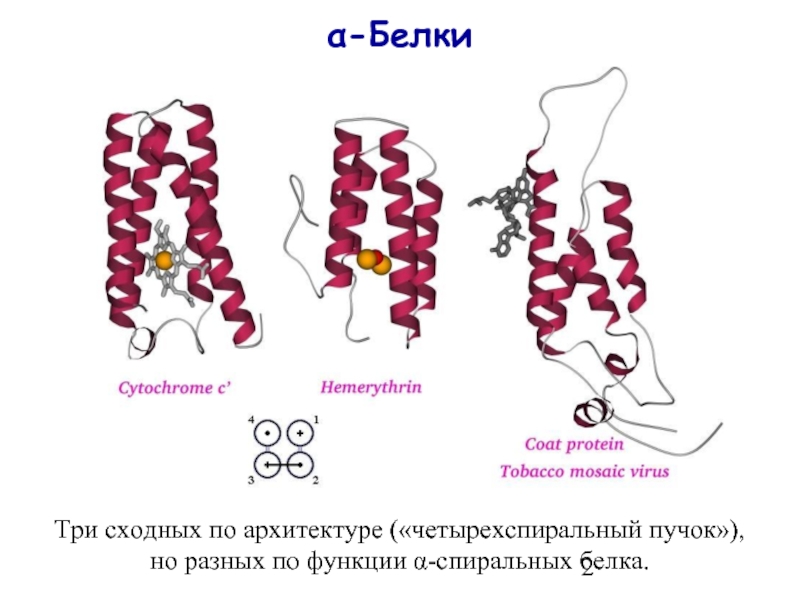
- 2. α-Белки Три сходных по архитектуре («четырехспиральный пучок»), но разных по функции α-спиральных белка.
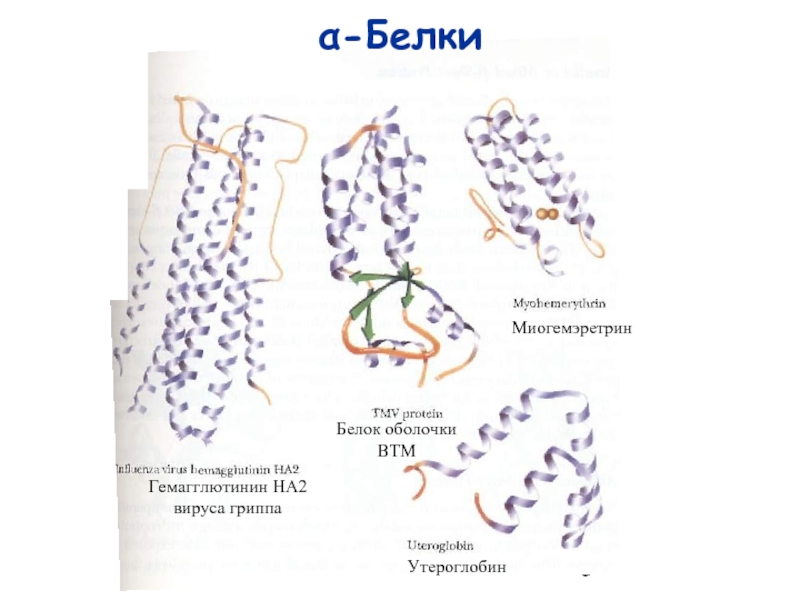
- 3. α-Белки Гемагглютинин HA2 вируса гриппа Белок оболочки ВТМ Миогемэретрин Утероглобин
- 4. Структурные мотивы (по Ефимову) Структурными мотивами принято
- 5. Новые структурные мотивы в α-спиральных белках
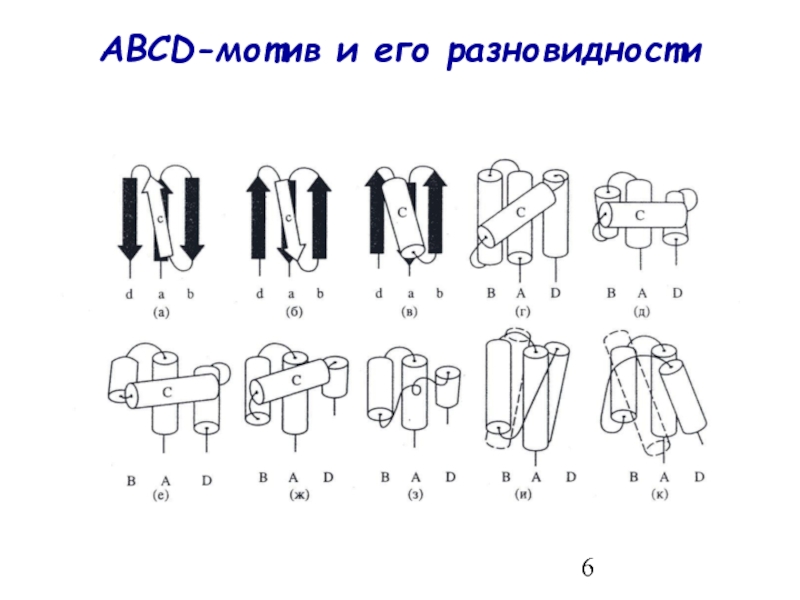
- 6. ABCD-мотив и его разновидности
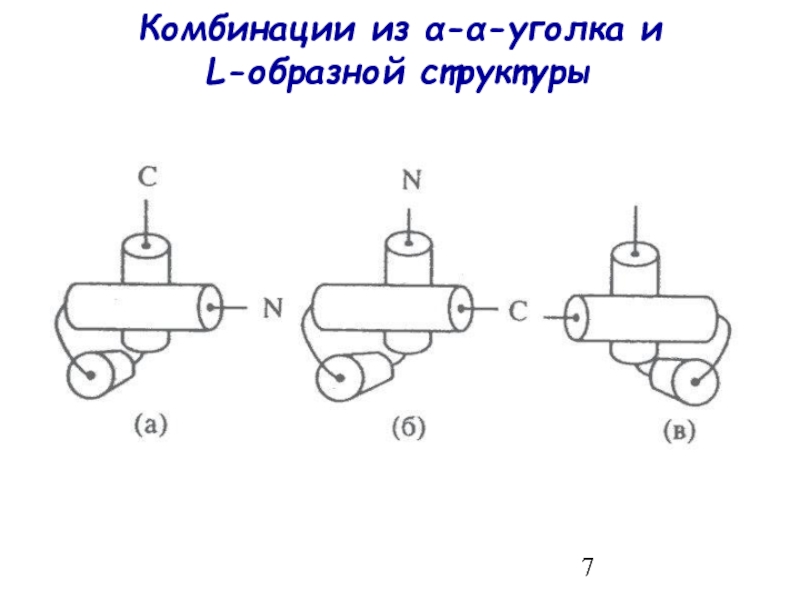
- 7. Комбинации из α-α-уголка и L-образной структуры
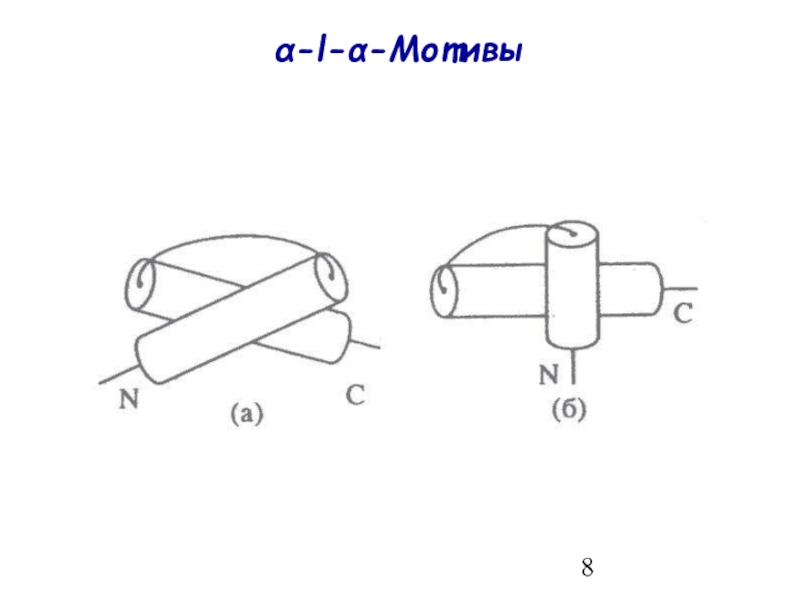
- 8. α-l-α-Мотивы
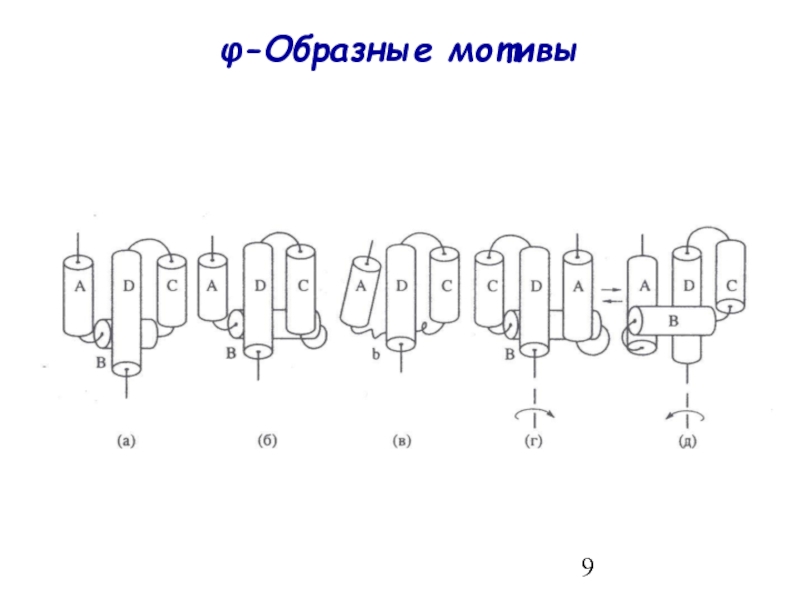
- 9. φ-Образные мотивы
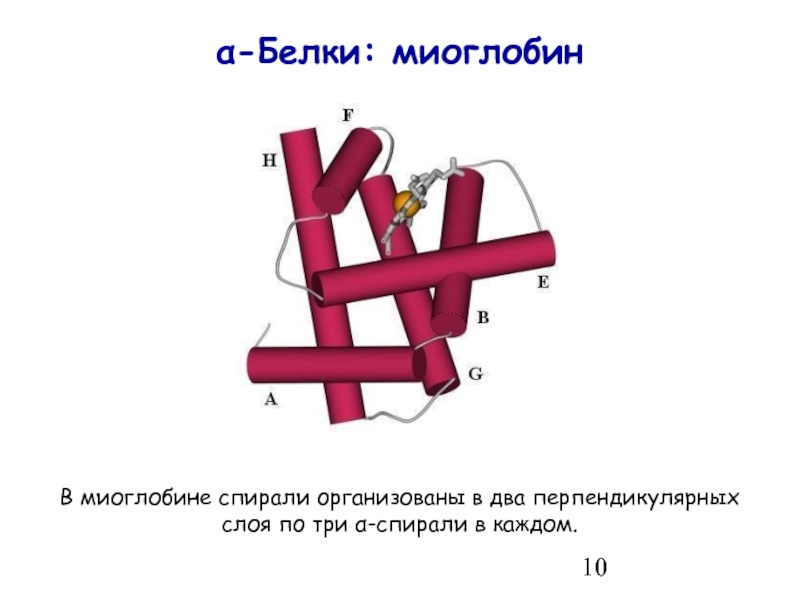
- 10. α-Белки: миоглобин В миоглобине спирали организованы
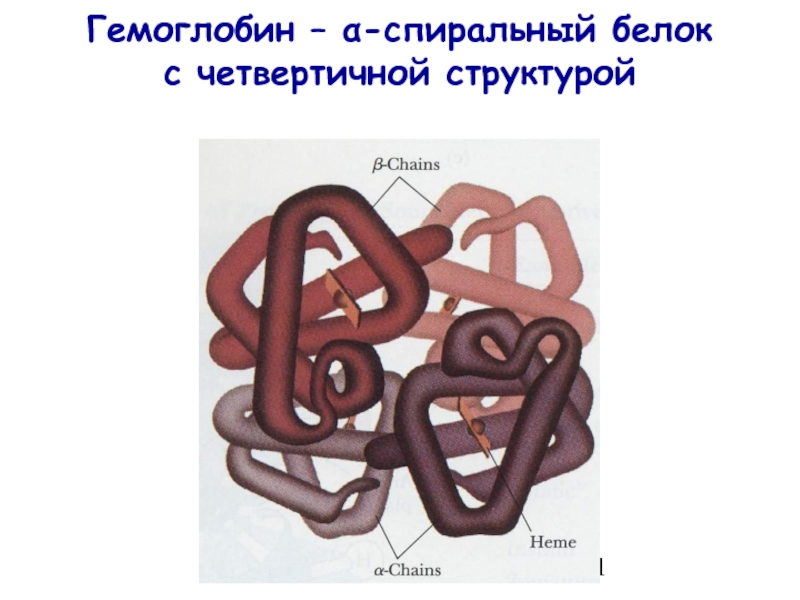
- 11. Гемоглобин – α-спиральный белок с четвертичной структурой
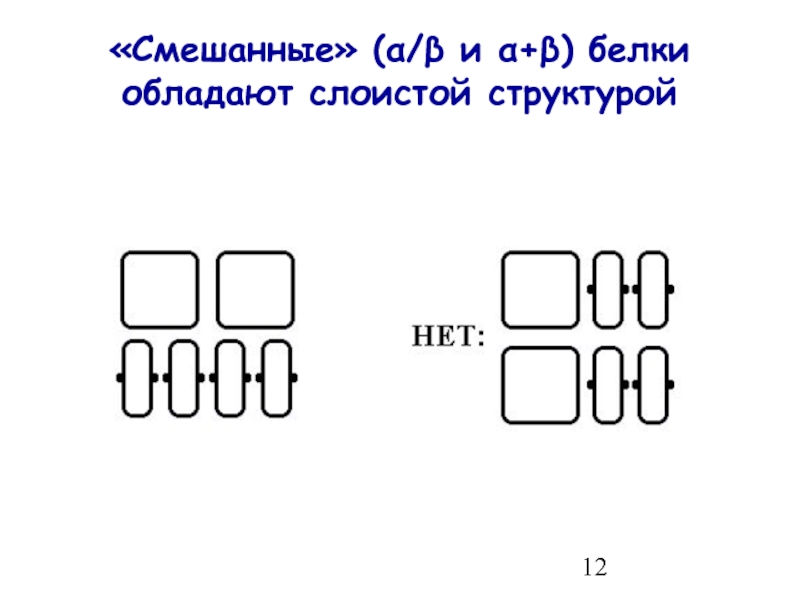
- 12. «Смешанные» (α/β и α+β) белки обладают слоистой структурой
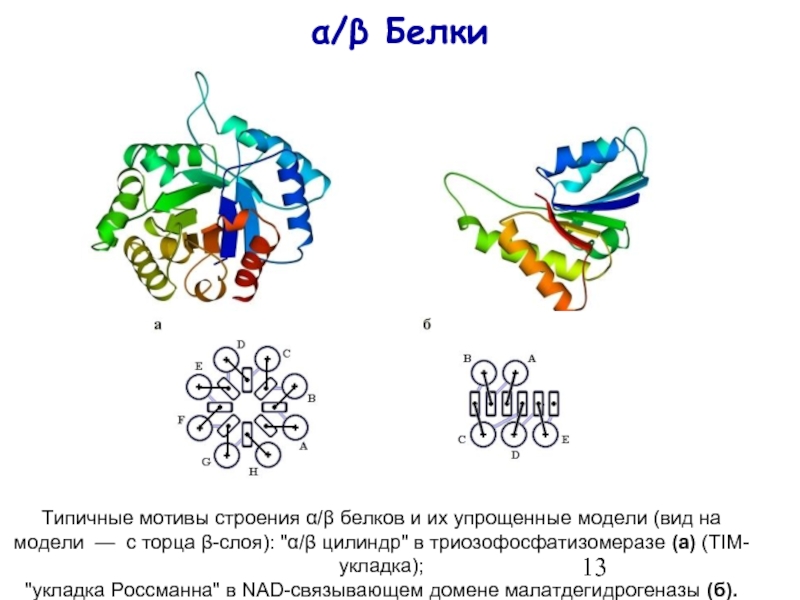
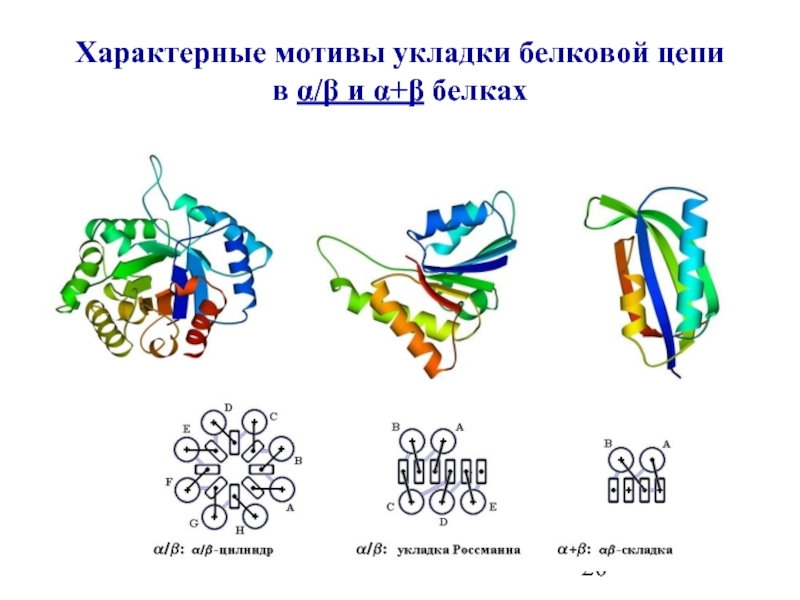
- 13. α/β Белки Типичные мотивы
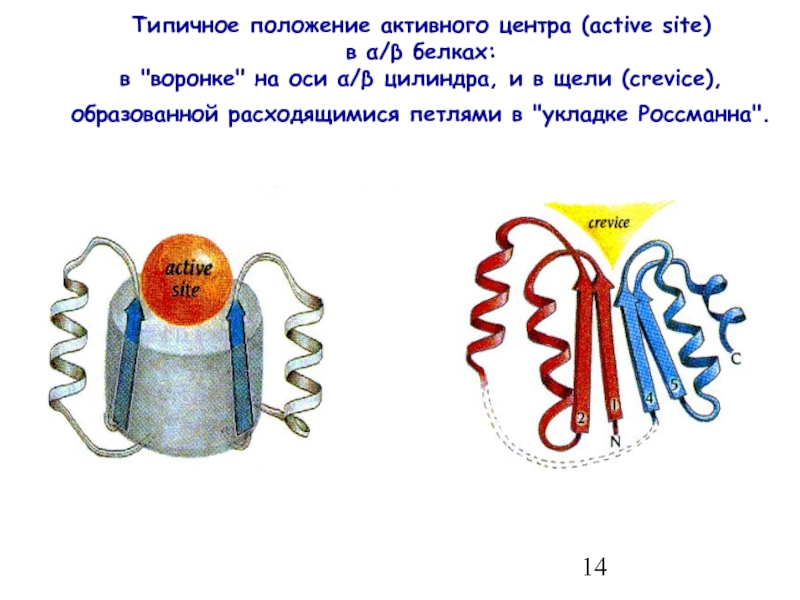
- 14. Типичное положение активного центра (active site)
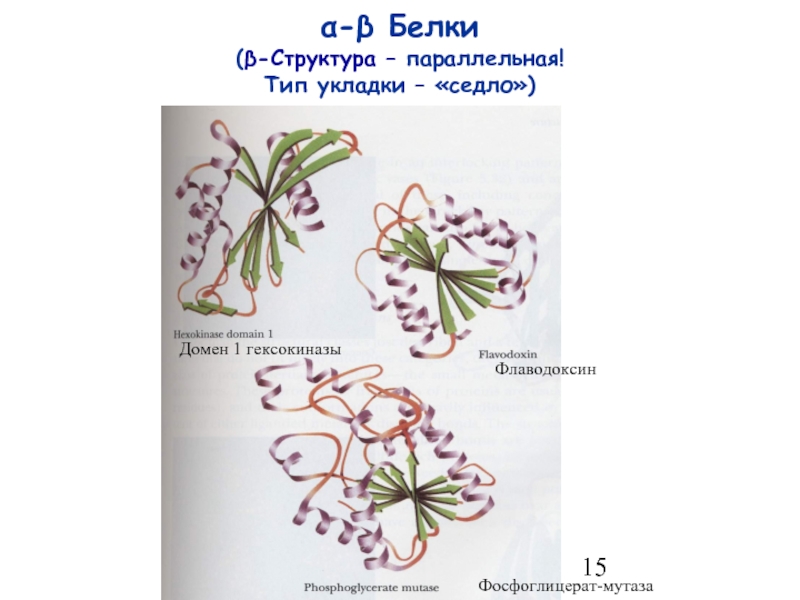
- 15. α-β Белки (β-Структура – параллельная! Тип укладки – «седло») Домен 1 гексокиназы Флаводоксин Фосфоглицерат-мутаза
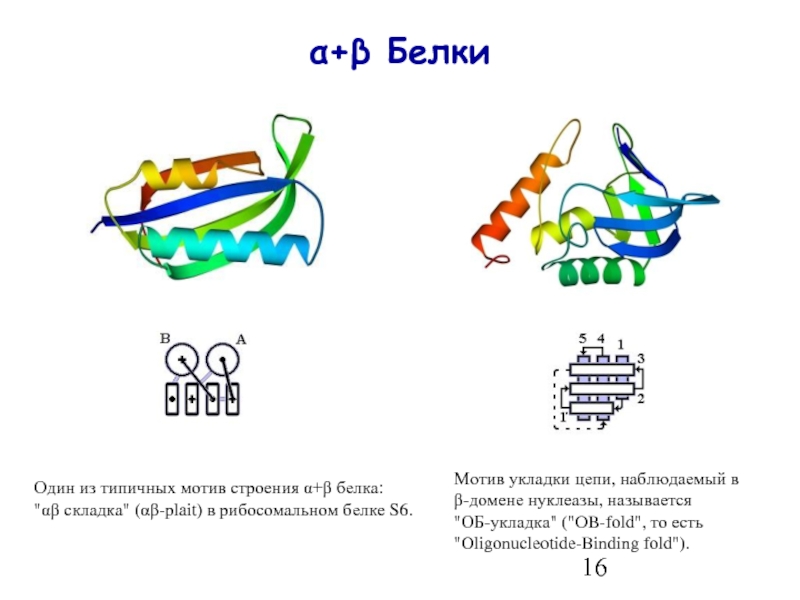
- 16. α+β Белки Один
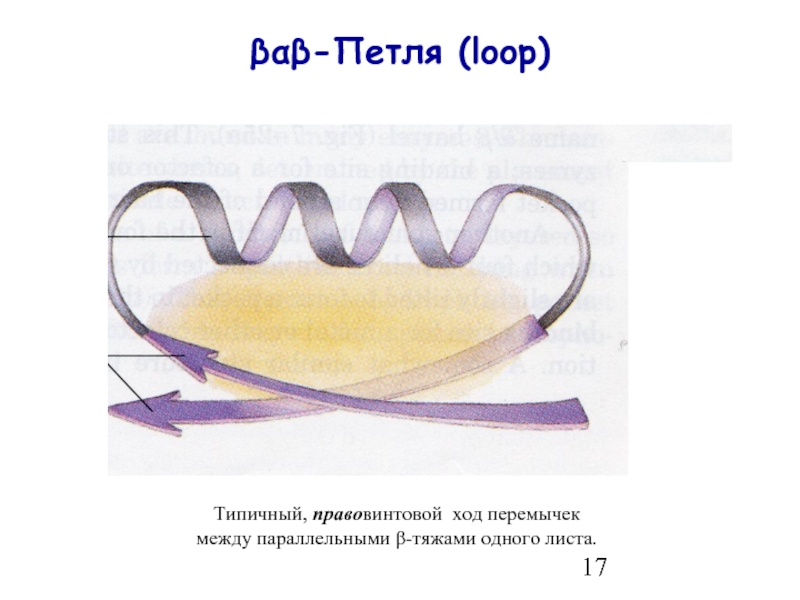
- 17. βαβ-Петля (loop) Типичный, правовинтовой ход перемычек между параллельными β-тяжами одного листа.
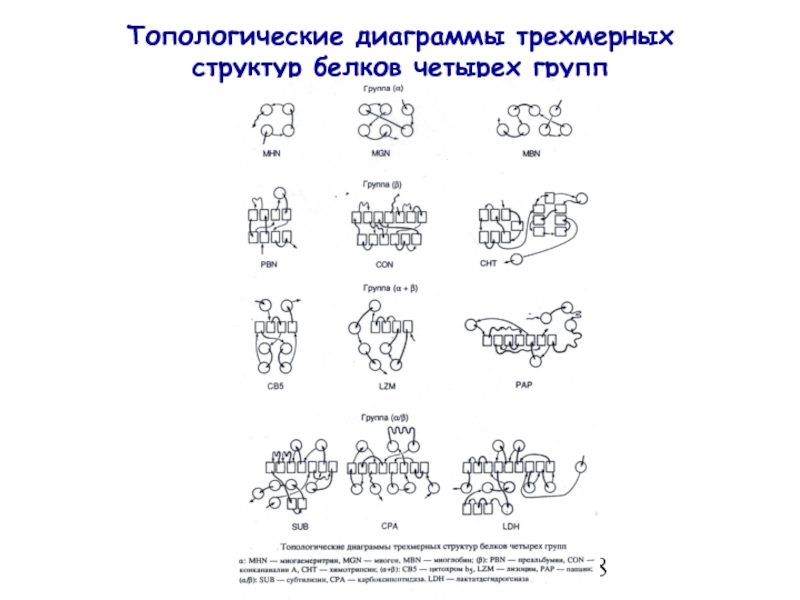
- 18. Топологические диаграммы трехмерных структур белков четырех групп
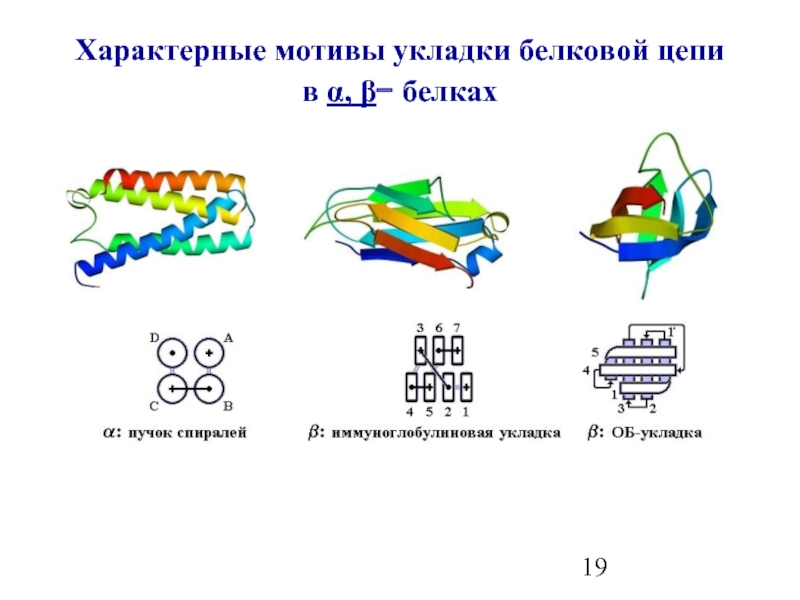
- 19. Характерные мотивы укладки белковой цепи в α, β− белках
- 20. Характерные мотивы укладки белковой цепи в α/β и α+β белках
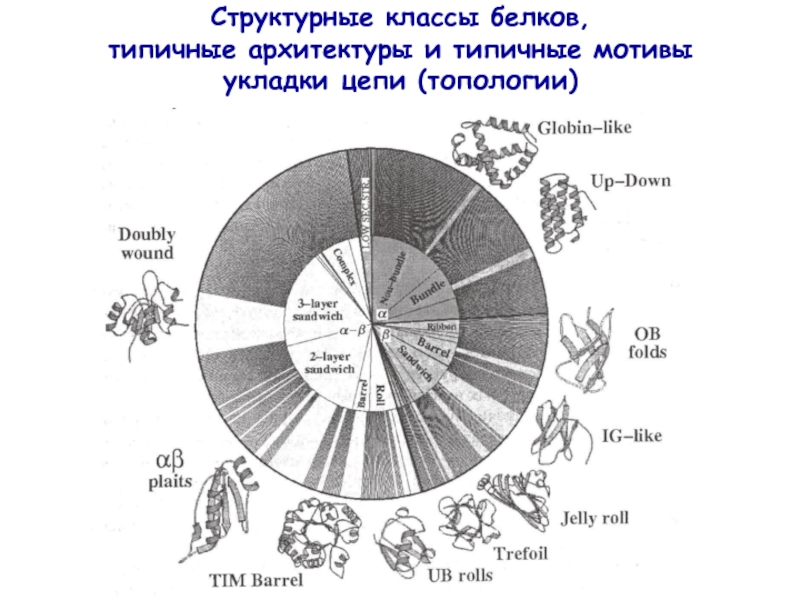
- 21. Структурные классы белков, типичные архитектуры и типичные мотивы укладки цепи (топологии)
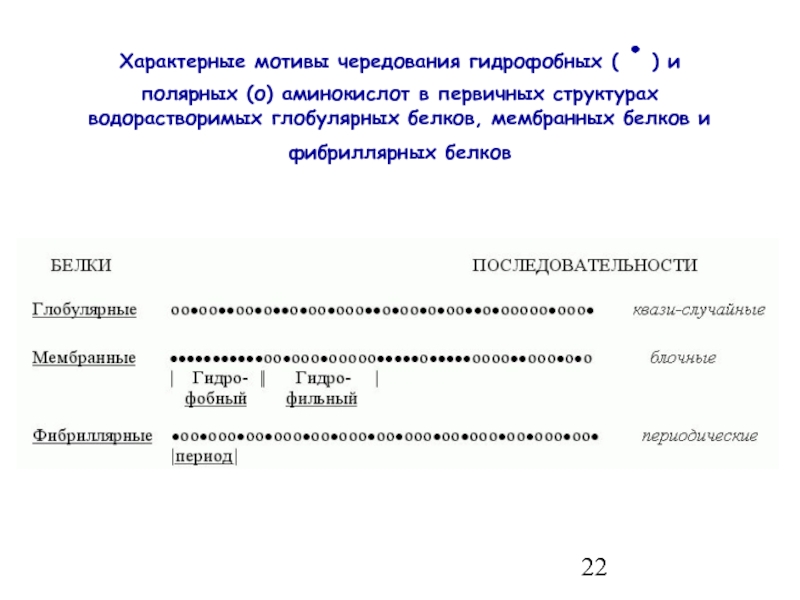
- 22. Характерные мотивы чередования гидрофобных (·) и полярных
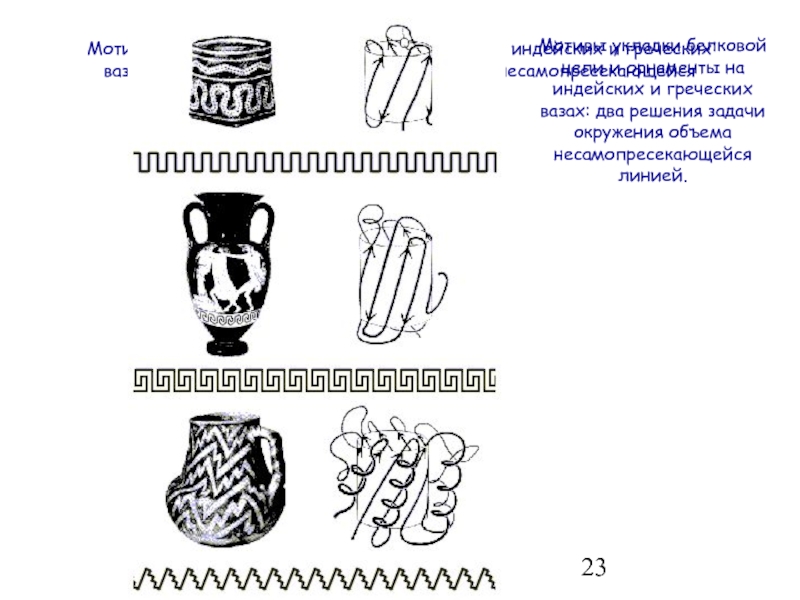
- 23. Мотивы укладки белковой цепи и орнаменты на
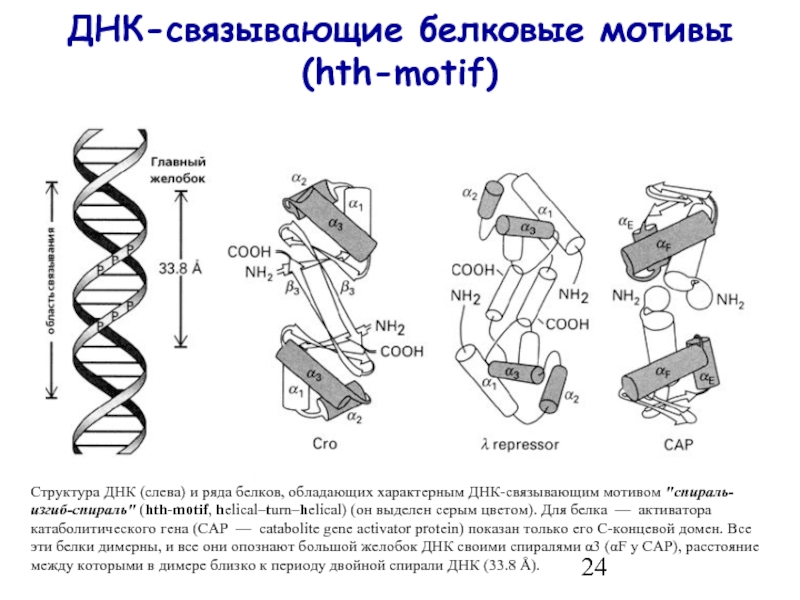
- 24. ДНК-связывающие белковые мотивы (hth-motif) Структура ДНК (слева)
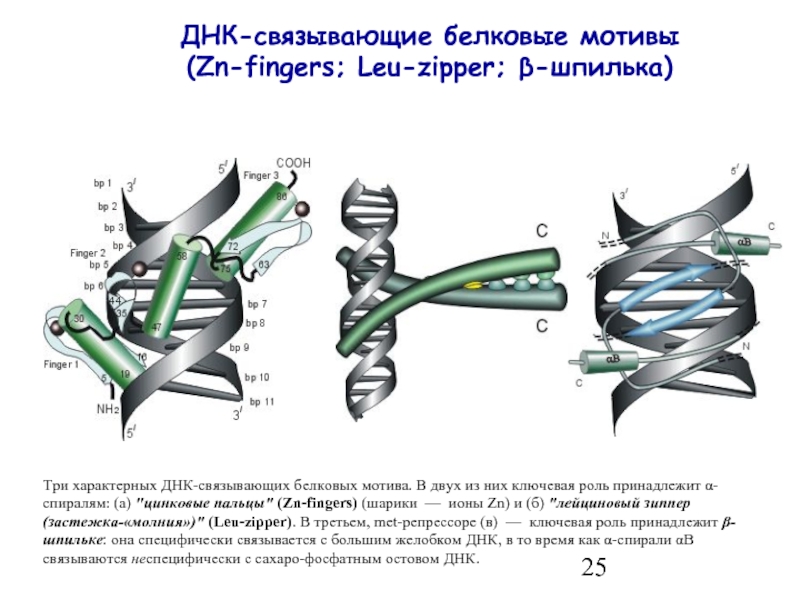
- 25. ДНК-связывающие белковые мотивы (Zn-fingers; Leu-zipper; β-шпилька) Три
- 26. Самоорганизация белков In vivo: Рибосома выдает белковую
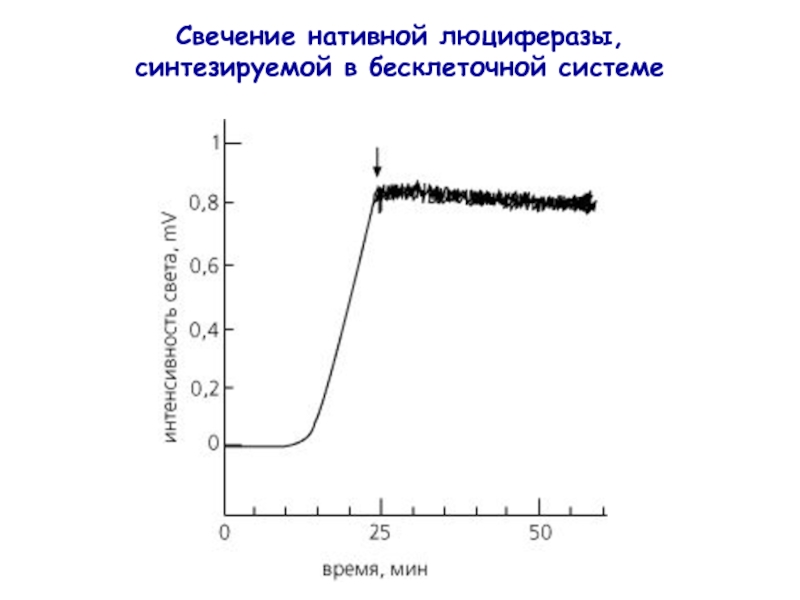
- 27. Свечение нативной люциферазы, синтезируемой в бесклеточной системе
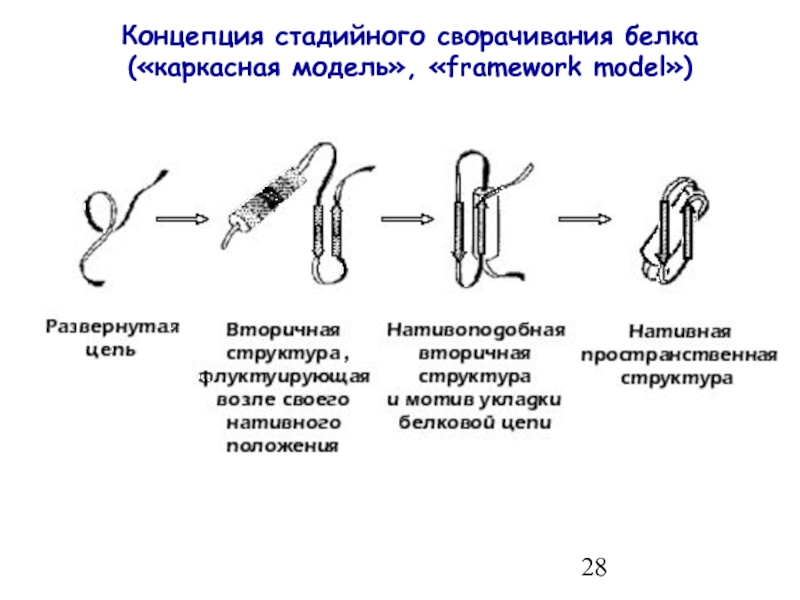
- 28. Концепция стадийного сворачивания белка («каркасная модель», «framework model»)
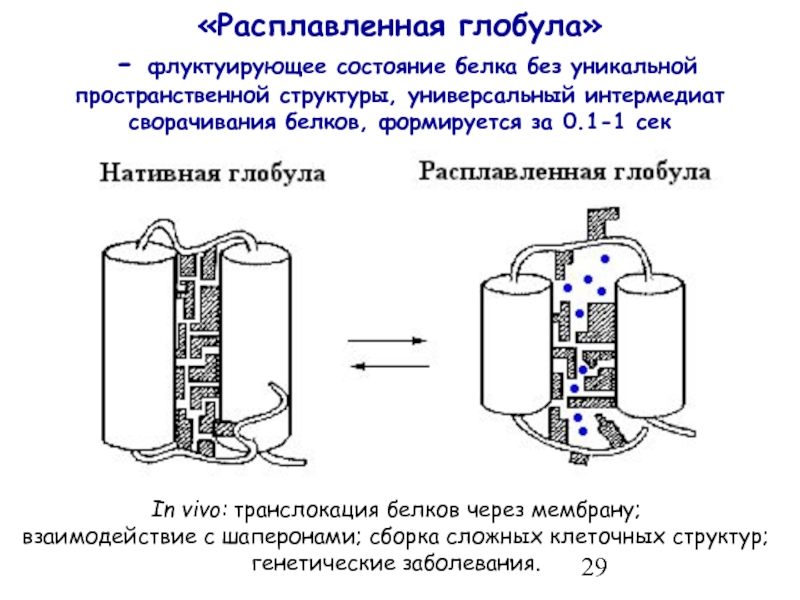
- 29. «Расплавленная глобула» - флуктуирующее состояние
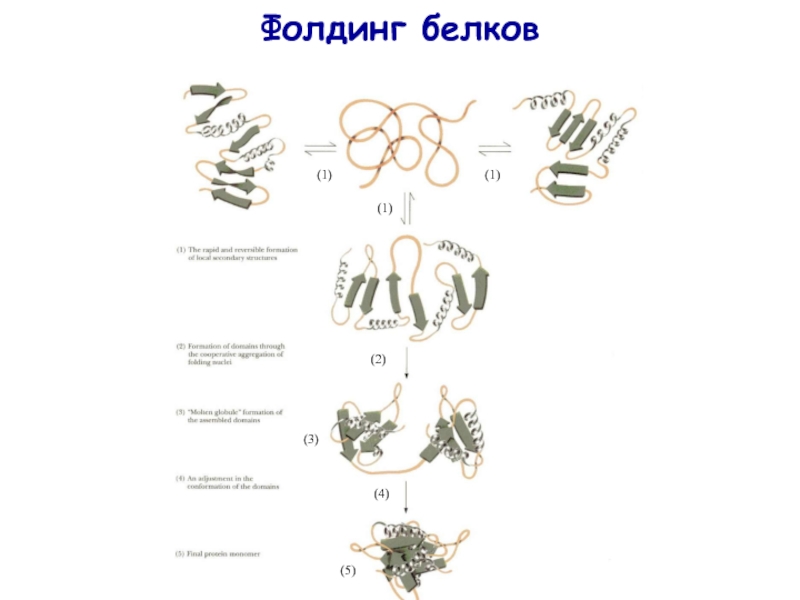
- 31. Фолдинг белков (1) (1) (1) (2) (3) (4) (5)
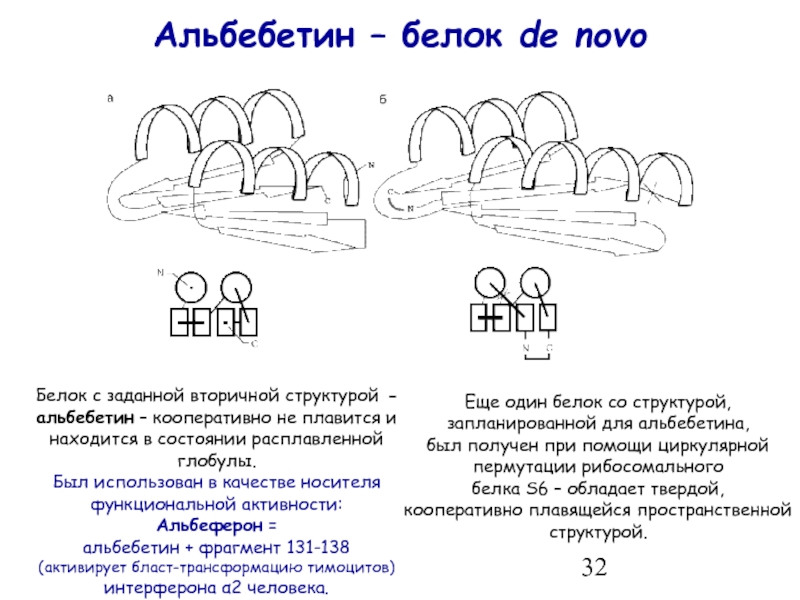
- 32. Альбебетин – белок de novo Белок с
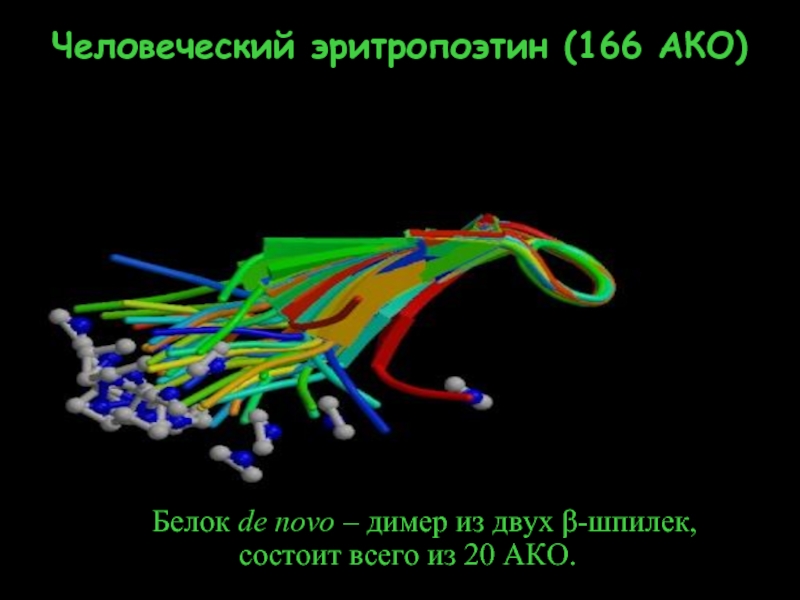
- 33. Белок de novo – димер из двух
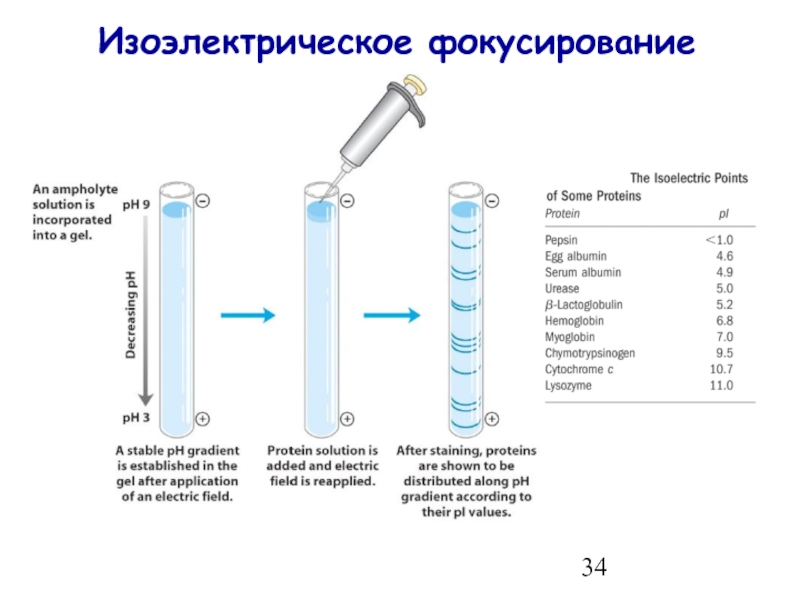
- 34. Изоэлектрическое фокусирование
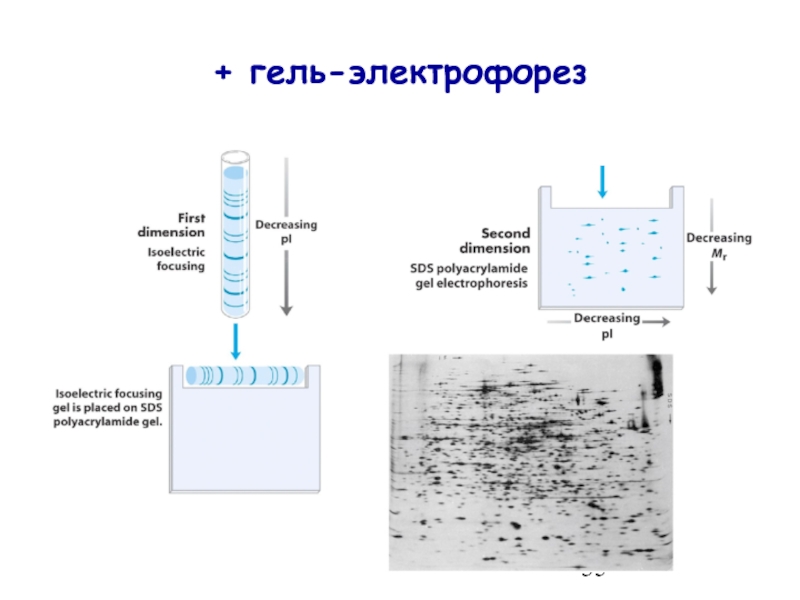
- 35. + гель-электрофорез
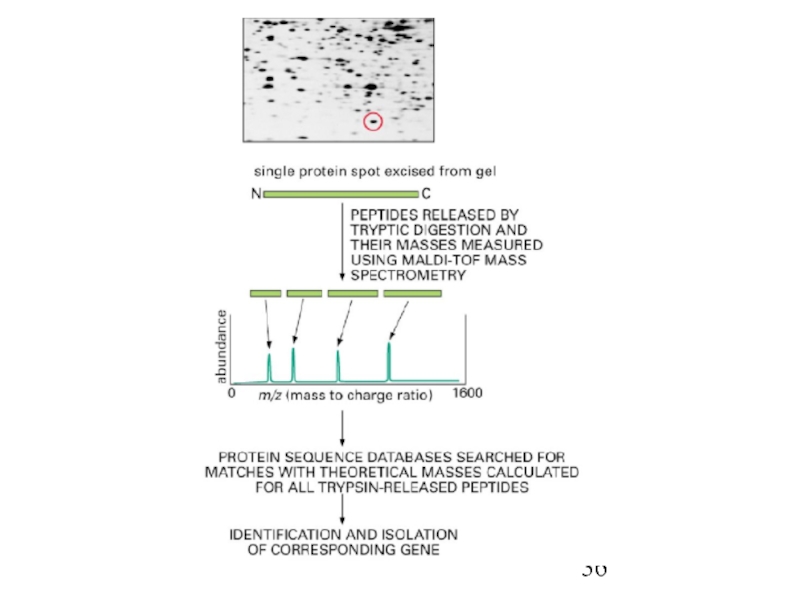
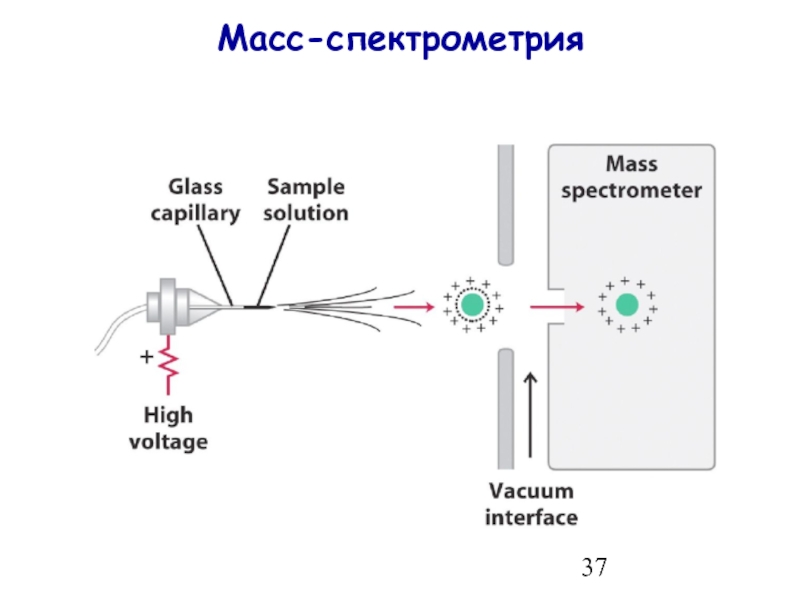
- 37. Масс-спектрометрия
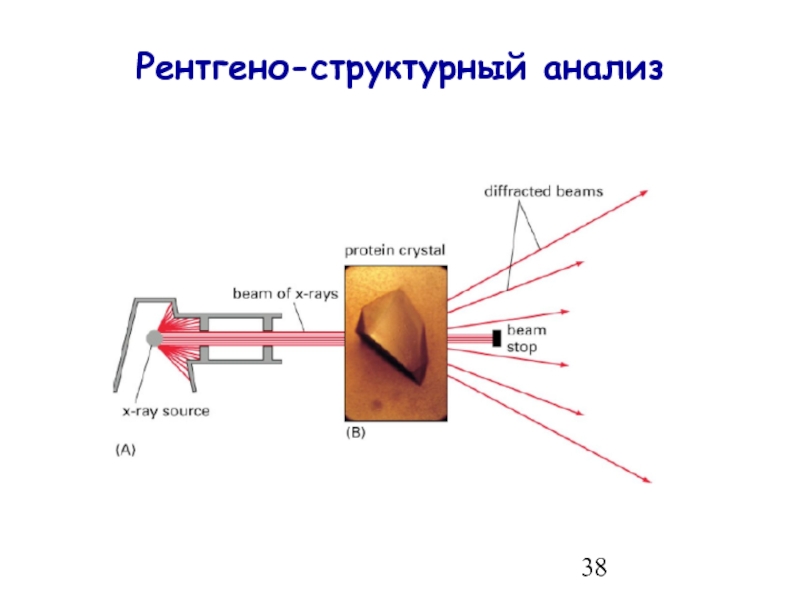
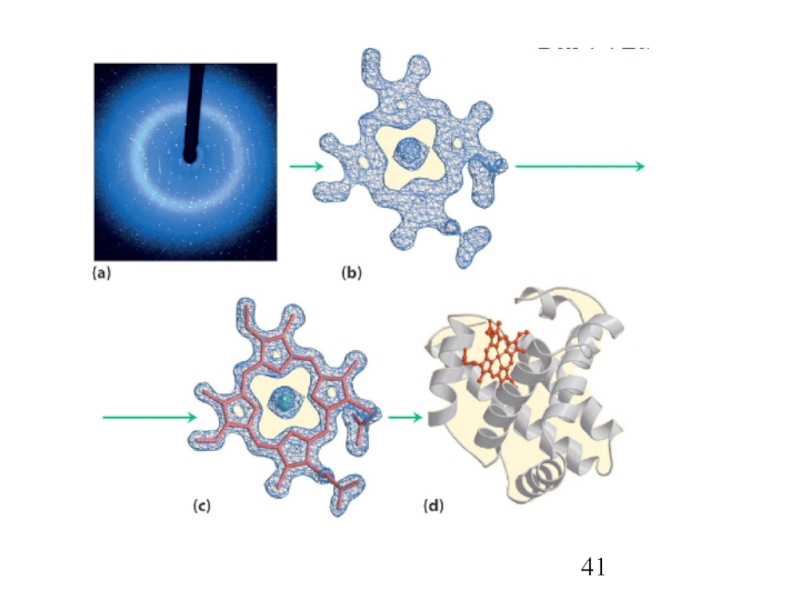
- 38. Рентгено-структурный анализ
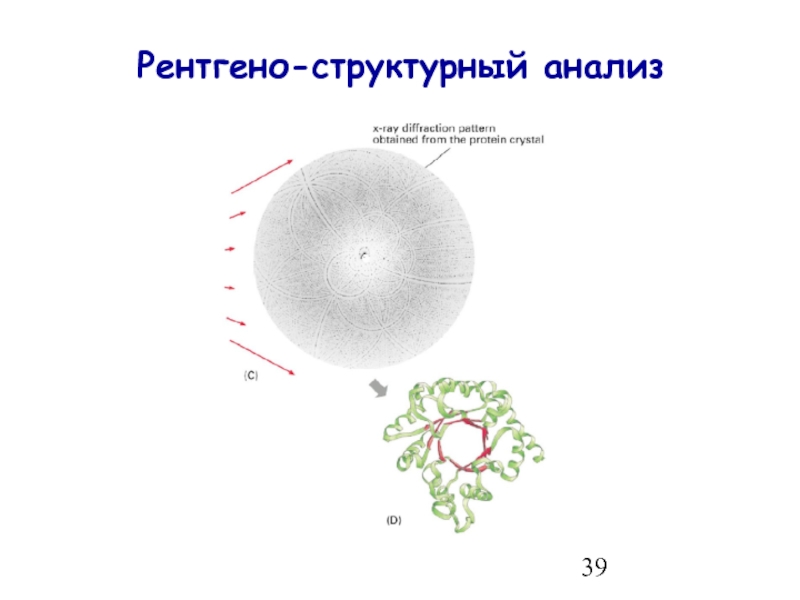
- 39. Рентгено-структурный анализ
- 43. Ядерный магнитный резонанс (ЯМР,NMR)
Слайд 2α-Белки
Три сходных по архитектуре («четырехспиральный пучок»),
но разных по функции α-спиральных белка.
Слайд 4Структурные мотивы (по Ефимову)
Структурными мотивами принято считать пространственно организованные структурные единицы,
С одной стороны, структурные мотивы являются "готовыми структурными блоками" или элементами третичной структуры белков, с другой - их можно рассматривать в качестве зародышей в процессах сворачивания белков или использовать в качестве стартовых структур при моделировании и предсказании пространственной структуры белков.
Слайд 5Новые структурные мотивы
в α-спиральных белках
Комбинации из α-α-уголка и L-образной
ABCD-мотив и его разновидности
α-l-α-Мотивы
φ-Образные мотивы
Слайд 10α-Белки: миоглобин
В миоглобине спирали организованы в два перпендикулярных
слоя по три α-спирали
Слайд 13α/β Белки
Типичные мотивы строения α/β белков и их упрощенные модели (вид
"укладка Россманна" в NAD-связывающем домене малатдегидрогеназы (б).
Слайд 14Типичное положение активного центра (active site) в α/β белках: в "воронке"
Слайд 15α-β Белки
(β-Структура – параллельная!
Тип укладки – «седло»)
Домен 1 гексокиназы
Флаводоксин
Фосфоглицерат-мутаза
Слайд 16α+β Белки
Один из типичных мотив строения α+β белка:
"αβ складка" (αβ-plait)
Мотив укладки цепи, наблюдаемый в
β-домене нуклеазы, называется
"ОБ-укладка" ("OB-fold", то есть "Oligonucleotide-Binding fold").
Слайд 17βαβ-Петля (loop)
Типичный, правовинтовой ход перемычек
между параллельными β-тяжами одного листа.
Слайд 22Характерные мотивы чередования гидрофобных (·) и полярных (о) аминокислот в первичных
Слайд 23Мотивы укладки белковой цепи и орнаменты на индейских и греческих вазах:
Мотивы укладки белковой цепи и орнаменты на индейских и греческих вазах: два решения задачи окружения объема несамопресекающейся линией.
Слайд 24ДНК-связывающие белковые мотивы
(hth-motif)
Структура ДНК (слева) и ряда белков, обладающих характерным ДНК-связывающим
Слайд 25ДНК-связывающие белковые мотивы
(Zn-fingers; Leu-zipper; β-шпилька)
Три характерных ДНК-связывающих белковых мотива. В двух
Слайд 26Самоорганизация белков
In vivo:
Рибосома выдает белковую цепь постепенно, с паузами (приостановка биосинтеза
В клетке белковая цепь сворачивается под опекой специальных белков – шаперонов, которые препятствуют агрегации белков.
Самоорганизация белков может ускоряться некоторыми ферментами типа пролил-изомеразы или дисульфид-изомеразы.
In vitro:
Спонтанная самоорганизация белка происходит при ренатурации белка в растворе при соответствующих внешних условиях (малая концентрация белка, нужный окислительно-восстановительный потенциал). Если белок свернулся in vitro, то он свернулся в ту же структуру, что и in vivo.
Это означает, что необходимая для построения трехмерной структуры белка
информация содержится в химической последовательности аминокислот
в его цепи.
Парадокс Левинталя: ~10100 возможных конформаций для цепи из 100 остатков, их «перебор» занял бы ~1080 лет при времени перехода из одной конформации в другую 10-13 сек (возраст Вселенной 1010 лет).
Ответ: самоорганизующийся белок следует по специальному «пути сворачивания», его нативная структура определяется не стабильностью, не термодинамикой, а кинетикой, т.е. она соответствует не глобальному, а просто быстро достижимому минимуму свободной энергии цепи.
Слайд 29«Расплавленная глобула» - флуктуирующее состояние белка без уникальной пространственной структуры, универсальный
In vivo: транслокация белков через мембрану;
взаимодействие с шаперонами; сборка сложных клеточных структур; генетические заболевания.
Слайд 32Альбебетин – белок de novo
Белок с заданной вторичной структурой - альбебетин
Был использован в качестве носителя функциональной активности:
Альбеферон =
альбебетин + фрагмент 131-138
(активирует бласт-трансформацию тимоцитов)
интерферона α2 человека.
Еще один белок со структурой, запланированной для альбебетина,
был получен при помощи циркулярной пермутации рибосомального
белка S6 – обладает твердой,
кооперативно плавящейся пространственной структурой.
Слайд 33Белок de novo – димер из двух β-шпилек,
Человеческий эритропоэтин (166 АКО)