- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Репликация ДНК и РНК презентация
Содержание
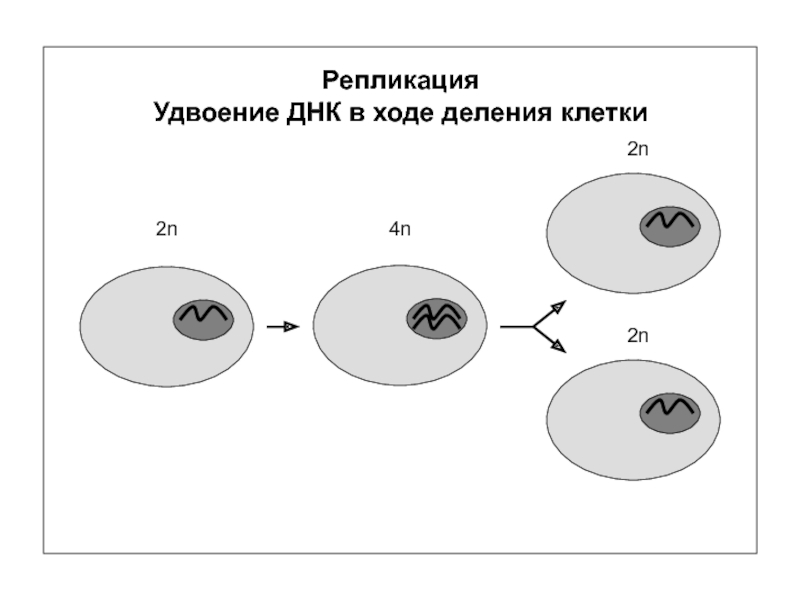
- 1. Репликация ДНК и РНК
- 2. ФУНКЦИИ НУКЛЕИНОВЫХ КИСЛОТ КАК ГЕНЕТИЧЕСКОГО МАТЕРИАЛА
- 3. Центральная догма молекулярной биологии Фрэнсис Крик
- 4. ДНК Хранение и передача нуклеиновыми кислотами генетической информации в неизменном виде
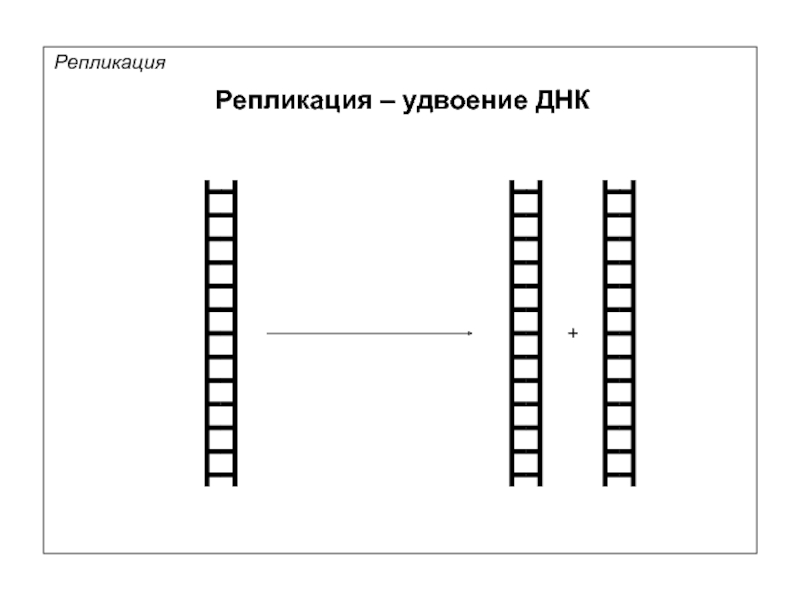
- 6. Репликация – удвоение ДНК Репликация +
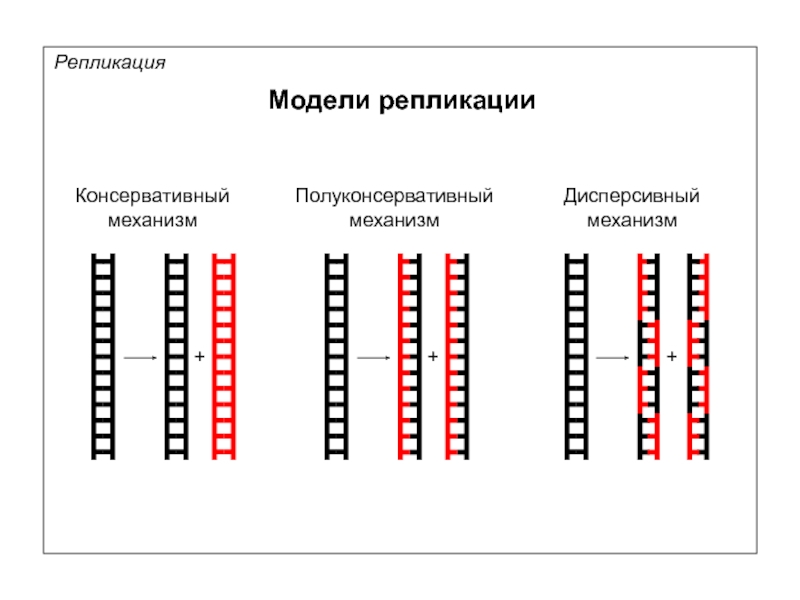
- 7. Модели репликации Репликация Консервативный механизм Полуконсервативный механизм Дисперсивный механизм + + +
- 8. Полуконсервативный механизм репликации Репликация Мэтью Стэнли
- 9. Эксперимент Мезельсона-Сталя (PNAS.-1958.-44:671-682) Репликация 14N -
- 10. Репликация Формирование градиента плотности CsCl (исходная
- 11. Репликация Зоны ДНК, очищенной из E.coli
- 12. Репликация ДНК из E.coli после выращивания
- 13. Репликация Что доказывает эксперимент Мезельсона-Сталя? 0
- 14. Репликация Точка начала репликации и репликационные
- 15. 13-19 мин Репликация Точка начала репликации
- 16. Репликация Репликация кольцевой ДНК механизм «катящегося
- 18. Небольшое отступление Кольцевая и псевдокольцевая ДНК
- 20. 1. Оксидоредуктазы 2. Трансферазы
- 21. Репликация ДНК-полимераза (трансфераза) α-[32P]-дезоксирибонуклеотиды α-[32P]-дАТФ α-[32P]-дГТФ
- 22. Очистка белков Освновной принцип – обогащение
- 23. Очистка белков Избирательное осаждение белков Изоэлектрическая
- 24. Избирательное осаждение белков
- 25. Избирательное осаждение белков Изоэлектрическая точка и
- 26. Избирательное осаждение белков Высаливание В водном растворе
- 27. Избирательное осаждение белков Высаливание
- 28. Избирательное осаждение белков Высаливание Очистка белков
- 29. Избирательное осаждение белков Денатурация (удаление из
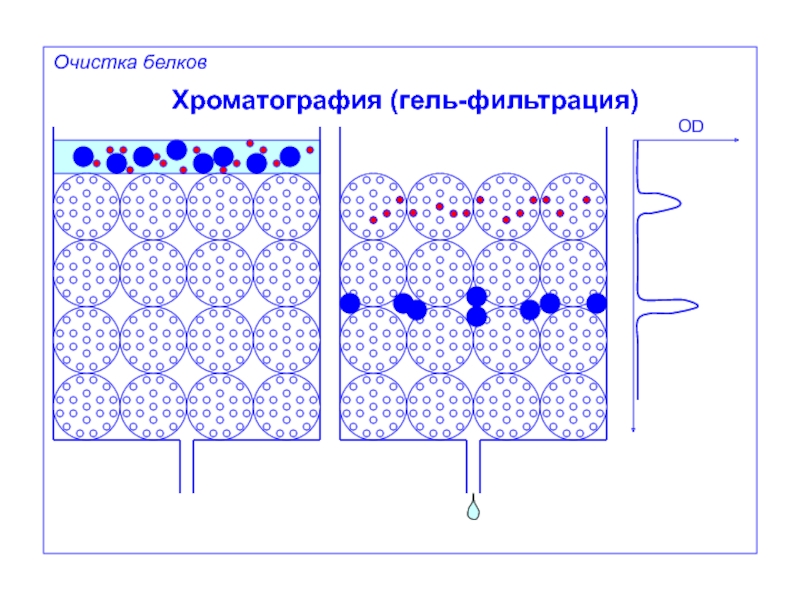
- 30. Хроматография (гель-фильтрация)
- 31. Репликация ДНК-полимераза
- 32. Удаляем нуклеотиды
- 33. Добавляем фракцию, обогащенную
- 34. Репликация ДНК-полимераза (трансфераза) (дNМФ)n + дNТФ
- 36. ДНК-полимераза требует наличия матрицы (материнской ДНК). ДНК-полимераза
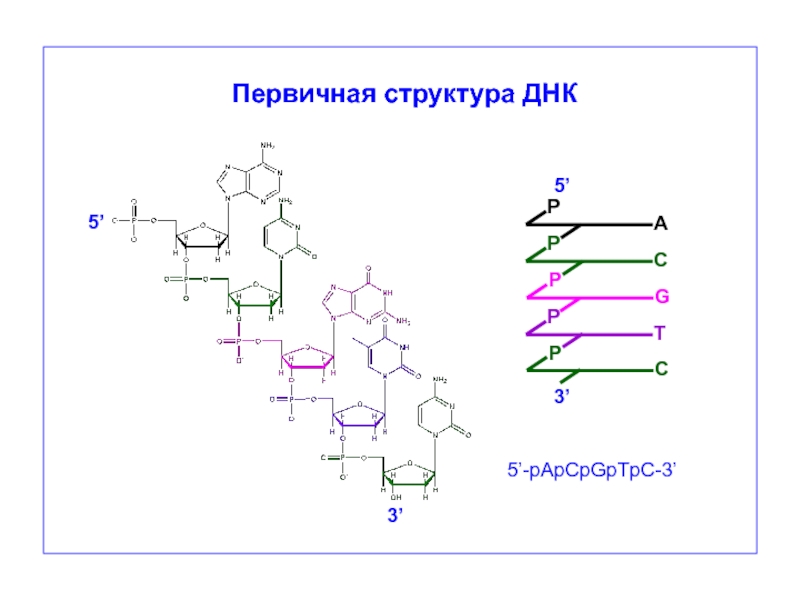
- 37. P G 5’ 3’ 5’-pApCpGpTpC-3’ P P
- 38. ДНК-полимераза работает только на одноцепочечной ДНК
- 39. ДНК-полимераза не может начать синтез ДНК с
- 40. Репликация ДНК-полимераза ДНК-полимераза присоединяет дезоксирибонуклеотидмонофосфат к
- 41. Репликация Лидирующая и отстающая нити ДНК
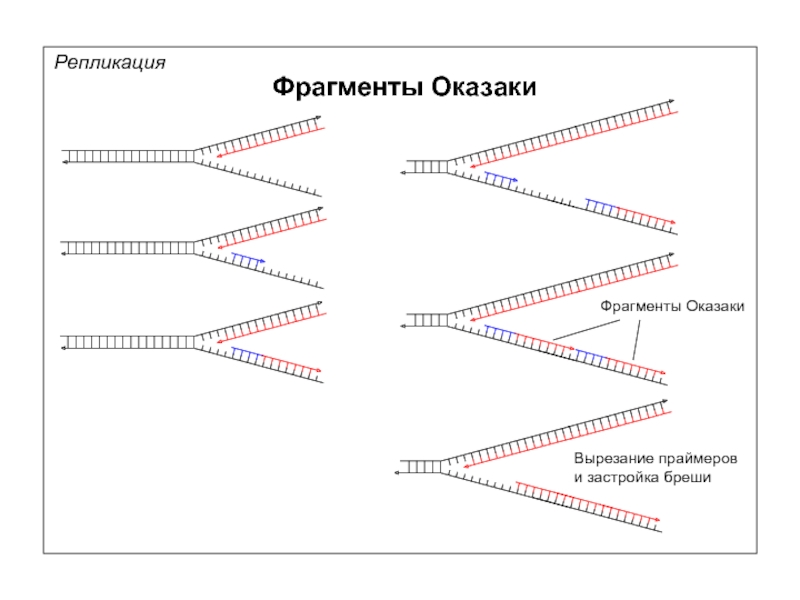
- 42. Репликация Фрагменты Оказаки Рэйдзи Оказаки (Reiji
- 43. Репликация Фрагменты Оказаки Фрагменты Оказаки Вырезание праймеров и застройка бреши
- 45. Репликация Этапы репликации Расплетание ДНК Синтез
- 46. Репликация Этапы репликации Расплетание ДНК Топоизомераза
- 47. Репликация Этапы репликации Синтез праймера
- 48. Репликация Этапы репликации Синтез нуклеотидов АДФ
- 49. Репликация Этапы репликации Синтез ДНК
- 50. Репликация Этапы репликации Синтез
- 51. Репликация Этапы репликации 5’
- 52. Репликация Этапы репликации
- 53. Репликация Этапы репликации
- 54. Репликация Этапы репликации
- 55. Репликация Этапы репликации
- 56. Репликация Этапы репликации
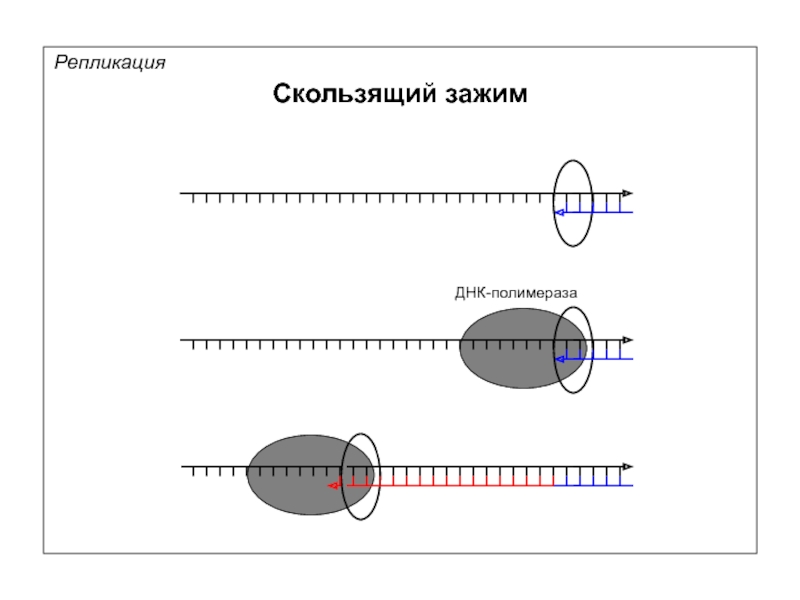
- 58. Репликация Скользящий зажим
- 59. Репликация Скользящий зажим Белок β и двухцепочечная ДНК Белок β PCNA
- 60. Репликация Скользящий зажим + PPi
- 61. Репликация Скользящий зажим ДНК-полимераза
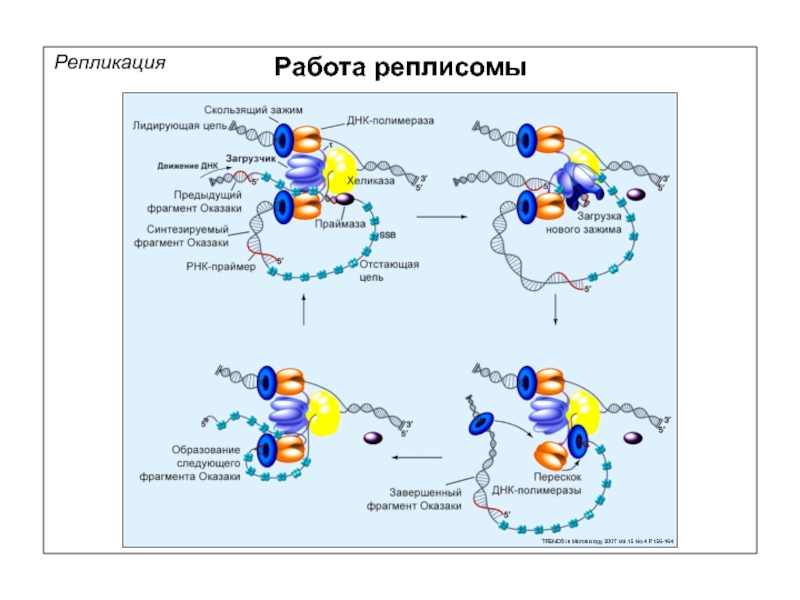
- 62. Репликация Работа реплисомы TRENDS in Microbiology 2007 Vol.15 No.4 P.156-164
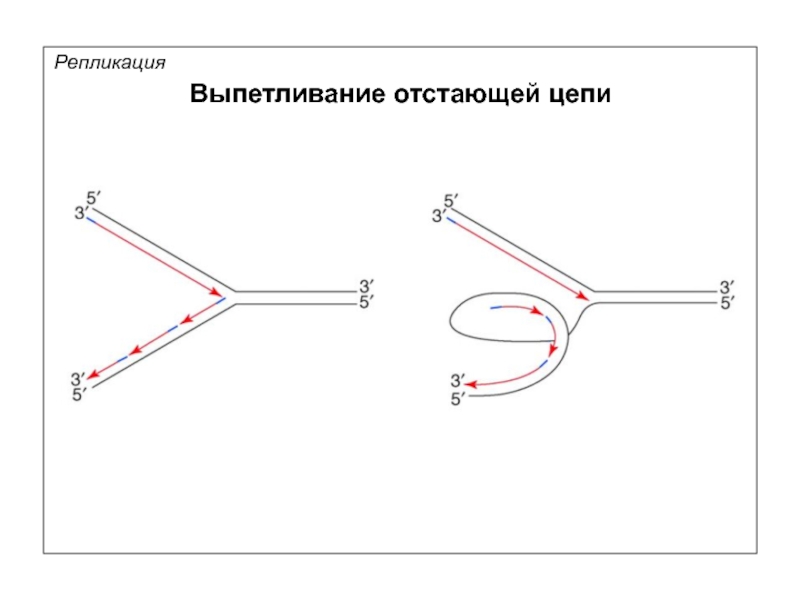
- 63. Репликация Выпетливание отстающей цепи
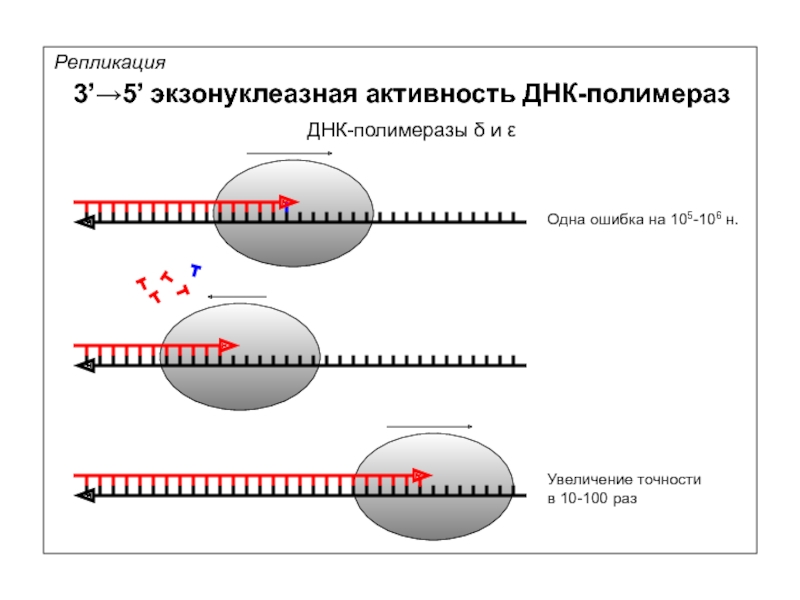
- 64. Репликация 3’→5’ экзонуклеазная активность ДНК-полимераз
- 66. Репликация Проблема концов хромосом эукариот Маргинотомия
- 68. Репликация Теломеры
- 69. Репликация Теломераза РНК-зависимая ДНК-полимераза (трансфераза) Добавляет
- 70. Репликация Теломераза Нобелевская премия 2009 г.
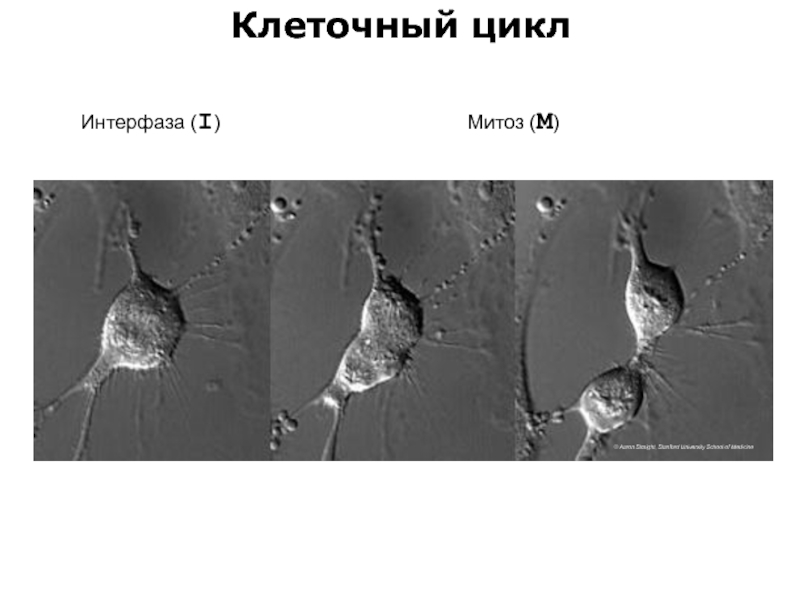
- 72. Клеточный цикл © Aaron Straight, Stanford University School of Medicine Интерфаза (I) Митоз (М)
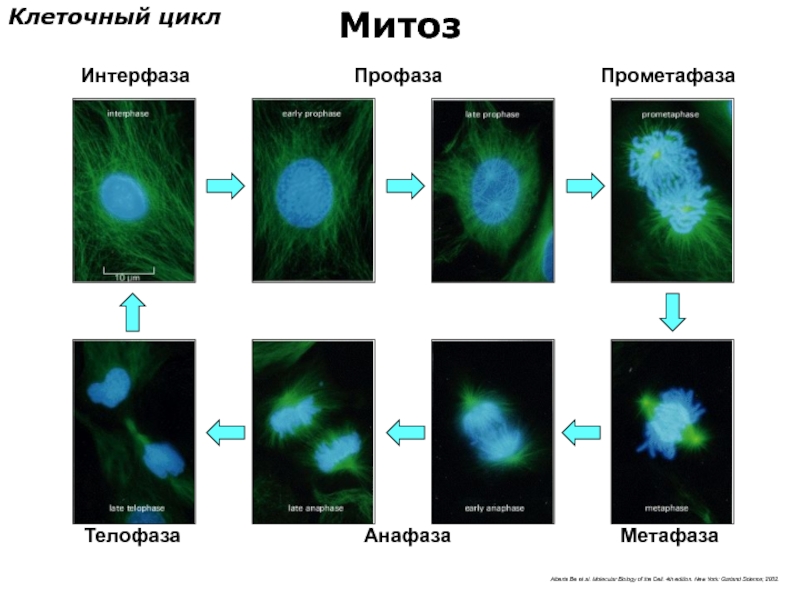
- 73. Интерфаза Метафаза Профаза Прометафаза Анафаза Телофаза Клеточный
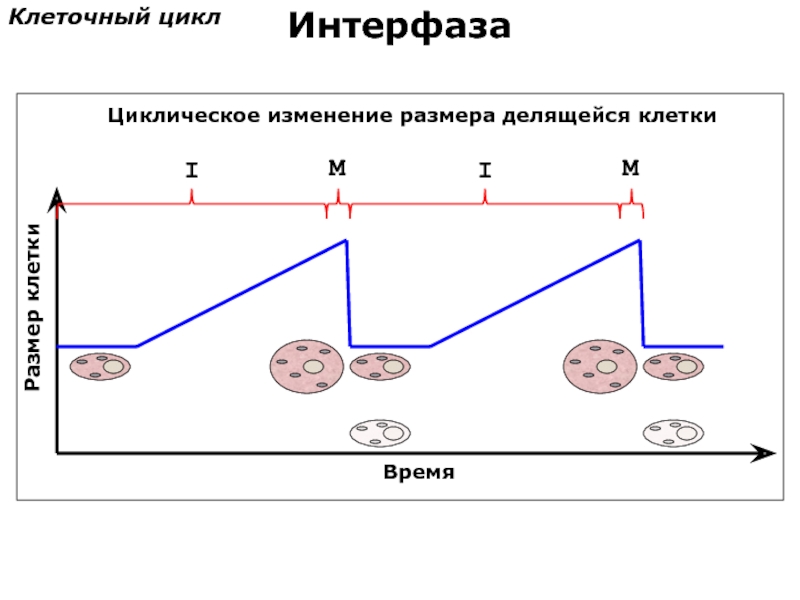
- 74. Размер клетки Время I M
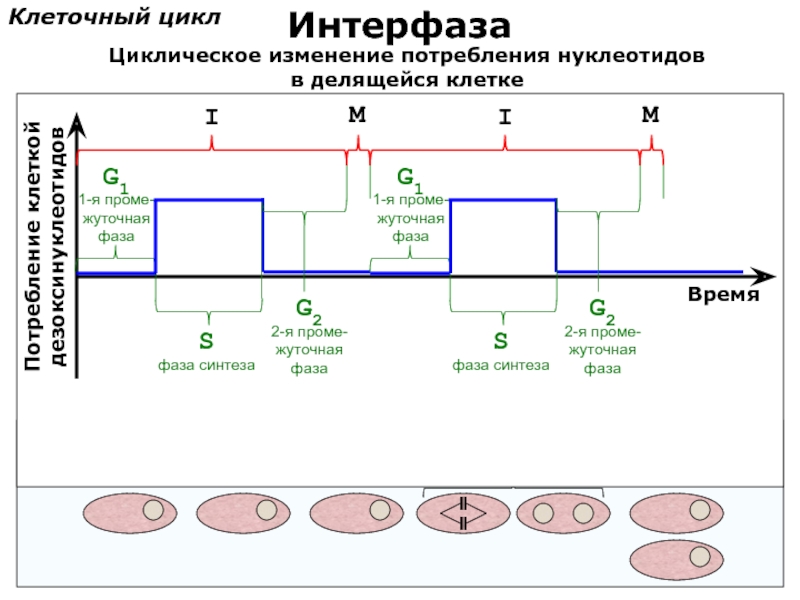
- 75. Клеточный цикл Интерфаза Потребление клеткой дезоксинуклеотидов
- 76. Клеточный цикл G0
- 77. Клеточный цикл Исследование клеточного цикла http://www.cbp.pitt.edu/faculty/yong_wan/index.html
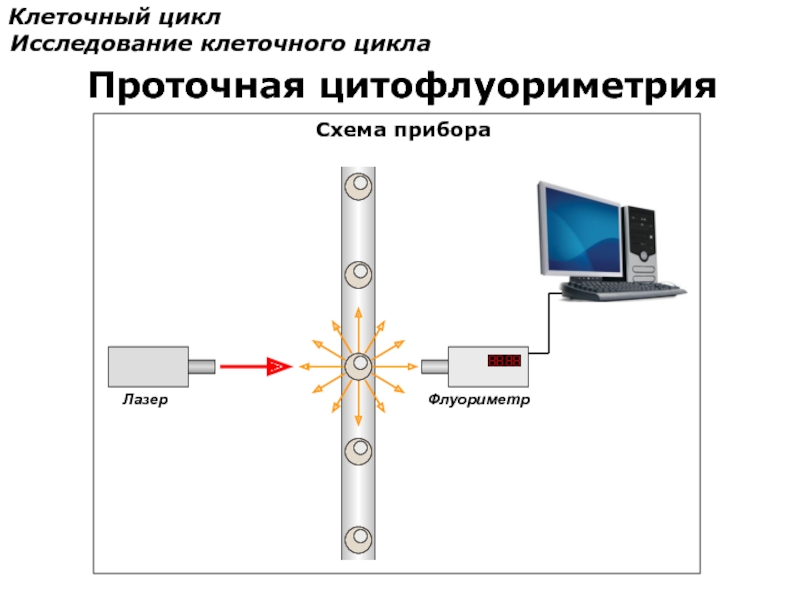
- 78. Клеточный цикл Исследование клеточного цикла Проточная
- 79. Количество ДНК в одной клетке Время
- 80. Клеточный цикл Исследование клеточного цикла Проточная цитофлуориметрия Схема прибора
- 81. Клеточный цикл Исследование клеточного цикла Проточная
- 82. Клеточный цикл Исследование клеточного
- 83. Клеточный цикл Исследование клеточного цикла Проточная цитофлуориметрия
- 85. Репликация Полимеразная цепная реакция (ПЦР) Матрица
- 86. Репликация Полимеразная цепная реакция (ПЦР) Симуляция работы хеликазы Плавление ДНК 96°С
- 87. Репликация Полимеразная цепная реакция (ПЦР) Симуляция работы праймазы Подбор и заказ праймеров Отжиг праймеров
- 88. Репликация Полимеразная цепная реакция (ПЦР) Полимеризация
- 89. Репликация ПЦР 1-й цикл Плавление Отжиг
- 90. Репликация ПЦР 2-й цикл Плавление Отжиг
- 91. Репликация ПЦР 3-й цикл Плавление Отжиг
- 92. Репликация ПЦР Матриц - 1
- 93. alexei@icp.ac.ru
Слайд 2
ФУНКЦИИ НУКЛЕИНОВЫХ КИСЛОТ
КАК ГЕНЕТИЧЕСКОГО МАТЕРИАЛА
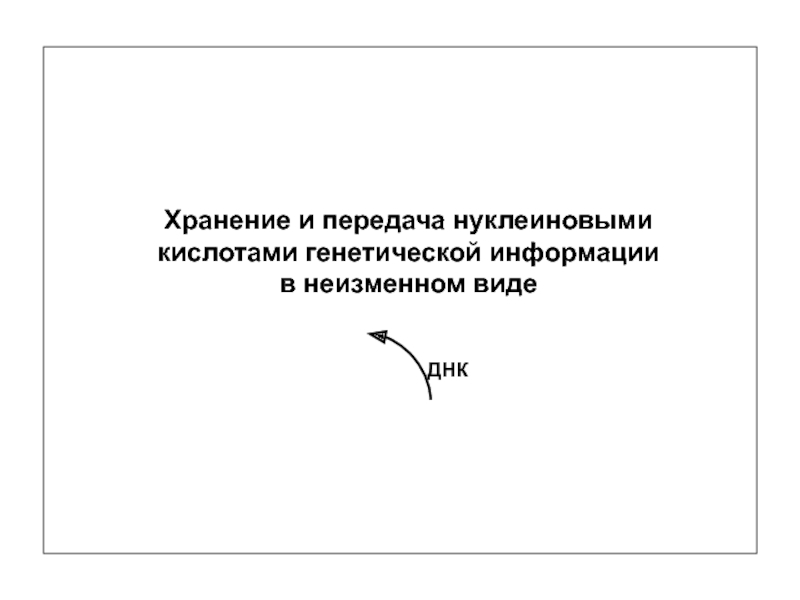
Хранение, передача и реализация генетической информации
Хранение –
Передача – копирование информации в неизменном виде
Реализация – извлечение и преобразование информации
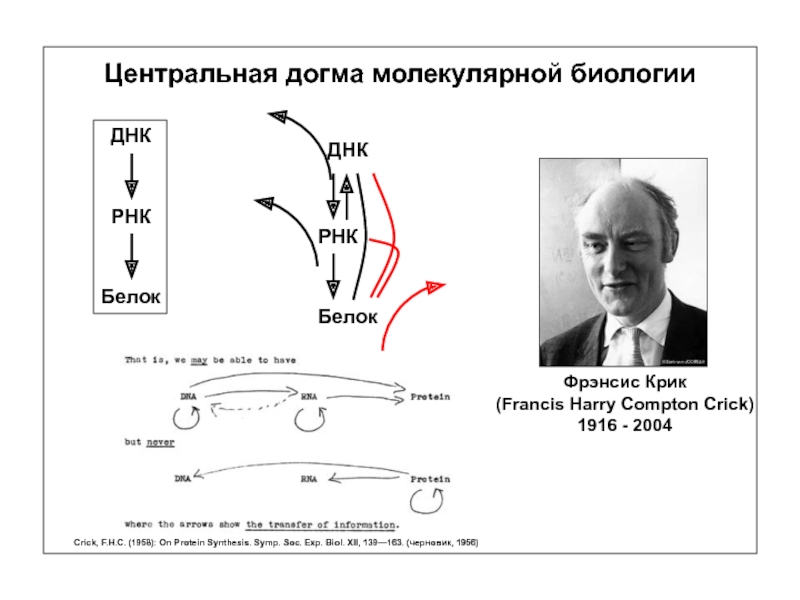
Слайд 3
Центральная догма молекулярной биологии
Фрэнсис Крик
(Francis Harry Compton Crick)
1916 - 2004
ДНК
РНК
Белок
ДНК
РНК
Белок
Crick, F.H.C.
Слайд 7
Модели репликации
Репликация
Консервативный
механизм
Полуконсервативный
механизм
Дисперсивный
механизм
+
+
+
Слайд 8
Полуконсервативный механизм репликации
Репликация
Мэтью Стэнли Мезенсон
Matthew Stanley Meselson
1930 г.р.
Франклин Уильям Сталь
Franklin William
1929 г.р.
(История самого красивого эксперимента в биологии)
Слайд 9
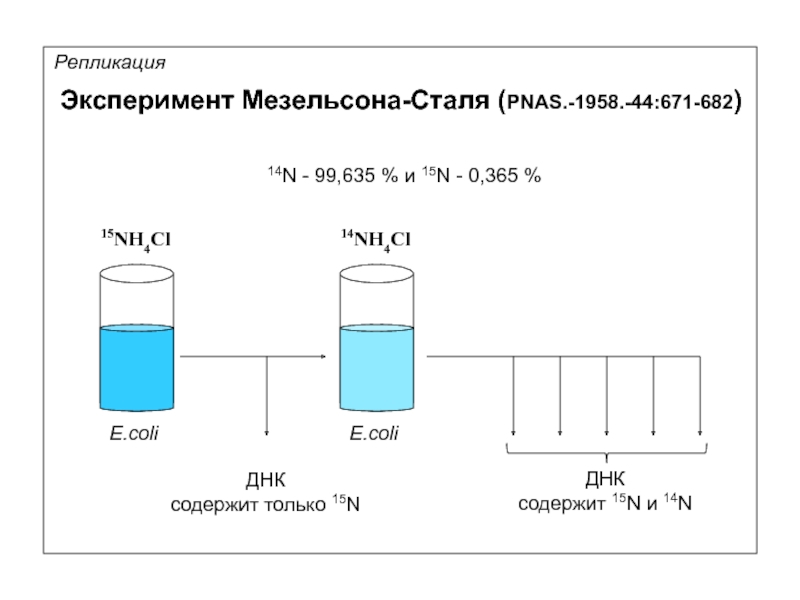
Эксперимент Мезельсона-Сталя (PNAS.-1958.-44:671-682)
Репликация
14N - 99,635 % и 15N - 0,365 %
15NH4Cl
E.coli
E.coli
14NH4Cl
ДНК
cодержит
ДНК
cодержит 15N и 14N
Слайд 10
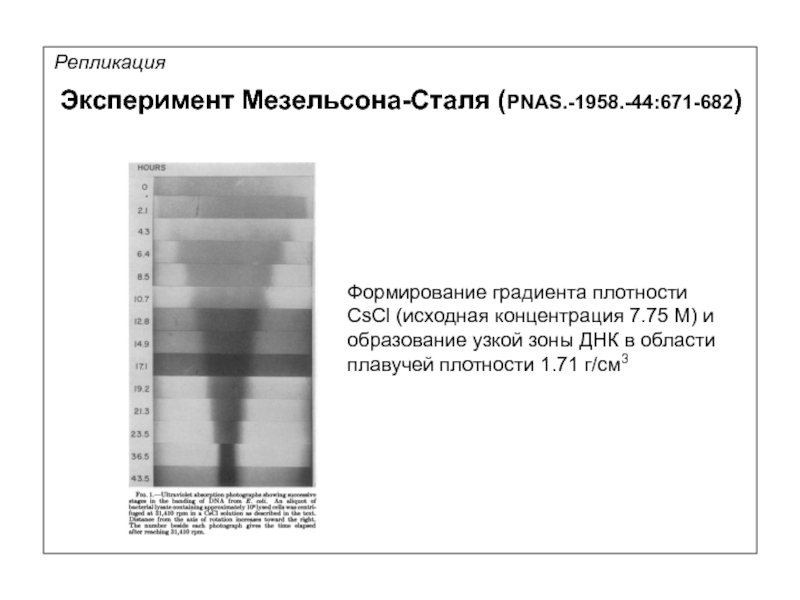
Репликация
Формирование градиента плотности
CsCl (исходная концентрация 7.75 М) и
образование узкой зоны ДНК
плавучей плотности 1.71 г/см3
Эксперимент Мезельсона-Сталя (PNAS.-1958.-44:671-682)
Слайд 11
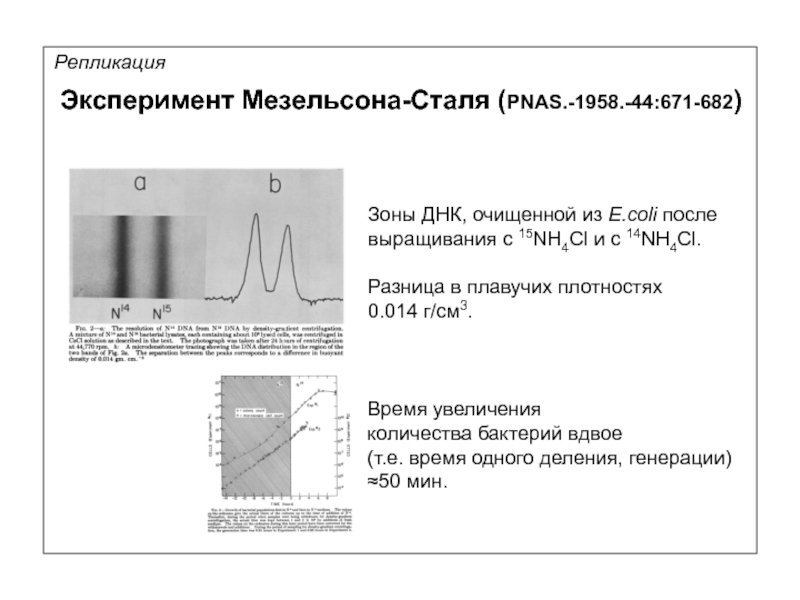
Репликация
Зоны ДНК, очищенной из E.coli после
выращивания с 15NH4Cl и c 14NH4Cl.
Разница
0.014 г/см3.
Время увеличения
количества бактерий вдвое
(т.е. время одного деления, генерации) ≈50 мин.
Эксперимент Мезельсона-Сталя (PNAS.-1958.-44:671-682)
Слайд 12
Репликация
ДНК из E.coli после выращивания с 15NH4Cl
ДНК из E.coli после
в течение 1 генерации
Замена 15NH4Cl на 14NH4Cl
ДНК из E.coli после выращивания с 14NH4Cl
в течение 3 генераций
ДНК из E.coli после выращивания с 14NH4Cl
в течение 2 генераций
ДНК из E.coli после выращивания с 14NH4Cl
в течение 4 генераций
15N
15N/14N
15N/14N
14N
15N/14N
14N
15N/14N
14N
Эксперимент Мезельсона-Сталя (PNAS.-1958.-44:671-682)
Слайд 13
Репликация
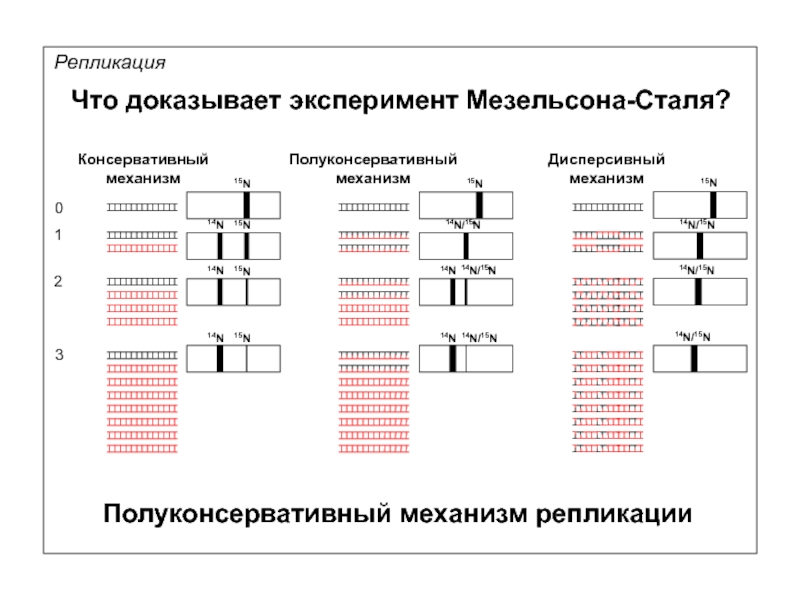
Что доказывает эксперимент Мезельсона-Сталя?
0
1
2
3
Дисперсивный
механизм
15N
15N
14N
15N
14N
15N
14N
15N
14N/15N
14N
14N
14N/15N
14N/15N
15N
14N/15N
14N/15N
14N/15N
Полуконсервативный механизм репликации
Слайд 14
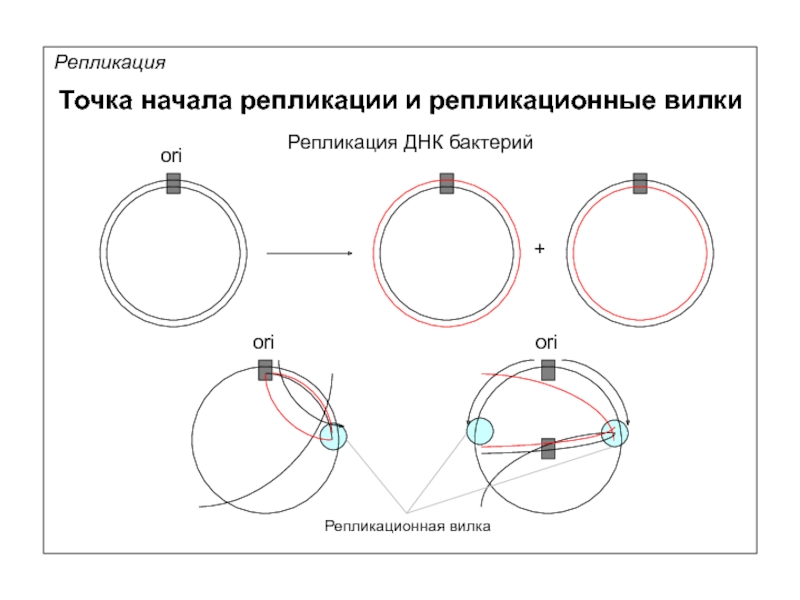
Репликация
Точка начала репликации и репликационные вилки
ori
Репликация ДНК бактерий
+
Репликационная вилка
Слайд 1513-19 мин
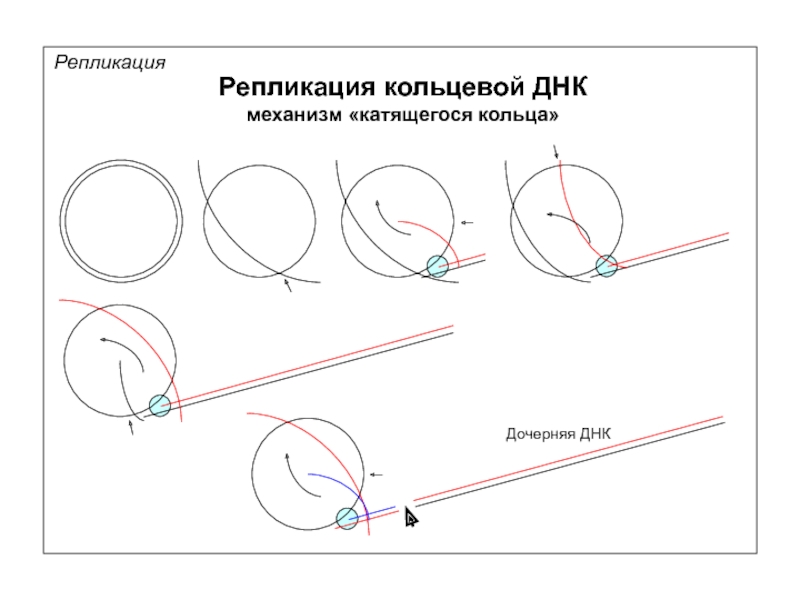
Репликация
Точка начала репликации и репликационные вилки
ori
ori
Эксперимент с меченными нуклеотидами разной
[3H]-тимин
с низкой удельной
радиоактивностью
[3H]-тимидин
с высокой удельной
радиоактивностью
2.5 мин
Очистка ДНК,
авторадиография
PNAS.-1972.-69:2842-2845
Слайд 18
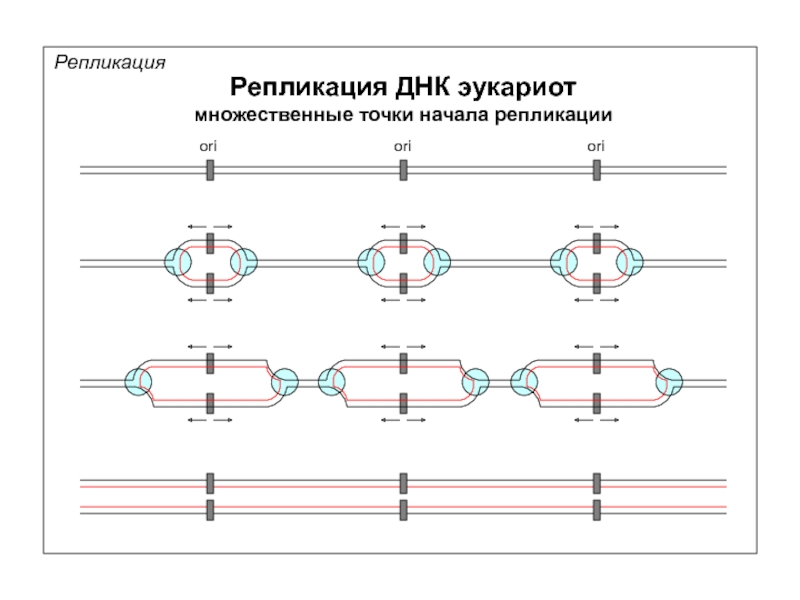
Небольшое отступление
Кольцевая и псевдокольцевая ДНК
Надцарство прокариот
(3.5 млрд. лет)
Надцарство эукариот
(1.5-2 млрд. лет)
©
Кольцевые хромосомы
Линейные хромосомы
Петли ДНК с фиксированными концами
Слайд 20
1. Оксидоредуктазы
2. Трансферазы
3. Гидролазы
4. Лиазы
5. Изомеразы
6. Лигазы
Небольшое отступление
A(окисл) + B(восст) →
A-X + B → A + B-X
A + H2O → B-H + C-OH
A → B + C
A → A’
A + B → C
Ферменты
Классы ферментов
Слайд 21
Репликация
ДНК-полимераза
(трансфераза)
α-[32P]-дезоксирибонуклеотиды
α-[32P]-дАТФ
α-[32P]-дГТФ
α-[32P]-дЦТФ
α-[32P]-дТТФ
+ экстракт E.coli
Очистка ДНК
Измерение
радиоактивности
ДНК
Слайд 22
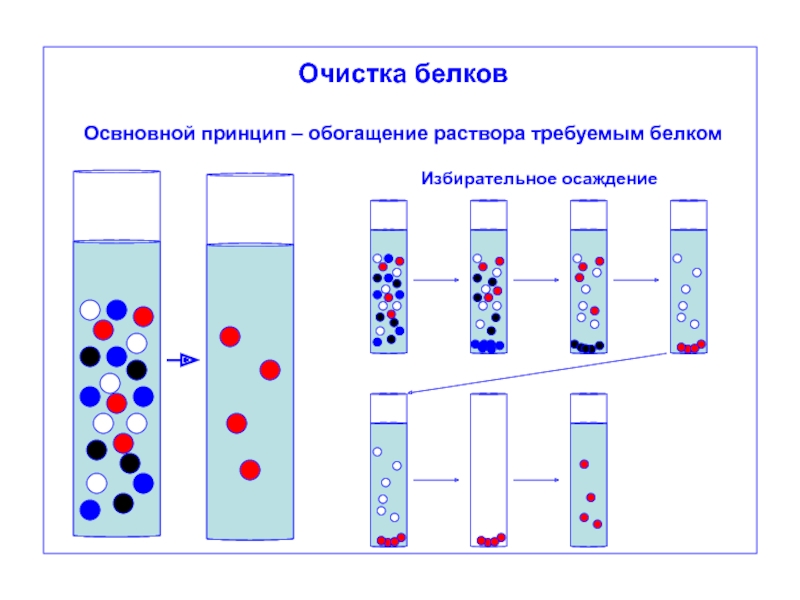
Очистка белков
Освновной принцип – обогащение раствора требуемым белком
Избирательное осаждение
Слайд 23
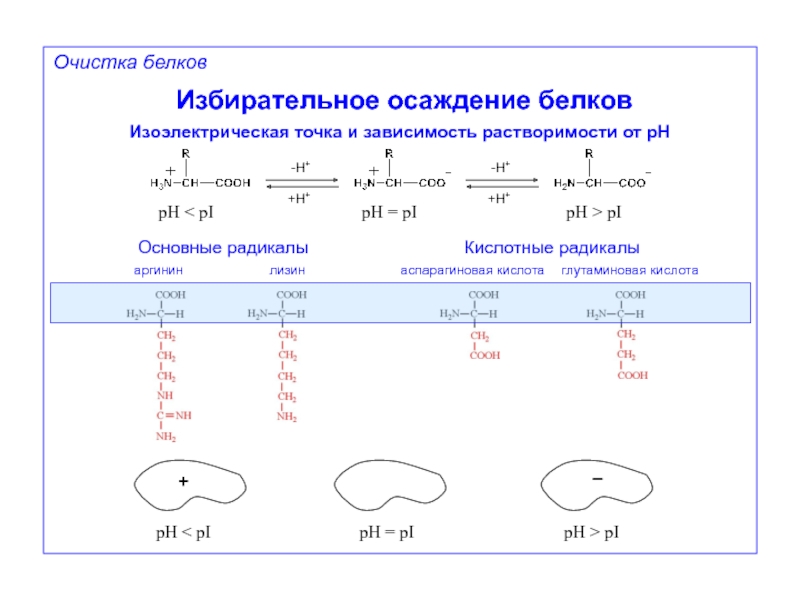
Очистка белков
Избирательное осаждение белков
Изоэлектрическая точка и зависимость растворимости от pH
-H+
+H+
-H+
+H+
pH
pH = pI
pH > pI
аспарагиновая кислота
глутаминовая кислота
Кислотные радикалы
аргинин
лизин
Основные радикалы
pH < pI
pH = pI
pH > pI
+
–
Слайд 24
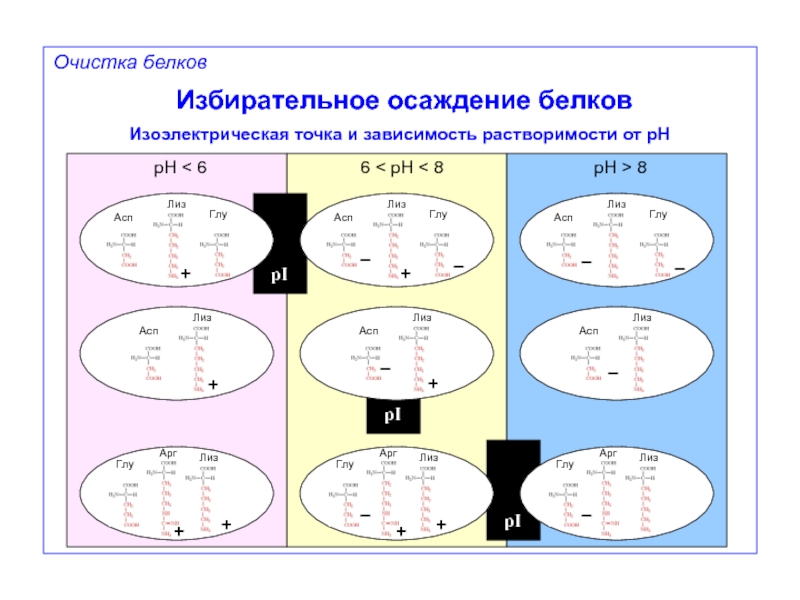
Избирательное осаждение белков
Изоэлектрическая точка и зависимость растворимости от pH
pH < 6
6
pH > 8
–
–
+
+
–
–
–
+
–
+
+
+
+
+
–
–
Очистка белков
Слайд 25
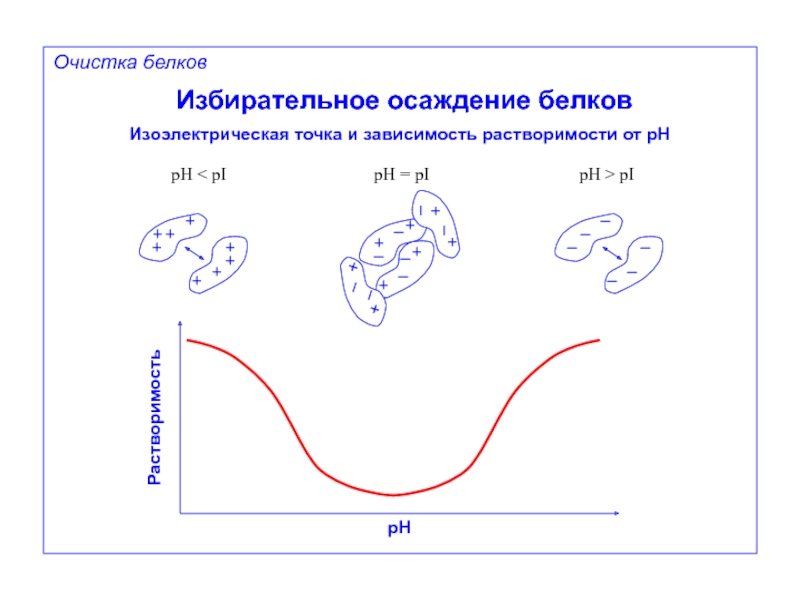
Избирательное осаждение белков
Изоэлектрическая точка и зависимость растворимости от pH
+
+
+
+
+
+
–
–
–
–
–
–
+
+
pH < pI
pH
pH > pI
pH
Растворимость
Очистка белков
Слайд 26Избирательное осаждение белков
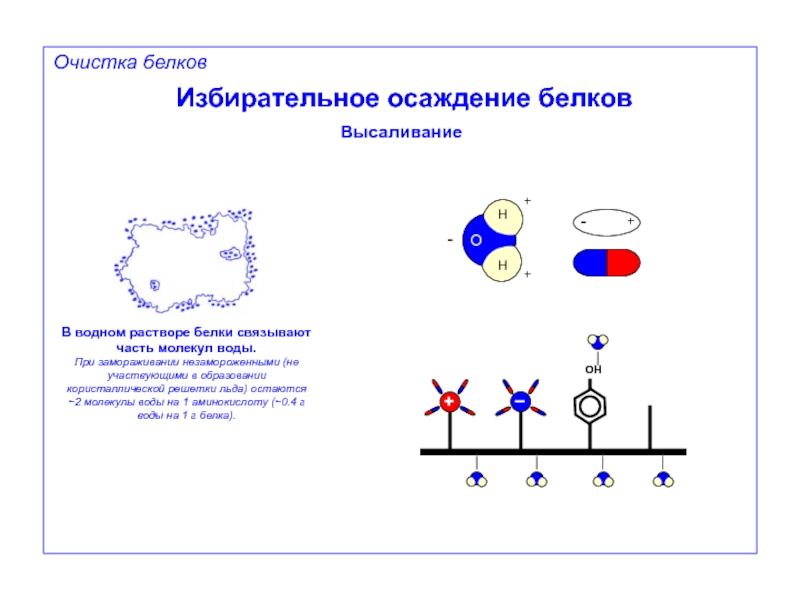
Высаливание
В водном растворе белки связывают часть молекул воды.
При замораживании
+
+
-
–
+
Очистка белков
Слайд 27
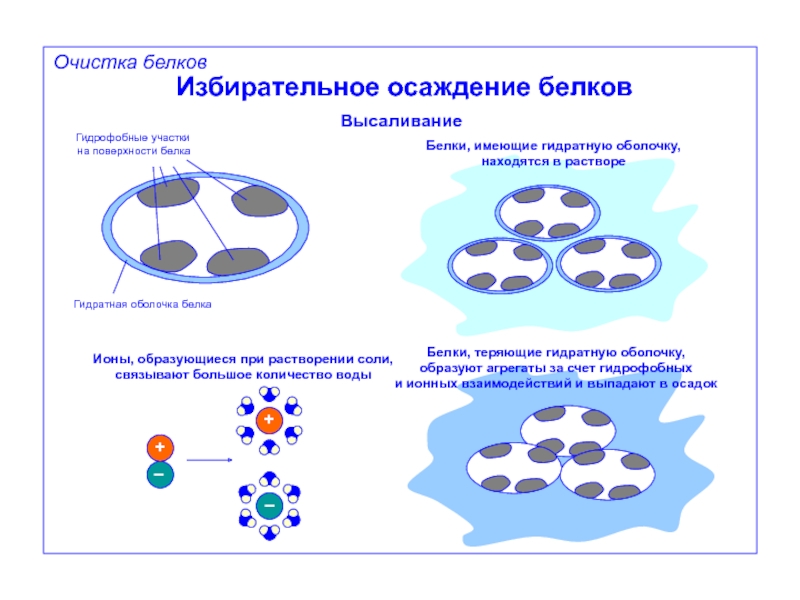
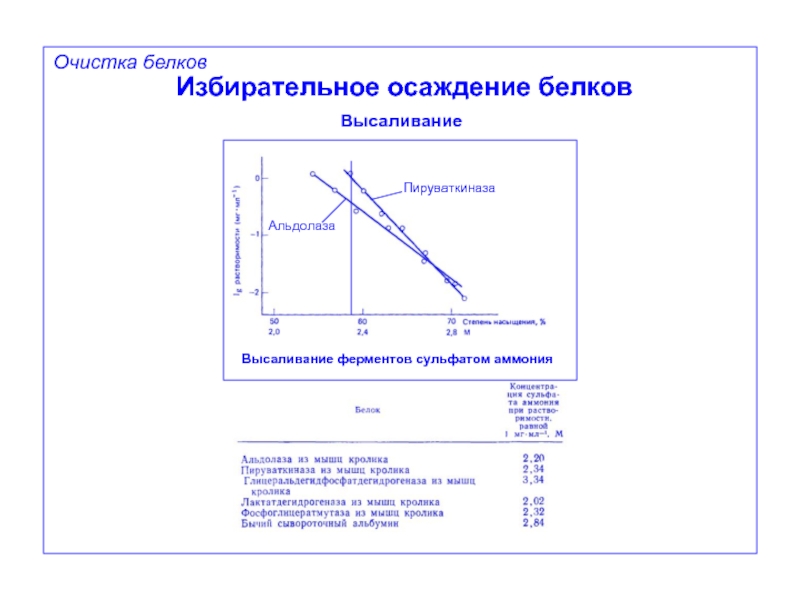
Избирательное осаждение белков
Высаливание
Гидрофобные участки
на поверхности белка
Гидратная оболочка белка
Белки, имеющие гидратную оболочку,
находятся
Белки, теряющие гидратную оболочку,
образуют агрегаты за счет гидрофобных
и ионных взаимодействий и выпадают в осадок
Ионы, образующиеся при растворении соли, связывают большое количество воды
Очистка белков
Слайд 29Избирательное осаждение белков
Денатурация
(удаление из смеси ненужных белков)
pH (сильный сдвиг)
Температура
Органические растворители
Денатурация
(потеря третичной
Агрегация и осаждение
стали доступны
для взаимодействий
многие группы,
скрытые в белковой глобуле
Очистка белков
Слайд 31
Репликация
ДНК-полимераза
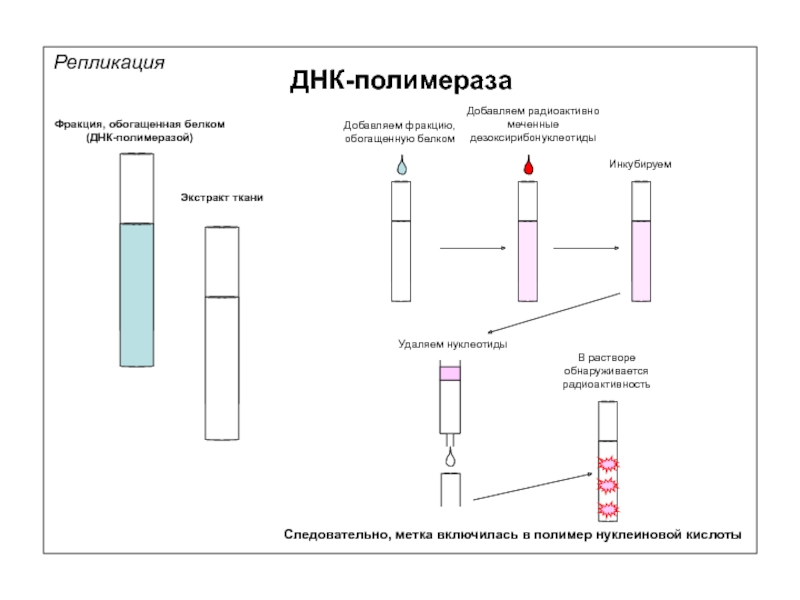
Фракция, обогащенная белком
(ДНК-полимеразой)
Экстракт ткани
Добавляем фракцию, обогащенную белком
Добавляем радиоактивно меченные дезоксирибонуклеотиды
Инкубируем
Удаляем нуклеотиды
В
Следовательно, метка включилась в полимер нуклеиновой кислоты
Слайд 32
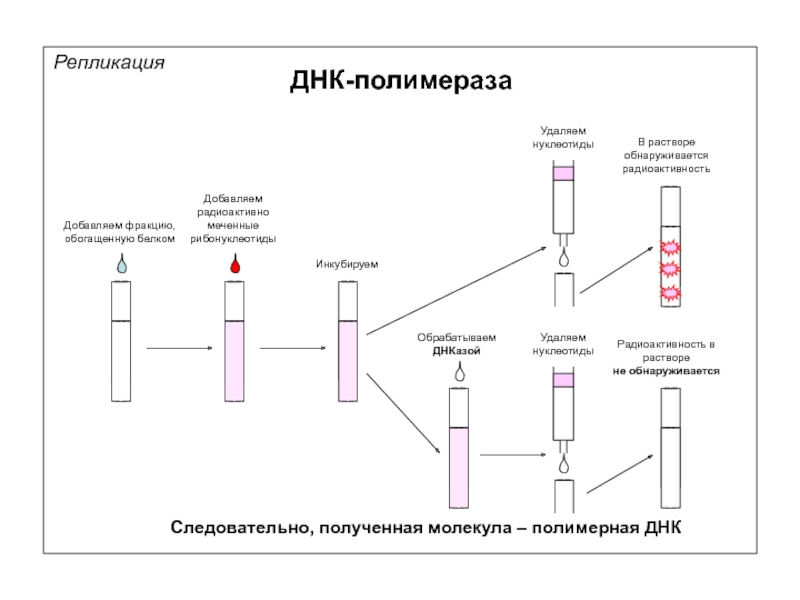
Удаляем
нуклеотиды
Удаляем
нуклеотиды
Добавляем фракцию, обогащенную белком
Добавляем радиоактивно меченные рибонуклеотиды
Инкубируем
Радиоактивность в растворе
не обнаруживается
Следовательно, полученная
Обрабатываем
ДНКазой
В растворе обнаруживается радиоактивность
Репликация
ДНК-полимераза
Слайд 33
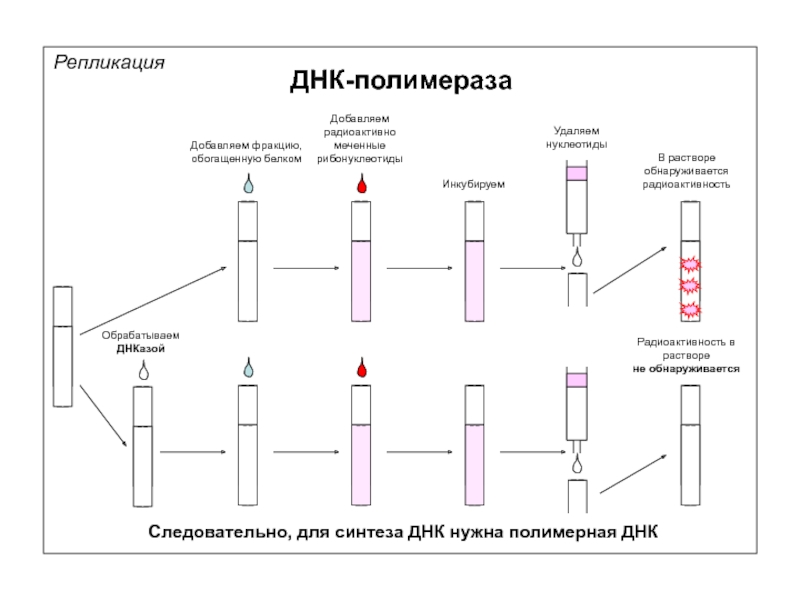
Добавляем фракцию, обогащенную белком
Добавляем радиоактивно меченные рибонуклеотиды
Инкубируем
Следовательно, для синтеза ДНК нужна
Обрабатываем
ДНКазой
Радиоактивность в растворе
не обнаруживается
В растворе обнаруживается радиоактивность
Репликация
Удаляем
нуклеотиды
ДНК-полимераза
Слайд 34
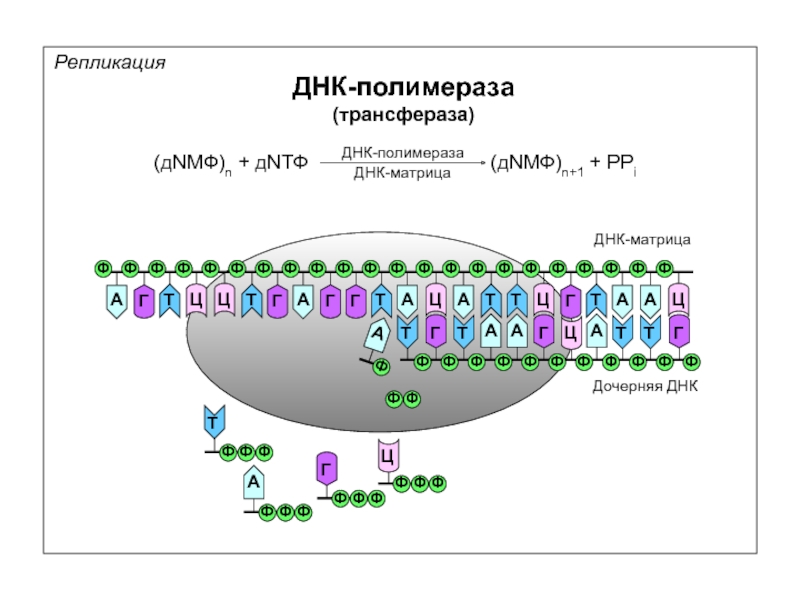
Репликация
ДНК-полимераза
(трансфераза)
(дNМФ)n + дNТФ
(дNМФ)n+1 + PPi
ДНК-полимераза
ДНК-матрица
ДНК-матрица
Дочерняя ДНК
Слайд 36ДНК-полимераза требует наличия матрицы (материнской ДНК).
ДНК-полимераза присоединяет дезоксирибонуклеозидмонофосфат в соответствии с
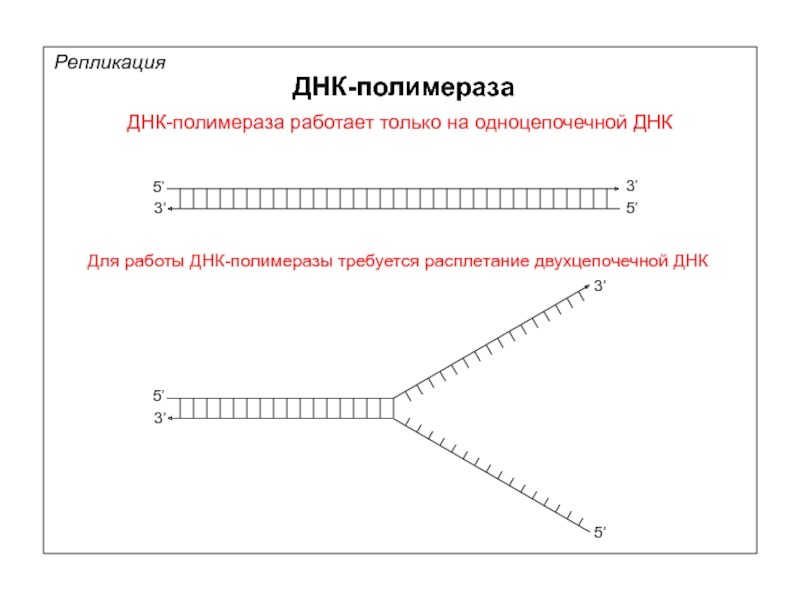
ДНК-полимераза работает только на одноцепочечной ДНК.
ДНК-полимераза не может начать синтез ДНК с первого нуклеотида, она присоединяет дезоксирибонуклеозидмонофосфат только к уже существующей ДНК (РНК).
ДНК-полимераза присоединяет дезоксирибонуклеозидмонофосфат к 3’-ОН группе дезоксирибозы.
Репликация
ДНК-полимераза
Слайд 38ДНК-полимераза работает только на одноцепочечной ДНК
Репликация
ДНК-полимераза
5’
5’
3’
3’
Для работы ДНК-полимеразы требуется расплетание двухцепочечной
5’
5’
3’
3’
Слайд 39ДНК-полимераза не может начать синтез ДНК с первого нуклеотида, она присоединяет
только к уже существующей ДНК
Репликация
ДНК-полимераза
5’
5’
3’
3’
5’
5’
3’
3’
Для работы ДНК-полимеразы требуется затравка (праймер)
5’
5’
3’
3’
5’
3’
3’
5’
Слайд 40
Репликация
ДНК-полимераза
ДНК-полимераза присоединяет дезоксирибонуклеотидмонофосфат
к 3’-ОН группе дезоксирибозы
5’
5’
3’
3’
5’
5’
3’
3’
Дочерняя нить ДНК растет в направлении
Матрицей служит материнская нить в направлении 3’-5’
5’
5’
3’
3’
Слайд 41
Репликация
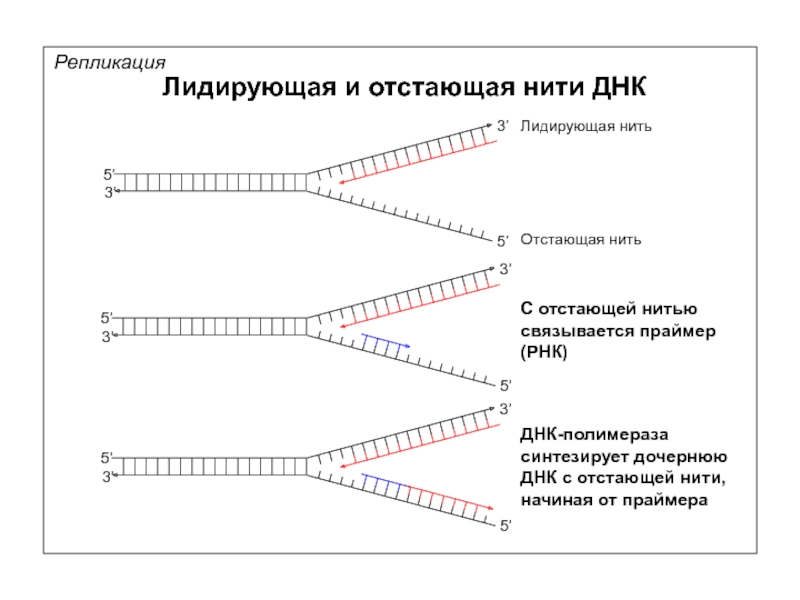
Лидирующая и отстающая нити ДНК
5’
5’
3’
3’
5’
5’
3’
3’
Лидирующая нить
Отстающая нить
С отстающей нитью связывается праймер
ДНК-полимераза синтезирует дочернюю ДНК с отстающей нити, начиная от праймера
Слайд 42
Репликация
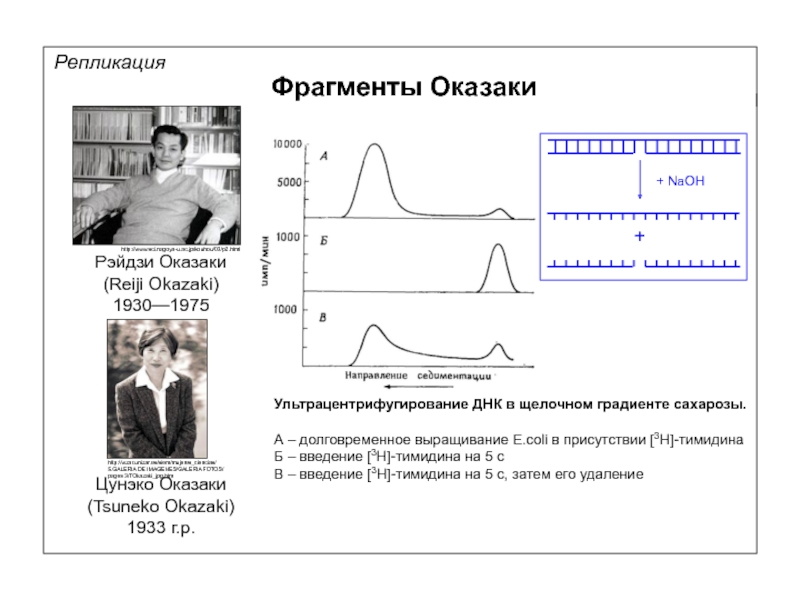
Фрагменты Оказаки
Рэйдзи Оказаки
(Reiji Okazaki)
1930—1975
Цунэко Оказаки
(Tsuneko Okazaki)
1933 г.р.
Ультрацентрифугирование ДНК в щелочном градиенте
А – долговременное выращивание E.coli в присутствии [3H]-тимидина
Б – введение [3H]-тимидина на 5 с
В – введение [3H]-тимидина на 5 с, затем его удаление
+ NaOH
+
Слайд 45
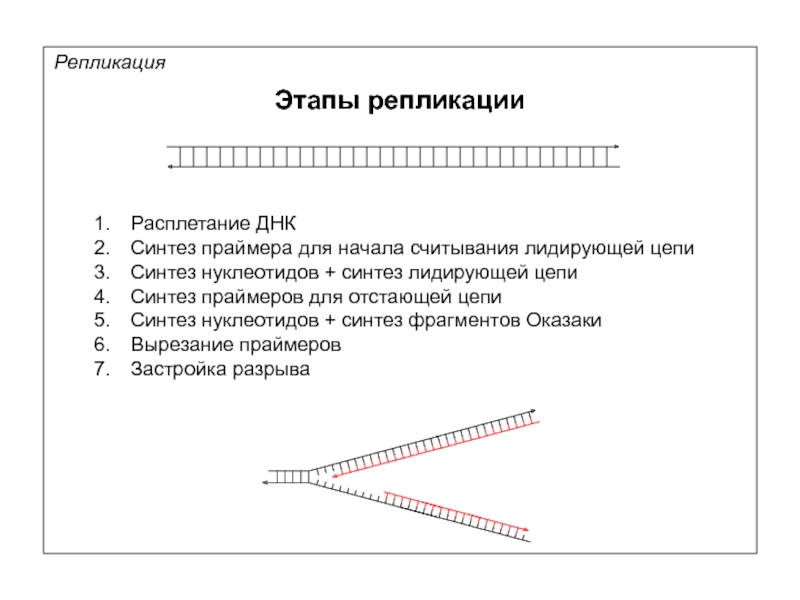
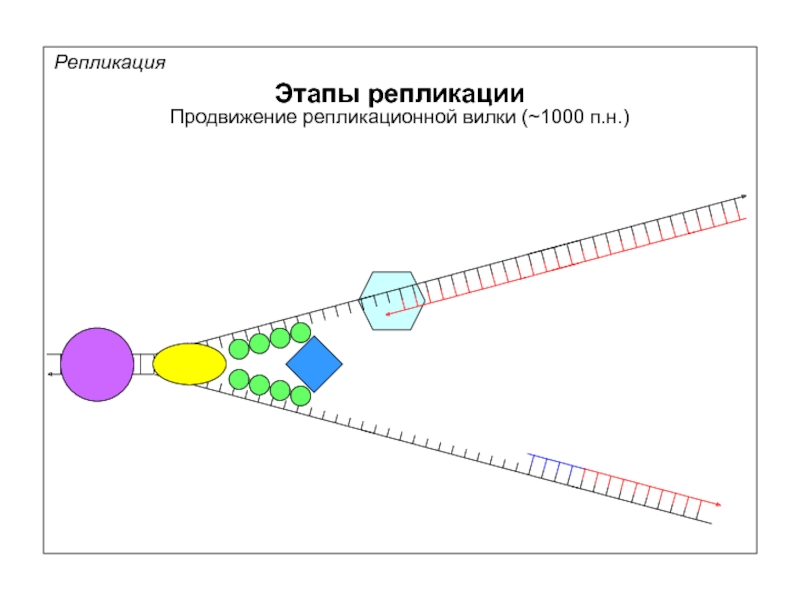
Репликация
Этапы репликации
Расплетание ДНК
Синтез праймера для начала считывания лидирующей цепи
Синтез нуклеотидов +
Синтез праймеров для отстающей цепи
Синтез нуклеотидов + синтез фрагментов Оказаки
Вырезание праймеров
Застройка разрыва
Слайд 46
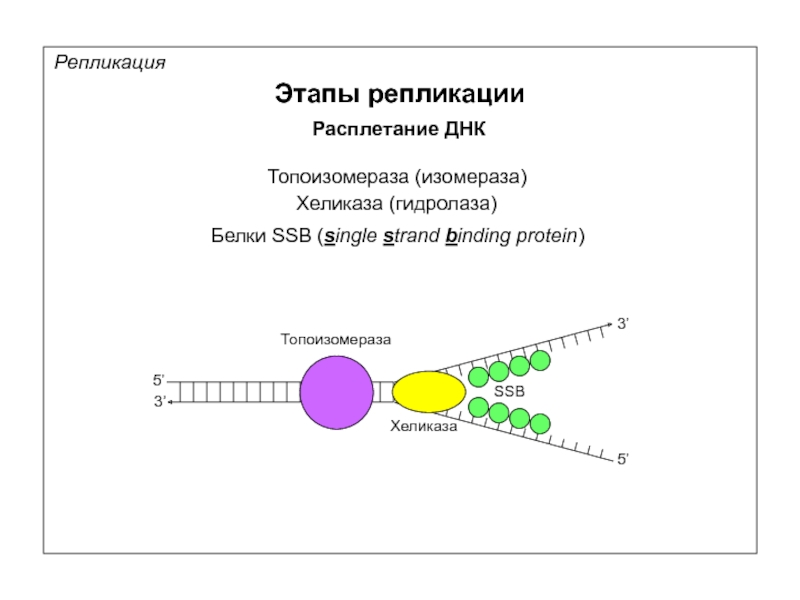
Репликация
Этапы репликации
Расплетание ДНК
Топоизомераза (изомераза)
Хеликаза (гидролаза)
5’
5’
3’
3’
Белки SSB (single strand binding protein)
Топоизомераза
Хеликаза
SSB
Слайд 47
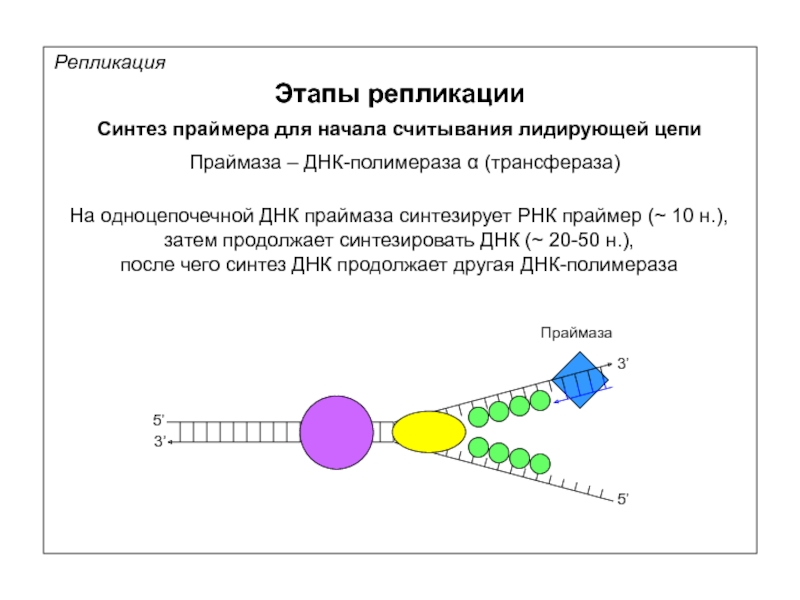
Репликация
Этапы репликации
Синтез праймера для начала считывания лидирующей цепи
Праймаза – ДНК-полимераза α
5’
5’
3’
3’
На одноцепочечной ДНК праймаза синтезирует РНК праймер (~ 10 н.),
затем продолжает синтезировать ДНК (~ 20-50 н.),
после чего синтез ДНК продолжает другая ДНК-полимераза
Праймаза
Слайд 48
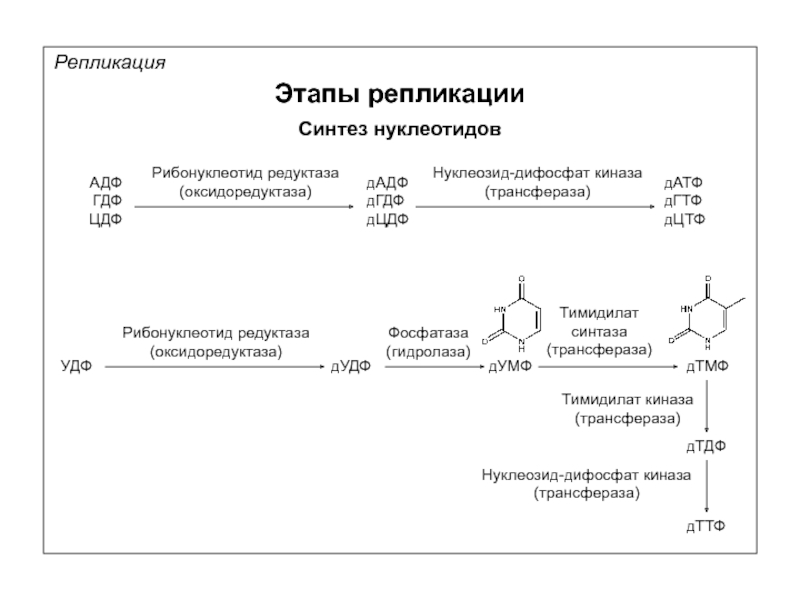
Репликация
Этапы репликации
Синтез нуклеотидов
АДФ
ГДФ
ЦДФ
Рибонуклеотид редуктаза
(оксидоредуктаза)
дАДФ
дГДФ
дЦДФ
Нуклеозид-дифосфат киназа
(трансфераза)
дАТФ
дГТФ
дЦТФ
УДФ
Рибонуклеотид редуктаза
(оксидоредуктаза)
дУДФ
Фосфатаза
(гидролаза)
дУМФ
Тимидилат
синтаза
(трансфераза)
дТМФ
дТДФ
дТТФ
Тимидилат киназа
(трансфераза)
Нуклеозид-дифосфат киназа
(трансфераза)
Слайд 49
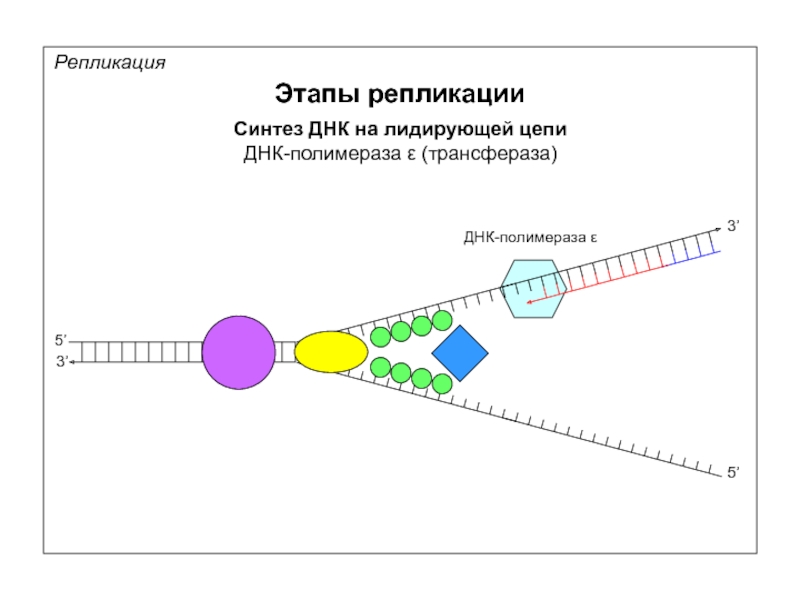
Репликация
Этапы репликации
Синтез ДНК на лидирующей цепи
ДНК-полимераза ε (трансфераза)
5’
5’
3’
3’
ДНК-полимераза ε
Слайд 50
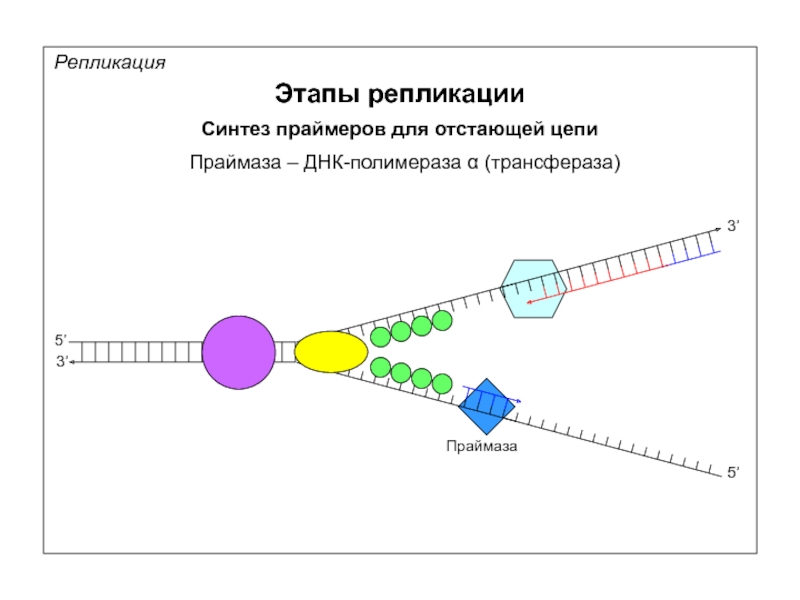
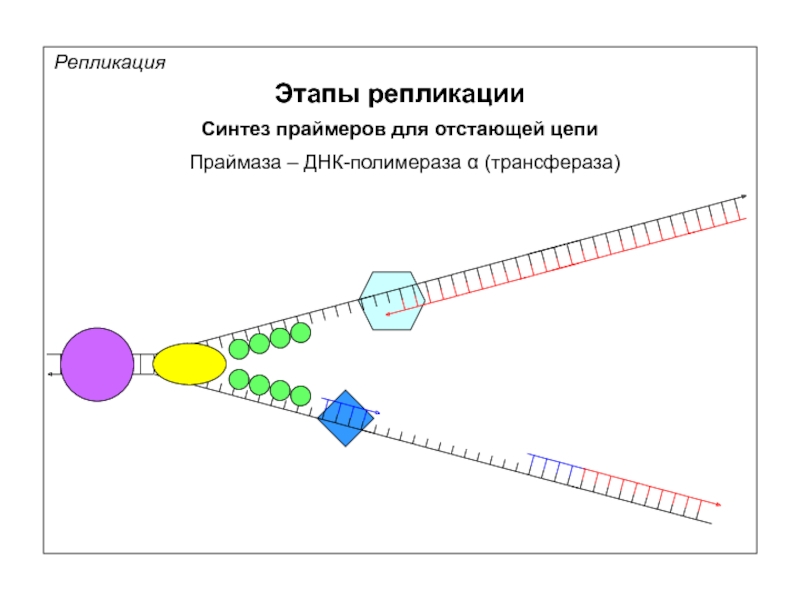
Репликация
Этапы репликации
Синтез праймеров для отстающей цепи
5’
5’
3’
3’
Праймаза – ДНК-полимераза α (трансфераза)
Праймаза
Слайд 51
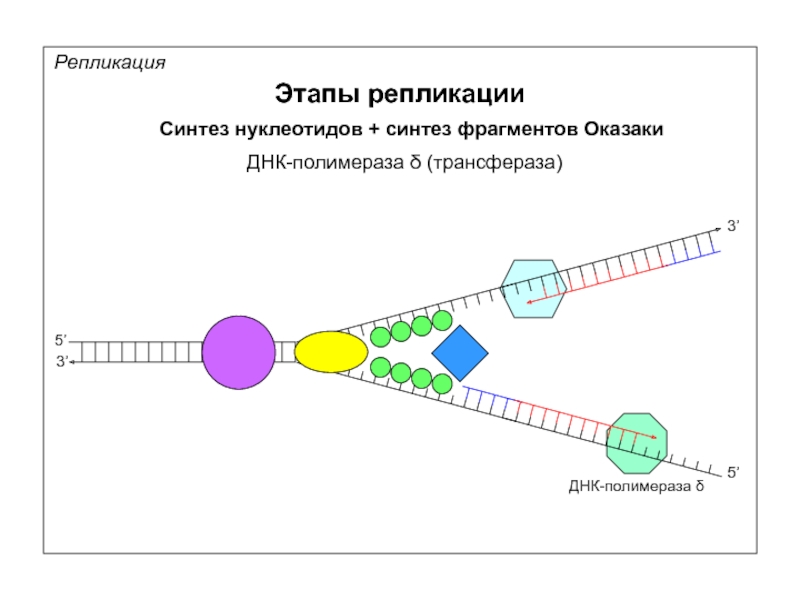
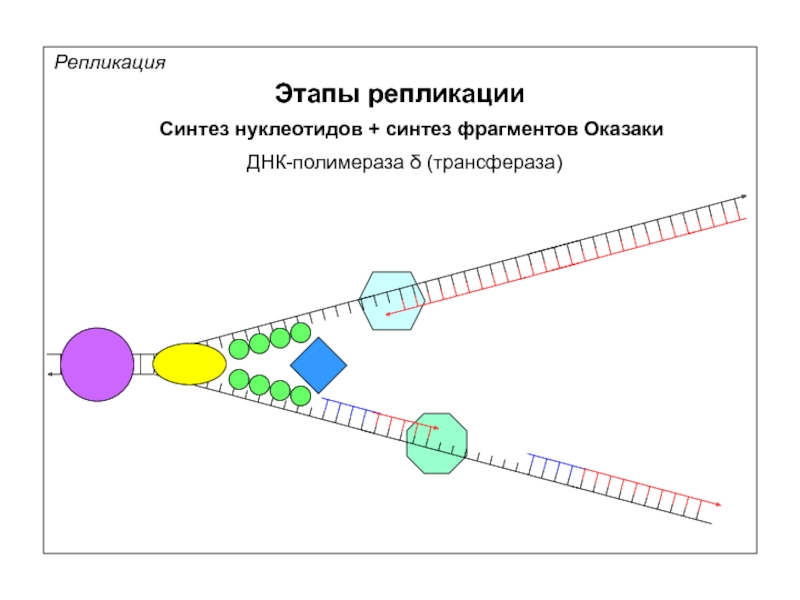
Репликация
Этапы репликации
5’
5’
3’
3’
Синтез нуклеотидов + синтез фрагментов Оказаки
ДНК-полимераза δ (трансфераза)
ДНК-полимераза δ
Слайд 53
Репликация
Этапы репликации
Синтез праймеров для отстающей цепи
Праймаза – ДНК-полимераза α (трансфераза)
Слайд 54
Репликация
Этапы репликации
Синтез нуклеотидов + синтез фрагментов Оказаки
ДНК-полимераза δ (трансфераза)
Слайд 55
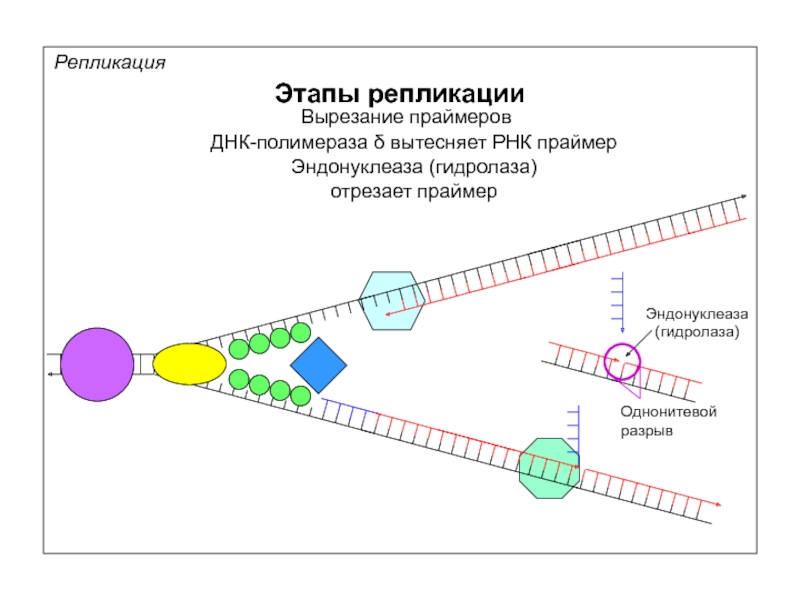
Репликация
Этапы репликации
Вырезание праймеров
ДНК-полимераза δ вытесняет РНК праймер
Эндонуклеаза (гидролаза)
отрезает праймер
Эндонуклеаза
(гидролаза)
Однонитевой
разрыв
Слайд 56
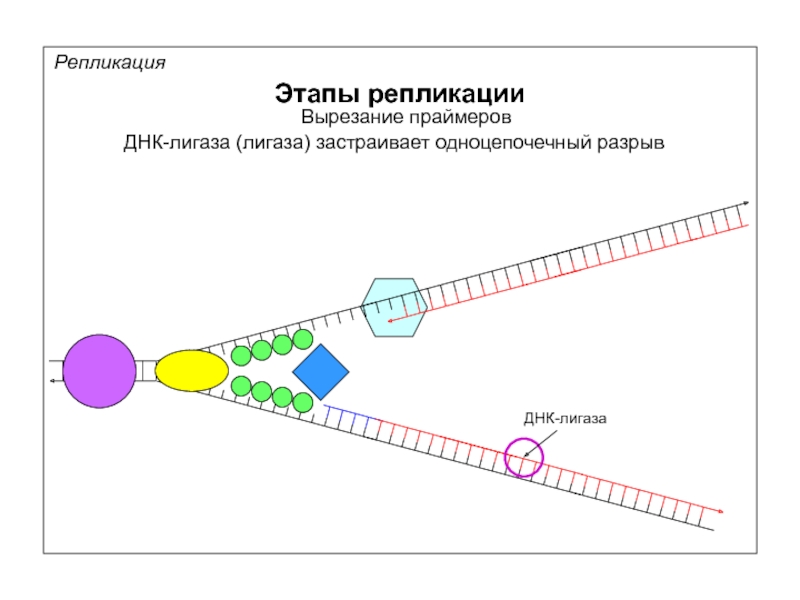
Репликация
Этапы репликации
Вырезание праймеров
ДНК-лигаза (лигаза) застраивает одноцепочечный разрыв
ДНК-лигаза
Слайд 58
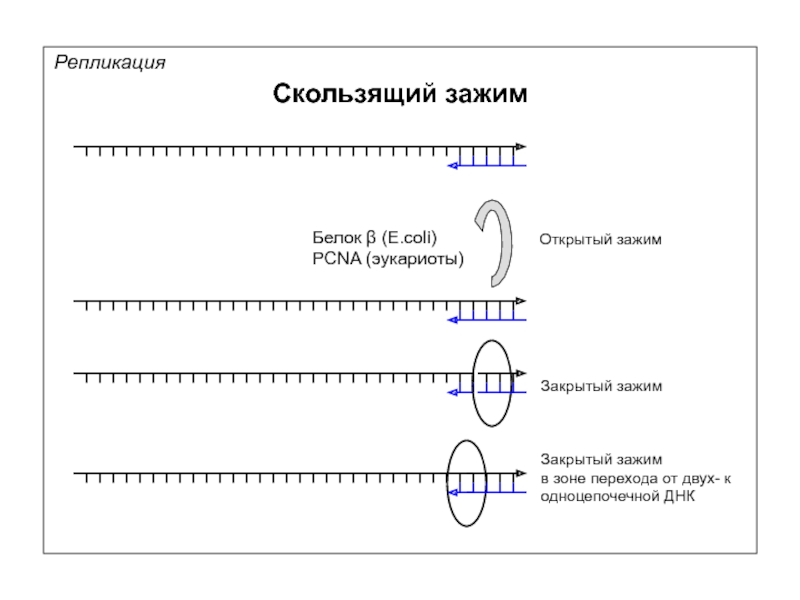
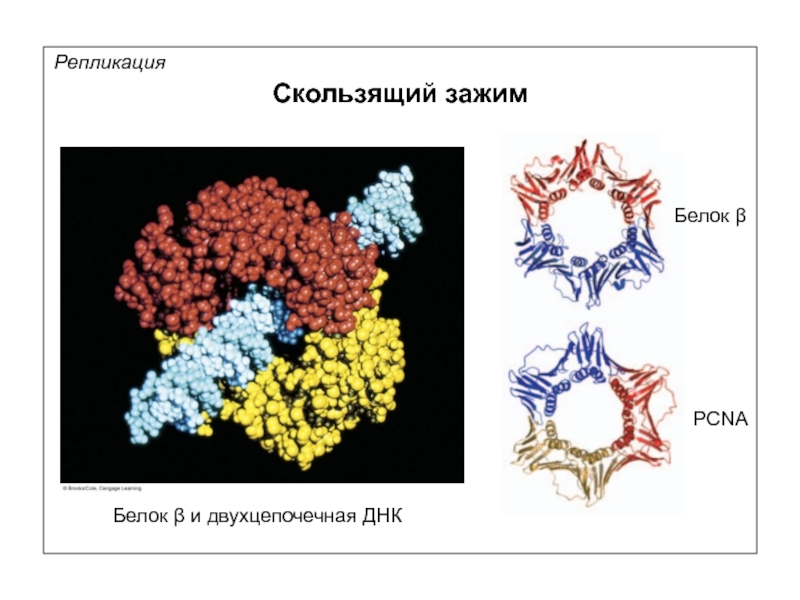
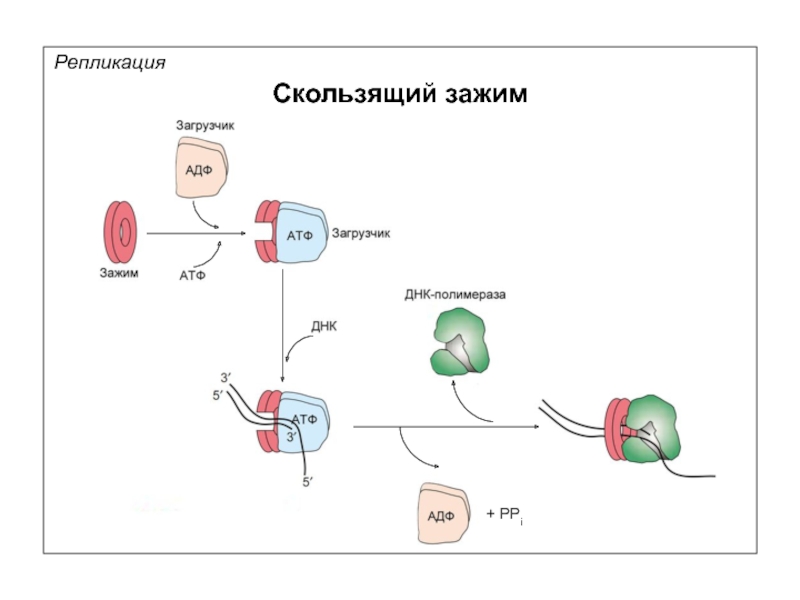
Репликация
Скользящий зажим
Белок β (E.coli)
PCNA (эукариоты)
Открытый зажим
Закрытый зажим
Закрытый зажим
в зоне перехода от
Слайд 64
Репликация
3’→5’ экзонуклеазная активность ДНК-полимераз
Одна ошибка на 105-106 н.
Увеличение точности
в 10-100 раз
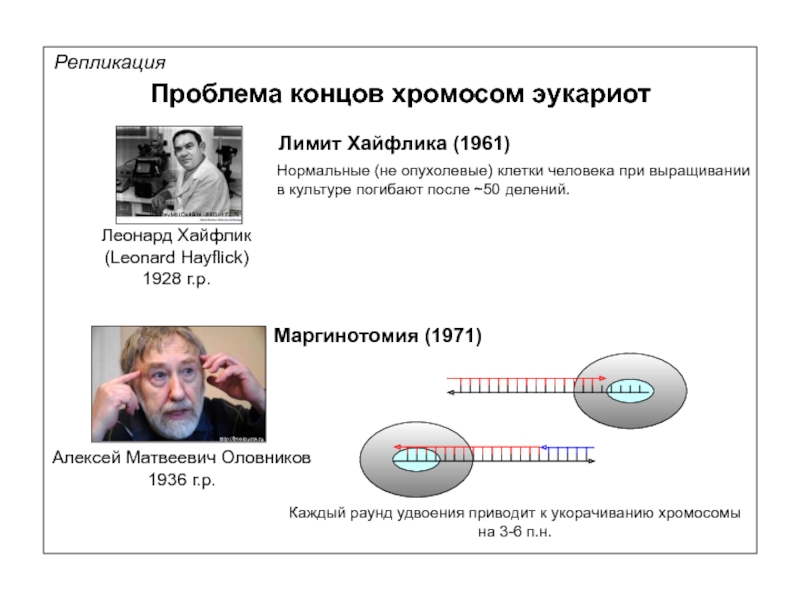
ДНК-полимеразы
Слайд 66
Репликация
Проблема концов хромосом эукариот
Маргинотомия (1971)
Лимит Хайфлика (1961)
Нормальные (не опухолевые) клетки человека
в культуре погибают после ~50 делений.
Nat.Rev.Mol.Cell Biol.-2000.-1:72-76
Каждый раунд удвоения приводит к укорачиванию хромосомы
на 3-6 п.н.
Слайд 67
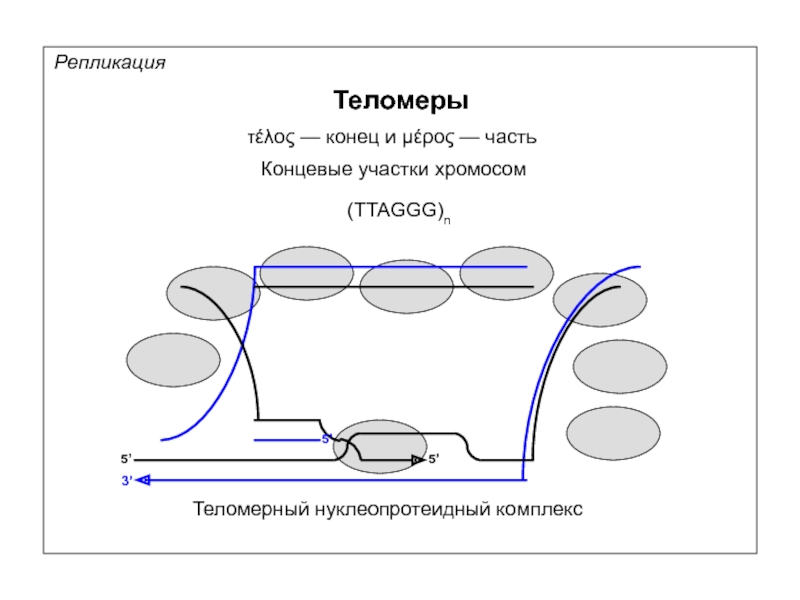
Репликация
Теломеры
τέλος — конец и μέρος — часть
Концевые участки хромосом
(TTAGGG)n
5’
5’
3’
5’
Теломерный нуклеопротеидный комплекс
Слайд 68
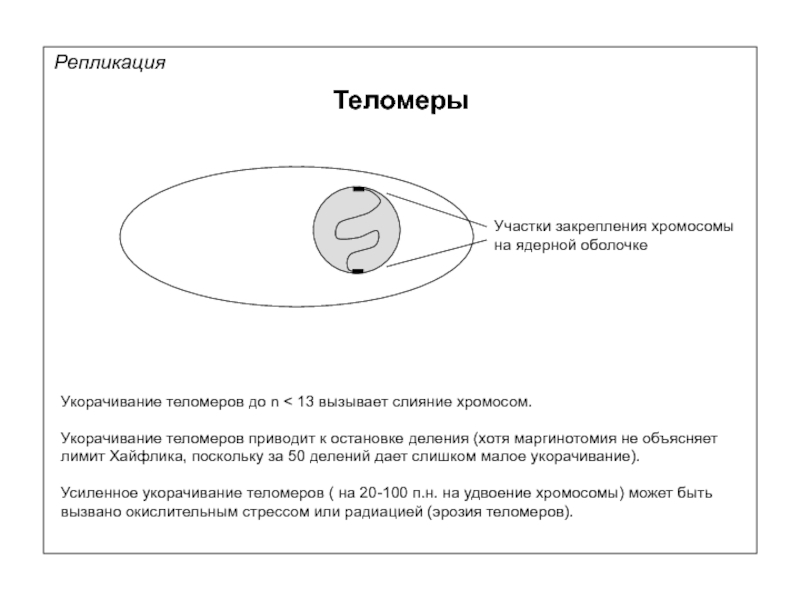
Репликация
Теломеры
Укорачивание теломеров до n < 13 вызывает слияние хромосом.
Укорачивание теломеров приводит
Усиленное укорачивание теломеров ( на 20-100 п.н. на удвоение хромосомы) может быть вызвано окислительным стрессом или радиацией (эрозия теломеров).
Участки закрепления хромосомы
на ядерной оболочке
Слайд 69
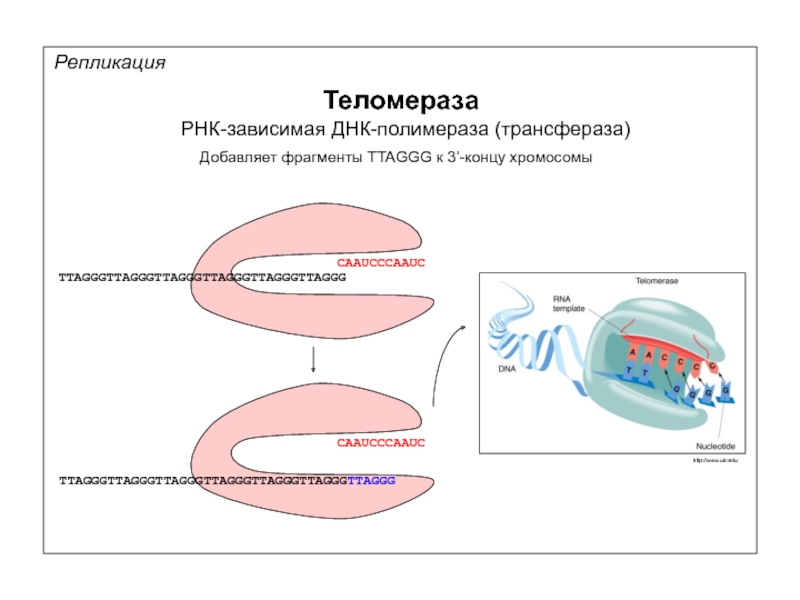
Репликация
Теломераза
РНК-зависимая ДНК-полимераза (трансфераза)
Добавляет фрагменты TTAGGG к 3’-концу хромосомы
CAAUCCCAAUC
TTAGGGTTAGGGTTAGGGTTAGGGTTAGGGTTAGGG
CAAUCCCAAUC
TTAGGGTTAGGGTTAGGGTTAGGGTTAGGGTTAGGGTTAGGG
http://www.uic.edu
Слайд 70
Репликация
Теломераза
Нобелевская премия 2009 г.
за открытие механизмов защиты хромосом теломерами
и фермента теломеразы
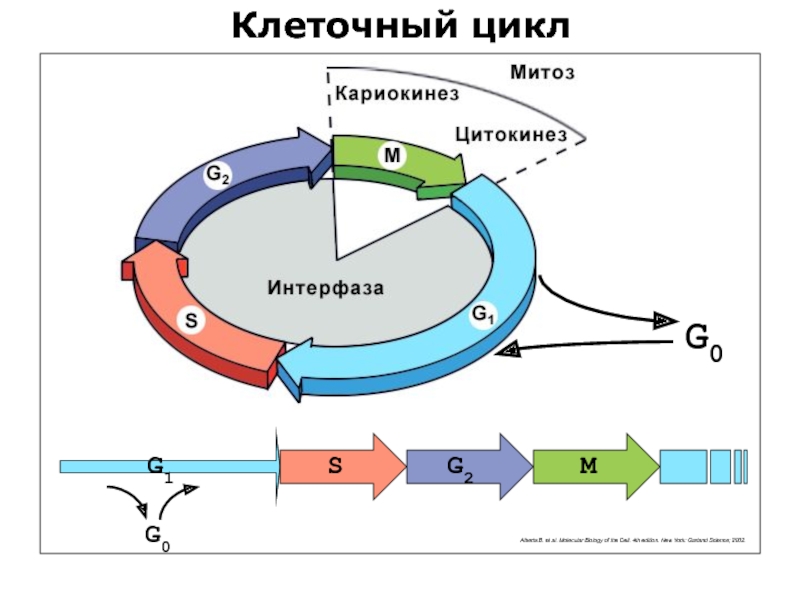
Слайд 72Клеточный цикл
© Aaron Straight, Stanford University School of Medicine
Интерфаза (I)
Митоз
Слайд 73Интерфаза
Метафаза
Профаза
Прометафаза
Анафаза
Телофаза
Клеточный цикл
Митоз
Alberts Bю et al. Molecular Biology of the Cell. 4th
Слайд 75Клеточный цикл
Интерфаза
Потребление клеткой
дезоксинуклеотидов
Время
S
фаза синтеза
G1
1-я проме-
жуточная
фаза
G2
2-я проме-
жуточная
фаза
S
фаза синтеза
G1
1-я проме-
жуточная
фаза
G2
2-я проме-
жуточная
фаза
I
M
I
M
Циклическое изменение потребления
в делящейся клетке
Слайд 76Клеточный цикл
G0
G1
G2
G0
S
M
Alberts B. et al. Molecular Biology of the Cell. 4th
Слайд 77Клеточный цикл
Исследование клеточного цикла
http://www.cbp.pitt.edu/faculty/yong_wan/index.html
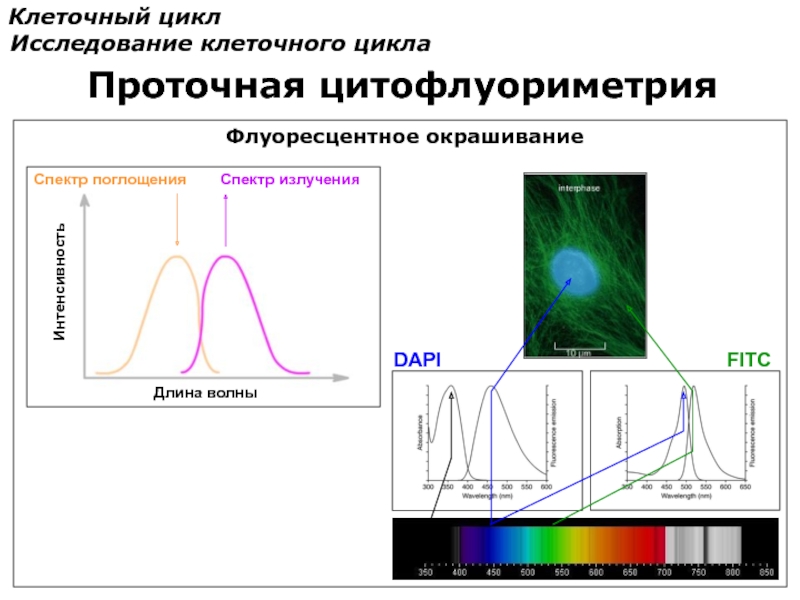
Слайд 78
Клеточный цикл
Исследование клеточного цикла
Проточная цитофлуориметрия
Спектр поглощения
Спектр излучения
Длина волны
Интенсивность
DAPI
FITC
Флуоресцентное окрашивание
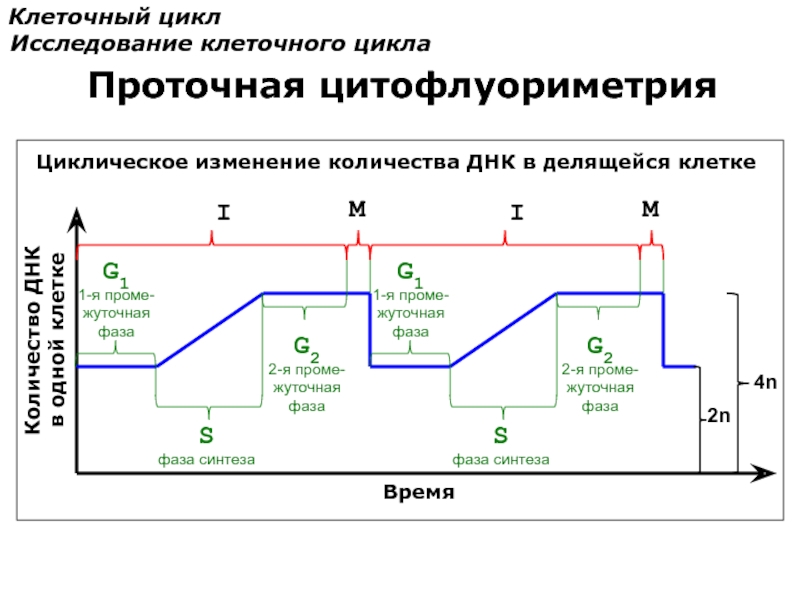
Слайд 79
Количество ДНК
в одной клетке
Время
S
фаза синтеза
G1
1-я проме-
жуточная
фаза
G2
2-я проме-
жуточная
фаза
S
фаза синтеза
G1
1-я проме-
жуточная
фаза
G2
2-я проме-
жуточная
фаза
I
M
I
M
Клеточный цикл
Исследование
Проточная цитофлуориметрия
Циклическое изменение количества ДНК в делящейся клетке
2n
4n
Слайд 81
Клеточный цикл
Исследование клеточного цикла
Проточная цитофлуориметрия
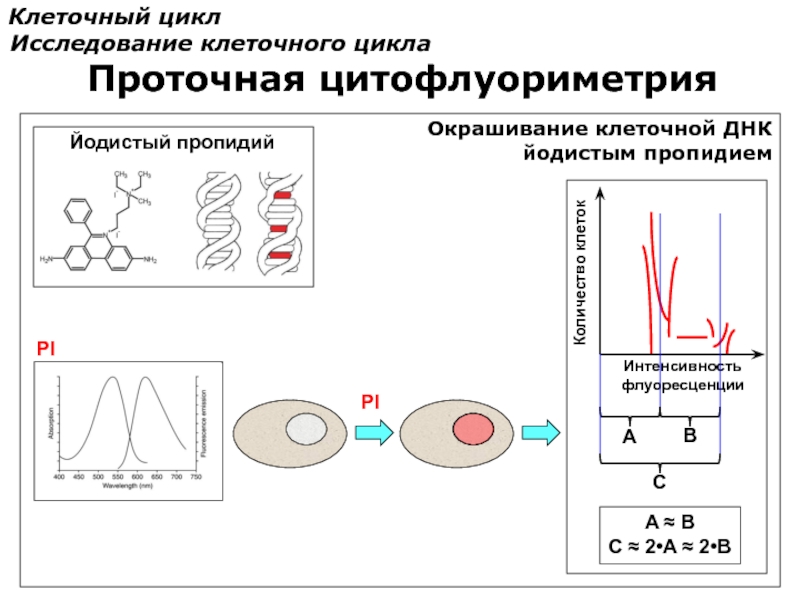
Окрашивание клеточной ДНК
йодистым пропидием
PI
Интенсивность
флуоресценции
Количество клеток
A
B
C
A ≈ B
C
Йодистый пропидий
Слайд 82
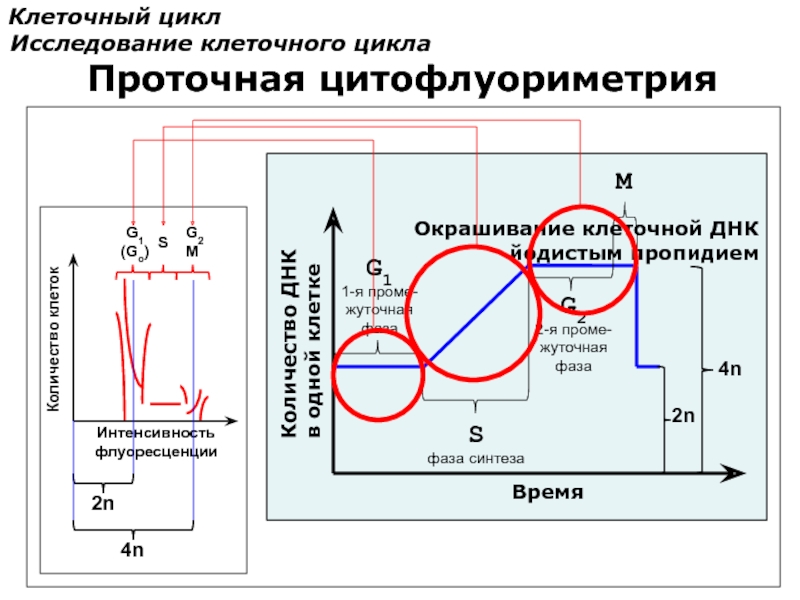
Клеточный цикл
Исследование клеточного цикла
Интенсивность
флуоресценции
Количество клеток
2n
4n
Окрашивание клеточной ДНК
йодистым пропидием
Количество ДНК
в одной клетке
Время
S
фаза
G1
1-я проме-
жуточная
фаза
G2
2-я проме-
жуточная
фаза
M
2n
4n
Проточная цитофлуориметрия
G1
(Go)
G2
M
S
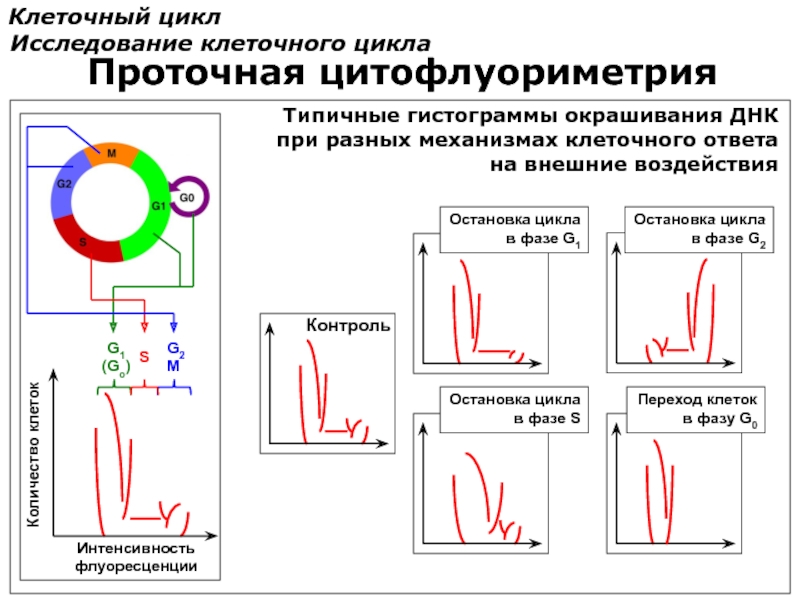
Слайд 83Клеточный цикл
Исследование клеточного цикла
Проточная цитофлуориметрия
Переход клеток
в фазу G0
Типичные гистограммы окрашивания ДНК
при
на внешние воздействия
Слайд 85
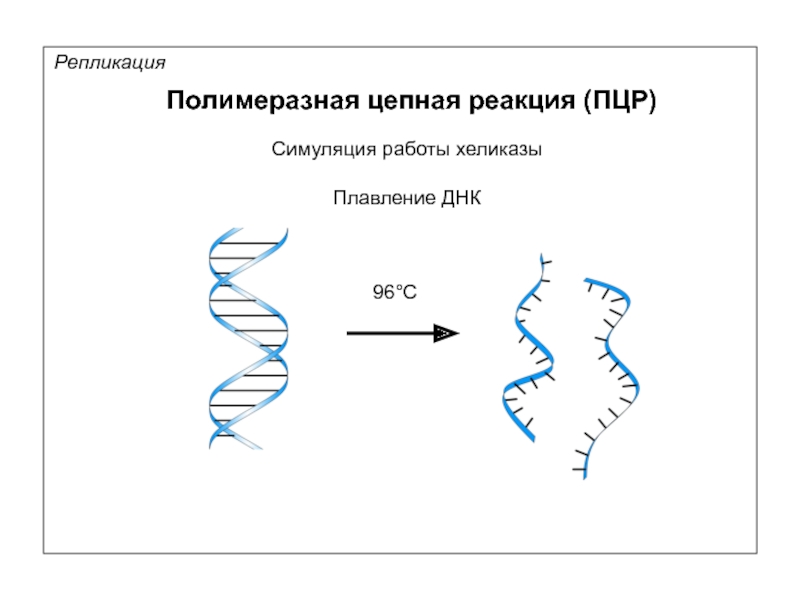
Репликация
Полимеразная цепная реакция (ПЦР)
Матрица
Симуляция работы хеликазы
Симуляция работы праймазы
Полимеризация ДНК
…
Слайд 87
Репликация
Полимеразная цепная реакция (ПЦР)
Симуляция работы праймазы
Подбор и заказ праймеров
Отжиг праймеров
Слайд 88
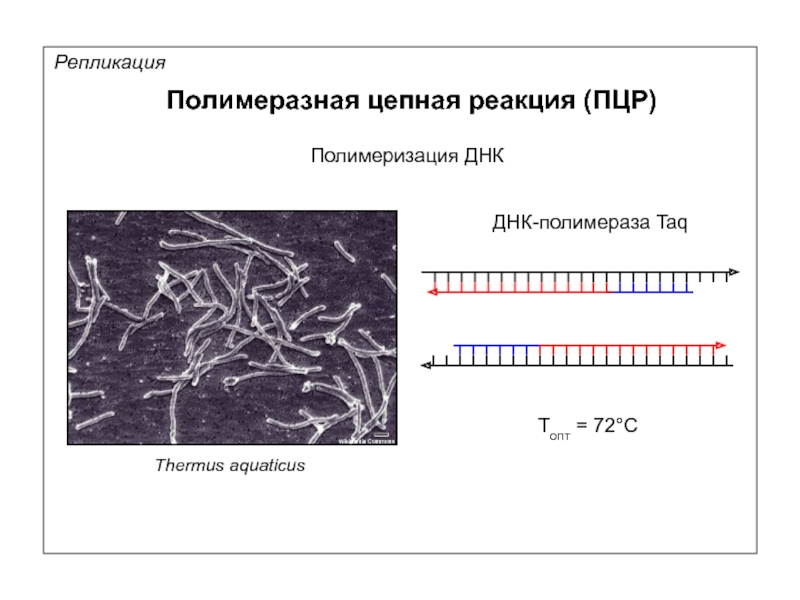
Репликация
Полимеразная цепная реакция (ПЦР)
Полимеризация ДНК
Thermus aquaticus
Wikimedia Commons
ДНК-полимераза Taq
Tопт = 72°С
Слайд 90
Репликация
ПЦР
2-й цикл
Плавление
Отжиг
Полимеризация
1 матрица (2 нити) + 2 полупродукта (4 нити) +
Слайд 91
Репликация
ПЦР
3-й цикл
Плавление
Отжиг
Полимеризация
1 матрица (2 нити) + 3 полупродукта (6 нитей) +
Слайд 92
Репликация
ПЦР
Матриц - 1
Полупродуктов – n
Продуктов – 2n-(n+1)
Метод ПЦР позволяет определить наличие
Продукт
Матриц - 1
Полупродуктов – 40
Продуктов – 240-(40+1) = 1.099.511.627.735 ≈ 1012
если n=40
Количество циклов - n
С 1 молекулы можно получить
до 100 нг продукта длиной 100 п.н.



![13-19 минРепликацияТочка начала репликации и репликационные вилкиorioriЭксперимент с меченными нуклеотидами разной удельной активности[3H]-тиминс низкой удельнойрадиоактивностью[3H]-тимидинс](/img/tmb/5/495100/5cdf71556b87d8015ba199271270ec91-800x.jpg)



![РепликацияДНК-полимераза(трансфераза)α-[32P]-дезоксирибонуклеотидыα-[32P]-дАТФα-[32P]-дГТФα-[32P]-дЦТФα-[32P]-дТТФ+ экстракт E.coliОчистка ДНКИзмерениерадиоактивностиДНК](/img/tmb/5/495100/352e10cdc6e4a6d408283b38c8b81265-800x.jpg)