- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Основные типы рецепторов растений презентация
Содержание
- 1. Основные типы рецепторов растений
- 2. Схема восприятия и трансдукции сигнала в изображении Бидструпа...
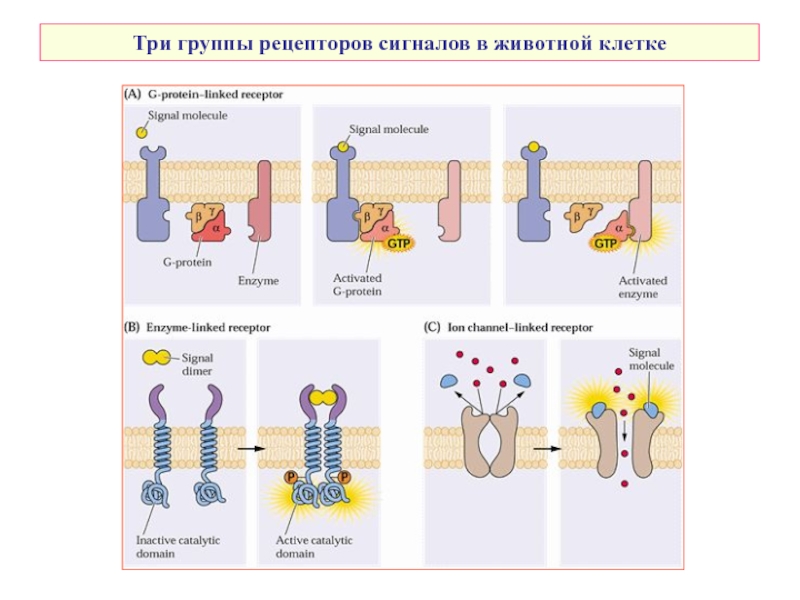
- 3. Три группы рецепторов сигналов в животной клетке
- 4. Основные типы рецепторов растений – как всегда,
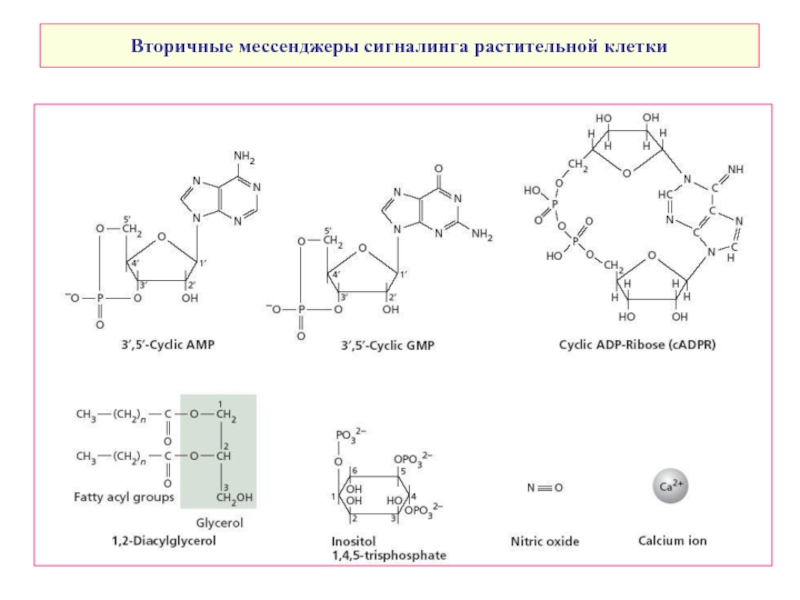
- 5. Вторичные мессенджеры сигналинга растительной клетки
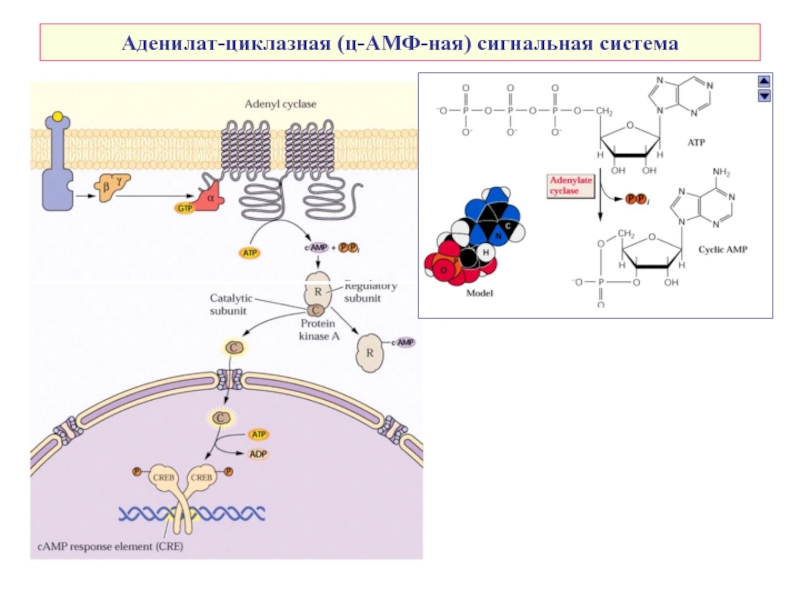
- 6. Аденилат-циклазная (ц-АМФ-ная) сигнальная система
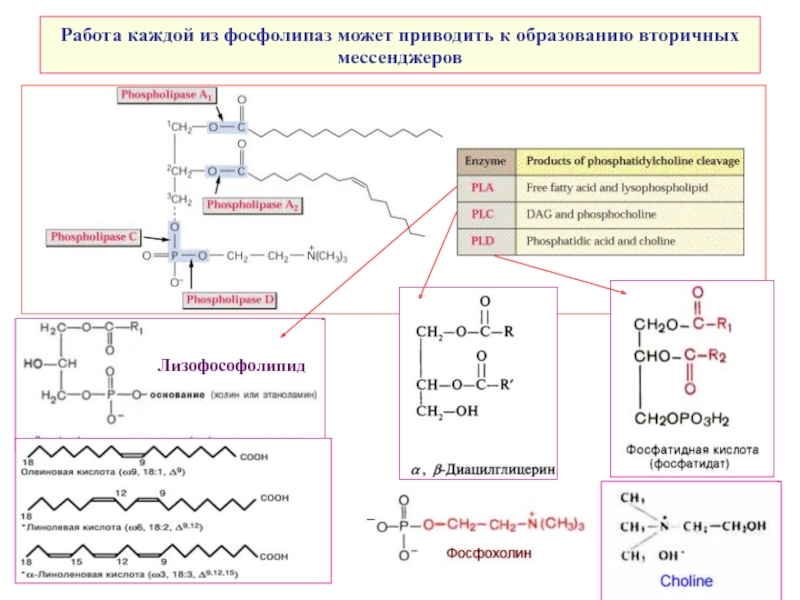
- 7. Работа каждой из фосфолипаз может приводить к образованию вторичных мессенджеров Лизофософолипид
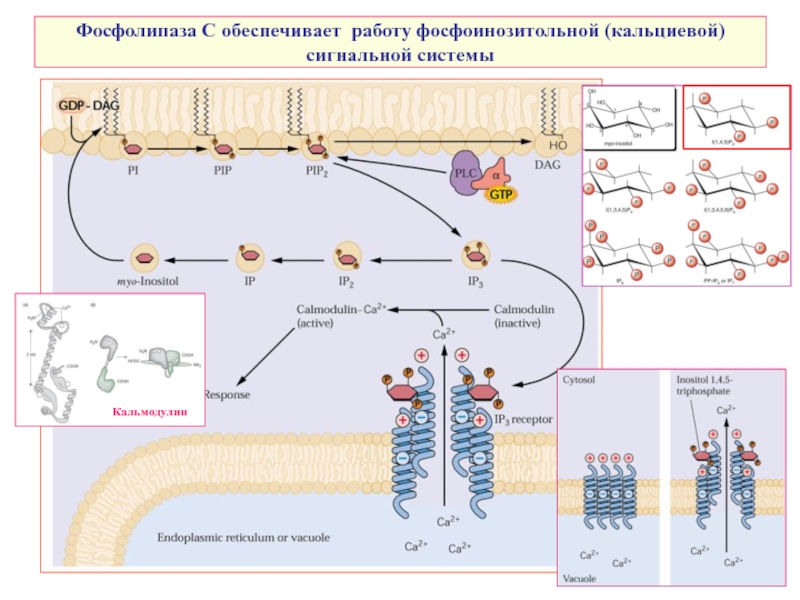
- 8. Фосфолипаза С обеспечивает работу фосфоинозитольной (кальциевой) сигнальной системы Кальмодулин
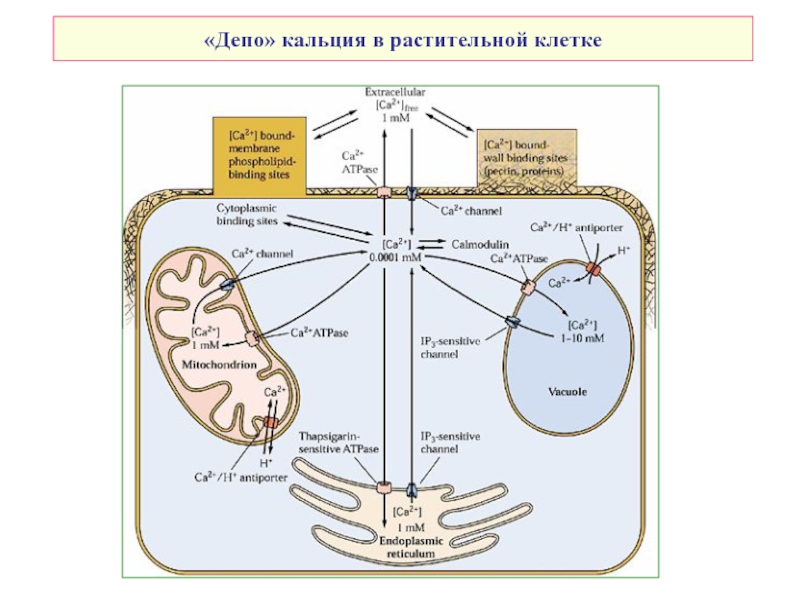
- 9. «Депо» кальция в растительной клетке
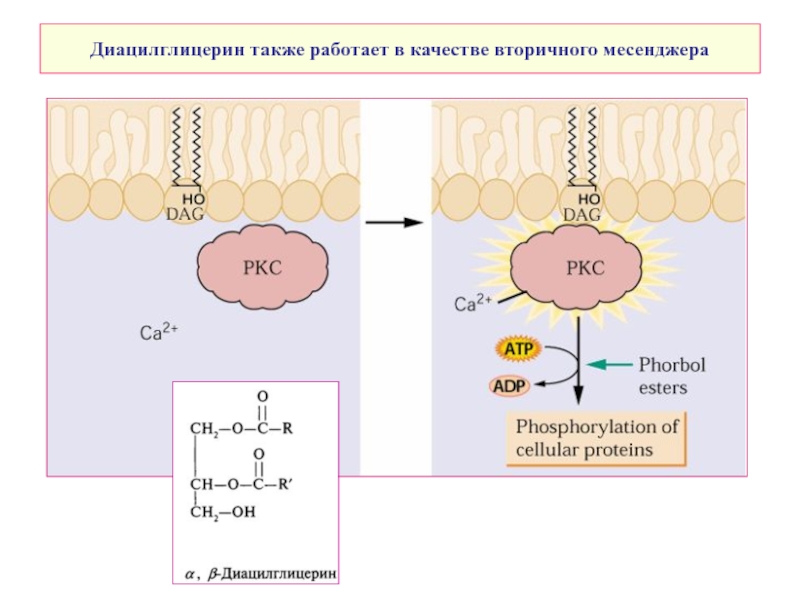
- 10. Диацилглицерин также работает в качестве вторичного месенджера
- 11. Работа фосфолипазы D приводит к образованию фосфатидной
- 12. Работа фосфолипазы А2 проводит к образованию жасмонатов
- 13. МАР-киназная сигнальная система и взаимодействие систем.
- 14. ФРТ ФРТ ФРТ ФРТ ФРТ ФРТ ФРТ ФРТ ФРТ ФРТ ФРТ ФРТ ФРТ ФРТ
- 15. Убиквитины – метки смерти…. Убиквитин – небольшой
- 16. Малые РНК делятся на: малые
- 17. siRNA из транспозонов или трансгенных промоторов
- 18. Микро РНК - посттранскрипционные репрессоры экспрессии генов.
- 19. Микро-РНК , чуть подробнее… 1). закодированы на
- 20. МикроРНК комплементарно связывается с мРНК генов-мишеней, что
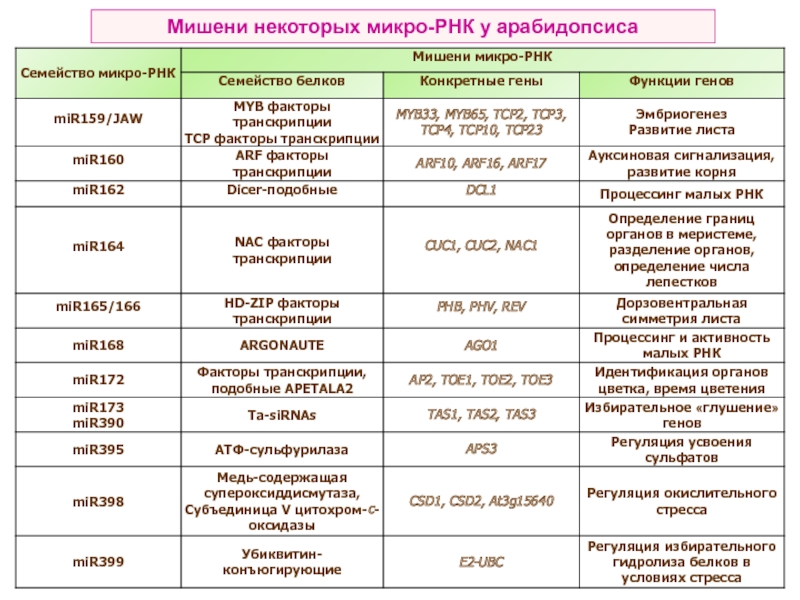
- 21. Мишени некоторых микро-РНК у арабидопсиса
- 22. Рецепторы ауксинов – экстра- или внутриклеточные? 1.
- 23. Система трансдукции ауксинового сигнала: AUX/IAA - ARF.
- 24. Существует как минимум два рецептора ауксинов.
- 25. Работа рецептора ауксина ядерной локализации. А.
- 26. Принципиальная схема работы двух рецепторов ауксинов –
- 27. Рецепция ауксинов белком ABP1 и начальные этапы передачи сигнала ???
- 28. Система трасдукции гиббереллинового сигнала очень похожа на
- 29. Сигнальная система гиббереллинов 1. GA1 из эмбриоида
- 30. Как нашли еtr1 –мутант у арабидопсиса
- 31. Двухкомпонентные рецепторные системы: гистидинкиназы микроорганизмов (A)
- 32. Гистидинкиназы, схема трансдукции сигнала Нpt – гистидин-фосфотрансферный
- 33. Рецепторы цтокинина и этилена – гистидинкиназы. В
- 34. Сигнальная система цитокининов 1. Цитокинин связывается с
- 35. Этилен работает «наоборот» - его присутствие инактивирует
- 36. Схема трансдукции этиленового сигнала 1. RAN1 белок
- 37. Схема трансдукции этиленового сигнала EIN5/XRN4
- 38. Сигнальные системы цитокинина и этилена взаимодействуют. A.
- 39. BRI1: LRR-RLK - рецептор брассиностероидов. LRR
- 40. Сигнальная система брассиностероидов. A. При отсутствии
- 41. Брассиностериоды как активируют транскрипцию некоторых генов, так
- 42. Рецептор брассиностероидов одновременно является и рецептором системина
- 43. Рецепция и передача сигнала АБК. Тяжелый случай…
- 44. FCA (Flowering time Control protein A) –
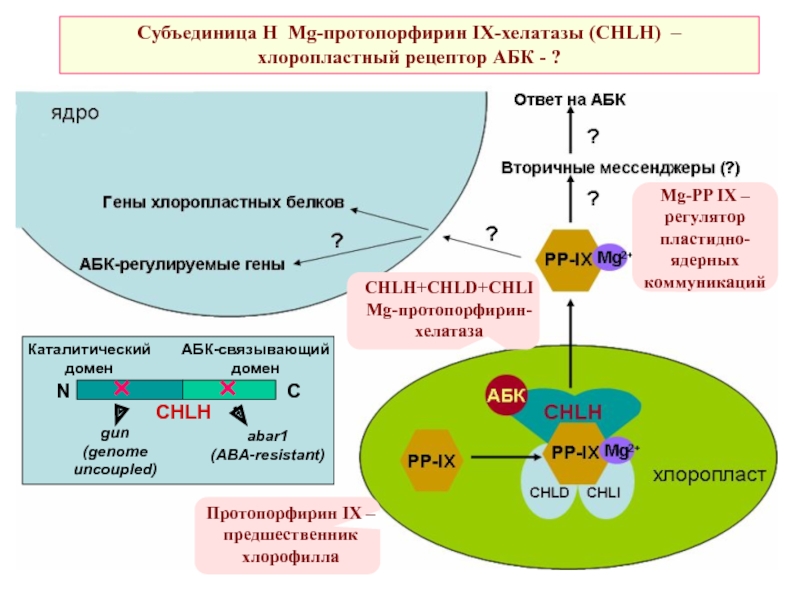
- 45. Субъединица Н Mg-протопорфирин IX-хелатазы (CHLH) –хлоропластный рецептор АБК - ?
- 46. GPCR (G-Protein Coupled Receptors) – плазмалемные рецепторы
- 47. Роль GCR2 как рецептора АБК. В настоящее
- 48. RCAR/PYR/PYL – цитозольные рецепторы АБК Regulatory
- 49. Регуляторные механизмы и трансфакторы АБК-сигналинга 1. АБК
- 50. Обобщенная схема АБК-сигналинга на 2015 год..
- 51. Сигнальные системы АБК («короткий сигналинг»), связанные с
- 52. Рецепторы трех гормонов работают по одному принципу..
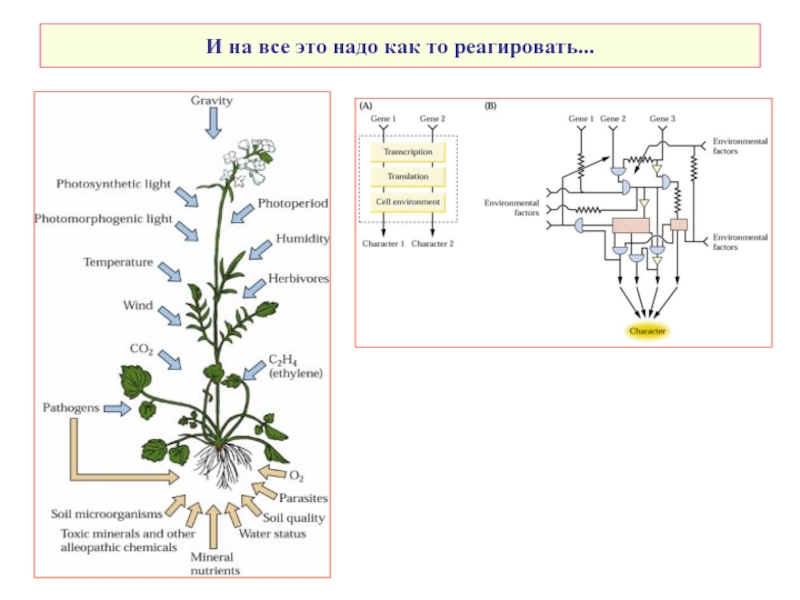
Слайд 4Основные типы рецепторов растений – как всегда, похоже, но не очень…
1. Рецепторные протеинкиназы
2. Рецепторы, ассоциированные с гетеротримерными и мономерными G-белками
3. Рецепторы, взаимодействующие с системой убиквитинирования
Рецепторы ауксинов, гиббереллинов, жасмоната
ГДФ
βγ
α
Ub
Ub
Мишени: МАР-киназный каскад,
Фосфопереносящие белки,
Малые ГТФазы
Мишени: Фосфолипазы,
Са2+ каналы,
МАР-киназный каскад
Мишени Репрессоры транскрипции
F-box
киназный домен
Thr
Thr
Thr
P
P
Рецепторы брассиностероидов, коротких пептидов
Рецепторы этилена, цитокининов
Рецепторы цитокининов. АБК
гистидин-аспарагиновые протеинкиназы (РК)
серин-треониовые РК
Слайд 7Работа каждой из фосфолипаз может приводить к образованию вторичных мессенджеров
Лизофософолипид
Слайд 8Фосфолипаза С обеспечивает работу фосфоинозитольной (кальциевой) сигнальной системы
Кальмодулин
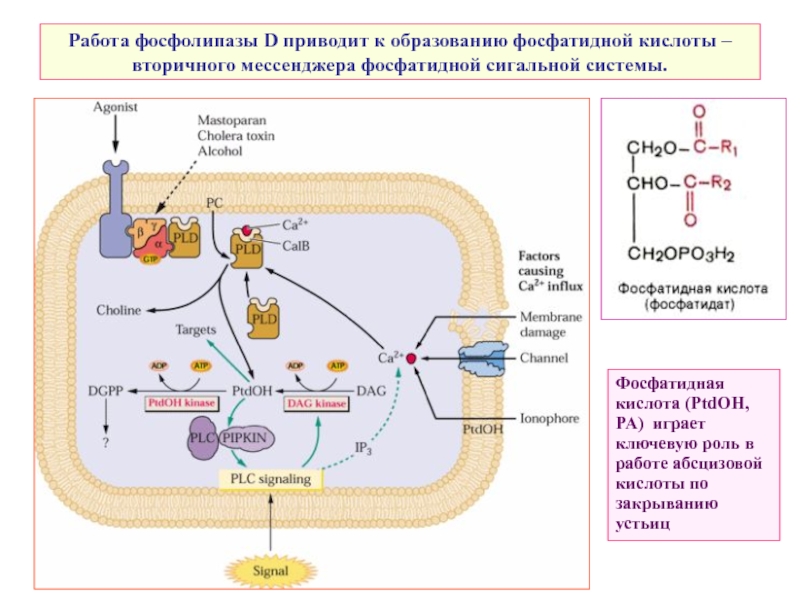
Слайд 11Работа фосфолипазы D приводит к образованию фосфатидной кислоты – вторичного мессенджера
Фосфатидная кислота (PtdOH, PA) играет ключевую роль в работе абсцизовой кислоты по закрыванию устьиц
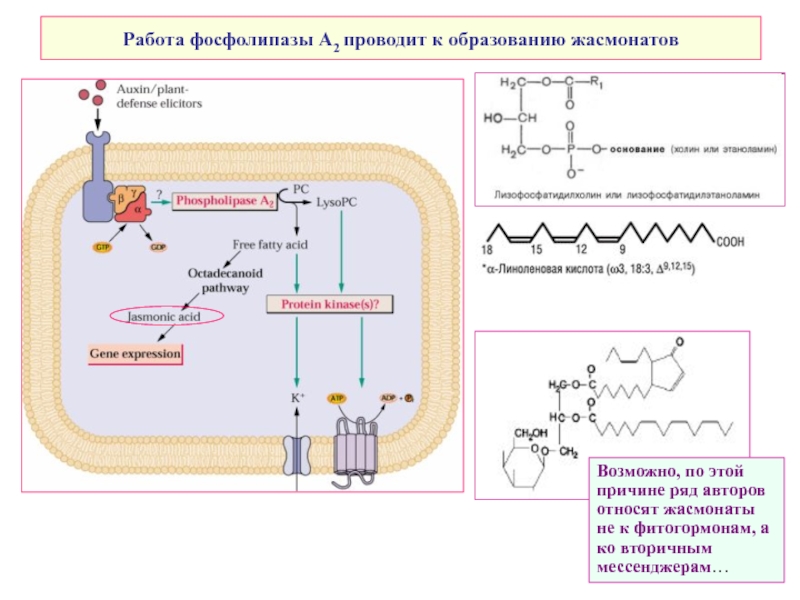
Слайд 12Работа фосфолипазы А2 проводит к образованию жасмонатов
Возможно, по этой причине ряд
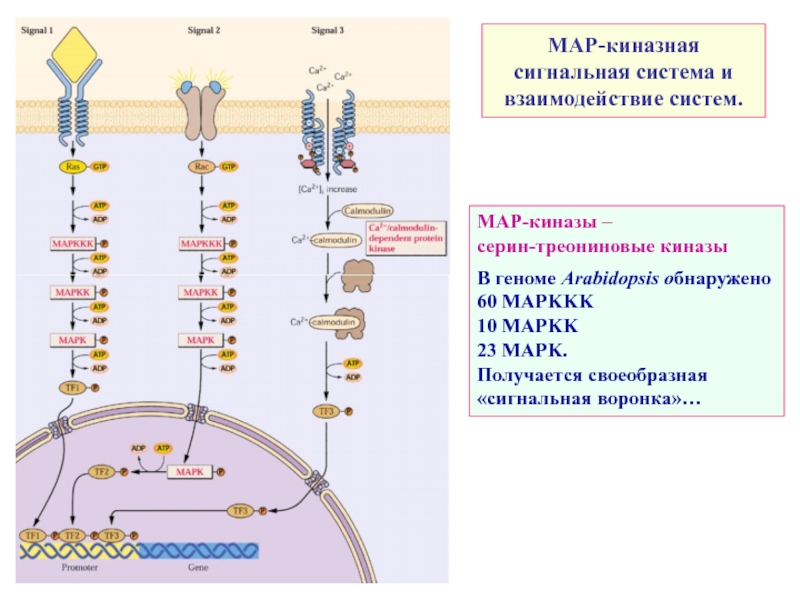
Слайд 13МАР-киназная сигнальная система и взаимодействие систем.
МАР-киназы –
серин-треониновые киназы
В геноме
60 MAPKKK
10 MAPKK
23 MAPK.
Получается своеобразная «сигнальная воронка»…
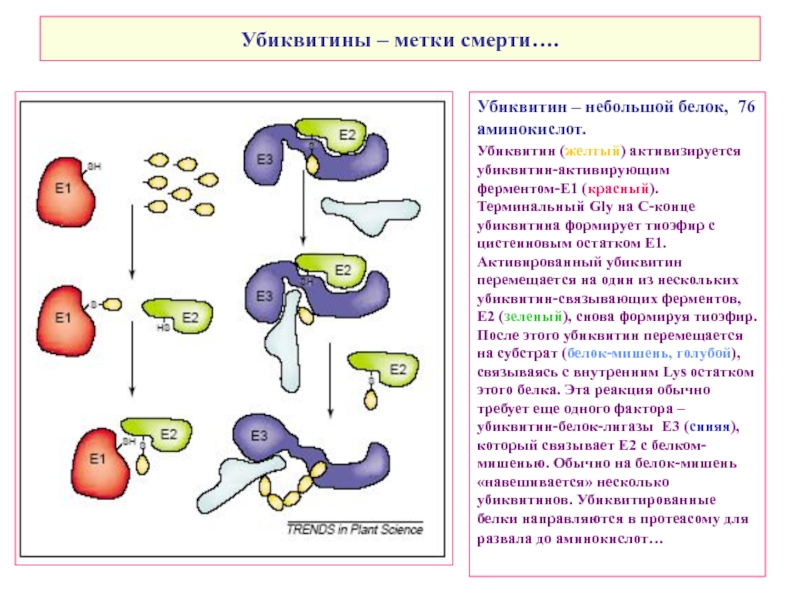
Слайд 15Убиквитины – метки смерти….
Убиквитин – небольшой белок, 76 аминокислот.
Убиквитин (желтый) активизируется
Слайд 16
Малые РНК делятся на: малые интерферирующие РНК (siRNA) - small
Открытие целого мира малых РНК (small RNAs, sRNAs), регулирующих экспрессию генов, - конец 1990-х годов,
в 2006 г. авторам этого открытия Andrew Fire (Фаер) и Кraig Mello (Мелло) была присуждена Нобелевская премия.
Малые РНК растений
Малые интерферирующие РНК растений (siRNA)
РНК-интерференция – процесс подавления экспрессии гена на стадии транскрипции, трансляции, дезаденилирования или деградации мРНК при помощи малых молекул РНК.
Малые интерферирующие РНК способны осуществлять направленную деградацию или блокировать трансляцию РНК определенной последовательности и участвовать, таким образом, в защите клетки от вирусов, репрессии трансгенов и подавлении экспрессии мобильных генетических элементов.
Непосредственными предшественниками siRNAs (в отличие от miРНК) являются двухцепочечные молекулы РНК, которые образуются в результате активности РНК-зависимых РНК-полимераз, собирающих вторую цепь на одноцепочечной вирусной РНК и на продуктах транскрипции ДНК транспозонов и трансгенов.
Слайд 17siRNA из транспозонов или трансгенных промоторов – контролируют сайленсинг транспозонов
siRNA растений и низших животных организмов является важным звеном внутриклеточного иммунитета, позволяющего распознавать и быстро расщепить чужую РНК.
Если в клетку проникает РНК–содержащий вирус, такая система защиты осуществляет направленную деградацию вирусной РНК.
Если же вирус содержит ДНК, система siRNA будет мешать ему производить вирусные белки (так как необходимая для этого мРНК будет распознаваться и разрезаться).
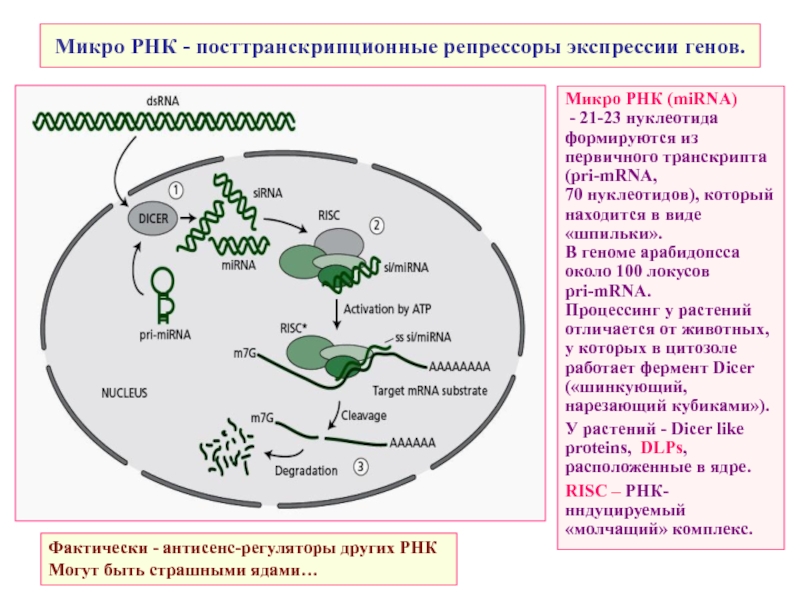
Слайд 18Микро РНК - посттранскрипционные репрессоры экспрессии генов.
Микро РНК (miRNA)
- 21-23
формируются из первичного транскрипта
(pri-mRNA,
70 нуклеотидов), который находится в виде «шпильки».
В геноме арабидопсса около 100 локусов
pri-mRNA.
Процессинг у растений отличается от животных, у которых в цитозоле работает фермент Dicer («шинкующий, нарезающий кубиками»).
У растений - Dicer like proteins, DLPs, расположенные в ядре.
RISC – РНК-нндуцируемый «молчащий» комплекс.
Фактически - антисенс-регуляторы других РНК Могут быть страшными ядами…
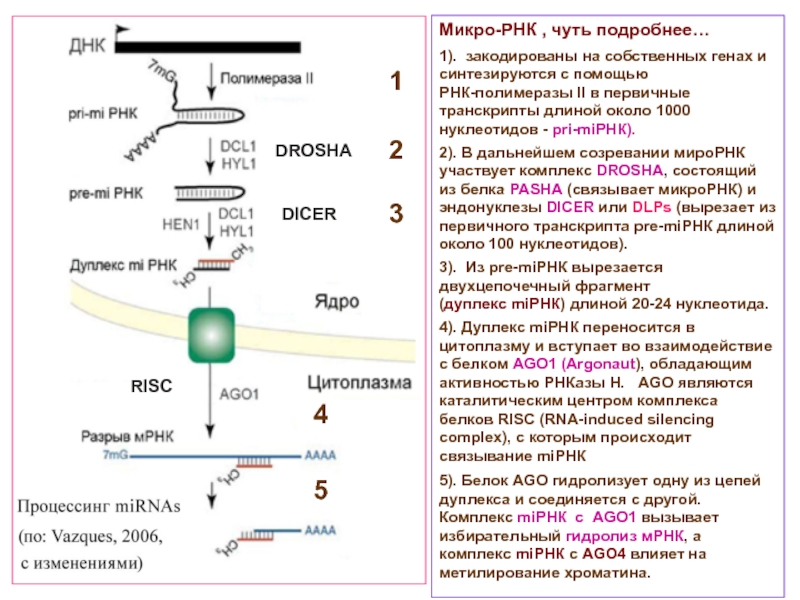
Слайд 19Микро-РНК , чуть подробнее…
1). закодированы на собственных генах и синтезируются с
РНК-полимеразы II в первичные транскрипты длиной около 1000 нуклеотидов - pri-miРНК).
2). В дальнейшем созревании мироРНК участвует комплекс DROSHA, состоящий из белка PASHA (связывает микроРНК) и эндонуклезы DICER или DLPs (вырезает из первичного транскрипта pre-miРНК длиной около 100 нуклеотидов).
3). Из pre-miРНК вырезается двухцепочечный фрагмент
(дуплекс miРНК) длиной 20-24 нуклеотида.
4). Дуплекс miРНК переносится в цитоплазму и вступает во взаимодействие с белком AGO1 (Argonaut), обладающим активностью РНКазы Н. AGO являются каталитическим центром комплекса белков RISC (RNA-induced silencing complex), с которым происходит связывание miРНК
5). Белок AGO гидролизует одну из цепей дуплекса и соединяется с другой. Комплекс miРНК с AGO1 вызывает избирательный гидролиз мРНК, а комплекс miРНК с AGO4 влияет на метилирование хроматина.
1
2
3
4
5
DROSHA
DICER
RISC
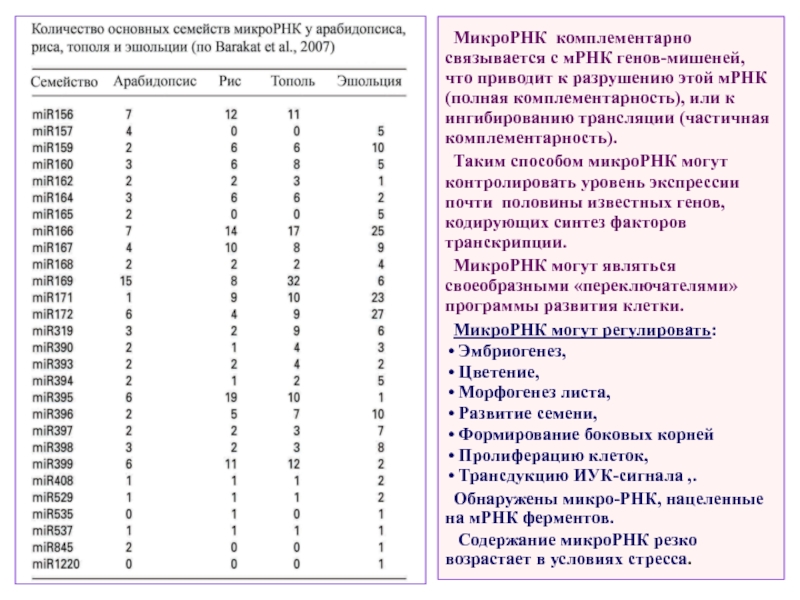
Слайд 20МикроРНК комплементарно связывается с мРНК генов-мишеней, что приводит к разрушению этой
Таким способом микроРНК могут контролировать уровень экспрессии почти половины известных генов, кодирующих синтез факторов транскрипции.
МикроРНК могут являться своеобразными «переключателями» программы развития клетки.
МикроРНК могут регулировать:
Эмбриогенез,
Цветение,
Морфогенез листа,
Развитие семени,
Формирование боковых корней
Пролиферацию клеток,
Трансдукцию ИУК-сигнала ,.
Обнаружены микро-РНК, нацеленные на мРНК ферментов.
Содержание микроРНК резко возрастает в условиях стресса.
Слайд 22Рецепторы ауксинов – экстра- или внутриклеточные?
1. ABP1? Белок семейства GPCR (G-Proteins
Около 22 кDa. У кукурузы – 5 генов. На N-конце - сигнал для транспорта в ЭР (38 а-к), на С-конце – КDEL, на N- конце – сайт связывания с ИУК:
His-Arg-His-Ser-Cys-Glu. Сайт гликозилирования (Asp33-Thr-Thr), До 90% белка - в ЭР.
2. Транспортеры ИУК? Транспортеры ИУК в клетку (4 гена - AUX1 и др.) из клетки (8 генов – PIN1, PIN2 и др).
3. ABP 60 kDa ? Гликозидаза цитокининовых конъюгатов. Взаимодействие фитогормонов?
4. ABP 24-25 kDa? Глютатион-5-трансфераза (GST).
GST контролирует уровень глютатиона, влияет на уровень жасмонатов, перекиси водорода.
Множественность рецепторов?
ИУК – особый гормон: специфичный полярный транспорт (от клетки к клетке), эндогенный ритм образования и транспорта.
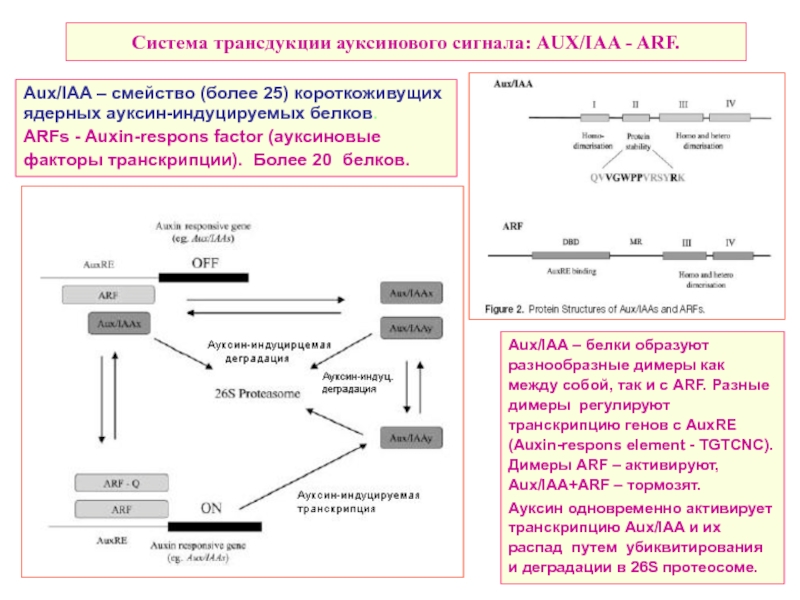
Слайд 23Система трансдукции ауксинового сигнала: AUX/IAA - ARF.
Aux/IAA – белки образуют разнообразные
Ауксин одновременно активирует транскрипцию Aux/IAA и их распад путем убиквитирования и деградации в 26S протеосоме.
Aux/IAA – смейство (более 25) короткоживущих ядерных ауксин-индуцируемых белков.
ARFs - Auxin-respons factor (ауксиновые факторы транскрипции). Более 20 белков.
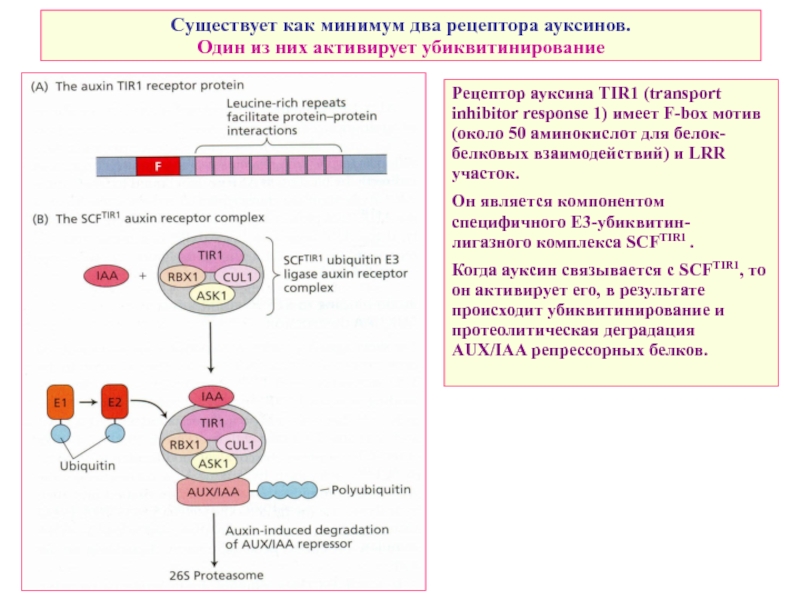
Слайд 24Существует как минимум два рецептора ауксинов. Один из них активирует убиквитинирование
Рецептор ауксина TIR1 (transport inhibitor response 1) имеет F-box мотив (около 50 аминокислот для белок-белковых взаимодействий) и LRR участок.
Он является компонентом специфичного E3-убиквитин-лигазного комплекса SCFTIR1 .
Когда ауксин связывается с SCFTIR1, то он активирует его, в результате происходит убиквитинирование и протеолитическая деградация AUX/IAA репрессорных белков.
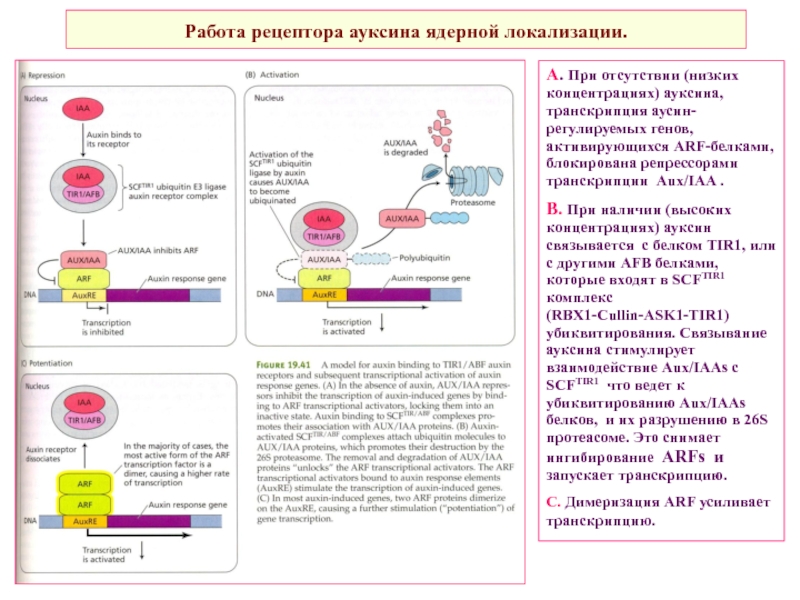
Слайд 25Работа рецептора ауксина ядерной локализации.
А. При отсутствии (низких концентрациях) ауксина,
В. При наличии (высоких концентрациях) ауксин связывается с белком TIR1, или с другими AFB белками, которые входят в SCFTIR1 комплекс (RBX1-Cullin-ASK1-TIR1) убиквитирования. Связывание ауксина стимулирует взаимодействие Aux/IAAs с SCFTIR1 что ведет к убиквитированию Aux/IAAs белков, и их разрушению в 26S протеасоме. Это снимает ингибирование ARFs и запускает транскрипцию.
С. Димеризация ARF усиливает транскрипцию.
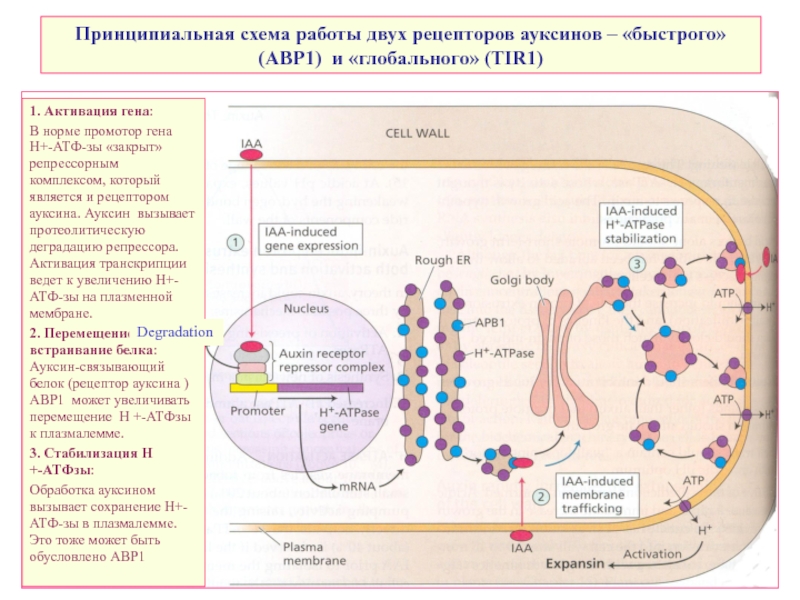
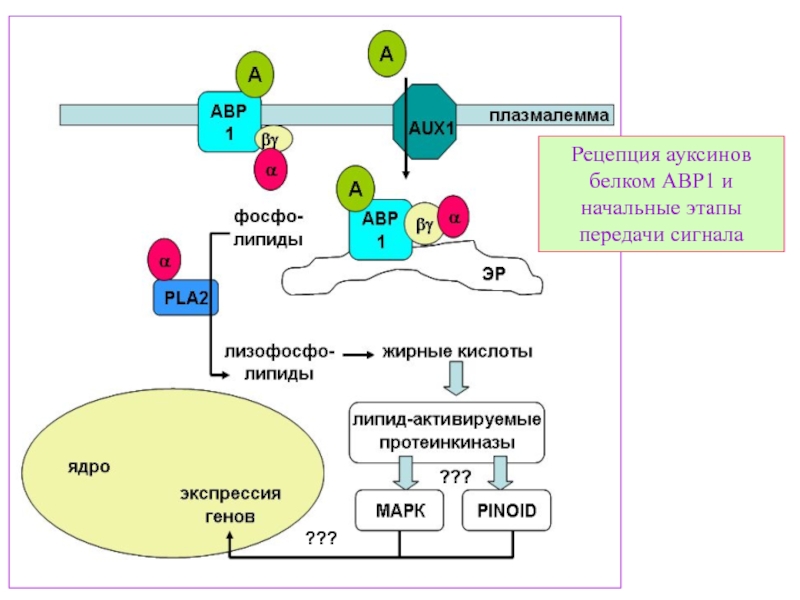
Слайд 26Принципиальная схема работы двух рецепторов ауксинов – «быстрого» (АВР1) и «глобального»
1. Активация гена:
В норме промотор гена Н+-АТФ-зы «закрыт» репрессорным комплексом, который является и рецептором ауксина. Ауксин вызывает протеолитическую деградацию репрессора. Активация транскрипции ведет к увеличению Н+-АТФ-зы на плазменной мембране.
2. Перемещение и встраивание белка: Ауксин-связывающий белок (рецептор ауксина ) ABP1 может увеличивать перемещение H +-ATФзы к плазмалемме.
3. Стабилизация H +-ATФзы:
Обработка ауксином вызывает сохранение Н+-АТФ-зы в плазмалемме. Это тоже может быть обусловлено ABP1
Degradation
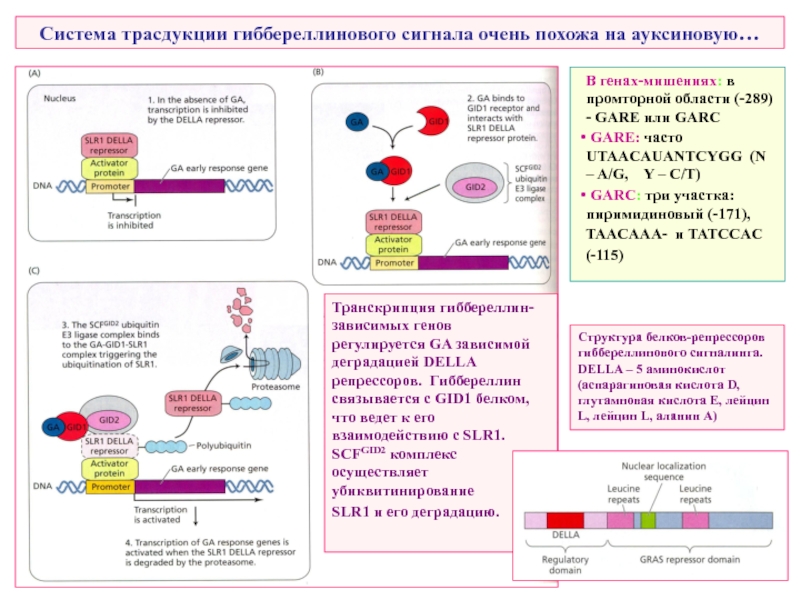
Слайд 28Система трасдукции гиббереллинового сигнала очень похожа на ауксиновую…
В генах-мишениях: в промторной
GARE: часто UTAACAUANTCYGG (N – A/G, Y – C/T)
GARC: три участка: пиримидиновый (-171),
TAACAAA- и TATCCAC
(-115)
Транскрипция гиббереллин-зависимых генов регулируется GA зависимой деградацией DELLA репрессоров. Гиббереллин связывается с GID1 белком, что ведет к его взаимодействию с SLR1. SCFGID2 комплекс осуществляет убиквитинирование
SLR1 и его деградацию.
Структура белков-репрессоров гиббереллинового сигналинга. DELLA – 5 аминокислот (аспарагиновая кислота D, глутамновая кислота E, лейцин L, лейцин L, аланин A)
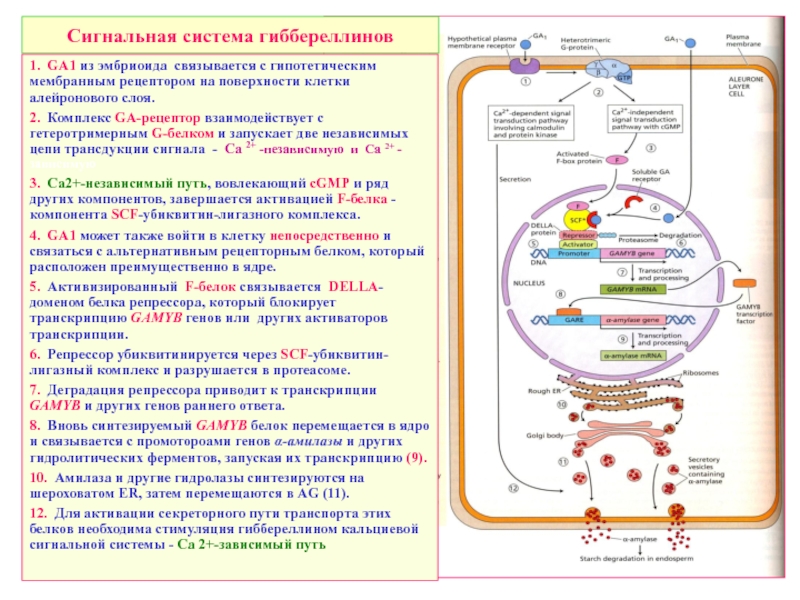
Слайд 29Сигнальная система гиббереллинов
1. GA1 из эмбриоида связывается с гипотетическим мембранным рецептором
2. Комплекс GA-рецептор взаимодействует с гетеротримерным G-белком и запускает две независимых цепи трансдукции сигнала - Са 2+ -независимую и Са 2+ -зависимую
3. Ca2+-независимый путь, вовлекающий cGMP и ряд других компонентов, завершается активацией F-белка - компонента SCF-убиквитин-лигазного комплекса.
4. GA1 может также войти в клетку непосредственно и связаться с альтернативным рецепторным белком, который расположен преимущественно в ядре.
5. Активизированный F-белок связывается DELLA-доменом белка репрессора, который блокирует транскрипцию GAMYB генов или других активаторов транскрипции.
6. Репрессор убиквитинируется через SCF-убиквитин-лигазный комплекс и разрушается в протеасоме.
7. Деградация репрессора приводит к транскрипции GAMYB и других генов раннего ответа.
8. Вновь синтезируемый GAMYB белок перемещается в ядро и связывается с промотороами генов α-амилазы и других гидролитических ферментов, запуская их транскрипцию (9).
10. Амилаза и другие гидролазы синтезируются на шероховатом ER, затем перемещаются в AG (11).
12. Для активации секреторного пути транспорта этих белков необходима стимуляция гиббереллином кальциевой сигнальной системы - Са 2+-зависимый путь
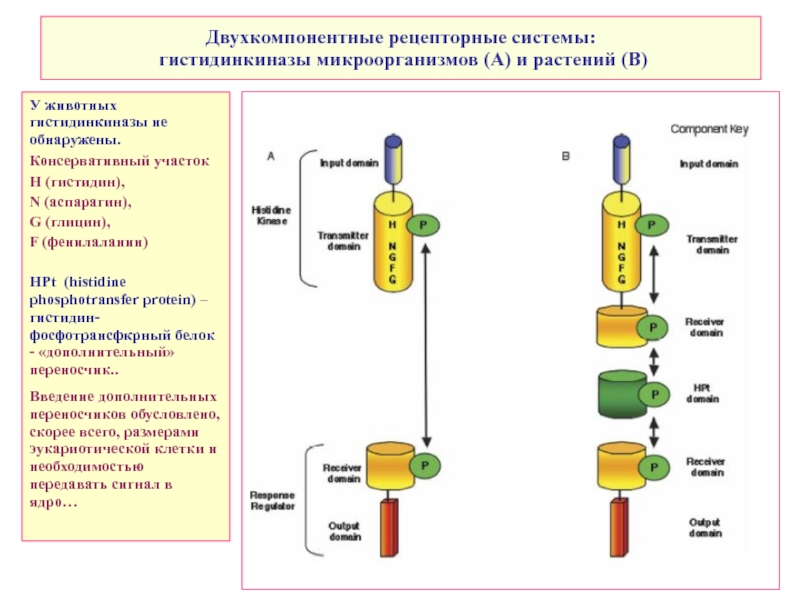
Слайд 31Двухкомпонентные рецепторные системы:
гистидинкиназы микроорганизмов (A) и растений (B)
У животных гистидинкиназы
Консервативный участок
H (гистидин),
N (аспарагин),
G (глицин),
F (фенилаланин)
HPt (histidine phosphotransfer protein) – гистидин-фосфотрансфкрный белок - «дополнительный» переносчик..
Введение дополнительных переносчиков обусловлено, скорее всего, размерами эукариотической клетки и необходимостью передавать сигнал в ядро…
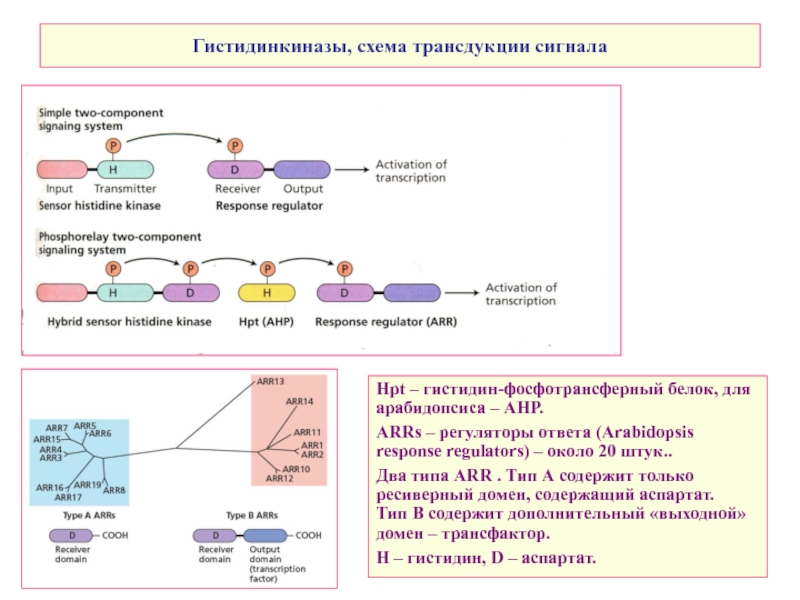
Слайд 32Гистидинкиназы, схема трансдукции сигнала
Нpt – гистидин-фосфотрансферный белок, для арабидопсиса – АНР.
ARRs
Два типа ARR . Тип А содержит только ресиверный домен, содержащий аспартат.
Тип В содержит дополнительный «выходной» домен – трансфактор.
H – гистидин, D – аспартат.
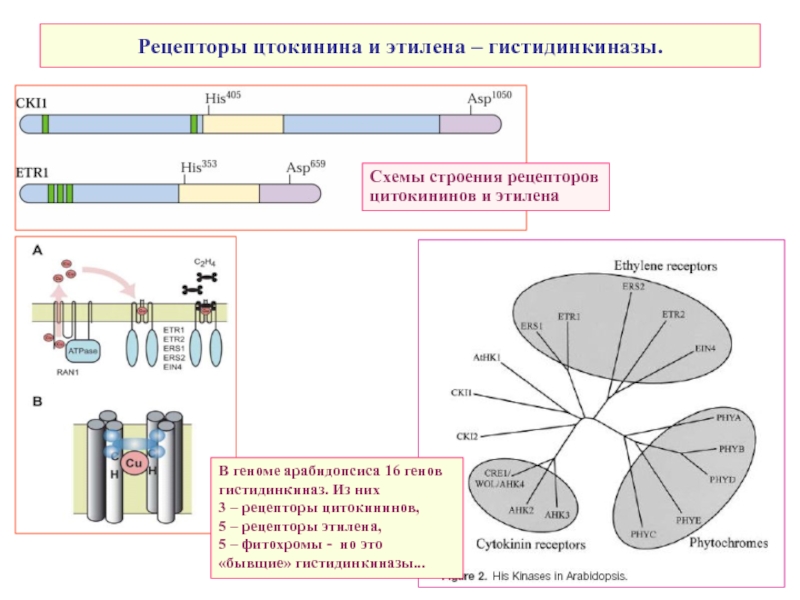
Слайд 33Рецепторы цтокинина и этилена – гистидинкиназы.
В геноме арабидопсиса 16 генов гистидинкиназ.
3 – рецепторы цитокининов,
5 – рецепторы этилена,
5 – фитохромы - но это «бывщие» гистидинкиназы...
Схемы строения рецепторов
цитокининов и этилена
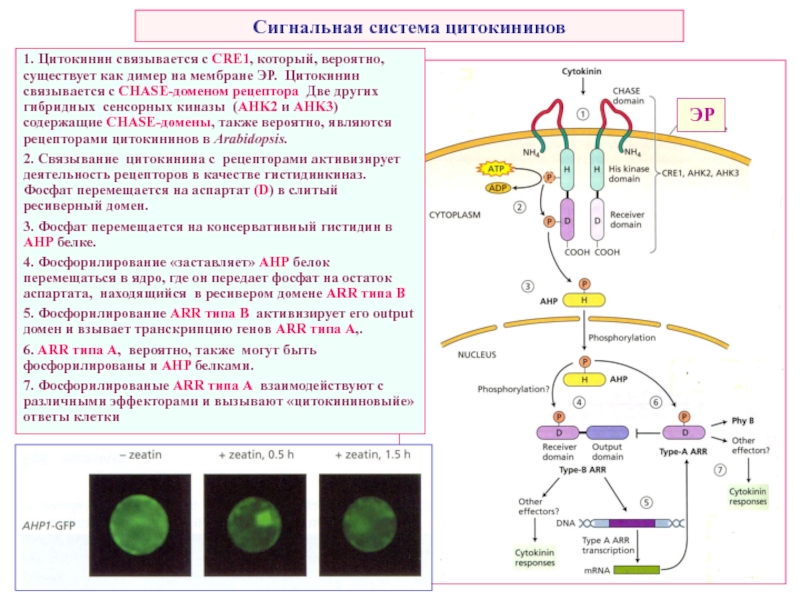
Слайд 34Сигнальная система цитокининов
1. Цитокинин связывается с CRE1, который, вероятно, существует как
2. Связывание цитокинина с рецепторами активизирует деятельность рецепторов в качестве гистидинкиназ. Фосфат перемещается на аспартат (D) в слитый ресиверный домен.
3. Фосфат перемещается на консервативный гистидин в AHP белке.
4. Фосфорилирование «заставляет» AHP белок перемещаться в ядро, где он передает фосфат на остаток аспартата, находящийся в ресивером домене ARR типа В
5. Фосфорилирование ARR типа В активизирует его output домен и взывает транскрипцию генов ARR типа А,.
6. ARR типа А, вероятно, также могут быть фосфорилированы и AHP белками.
7. Фосфорилированые ARR типа А взаимодействуют с различными эффекторами и вызывают «цитокининовыйе» ответы клетки
ЭР
Слайд 35Этилен работает «наоборот» - его присутствие инактивирует рецепторы…
Пять рецепторов этилена у
отсутствует «главный» гистидин…
GAF – консервативный
cGMP-связывающий домен.
Найденный у различных белков. Обычно его функции – небольшой регуляторный участок, связывающий молекулы.
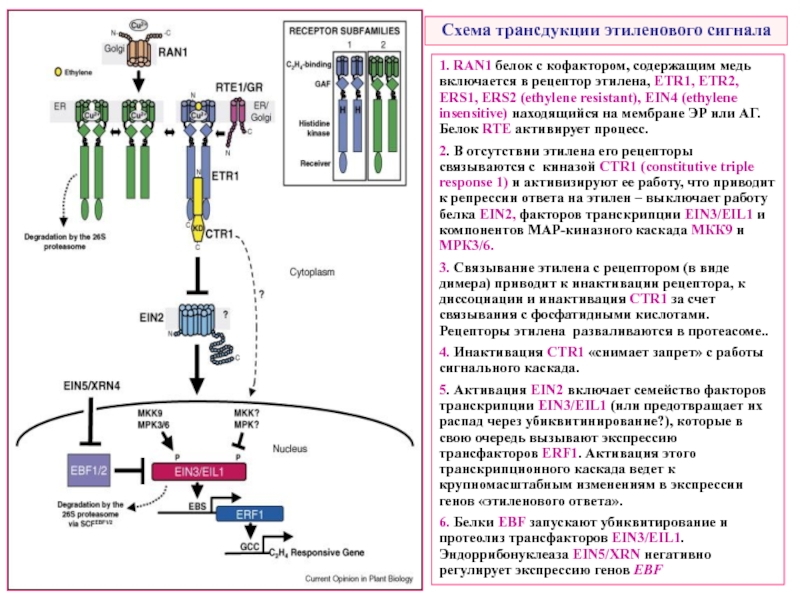
Слайд 36Схема трансдукции этиленового сигнала
1. RAN1 белок с кофактором, содержащим медь включается
2. В отсутствии этилена его рецепторы связываются с киназой CTR1 (constitutive triple response 1) и активизируют ее работу, что приводит к репрессии ответа на этилен – выключает работу белка EIN2, факторов транскрипции EIN3/EIL1 и компонентов МАР-киназного каскада МКК9 и МРК3/6.
3. Связывание этилена с рецептором (в виде димера) приводит к инактивации рецептора, к диссоциации и инактивация CTR1 за счет связывания с фосфатидными кислотами. Рецепторы этилена разваливаются в протеасоме..
4. Инактивация CTR1 «снимает запрет» с работы сигнального каскада.
5. Активация EIN2 включает семейство факторов транскрипции EIN3/EIL1 (или предотвращает их распад через убиквитинирование?), которые в свою очередь вызывают экспрессию трансфакторов ERF1. Активация этого транскрипционного каскада ведет к крупномасштабным изменениям в экспрессии генов «этиленового ответа».
6. Белки EBF запускают убиквитирование и протеолиз трансфакторов EIN3/EIL1. Эндоррибонуклеаза EIN5/XRN негативно регулирует экспрессию генов EBF
Слайд 37Схема трансдукции этиленового сигнала
EIN5/XRN4
MAPK
Контроль развития
CTR1 - Ser\Thr протеинкиназа, негативный регулятор этиленового
Протеинкиназа, MAPKKK, гомолог Raf протеинкиназ млекопитающих. «Анитпод» обычных MAPKKK – киназы «нижних» уровней она не активирует, а ингибирует и фосфатидные кислоты ее не стимулируют, а выключают. В отсутствии этилена связана с его рецепторами, активна и ответа на этилен нет. При связывании этилена CTR1 «уходит» из комплекса с рецепторами, связывается с фостфатидными кислотами, деградирует - происходит запуск ответа на этилен
EIN2 - позитивный регулятор этиленового сигналлинга,
Белок с неизвестной функцией, у арабидопсиса кодируется одним геном. N-концевой трансмембранный домен гомологичен металлотранспортерам Nramp, но ничего не транспортирует.. С-концевой цитоплазматический домен – важен для функции, но неясно как…
EIN3, EIL1 и EIL2 - этилен-зависимые транскрипционные факторы
Позитивные регуляторы этиленового сигналинга, локализуются в ядре, короткоживущие белки (время полужизни – 30 мин), ответ на этилен регулируется стабильностью EIN3 белков, но не уровнем их экспрессии. Индуцируют экспрессию гена ERF1 (Ethylene Response Factor)
EIN5/XRN4 – рибонуклеаза, регулирует уровень транскриптов EBF1/2 - компонентов убиквитин-лигазного комплекса
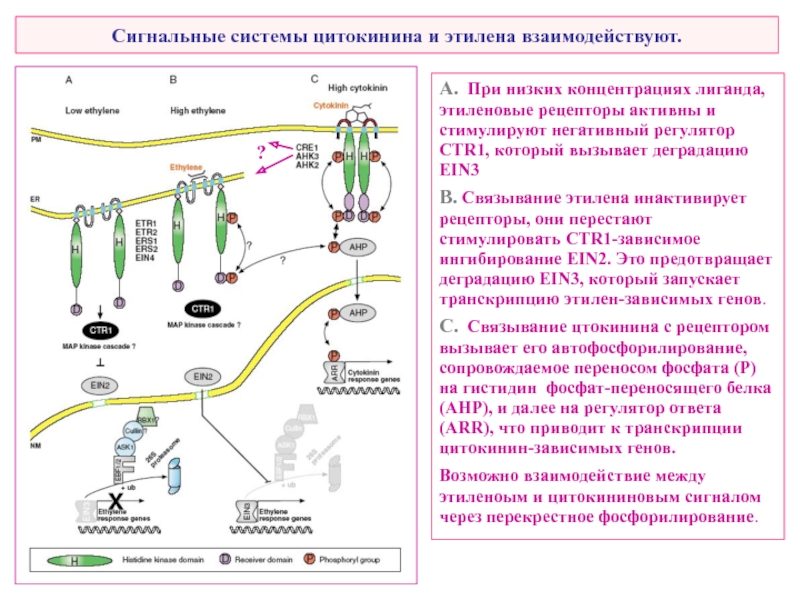
Слайд 38Сигнальные системы цитокинина и этилена взаимодействуют.
A. При низких концентрациях лиганда, этиленовые
B. Связывание этилена инактивирует рецепторы, они перестают стимулировать CTR1-зависимое ингибирование EIN2. Это предотвращает деградацию EIN3, который запускает транскрипцию этилен-зависимых генов.
C. Связывание цтокинина с рецептором вызывает его автофосфорилирование, сопровождаемое переносом фосфата (P) на гистидин фосфат-переносящего белка (AHP), и далее на регулятор ответа (ARR), что приводит к транскрипции цитокинин-зависимых генов.
Возможно взаимодействие между этиленоым и цитокининовым сигналом через перекрестное фосфорилирование.
?
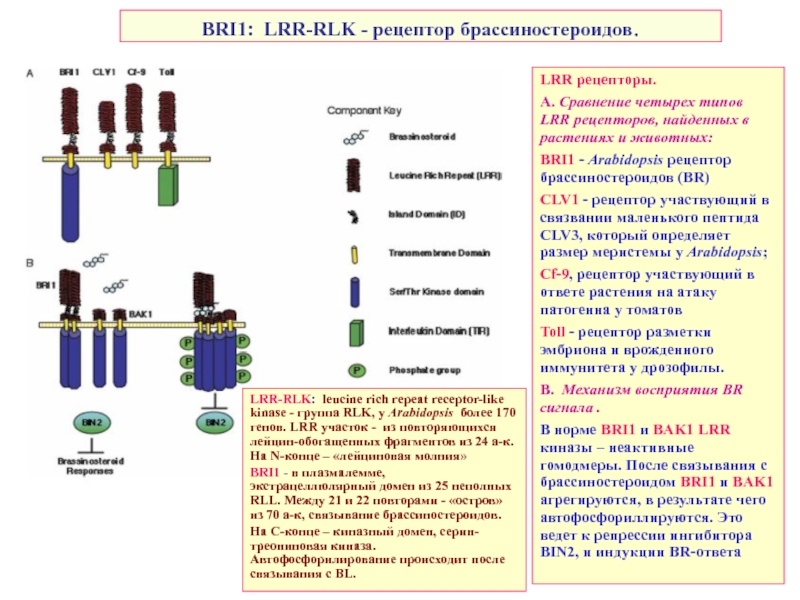
Слайд 39BRI1: LRR-RLK - рецептор брассиностероидов.
LRR рецепторы.
А. Сравнение четырех типов
BRI1 - Arabidopsis рецептор брассиностероидов (BR)
CLV1 - рецептор участвующий в связвании маленького пептида CLV3, который определяет размер меристемы у Arabidopsis;
Cf-9, рецептор участвующий в ответе растения на атаку патогенна у томатов
Toll - рецептор разметки эмбриона и врожденного иммунитета у дрозофилы.
B. Механизм восприятия BR сигнала .
В норме BRI1 и BAK1 LRR киназы – неактивные гомодмеры. После связывания с брассиностероидом BRI1 и BAK1 агрегируются, в результате чего автофосфориллируются. Это ведет к репрессии ингибитора BIN2, и индукции BR-ответа
LRR-RLK: leucine rich repeat receptor-like kinase - группа RLK, у Arabidopsis более 170 генов. LRR участок - из повторяющихся лейцин-обогащенных фрагментов из 24 а-к. На N-конце – «лейциновая молния»
BRI1 - в плазмалемме, экстрацеллюлярный домен из 25 неполных RLL. Между 21 и 22 повторами - «остров» из 70 а-к, связывание брассиностероидов.
На С-конце – киназный домен, серин-треониновая киназа. Автофосфорилирование происходит после связывания с BL.
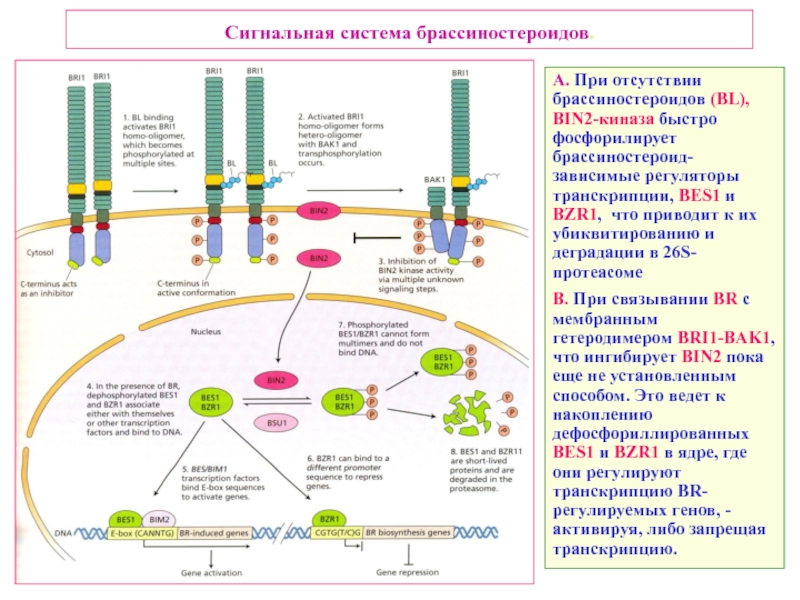
Слайд 40Сигнальная система брассиностероидов.
A. При отсутствии брассиностероидов (BL), BIN2-киназа быстро фосфорилирует
B. При связывании BR c мембранным гетеродимером BRI1-BAK1, что ингибирует BIN2 пока еще не установленным способом. Это ведет к накоплению дефосфориллированных BES1 и BZR1 в ядре, где они регулируют транскрипцию BR-регулируемых генов, - активируя, либо запрещая транскрипцию.
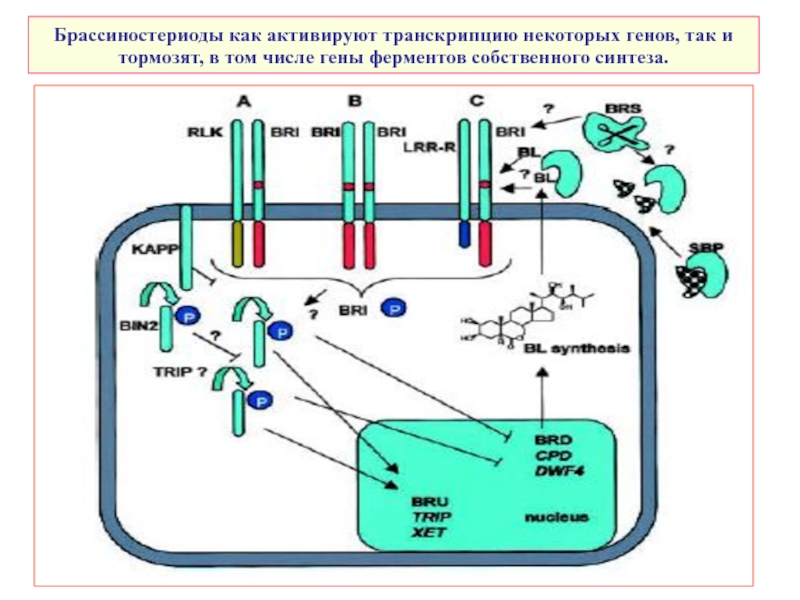
Слайд 41Брассиностериоды как активируют транскрипцию некоторых генов, так и тормозят, в том
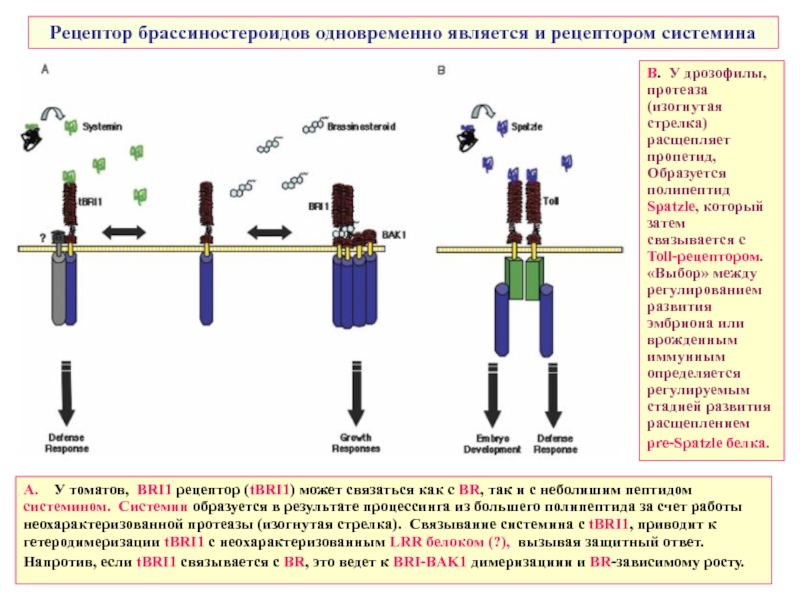
Слайд 42Рецептор брассиностероидов одновременно является и рецептором системина
А. У томатов, BRI1
Напротив, если tBRI1 связывается с BR, это ведет к BRI-BAK1 димеризациии и BR-зависимому росту.
В. У дрозофилы, протеаза (изогнутая стрелка) расщепляет пропетид, Образуется полипептид Spatzle, который затем связывается с Toll-рецептором. «Выбор» между регулированием развития эмбриона или врожденным иммунным определяется регулируемым стадией развития расщеплением
pre-Spatzle белка.
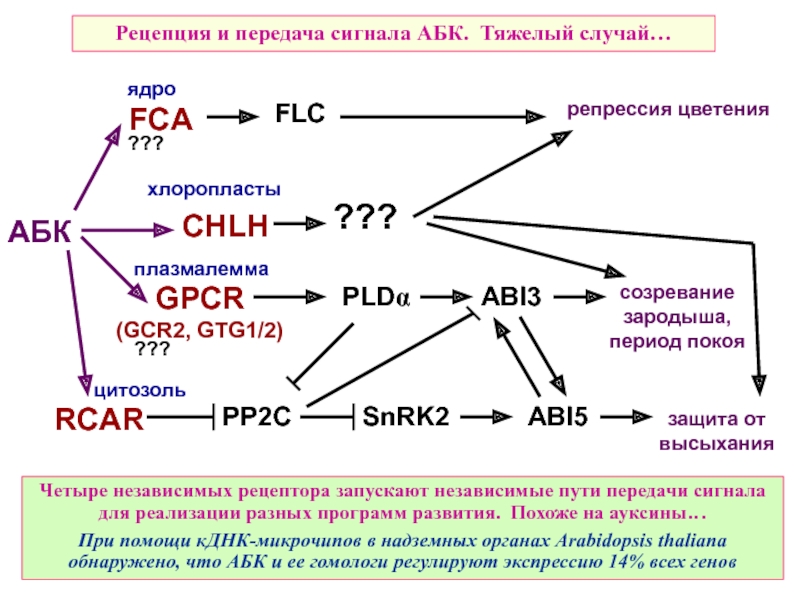
Слайд 43Рецепция и передача сигнала АБК. Тяжелый случай…
защита от высыхания
Четыре независимых рецептора
При помощи кДНК-микрочипов в надземных органах Arabidopsis thaliana обнаружено, что АБК и ее гомологи регулируют экспрессию 14% всех генов
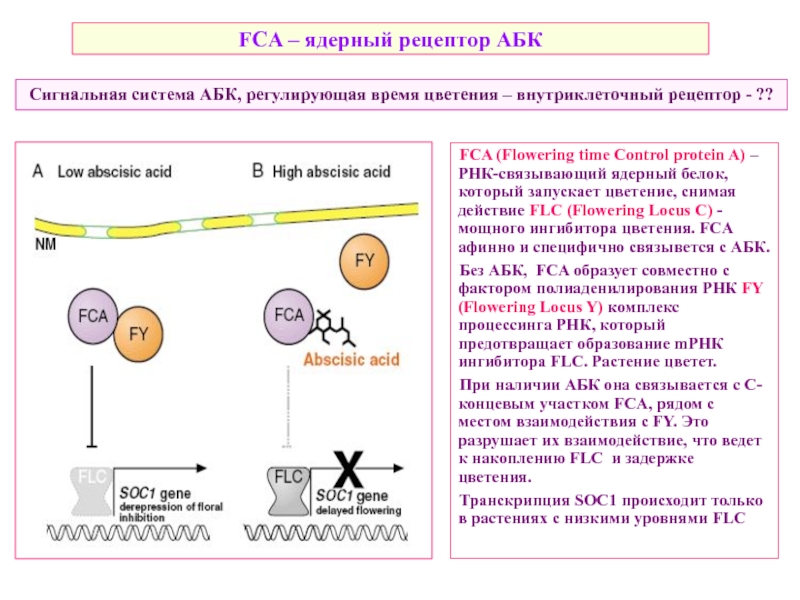
Слайд 44FCA (Flowering time Control protein A) – РНК-связывающий ядерный белок, который
Без АБК, FCA образует совместно с фактором полиаденилирования РНК FY (Flowering Locus Y) комплекс процессинга РНК, который предотвращает образование mРНК ингибитора FLC. Растение цветет.
При наличии АБК она связывается c С-концевым участком FCA, рядом с местом взаимодействия с FY. Это разрушает их взаимодействие, что ведет к накоплению FLC и задержке цветения.
Транскрипция SOC1 происходит только в растениях с низкими уровнями FLC
Сигнальная система АБК, регулирующая время цветения – внутриклеточный рецептор - ??
FCA – ядерный рецептор АБК
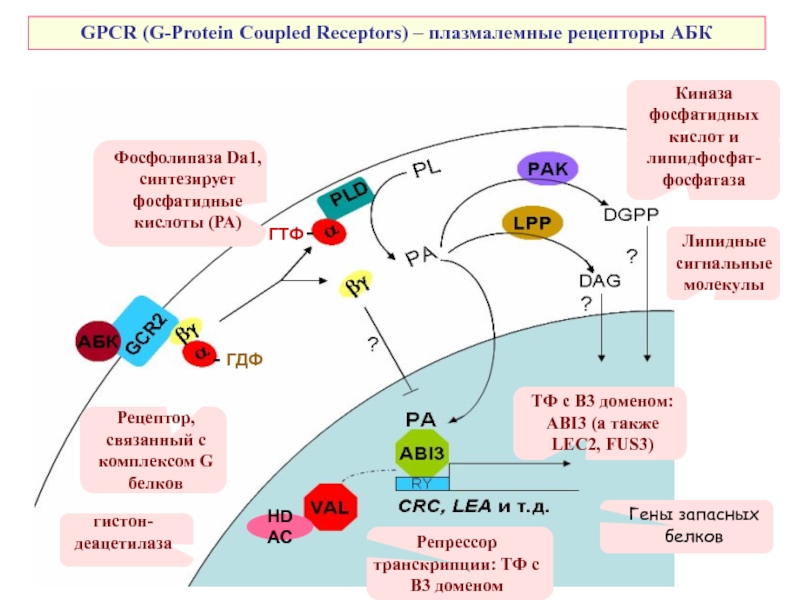
Слайд 46GPCR (G-Protein Coupled Receptors) – плазмалемные рецепторы АБК
ТФ с В3 доменом:
Рецептор, связанный с комплексом G белков
ГДФ
ГТФ
Фосфолипаза Da1,
синтезирует фосфатидные кислоты (РА)
Киназа фосфатидных кислот и липидфосфат-фосфатаза
Липидные сигнальные молекулы
Гены запасных белков
HDAC
Репрессор транскрипции: ТФ с В3 доменом
гистон-деацетилаза
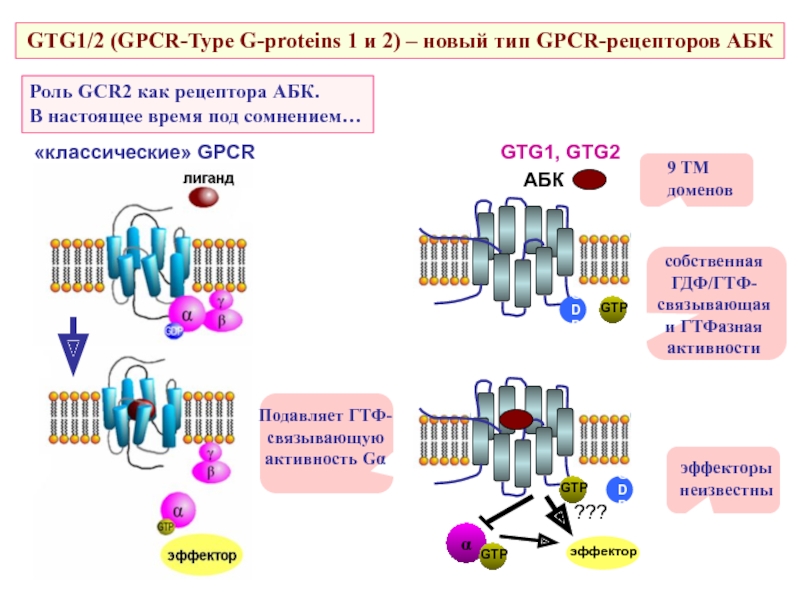
Слайд 47Роль GCR2 как рецептора АБК.
В настоящее время под сомнением…
GTG1/2 (GPCR-Type G-proteins
«классические» GPCR
9 ТМ
доменов
собственная ГДФ/ГТФ-связывающая и ГТФазная активности
эффекторы неизвестны
Подавляет ГТФ-связывающую активность Gα
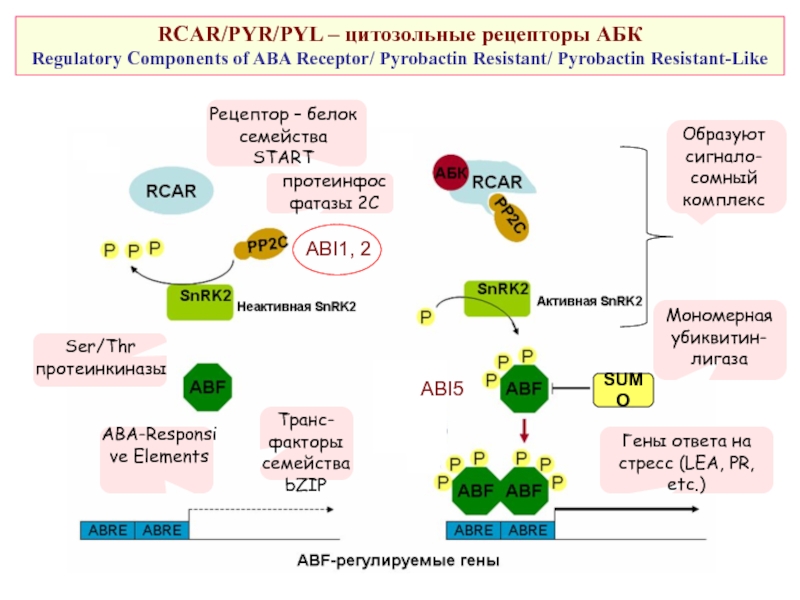
Слайд 48RCAR/PYR/PYL – цитозольные рецепторы АБК
Regulatory Components of ABA Receptor/ Pyrobactin
Гены ответа на стресс (LEA, PR, etc.)
ABI5
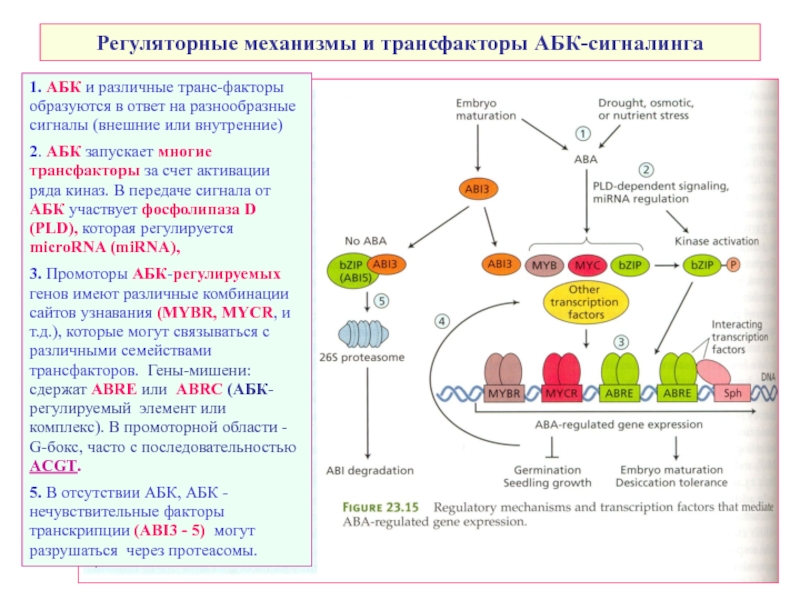
Слайд 49Регуляторные механизмы и трансфакторы АБК-сигналинга
1. АБК и различные транс-факторы образуются в
2. АБК запускает многие трансфакторы за счет активации ряда киназ. В передаче сигнала от АБК участвует фосфолипаза D (PLD), которая регулируется microRNA (miRNA),
3. Промоторы АБК-регулируемых генов имеют различные комбинации сайтов узнавания (MYBR, MYCR, и т.д.), которые могут связываться с различными семействами трансфакторов. Гены-мишени: сдержат ABRE или ABRC (АБК-регулируемый элемент или комплекс). В промоторной области - G-бокс, часто с последовательностью ACGT.
5. В отсутствии АБК, АБК -нечувствительные факторы транскрипции (ABI3 - 5) могут разрушаться через протеасомы.
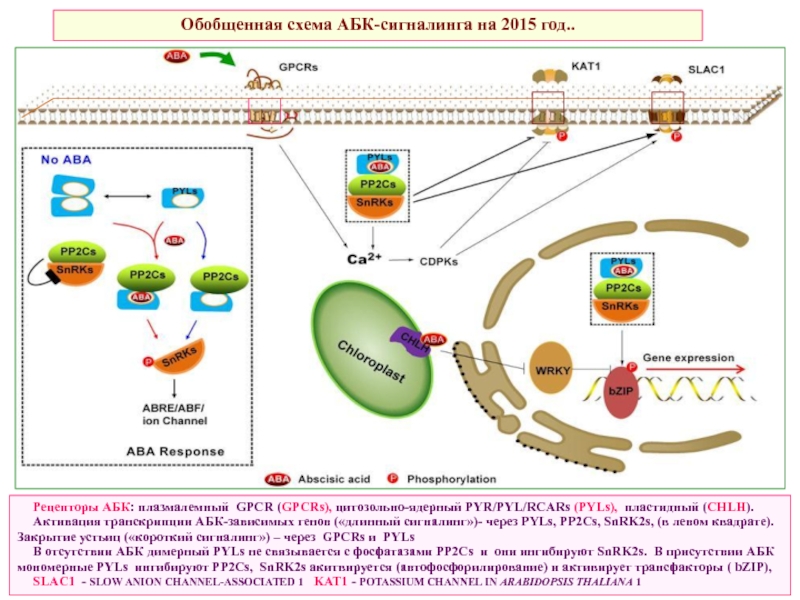
Слайд 50Обобщенная схема АБК-сигналинга на 2015 год..
Рецепторы АБК: плазмалемный GPCR (GPCRs), цитозольно-ядерный
Активация транскрипции АБК-зависимых генов («длинный сигналинг»)- через PYLs, PP2Cs, SnRK2s, (в левом квадрате). Закрытие устьиц («короткий сигналинг») – через GPCRs и PYLs
В отсутствии АБК димерный PYLs не связывается с фосфатазами PP2Cs и они ингибируют SnRK2s. В присутствии АБК мономерные PYLs ингибируют PP2Cs, SnRK2s акитвируется (автофосфорилирование) и активирует трансфакторы ( bZIP),
SLAC1 - SLOW ANION CHANNEL-ASSOCIATED 1 KAT1 - POTASSIUM CHANNEL IN ARABIDOPSIS THALIANA 1
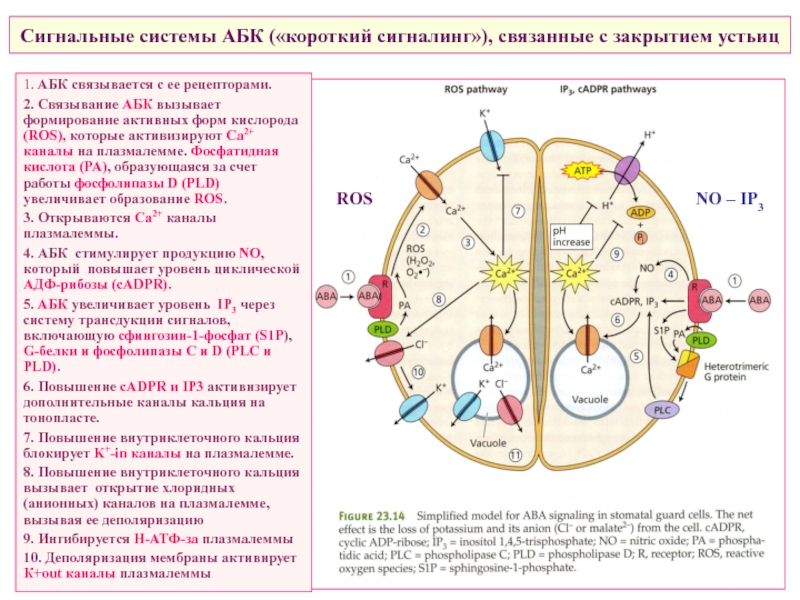
Слайд 51Сигнальные системы АБК («короткий сигналинг»), связанные с закрытием устьиц
1. АБК связывается
2. Связывание АБК вызывает формирование активных форм кислорода (ROS), которые активизируют Ca2+ каналы на плазмалемме. Фосфатидная кислота (PA), образующаяся за счет работы фосфолипазы D (PLD) увеличивает образование ROS.
3. Открываются Ca2+ каналы плазмалеммы.
4. АБК стимулирует продукцию NO, который повышает уровень циклической АДФ-рибозы (cADPR).
5. АБК увеличивает уровень IP3 через систему трансдукции сигналов, включающую сфингозин-1-фосфат (S1P), G-белки и фосфолипазы С и D (PLC и PLD).
6. Повышение cADPR и IP3 активизирует дополнительные каналы кальция на тонопласте.
7. Повышение внутриклеточного кальция блокирует K+-in каналы на плазмалемме.
8. Повышение внутриклеточного кальция вызывает открытие хлоридных (анионных) каналов на плазмалемме, вызывая ее деполяризацию
9. Ингибируется Н-АТФ-за плазмалеммы
10. Деполяризация мембраны активирует К+out каналы плазмалеммы
ROS
NO – IP3
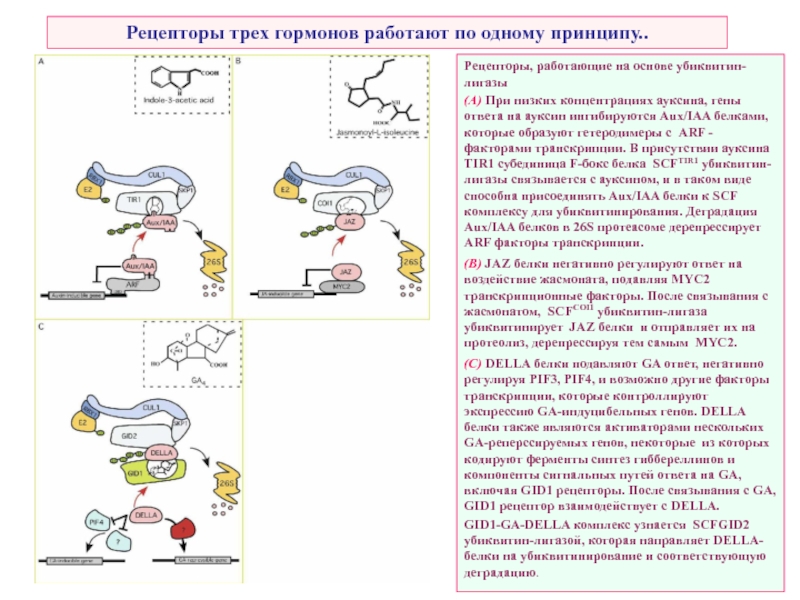
Слайд 52Рецепторы трех гормонов работают по одному принципу..
Рецепторы, работающие на основе убиквитин-лигазы
(A) При низких концентрациях ауксина, гены ответа на ауксин ингибируются Aux/IAA белками, которые образуют гетеродимеры с ARF - факторами транскрипции. В присутствии ауксина TIR1 субединица F-бокс белка SCFTIR1 убиквитин-лигазы связывается с ауксином, и в таком виде способна присоединять Aux/IAA белки к SCF комплексу для убиквитинирования. Деградация Aux/IAA белков в 26S протеасоме дерепрессирует ARF факторы транскрипции.
(B) JAZ белки негативно регулируют ответ на воздействие жасмоната, подавляя MYC2 транскрипционные факторы. После связывания с жасмонатом, SCFCOI1 убиквитин-лигаза убиквитинирует JAZ белки и отправляет их на протеолиз, дерепрессируя тем самым MYC2.
(C) DELLA белки подавляют GA ответ, негативно регулируя PIF3, PIF4, и возможно другие факторы транскрипции, которые контроллируют экспрессию GA-индуцибельных генов. DELLA белки также являются активаторами нескольких GA-реперссируемых генов, некоторые из которых кодируют ферменты синтез гиббереллинов и компоненты сигнальных путей ответа на GA, включая GID1 рецепторы. После связывания с GA, GID1 рецептор взаимодействует с DELLA.
GID1-GA-DELLA комплекс узнается SCFGID2 убиквитин-лигазой, которая направляет DELLA-белки на убиквитинирование и соответствующую деградацию.