- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Обмен липидов презентация
Содержание
- 1. Обмен липидов
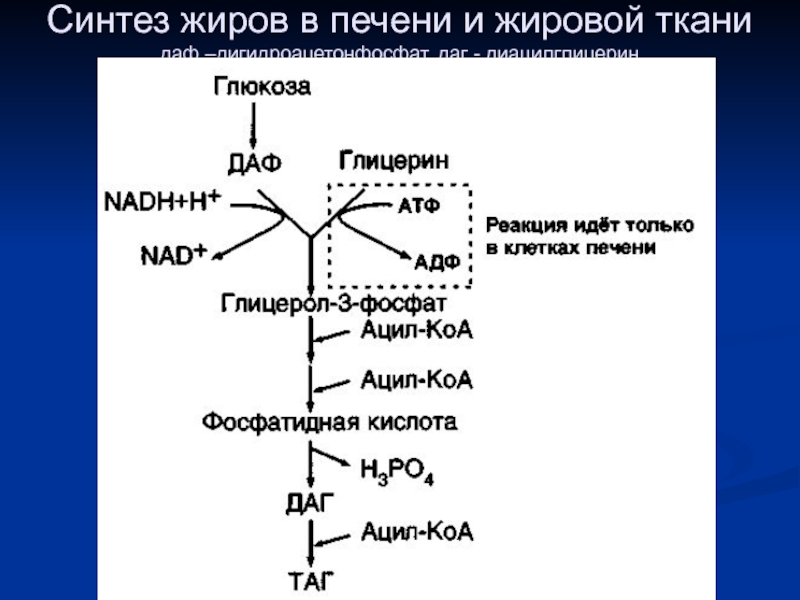
- 2. Синтез жиров в печени и жировой ткани даф –дигидроацетонфосфат, даг - диацилглицерин
- 3. Биосинтез жирных кислот Источником углерода для синтеза
- 5. Синтез жирных кислот Синтез жирных кислот имеет
- 6. Из ацетил-КоА образуется малонил-КоА:
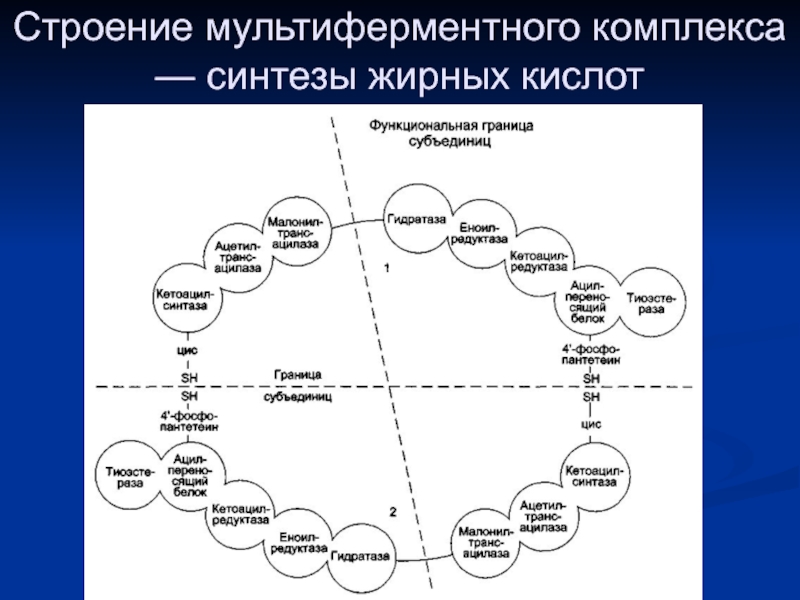
- 7. Строение мультиферментного комплекса — синтезы жирных кислот
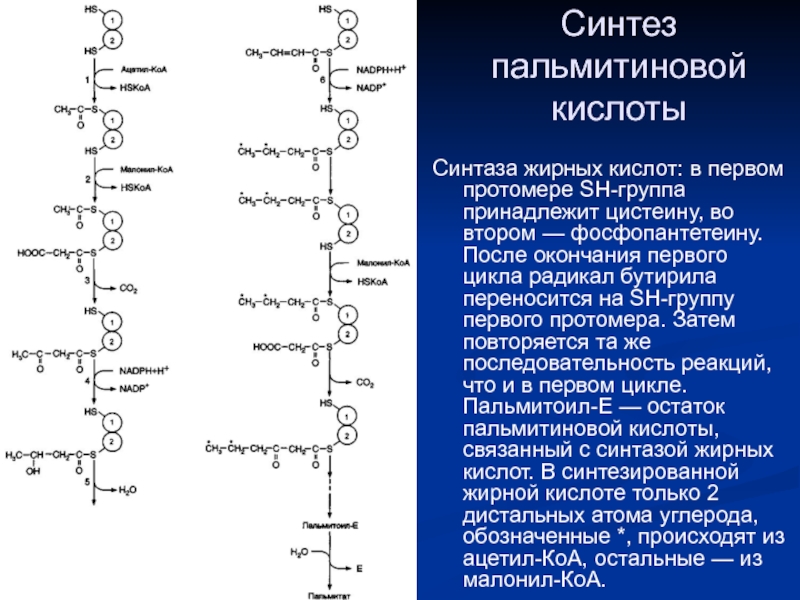
- 8. Синтез пальмитиновой кислоты Синтаза жирных кислот: в
- 9. Общая схема реакций синтеза пальмитиновой кислоты
- 10. Образование двойных связей в радикалах жирных кислот
- 11. Образование двойных связей Для образования двойной связи
- 12. Образование ненасыщенных жирных кислот
- 13. Регуляция липидного обмена 1. Внешние факторы (тип
- 14. 2. Внутренние факторы: гормоны, усиливающие процессы липогенеза:
- 15. Патология липидного обмена 1. Ожирение Причины:
- 16. 2. Нарушения переваривания и усвоения липидов: заболевания
- 17. 3. Кетозы – характеризуются кетонемией и кетонурией.
- 18. 4. Атеросклероз: увеличение в крови свободных жирных кислот; увеличение в крови ЛПОНП и ЛПНП.
- 19. Обмен белков
- 20. Белки Белки – биологические полимерные молекулы,
- 21. Функции белков. Каталитическая – ферменты Пластическая –
- 22. Содержание белков в тканях, %
- 23. Простые белки а) альбумины б) глобулины в)
- 24. Сложные белки а) нуклеопротеины б) хромопротеины в) фосфоропротеины г) гликопротеины д) липопротеины е) металлопротеины
- 25. Аминокислоты Заменимые Глицин Аланин Серин Цистеин Аспарагиновая
- 26. Классификация белков по их полноценности Полноценные белки
- 27. АЗОТИСТЫЙ БАЛАНС Азотистый баланс — разница между
- 28. Виды азотистого баланса Положительный: количество усвоенного азота
- 29. Отрицательный азотистый баланс: количество выделенного азота больше,
- 30. Азотистое равновесие (нулевой баланс): количество усвоенного и
- 31. Белковая недостаточность Известно, что даже длительное исключение
- 32. Белковый минимум Это наименьшее количество белка в
- 33. Нормы протеина в рационе Они расчитываются с
- 34. В организме человека в сутки распадается на
- 35. Количество белка в некоторых пищевых продуктах
- 36. Переваривание белков Основной смысл переваривания белков состоит
- 37. Переваривание белков осуществляется комплексом пищеварительных ферментов, которые
- 38. Переваривание белков в желудке Желудочный сок —
- 39. Под действием НС1 происходит денатурация белков пищи,
- 40. Секреция соляной кислоты в желудке
- 41. Механизм активации пепсина Под действием гастринов в
- 42. Особенности переваривания белков в желудке у молодых
- 43. Компоненты желудочного сока в норме и при патологических состояниях
- 44. Механизм действия пепсина Белки рациона + НОН
- 45. Активация панкреатических ферментов В поджелудочной железе синтезируются
- 46. - Активация трипсиногена происходит под действием фермента
- 47. - Образовавшийся трипсин активирует химотрипсиноген: трипсин Химотрипсиноген
- 48. Активация химотрипсиногена
- 49. Остальные проферменты панкреатических протеаз (проэластаза и прокарбоксипептидазы
- 50. Карбоксипептидазы А и В — цинксодержащие ферменты,
- 51. Аминопептидазы последовательно отщепляют N-концевые аминокислоты пептидной цепи.
- 52. Механизм действия экзопептидаз
- 53. Защита клеток от действия протеаз Клетки
- 54. Защита от действия протеаз В полости желудка
- 55. Механизм всасывания аминокислот в кишечнике
- 56. В настоящёе время известно по крайней мере
- 57. Гниение белков в толстом отделе кишечника БЕЛКИ
- 58. Переваривание белков у жвачных Белки
- 59. Фонд свободных аминокислот организма составляет примерно 35
- 60. Источники аминокислот 1. Белки корма (экзогенные аминокислоты).
- 61. Пути использования аминокислот в организме Биосинтез белков,
- 63. КАТАБОЛИЗМ АМИНОКИСЛОТ Аминокислоты, образующиеся при переваривании белков
- 64. Трансаминирование Трансаминирование — реакция переноса α-аминогруппы с
- 65. Реакция трансаминирования
- 66. Аминотрансферазы Аминотрансферазы обнаружены как в цитоплазме, так
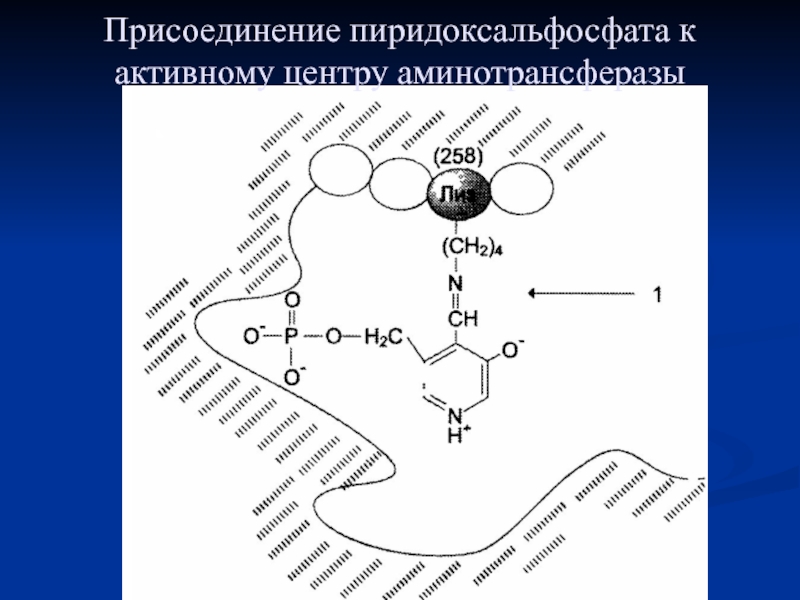
- 67. Присоединение пиридоксальфосфата к активному центру аминотрансферазы
- 68. Основной путь трансаминирования Чаще всего
- 70. Аминотрансферазы обладают субстратной специфичностью к разным аминокислотам.
- 71. Аланинаминотрансфераза АЛТ (АлАТ) катализирует реакцию трансаминирования между
- 72. ACT (АсАТ) катализирует реакцию трансаминирования между аспартатом
- 73. Биологическое значение трансаминирования Реакции трансаминирования играют большую
- 74. Дезаминирование аминокислот Дезаминирование аминокислот — реакция отщепления
- 75. Виды дезаминирования Окислительное (идет в две ступени); Восстановительное; Гидролитическое; Внутримолекулярное; Трансаминирование.
- 76. Окислительное дезаминирование Наиболее активно в тканях
- 77. Дезаминирование глутамата
- 78. Непрямое дезаминирование (трансдезаминирование) Большинство аминокислот не
- 79. Восстановительное дезаминирование
- 80. Гидролитическое дезаминирование
- 81. Внутримолекулярное дезаминирование
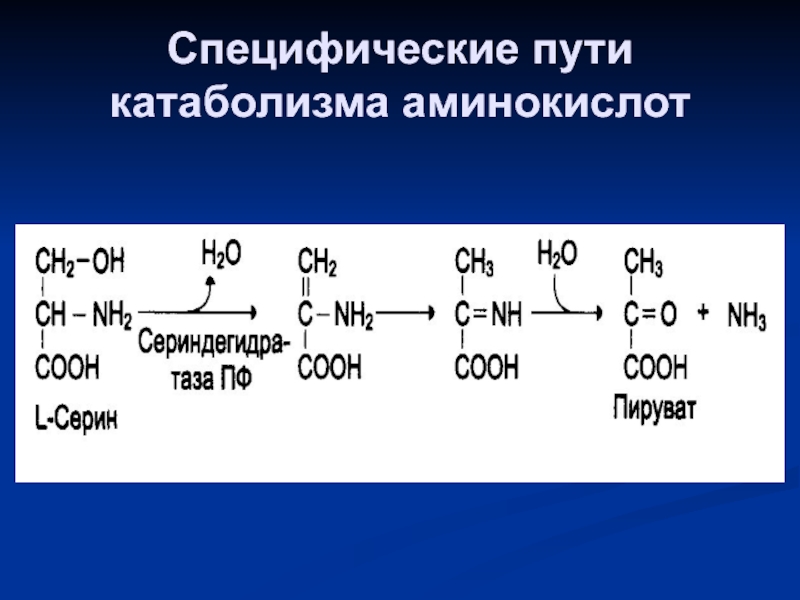
- 82. Специфические пути катаболизма аминокислот
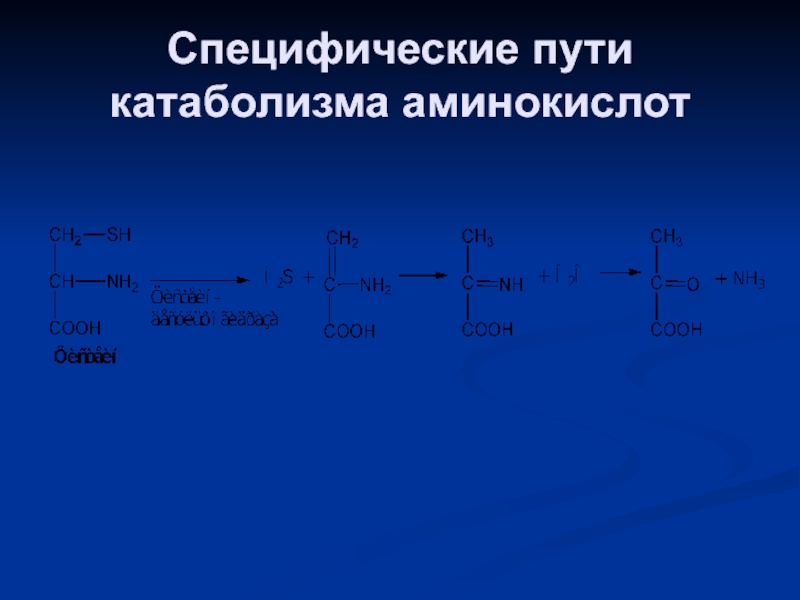
- 83. Специфические пути катаболизма аминокислот
- 84. Гликогенные и кетогенные аминокислоты Аминокислоты, которые в
- 85. Гликогенные и кетогенные амнокислоты
- 86. Декарбоксилирование аминокислот
- 87. Биологическая роль гистамина Много образуется в очаге
- 88. Декарбоксилирование аминокислот
- 89. Токсичность аммиака Аммиак легко проникает через мембраны
- 90. Токсичность аммиака Повышение концентрации аммиака в крови
- 91. Пути обезвреживания аммиака Временное обезвреживание (во всех
- 93. +NH3
- 94. Связывание аммиака Основной реакцией связывания аммиака, протекающей
- 95. Глутамин — основной донор азота в организме.
- 96. Орнитиновый цикл Мочевина — основной конечный
- 97. Орнитиновый цикл
- 98. Орнитиновый цикл
- 99. Орнитиновый цикл
- 100. Орнитиновый цикл
- 101. Орнитиновый цикл
- 102. Схема орнитинового цикла
- 103. При образовании мочевины используется А) аммиак –
- 104. Анаболическая фаза обмена белков Синтез заменимых аминокислот.
- 105. Синтез заменимых аминокислот Углеродный скелет заменимых аминокислот
- 106. Восстановительное аминирование α-кетокислот
- 107. Трансаминирование
- 108. Предшественники заменимых аминокислот
- 109. Образование аминокислот из углеводов СН3СО ·
Слайд 3Биосинтез жирных кислот
Источником углерода для синтеза жирных кислот служит ацетил-КоА, образующийся
Слайд 5Синтез жирных кислот
Синтез жирных кислот имеет ряд особенностей:
в отличие от окисления
источником синтеза является малонил-КоА, образующийся из ацетил-КоА;
ацетил-КоА непосредственно в реакциях синтеза используется только как затравка;
для восстановления промежуточных продуктов синтеза жирных кислот используется НАДФ · Н2;
все стадии синтеза жирной кислоты из малонил-КоА представляют собой циклический процесс, который протекает на поверхности пальмитатсинтетазы.
Слайд 8Синтез пальмитиновой кислоты
Синтаза жирных кислот: в первом протомере SH-группа принадлежит цистеину,
Слайд 10Образование двойных связей в радикалах жирных кислот
Включение двойных связей в радикалы
Образование двойных связей в радикалах жирных кислот происходит в ЭР в реакциях с участием молекулярного кислорода, NADH и цитохрома b5.
Слайд 11Образование двойных связей
Для образования двойной связи в радикале жирной кислоты требуется
Слайд 13Регуляция липидного обмена
1. Внешние факторы (тип питания):
избыток углеводов в рационе усиливает
голодание или богатая жирами пища снижают процессы синтеза жиров.
Слайд 142. Внутренние факторы:
гормоны, усиливающие процессы липогенеза:
- инсулин;
гормоны, усиливающие процессы липолиза (распада
- тироксин;
- адреналин и норадреналин;
- андрогены;
- соматотропный и липотропный гормоны.
Слайд 15Патология липидного обмена
1. Ожирение
Причины:
гипофункция щитовидной железы (по тироксину);
недостаток липотропного гормона
Слайд 162. Нарушения переваривания и усвоения липидов:
заболевания поджелудочной железы (недостаточная секреция и
нарушение выделения и секреции желчи (желчных кислот);
воспаления слизистой оболочки кишечника (нарушения процессов всасывания).
Слайд 173. Кетозы – характеризуются кетонемией и кетонурией. Причины:
недостаток инсулина;
В3-авитаминоз (недостаток НS-КоА);
недостаток
избыток ацетил-КоА, который усиливает избыточный синтез кетоновых тел;
D-авитаминоз, при котором угнетается активность пускового фермента ЦТК цитратсинтазы;
избыточное количество в рационе белков и кетогенных аминокислот (лейцин, лизин, фенилаланин, тирозин, триптофан) при недостатке в организме углеводов.
Слайд 20Белки
Белки – биологические полимерные молекулы, мономерами которых являются аминокислоты, соединенные пептидными
Индивидуальность белковых молекул определяется порядком чередования аминокислот и их количеством.
Белки имеют м.м. от 5 тыс. Д и более.
Слайд 21Функции белков.
Каталитическая – ферменты
Пластическая – структурные белки
Регуляторная – гормоны, ферменты
Сократительная –
Защитная – иммуноглобулины
Энергетическая – отслужившие белки
Рецепторная – некоторые белки мембран
Транспортная – белки крови, белки мембран.
Гистосовместимость – некоторые белки мембран.
И др.
В организме животных белков - 18-21%, у растений – 0,01-15%
Слайд 22Содержание белков в тканях, %
Организм – 18-21
Мышцы – 19-23
Печень – 18-19
Почки – 16-18
Головной мозг – 8-10
Кости – 8-9
Растения
Зерна – 10-16
Стебли – 1,5-3
Листья – 1,2-3
Слайд 23Простые белки
а) альбумины
б) глобулины
в) гистоны
г) протамины
д) глютелины
е) проламины
ж) склеропротеины
Слайд 24Сложные белки
а) нуклеопротеины
б) хромопротеины
в) фосфоропротеины
г) гликопротеины
д) липопротеины
е) металлопротеины
Слайд 25Аминокислоты
Заменимые
Глицин
Аланин
Серин
Цистеин
Аспарагиновая кислота
Глютаминовая кислота
Тирозин
Пролин
Аспарагин
Глютамин
Незаменимые
Треонин
Метионин
Валин
Лейцин
Изолейцин
Лизин
Аргинин
Фенилаланин
Гистидин
Триптофан
Слайд 26Классификация белков по их полноценности
Полноценные белки содержат все незаменимые аминокислоты. К
Неполноценные белки. В их структуре отсутствует хотя бы одна из незаменимых аминокислот. К ним относят, в основном, белки растительного происхождения, за исключением некоторых белков бобовых и гречихи.
Слайд 27АЗОТИСТЫЙ БАЛАНС
Азотистый баланс — разница между количеством азота, усвоенного организмом, и
Виды азотистого баланса: 1) положительный,
2) отрицательный, 3) нулевой (азотистое равновесие).
Аминокислоты (свободные и в составе белков) содержат почти 95% всего азота, поэтому именно они поддерживают азотистый баланс организма.
Слайд 28Виды азотистого баланса
Положительный: количество усвоенного азота больше, чем количество выделенного азота,
Этот вид баланса наблюдается:
- у молодых растущих животных;
- у продуктивных животных;
- при беременности;
- в восстановительный период после тяжелой болезни.
Слайд 29Отрицательный азотистый баланс: количество выделенного азота больше, чем количество усвоенного азота,
- при тяжелых заболеваниях;
- при старении животных;
- при голодании;
- при различных авитаминозах;
- при недостатке в рационе незаменимых аминокислот.
Слайд 30Азотистое равновесие (нулевой баланс): количество усвоенного и выделенного азота равно. Это
Слайд 31Белковая недостаточность
Известно, что даже длительное исключение из рациона человека жиров или
Слайд 32Белковый минимум
Это наименьшее количество белка в рационе, которое обеспечивает восполнение всех
- Свиньи взрослые - 1,0 г;
- Свиньи при откорме – 3,0 г;
- Коровы не лактирующие – 0,6-0,8 г;
- Коровы лактирующие – 1,2-1,4 г;
- Овцы – 1,0 г;
- Лошади не работающие – 0,8 г;
- Лошади работающие – 1,2-1,4 г.
Слайд 33Нормы протеина в рационе
Они расчитываются с учетом вида животного, возраста, направления
Современные технологии животноводства предполагают балансировку рационов животных не только по количеству белков в рационе, но и по аминокислотному составу (содержанию незаменимых аминокислот и их соотношению.
Слайд 34В организме человека в сутки распадается на аминокислоты около 400 г
Источники аминокислот
Слайд 36Переваривание белков
Основной смысл переваривания белков состоит в их гидролизе до свободных
Исключением из этого правила является всасывание иммуноглобулинов молозива (без предварительного их гидролиза) стенкой кишечника новорожденных животных, благодаря которому возникает молозивный (колостральный) иммунитет, который обеспечивает устойчивость их в первые месяцы их жизни.
Слайд 37Переваривание белков осуществляется комплексом пищеварительных ферментов, которые называются протеолитическими или протеазами.
Протеазы
Протеазы, гидролизующие пептидные связи внутри белковой молекулы, относят к группе эндопептидаз (пепсин, трипсин, химотрипсин). Ферменты, относящиеся к группе экзопептидаз, гидролизуют пептидную связь, образованную концевыми аминокислотами (карбоксиполипептидаза и аминополипептидаза).
Слайд 38Переваривание белков в желудке
Желудочный сок — продукт нескольких типов клеток. Обкладочные
Слайд 39Под действием НС1 происходит денатурация белков пищи, не подвергшихся термической обработке,
Роль НС1 в пищеварении
Слайд 41Механизм активации пепсина
Под действием гастринов в главных клетках желудочных желёз стимулируются
Слайд 42Особенности переваривания белков в желудке у молодых животных
В молочный период вскармливания
Слайд 44Механизм действия пепсина
Белки рациона + НОН → высокомолекулярные полипептиды
Пепсин гидролизует внутренние
Слайд 45Активация панкреатических ферментов
В поджелудочной железе синтезируются проферменты ряда протеаз: трипсиноген, химотрипсиноген,
Слайд 46- Активация трипсиногена происходит под действием фермента эпителия кишечника энтеропептидазы (энтерокиназы):
Энтеропептидаза
Трипсиноген
+ гексапептид
- Механизм действия:
Высокомолекулярные полипептиды + НОН →
(белки, непереваренные пепсином)
→ полипептиды + олигопептиды+дипептиды + + свободные аминокислоты
- Трипсин расщепляет пептидные связи, в образовании которых участвуют карбоксильные группы аргинина или лизина.
Слайд 47- Образовавшийся трипсин активирует химотрипсиноген:
трипсин
Химотрипсиноген + НОН → Химотрипсин
(неактивная
- Механизм действия:
химотрипсин
Полипептиды + НОН → низкомолекулярные полипептиды + свободные аминокислоты
- Химотрипсин расщепляет пептидные связи, в образовании которых участвуют карбоксильные группы тирозина, фенилаланина, триптофана и метионина.
Активация химотрипсиногена
Слайд 49Остальные проферменты панкреатических протеаз (проэластаза и прокарбоксипептидазы А и В) также
Активация протеаз
Слайд 50Карбоксипептидазы А и В — цинксодержащие ферменты, отщепляют С-концевые остатки аминокислот.
Последний этап переваривания — гидролиз небольших пептидов, происходит под действием ферментов аминопептидаз и дипептидаз, которые синтезируются клетками тонкого кишечника в активной форме.
Специфичность действия протеаз
Слайд 51Аминопептидазы последовательно отщепляют N-концевые аминокислоты пептидной цепи. Наиболее известна лейцинаминопептидаза —
Дипептидазы расщепляют дипептиды на аминокислоты, но не действуют на трипептиды.
В результате последовательного действия всех пищеварительных протеаз большинство пищевых белков расщепляется до свободных аминокислот.
Места действия протеаз
Слайд 53Защита клеток от действия протеаз
Клетки поджелудочной железы защищены от действия пищеварительных
эти ферменты образуются в виде неактивных предшественников в клетках поджелудочной железы и активируются только после секреции в просвет кишечника. Таким образом, место синтеза и место действия этих ферментов пространственно разделены.
в клетках поджелудочной железы присутствует белок-ингибитор трипсина, образующий с активной формой фермента (в случае преждевременной активации) прочный комплекс.
Слайд 54Защита от действия протеаз
В полости желудка и кишечника протеазы не контактируют
Разрушение клеточных белков протеазами происходит при язвенной болезни желудка или двенадцатиперстной кишки. Однако начальные механизмы возникновения язвы ещё мало изучены.
Слайд 56В настоящёе время известно по крайней мере пять специфических транспортных систем,
нейтральных, с короткой боковой цепью (аланин, серии, треонин);
нейтральных, с длинной или разветвлённой боковой цепью (валин, лейцин, изолейцин);
с катионными радикалами (лизин, аргинин);
с анионными радикалами (глутаминовая и аспарагиновая кислоты);
иминокислот (пролин, оксипролин).
Перенос аминокислот
Слайд 57Гниение белков в толстом отделе кишечника
БЕЛКИ
гнилостные
бактерии
ЯДОВИТЫЕ ВЕЩЕСТВА
аммиак, сероводород, путресцин, кадаверин, фенол, крезол,
индол, скатол, др. вещества.
+НОН
гнилостные
бактерии
Слайд 58Переваривание белков у жвачных
Белки
пищи
бактериальный белок
Мочевина
Аммонийные соли NH3 сычуг
Нитраты кишечник
карбоновые кислоты
аминокислоты
в кровь
бактерии
бактерии
бактерии
бактерии
Слайд 59Фонд свободных аминокислот организма составляет примерно 35 г. Содержание свободных аминокислот
Источники свободных аминокислот в клетках - белки пищи, собственные белки тканей и синтез аминокислот из углеводов.
Фонд свободных аминокислот
Слайд 60Источники аминокислот
1. Белки корма (экзогенные аминокислоты).
2. Белки тканей при распаде в
3. Синтез заменимых аминокислот из других веществ (эндогенные аминокислоты).
Слайд 61Пути использования аминокислот в организме
Биосинтез белков, специфичных для данного организма.
Синтез биологически
Синтез углеводов, липидов.
Окисление для получения энергии (при окислении 1 г белка выделяется 17,1 кДж энергии).
Слайд 63КАТАБОЛИЗМ АМИНОКИСЛОТ
Аминокислоты, образующиеся при переваривании белков и поступающие в клетки тканей,
Катаболизм большинства аминокислот начинается с отщепления α-аминогруппы. Аминокислота теряет аминогруппу в результате двух типов реакций: трансаминирования, дезаминирования.
Слайд 64Трансаминирование
Трансаминирование — реакция переноса α-аминогруппы с аминокислоты на α-кетокислоту, в результате
Реакции катализируют ферменты аминотрансферазы, коферментом которых служит пиридоксальфосфат (ПФ) — производное витамина В6 (пиридоксина).
Слайд 66Аминотрансферазы
Аминотрансферазы обнаружены как в цитоплазме, так и в митохондриях клеток эукариот.
Слайд 68 Основной путь трансаминирования
Чаще всего в реакциях трансаминированиш участвуют аминокислоты, содержание
Акцептором аминогруппы любой аминокислоты, подвергающейся трансаминированию, служит
α-кетоглутарат. Принимая аминогруппу, он превращается в глутамат, который способен передавать эту группу любой α-кетокислоте с образованием другой аминокислоты.
Слайд 70Аминотрансферазы обладают субстратной специфичностью к разным аминокислотам. В тканях человека обнаружено
Специфичность аминотрансфераз
Слайд 71Аланинаминотрансфераза
АЛТ (АлАТ) катализирует реакцию трансаминирования между аланином и α-кетоглутаратом.
Локализован этот фермент
Слайд 72ACT (АсАТ) катализирует реакцию трансаминирования между аспартатом и α-кетоглутаратом аналогично предыдущей.
В
Так как наибольшее количество АЛТ и ACT сосредоточено в печени и миокарде, а содержание в крови очень низкое, можно говорить об органоспецифичности этих ферментов.
При инфаркте миокарда отмечают значительное увеличение активности АСТ, а при заболеваниях печени увеличивается активность АЛТ.
Аспаратаминотрансфераза
Слайд 73Биологическое значение трансаминирования
Реакции трансаминирования играют большую роль в обмене аминокислот. Поскольку
Трансаминирование - первая стадия дезаминирования большинства аминокислот, т.е. начальный этап их катаболизма.
Слайд 74Дезаминирование аминокислот
Дезаминирование аминокислот — реакция отщепления α-аминогруппы от аминокислоты, в
Аммиак токсичен для ЦНС, поэтому в организме человека и млекопитающих он превращается в нетоксичное хорошо растворимое соединение — мочевину.
Слайд 75Виды дезаминирования
Окислительное (идет в две ступени);
Восстановительное;
Гидролитическое;
Внутримолекулярное;
Трансаминирование.
Слайд 76Окислительное дезаминирование
Наиболее активно в тканях происходит деза-минирование глутаминовой кислоты. Реакцию катализирует
Слайд 78Непрямое дезаминирование (трансдезаминирование)
Большинство аминокислот не способно дезаминироваться в одну стадию, подобно
Слайд 84Гликогенные и кетогенные аминокислоты
Аминокислоты, которые в процессе катаболизма превращаются в пируват,
Аминокислоты, из которых синтез углеводов не возможен, так как в ходе катаболизма они превращаются в ацетоацетат и ацетил-КоА, называют кетогенными.
Слайд 87Биологическая роль гистамина
Много образуется в очаге воспаления: обладает сосудорасширяющим действием, ускоряет
Образуется в слизистой желудка, где активирует секрецию пепсиногена и НСl.
Депонируется в тучных клетках соединительной ткани в виде белково-гепаринового комплекса.
Многие антивостолительные средства по механизму действия являются антигистаминными.
Слайд 89Токсичность аммиака
Аммиак легко проникает через мембраны в клетки и в митохондриях
а-Кетоглутарат + NADH + Н+ + NH3 -» Глутамат + NAD+.
Уменьшение концентрации а-кетоглутарата вызывает:
угнетение обмена аминокислот (реакции транса-минирования) и, следовательно, синтеза из них нейромедиаторов (ацетилхолина, дофамина и др.);
гипоэнергетическое состояние в результате снижения скорости ЦТК.
Слайд 90Токсичность аммиака
Повышение концентрации аммиака в крови сдвигает рН в щелочную сторону
Высокие концентрации аммиака стимулируют синтез глутамина из глутамата в нервной ткани (при участии глутаминсинтетазы):
Глутамат + NH3 + АТФ —» Глутамин + АДФ + Н3Р04.
Накопление глутамина в клетках нейроглии приводит к повышению осмотического давления в них, набуханию астроцитов и в больших концентрациях может вызвать отёк мозга.
Слайд 91Пути обезвреживания аммиака
Временное обезвреживание (во всех тканях):
- образование аммонийных солей;
- образование
Конечное (окончательное) обезвреживание (в печени):
- синтез мочевины (орнитиновый цикл).
Слайд 94Связывание аммиака
Основной реакцией связывания аммиака, протекающей во всех тканях организма, является
Слайд 95Глутамин — основной донор азота в организме.
Высокий уровень глутамина в крови
Слайд 96Орнитиновый цикл
Мочевина — основной конечный продукт азотистого обмена, в составе которого
Слайд 103При образовании мочевины используется
А) аммиак – одна молекула
Б) СО2 – одна
В) аминогруппа аспарагиновой кислоты – одна молекула
При образовании одной молекулы мочевины расходуется три молекулы АТФ.
Слайд 104Анаболическая фаза обмена белков
Синтез заменимых аминокислот.
Синтез специфических белков.
Синтез азотсодержащих веществ:
-биогенные амины;
-гормоны
-гем и др.
Слайд 105Синтез заменимых аминокислот
Углеродный скелет заменимых аминокислот образуется из промежуточных метаболитов гликолиза,
Пути биосинтеза аминокислот:
-прямое (восстановительное) аминирование
α-кетокислот;
-реакции трансаминирования.
Слайд 109Образование аминокислот из углеводов
СН3СО · S · КоА
глюкоза
ЩУК
α-кетоглютарат
аминокислоты