- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Обмен белков. Общие пути обмена аминокислот презентация
Содержание
- 1. Обмен белков. Общие пути обмена аминокислот
- 2. Белки пищи – 100г/сутки
- 3. Значение знаний путей обмена аминокислот Из аминокислот
- 4. Показателем состояния белкового и аминокислотного обмена является
- 5. Положительный (количество выделяемого азота меньше
- 6. 1.Заменимые – Ала, Асп, Асн,
- 7. Полипептиды Олигопептиды и аминокислоты АМИНОКИСЛОТЫ Аминопептидаза Дипептидаза
- 8. Пепсиноген Пептид ПЕПСИН
- 9. Переваривание белков (тонкий кишечник) Трипсиноген
- 10. Переваривание белков в кишечнике Белок Аминокислоты Дипептиды
- 11. Мембранный транспорт аминокислот Осуществляется 5 транспортными системами
- 12. Промежуточный обмен АМК в тканях. катаболизм
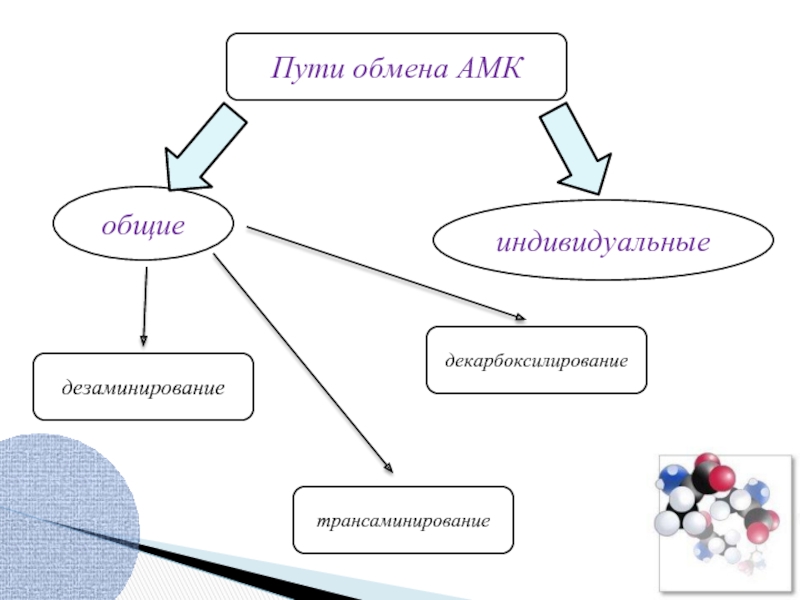
- 13. Пути обмена АМК общие индивидуальные трансаминирование декарбоксилирование дезаминирование
- 14. Общие пути катаболизма аминокислот Аминокислота Декарбоксилирование
- 15. R аминокислота α-кетокислота ОПК NH3
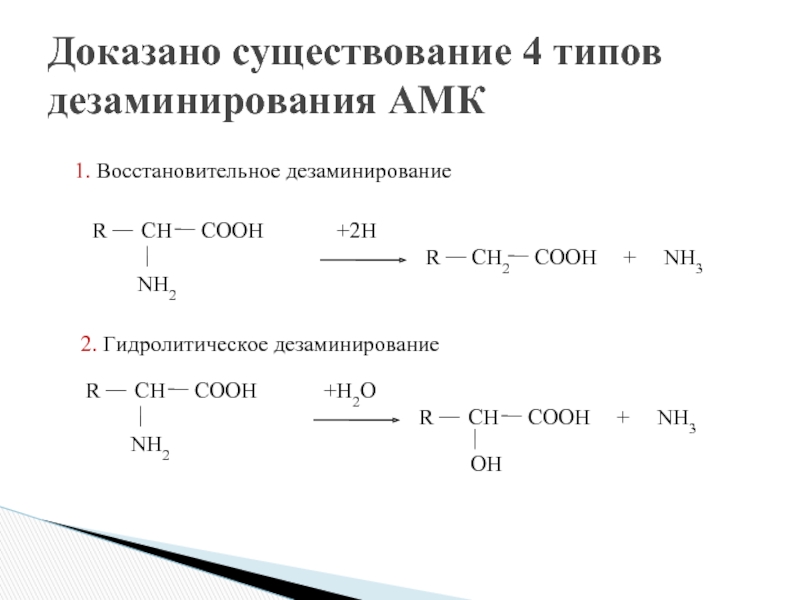
- 16. Доказано существование 4 типов дезаминирования АМК
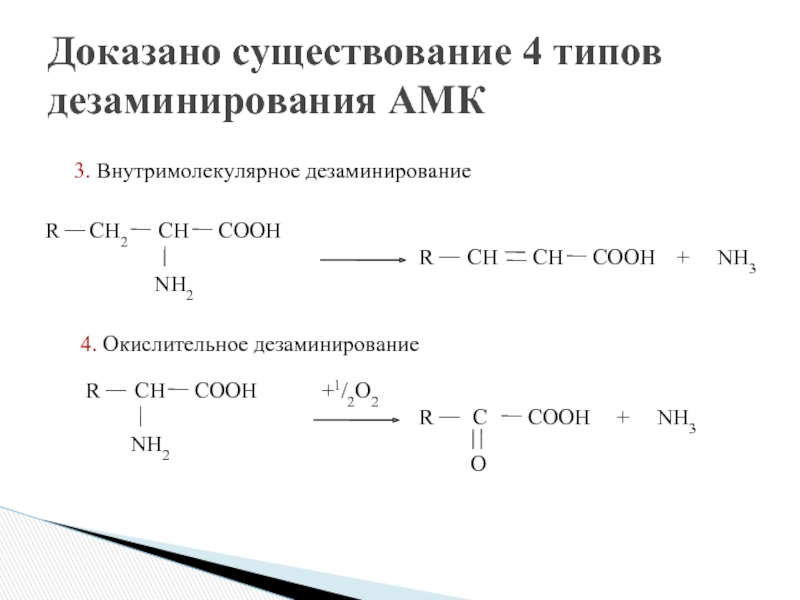
- 17. Доказано существование 4 типов дезаминирования АМК
- 18. 1. Прямое: 1.1. Окислительное (ГЛУ);
- 19. НАD+ НАDH+Н+ + NH3
- 20. H2O L -
- 21. N NH -CH2-CH-COOH NH2 NH3
- 22. H2O CH2 C-NH2 COOH
- 23. Непрямое окислительное дезаминирование
- 24. Непрямое неокислительное дезаминирование (для мышечной ткани и
- 25. Реакция трансаминирования аминокислот Трансаминирование – реакция переноса
- 26. Реакции трансаминирования выполняют важные физиологические функции:
- 27. Декарбоксилирование – отщепление α-карбоксильной
- 28. Биологическая роль и предшественники некоторых биогенных аминов
- 29. N NH СООH
- 30. Обезвреживание аммиака в тканях
- 31. Источники и способы обезвреживания
- 32. CO – NH2 (CH2)2 CH –
- 33. Эта реакция идет с незначительной скоростью ,
- 34. Образование аланина (глюкозо-аланиновый цикл)
- 35. Образование аммонийных солей Глутамин
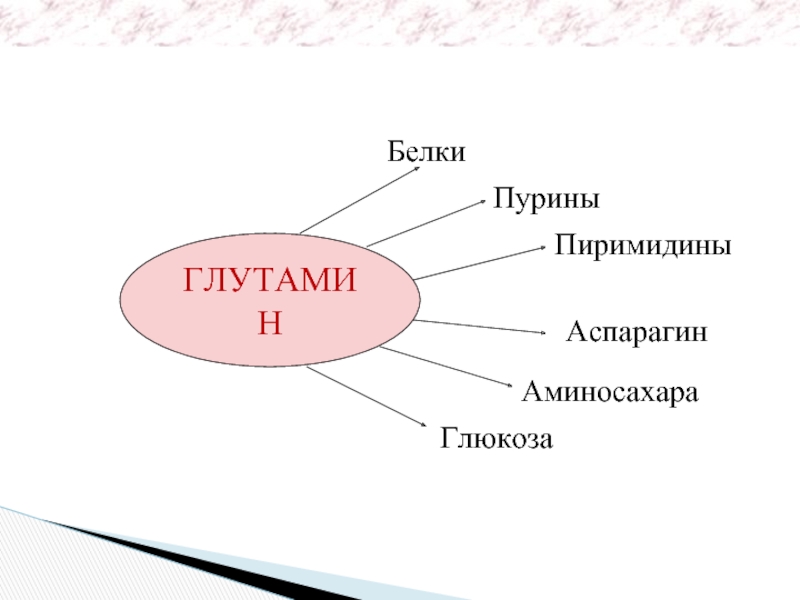
- 36. ГЛУТАМИН Белки Пурины Пиримидины Аспарагин Аминосахара Глюкоза Биологическая роль глутамина
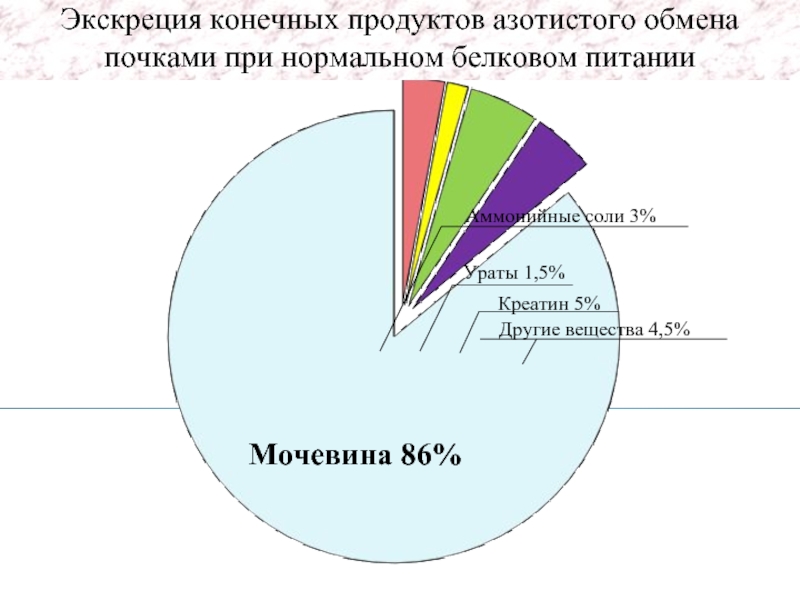
- 37. Мочевина 86% Экскреция конечных продуктов азотистого обмена почками при нормальном белковом питании
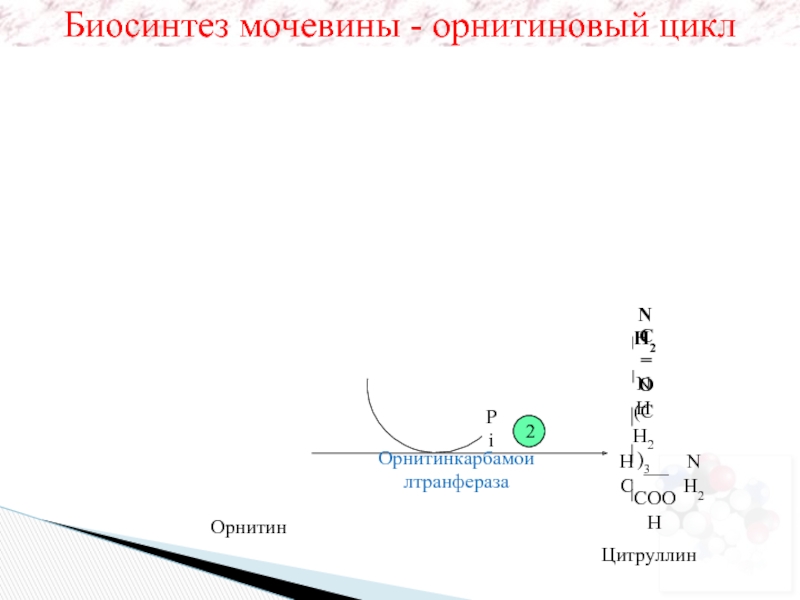
- 38. Цитруллин Орнитин Pi 2
- 39. NH2 C=O NH2
- 40. Заболевания печени (гепатит, цирроз) или наследственный
- 41. При увеличении концентрации аммиака в 8 –
- 42. Образование большого количества NH4+ может привести к
- 43. Гипераммониемия усиливает синтез глутамина из глутамата в
- 44. Судорожные припадки могут быть также следст-вием подавления
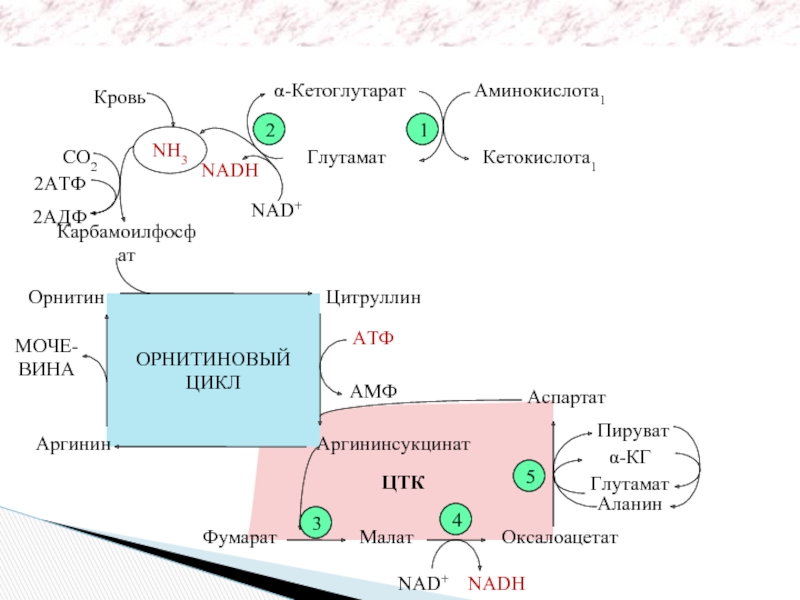
- 45. ОРНИТИНОВЫЙ ЦИКЛ Кровь NH3
- 46. Пируват Ацетил КоА Цитрат Оксалоацетат
Слайд 2
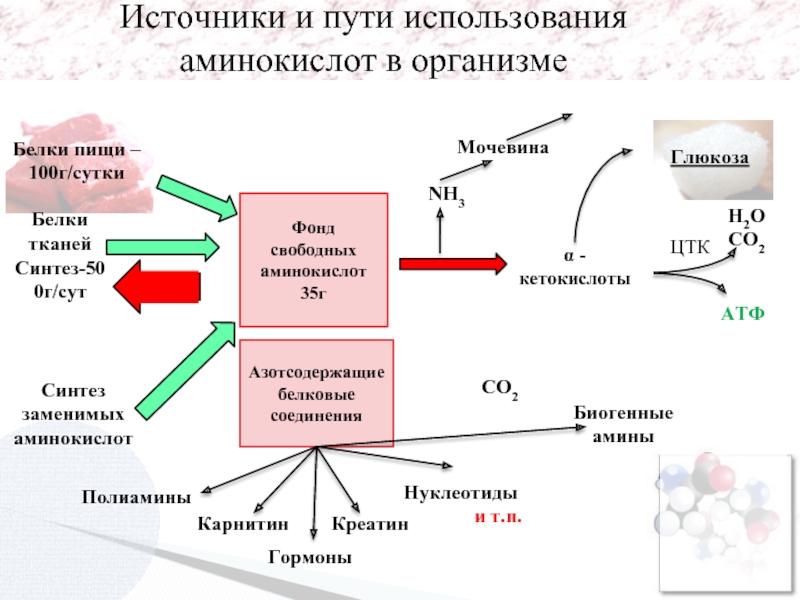
Белки пищи – 100г/сутки
Фонд свободных аминокислот 35г
Белки тканей
Синтез-500г/сут
Синтез заменимых аминокислот
Полиамины
Гормоны
Карнитин
Креатин
Нуклеотиды
и т.п.
Биогенные амины
α - кетокислоты
АТФ
Н2О
СО2
Мочевина
ЦТК
NH3
СО2
Глюкоза
Источники и пути использования аминокислот в организме
Азотсодержащие белковые соединения
Экскреция
Гем
Слайд 3Значение знаний путей обмена аминокислот
Из аминокислот построены белки;
Из аминокислот синтезируются многие
Нарушение обмена аминокислот лежат в основе патогенеза многих приобретенных и врожденных заболеваний;
Широкое использование определения содержания аминокислот, промежуточных и конечных продуктов в биологических жидкостях для диагностических целей;
Используются как лекарственные препараты.
Слайд 4Показателем состояния белкового и аминокислотного обмена является азотистый баланс
Азотистый баланс
Слайд 5
Положительный (количество выделяемого азота меньше поступающего) – у детей, выздоравливающих больных
Виды азотистого баланса
Отрицательный (количество выделяемого азота больше поступающего) – при тяжелых заболеваниях, голодании, старении, распаде опухоли, малобелковое или неполноценное питание;
Равный нулю (азотистое равновесие) – у здоровых взрослых людей при нормальном питании.
Слайд 6
1.Заменимые – Ала, Асп, Асн, Глу, Глн, Про, Гли, Сер –
3. Частично заменимые – Гис, Арг – синтезируются в организме очень медленно, в количествах не покрывающих потребностей организма, особенно в детском возрасте;
2. Незаменимые – Вал, Лей, Иле, Мет, Фен, Три, Лиз, Тре – не синтезируются в организме;
4. Условно заменимые – Цис, Тир – синтезируются из незаменимых аминокислот Мет и Фен (соответственно).
Полноценный белок:
1. набор незаменимых аминокислот;
2. соотношение аминокислот должно быть близким к их соотношению в белках человека.
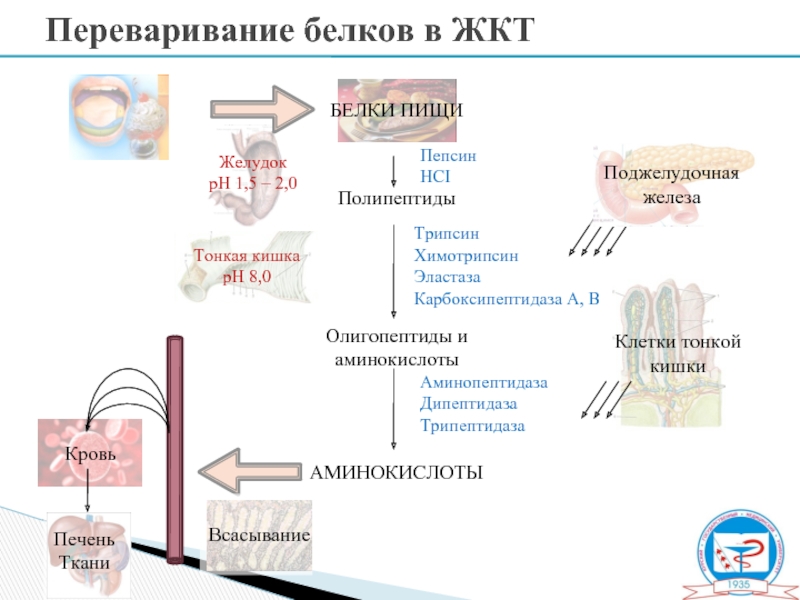
Слайд 7Полипептиды
Олигопептиды и
аминокислоты
АМИНОКИСЛОТЫ
Аминопептидаза
Дипептидаза
Трипептидаза
Трипсин
Химотрипсин
Эластаза
Карбоксипептидаза А, В
Пепсин
HCI
Переваривание белков в ЖКТ
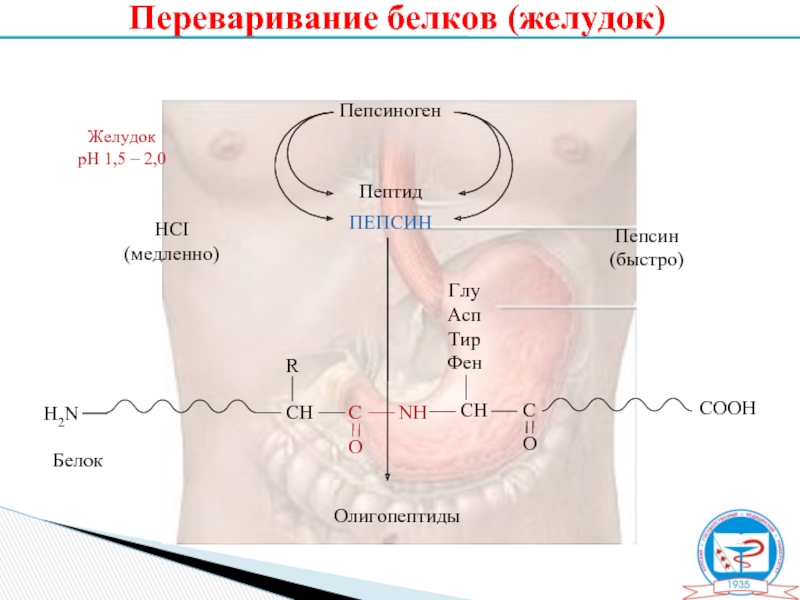
Слайд 8Пепсиноген
Пептид
ПЕПСИН
Олигопептиды
Желудок
рН 1,5 – 2,0
HCI
(медленно)
Пепсин
(быстро)
Переваривание белков (желудок)
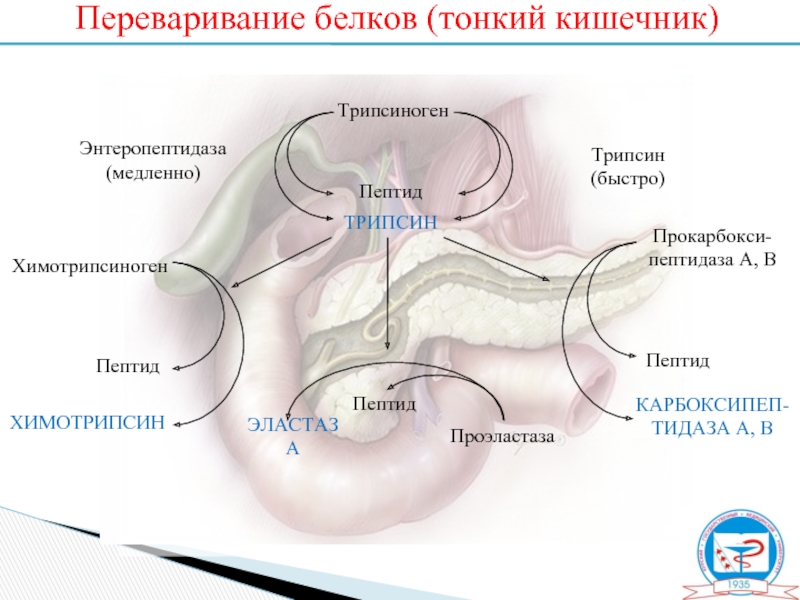
Слайд 9Переваривание белков (тонкий кишечник)
Трипсиноген
Пептид
ТРИПСИН
Энтеропептидаза
(медленно)
Трипсин
(быстро)
Пептид
Пептид
Пептид
ХИМОТРИПСИН
КАРБОКСИПЕП-
ТИДАЗА А, В
Химотрипсиноген
Прокарбокси-
пептидаза А, В
ЭЛАСТАЗА
Проэластаза
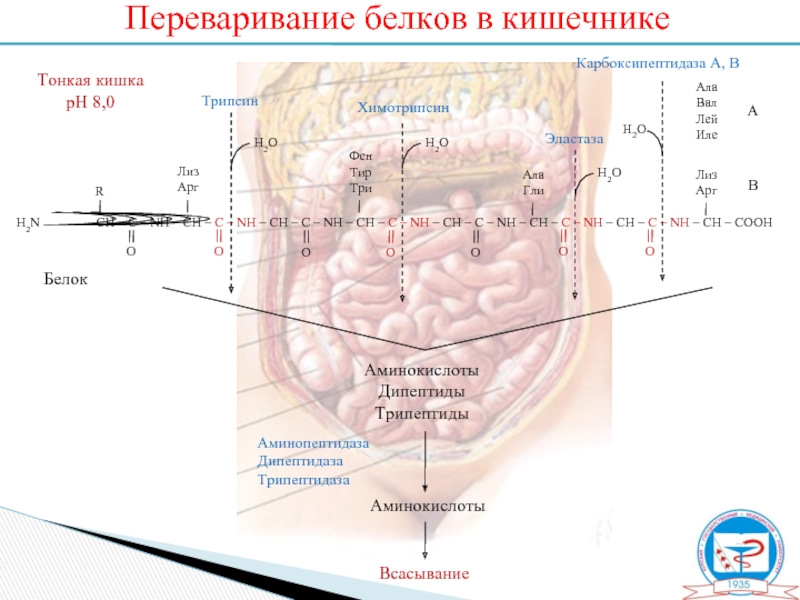
Слайд 10Переваривание белков в кишечнике
Белок
Аминокислоты
Дипептиды
Трипептиды
Аминокислоты
Всасывание
Аминопептидаза
Дипептидаза
Трипептидаза
Тонкая кишка
рН 8,0
Слайд 11Мембранный транспорт аминокислот
Осуществляется 5 транспортными системами
(белки-переносчики) с затратой энергии:
Аминокислоты
С нейтральными разветвленными радикалами (лей, илей, вал).
С катионным радикалом (лиз, арг).
С анионным радикалом (глу, асп);
Иминокислоты (про, опро).
Переносчики аминокислот 1-й, 5-й групп и мет являются натрий-зависимыми
Слайд 12
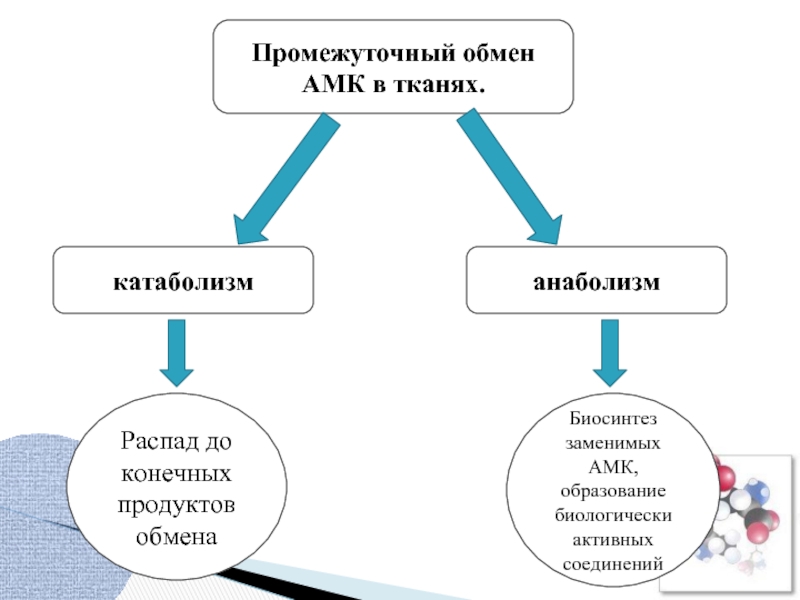
Промежуточный обмен АМК в тканях.
катаболизм
анаболизм
Распад до конечных продуктов обмена
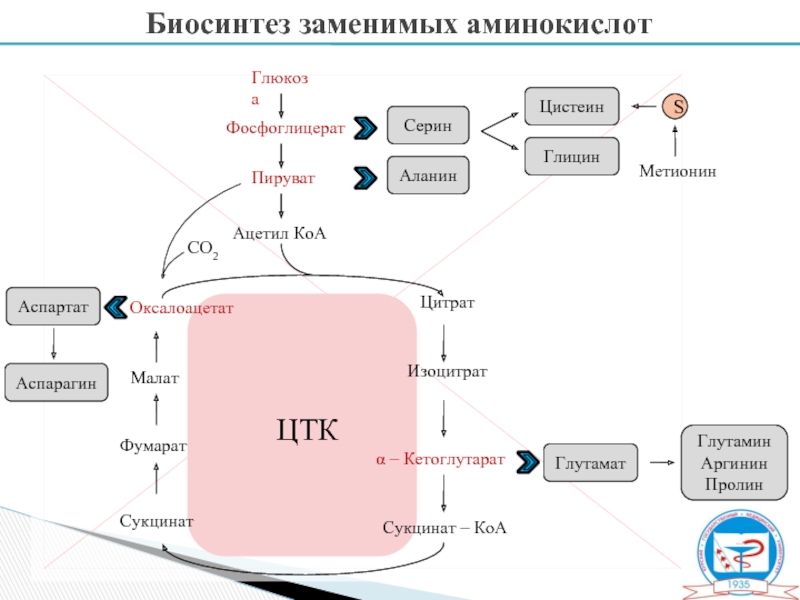
Биосинтез заменимых АМК,
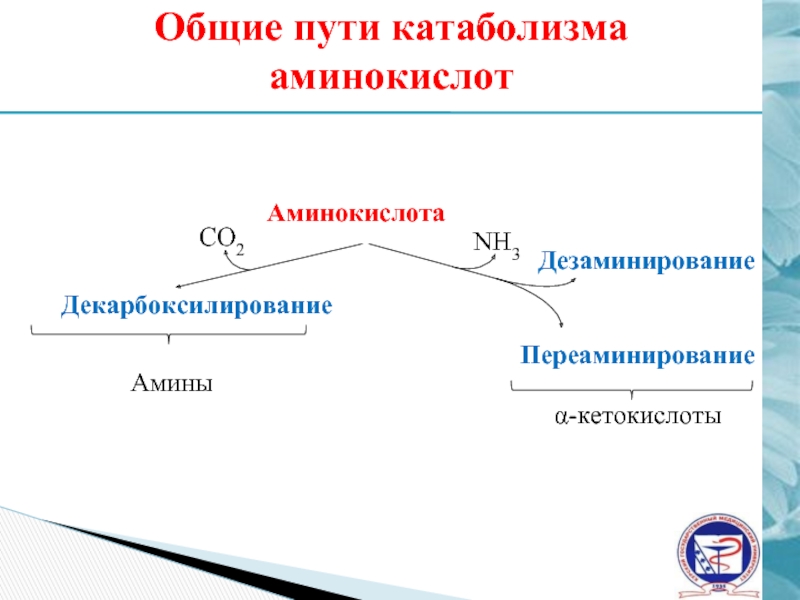
Слайд 14Общие пути катаболизма аминокислот
Аминокислота
Декарбоксилирование
СО2
Амины
NH3
Дезаминирование
Переаминирование
α-кетокислоты
Слайд 15
R
аминокислота
α-кетокислота
ОПК
NH3
аммиак
Мочевина
Синтез аминокислот
Аммонийные соли
Экскреция
Глюкоза (глюконеогенез )
Кетоновые тела (кетогенез)
Окисление до СО2 и Н2О
Дезаминирование
H2N-CH-COOH
Основные этапы катаболизма аминокислот
Слайд 18
1. Прямое:
1.1. Окислительное (ГЛУ);
1.2. Неокислительное (СЕР, ТРЕ, ГИС, ЦИС);
2. Непрямое (все
2.1. Окислительное (трансдезаминирование)
2.2. Неокислительное
Виды реакции дезаминирования
Слайд 19
НАD+
НАDH+Н+
+ NH3
COOH
(CH2) 2
C=NH
COOH
Прямое окислительное дезаминирование
H2О
H2О
Глутамат
Глутаматдегидрогеназа
α-кетоглутарат
рРРРРРРр
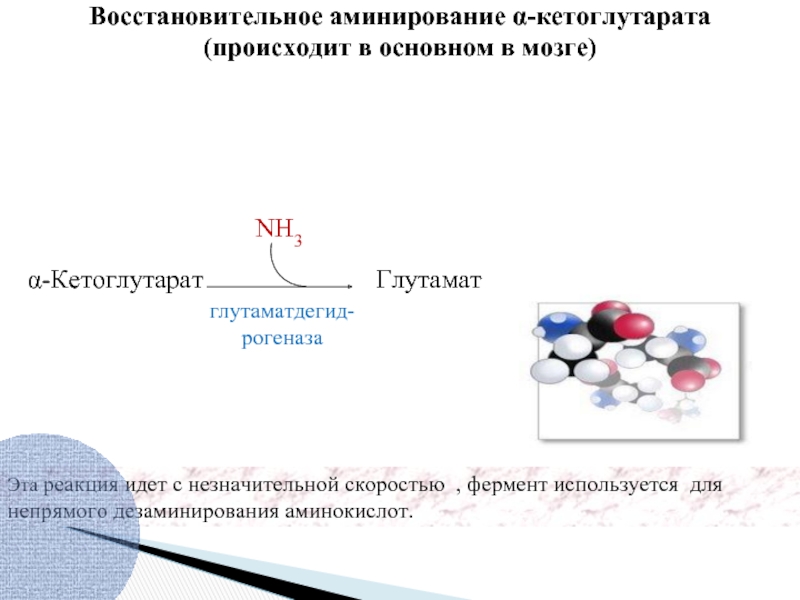
Реакция идет в митохондриях клеток многих тканей,
Слайд 21
N
NH
-CH2-CH-COOH
NH2
NH3
N
NH
-CH=CH-COOH
гистидаза
Прямое неокислительное дезаминирование
Гистидин
Уроканиновая кислота
Слайд 22
H2O
CH2
C-NH2
COOH
CH3
C=NH
COOH
+ NH3
Серин
ПФ
H2O
Пируват
Треонин
CH3
CH-NH2
CН-OH
COOH
CH3
C-NH2
CН
COOH
CH3
C=NH
CН2
COOH
CH3
C=О
CН2
COOH
+ NH3
H2O
H2O
α - кетобутират
ПФ
Прямое неокислительное дезаминирование
Слайд 23
Непрямое окислительное дезаминирование
α - кетоглутарат
Аминокислота
α - кетокислота
глутамат
глутаматдегидрогеназа
НАD+
НАDH+Н+
1
2
NH3
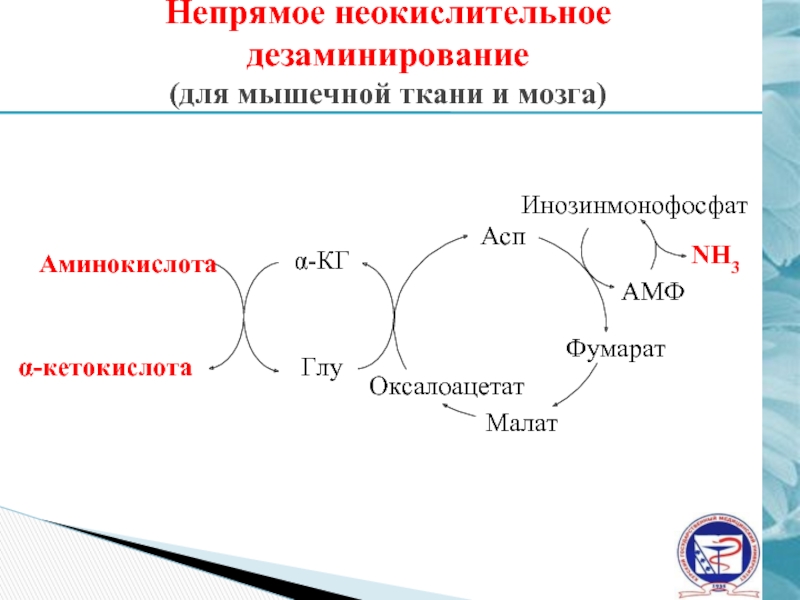
Слайд 24Непрямое неокислительное дезаминирование
(для мышечной ткани и мозга)
Асп
α-кетокислота
Аминокислота
α-КГ
Глу
Оксалоацетат
Малат
Фумарат
АМФ
Инозинмонофосфат
NH3
Слайд 25Реакция трансаминирования аминокислот
Трансаминирование – реакция переноса аминогруппы с аминокислоты (донор) на
R1
CH-NH2
COOH
+
R2
C=O
COOH
Аминтранс-
фераза
Пиридоксаль-
фосфат (В6)
R1
C=O
COOH
+
R2
CH-NH2
COOH
Аминокислота
α-кетокислота
α-кетокислота
Аминокислота
Асп
Ала
+
+
α-кетоглутарат
α-кетоглутарат
Аст
Алт
Оксалоацетат
Пируват
+
+
Глу
Глу
Слайд 26
Реакции трансаминирования выполняют
важные физиологические функции:
из α-кетокислот синтезируются аминокислоты, необходимые для
происходит перераспределение аминного азота в тканях и органах;
начинается катаболизм большинства аминокислот – первая стадия непрямого дезаминирования.
Слайд 27
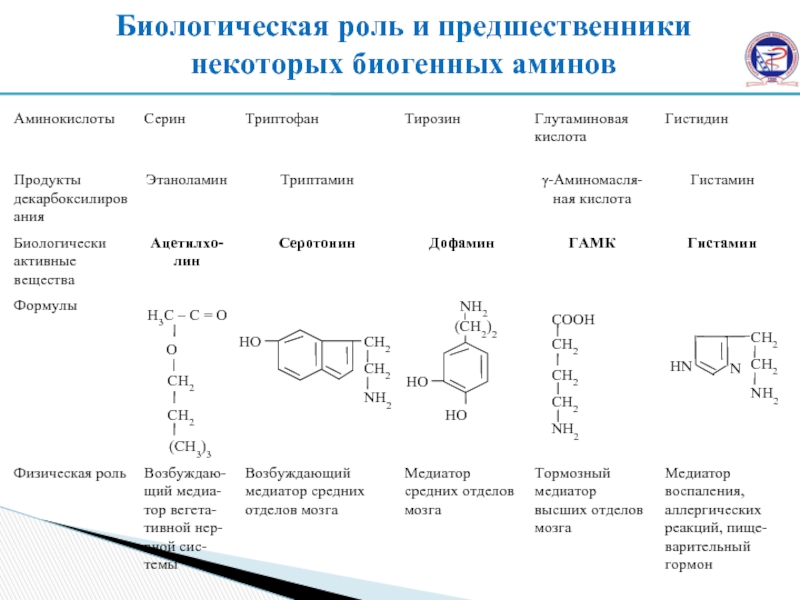
Декарбоксилирование – отщепление α-карбоксильной группы, с образованием СО2 и биогенных аминов.
R
COOH
H
C
NH2
Аминокислота
R
CН2
Декарбоксилаза
CO2
В процессе декарбоксилирования аминокислот синтезируются нейромедиаторы ( серотонин, дофамин, ГАМК), гормоны (норадреналин, адреналин), регуляторные факторы местного действия (гистамин).
Биогенный амин
NH2
Слайд 28Биологическая роль и предшественники некоторых биогенных аминов
НO
НO
(СН2)2
NН2
СН2
СН2
СН2
СOOН
NН2
СН2
СН2
NН2
НN
N
Слайд 29
N
NH
СООH
СH
СH2
NH2
СО2
NH2
СH2
СH2
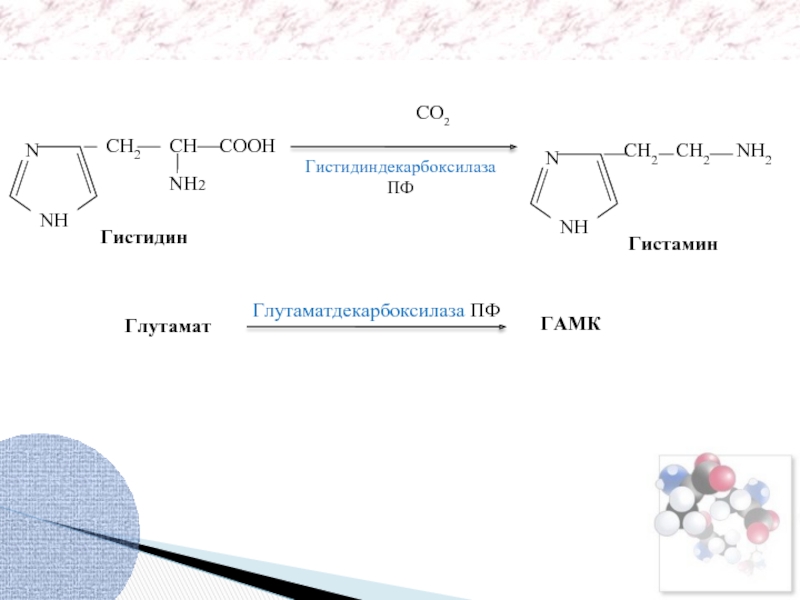
Гистидин
Гистамин
N
NH
Глутамат
ГАМК
Глутаматдекарбоксилаза ПФ
Гистидиндекарбоксилаза
ПФ
Декарбоксилирование гистидина, глутамата и триптофана
Триптофан
Серотонин
Декарбоксилаза ПФ
Слайд 31
Источники и способы обезвреживания аммиака в разных тканях
Аммиак
Нуклеотиды
Биогенные амины
Аминокислоты
Синтез мочевины
(~25 г\сут)
Синтез
Образование аланина
Образование глутамата – восстановитель-
ное аминирование
Образование аммонийных солей (~ 0,5г\сут)
Печень
Мышцы, мозг и другие ткани
Мышцы, кишечник
Почки
Мозг
Гниение белков
Слайд 32
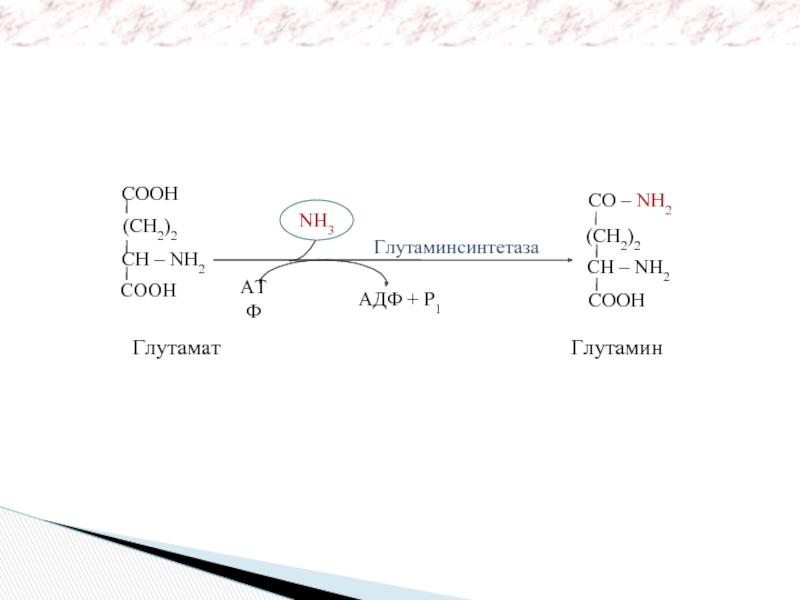
CO – NH2
(CH2)2
CH – NH2
COOH
Глутамат
NH3
АТФ
АДФ + Р1
Глутаминсинтетаза
Глутамин
Обезвреживание аммиака – реакция амидирования
Слайд 33Эта реакция идет с незначительной скоростью , фермент используется для непрямого
α-Кетоглутарат
глутаматдегид-рогеназа
Глутамат
NH3
Восстановительное аминирование α-кетоглутарата
(происходит в основном в мозге)
Слайд 34
Образование аланина (глюкозо-аланиновый цикл)
α-Кето-
глутарат
Глутамат
Аминокислоты
Кетокислоты
Аланин
Аланин
Оксалоацетат
Малат
Пируват
Пируват
α-Кетоглутарат
Глутамат
Аспартат
Орнитино-вый цикл
Фумарат
NH3
Глюкоза
Глюкоза
Гликолиз
Глюконеогенез
МОЧЕВИНА
Мышцы и другие ткани
Кровь
Печень
Слайд 35
Образование аммонийных солей
Глутамин
Глутаминаза
Глутамат
NH3
H+
NH4A
Аммонийные соли
Экскреция
Почки
H2О
Глутамат
дегидрогеназа
NH3
α-Кетоглутарат
ОПК
H+
H+
+
Эта
Слайд 37
Мочевина 86%
Экскреция конечных продуктов азотистого обмена почками при нормальном белковом питании
Слайд 38
Цитруллин
Орнитин
Pi
2
Орнитинкарбамоилтранфераза
Биосинтез мочевины - орнитиновый цикл
1
Карбамоилфоcфат –
синтетаза I
CO2
NH3
2АТФ
2Pi
+ 2АДФ
H2O
NH2
C=O
Карбамоилфоcфат
Печень
Митохондрия
(матрикс)
Слайд 39
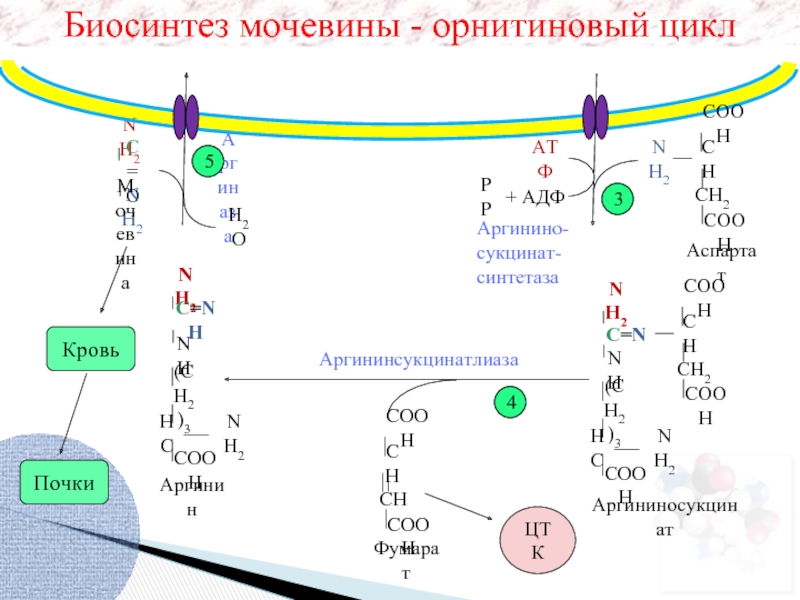
NH2
C=O
NH2
Аргиназа
H2O
Аргинин
Кровь
Почки
Аргининсукцинатлиаза
РP
+ АДФ
АТФ
NH2
Аспартат
Аргинино-
сукцинат-
синтетаза
Аргининосукцинат
Фумарат
ЦТК
3
5
4
Мочевина
Биосинтез мочевины - орнитиновый цикл
Слайд 40
Заболевания печени (гепатит, цирроз) или наследственный дефект ферментов обезвреживания аммиака могут
Известно 5 наследственных заболеваний, обус-ловленных дефектом 5 ферментов орнитинового цикла:
Гипераммониемия I и II типа
Цитруллинемия
Аргиносукцинатурия
Гипераргининемия
Слайд 41При увеличении концентрации аммиака в 8 – 10 раз (до 0,6
Наблюдаются:
Головокружение;
Тошнота;
Рвота;
Судорожные припадки с потерей сознания.
Наследственные формы гипераммониемии приводят к отставанию в умственном развитии детей
Слайд 42Образование большого количества NH4+ может привести к сдвигу рН крови в
Высокое содержание NH3 в тканях снижает количество α-кетоглутарата, так как он связывает избыток аммиака и превращается в глутамат. Это вызывает угнетение обмена аминокислот (трансамини-рования) и ЦТК (гипоэнергетическое состояние)
Слайд 43Гипераммониемия усиливает синтез глутамина из глутамата в нервной ткани. Содержание глутамата
Токсичность аммиака
ГАМК + СО2
Глутамат
В результате происходит повышение нервно-мышечной возбудимости и возникают судороги.
Слайд 44Судорожные припадки могут быть также следст-вием подавления работы Na+, K+-АТФаз, нарушения
Для снижения концентрации NH3 в крови и облегчения состояния больных рекомендуется мало-белковая диета и введение метаболитов орнитино-вого цикла (аргинин, цитруллин, глутамат).
Токсичность аммиака