- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Обмен белков и аминокислот презентация
Содержание
- 1. Обмен белков и аминокислот
- 2. АЗОТИСТЫЙ БАЛАНС Азотистый баланс — разница между
- 3. Если количество поступающего азота равно количеству выделяемого,
- 4. Белковая недостаточность Известно, что даже длительное исключение
- 5. В организме человека в сутки распадается на
- 6. Фонд свободных аминокислот организма составляет примерно 35
- 7. Источники аминокислот 1. Белки корма 2. Белки
- 8. Пути использования аминокислот в организме Биосинтез белков
- 10. Количество белка в некоторых пищевых продуктах
- 11. ПЕРЕВАРИВАНИЕ БЕЛКОВ В пищевых продуктах содержание свободных
- 12. Переваривание белков в желудке Желудочный сок —
- 13. Под действием НС1 происходит денатурация белков пищи,
- 14. Секреция соляной кислоты в желудке
- 15. Механизм активации пепсина Под действием гастринов в
- 16. Особенности переваривания белков в желудке У детей
- 17. Компоненты желудочного сока в норме и при патологических состояниях
- 18. Активация панкреатических ферментов В поджелудочной железе синтезируются
- 19. Активация трипсиногена происходит под действием фермента эпителия
- 20. Образовавшийся трипсин активирует химотрипсиноген, из которого получается
- 21. Активация химотрипсиногена
- 22. Остальные проферменты панкреатических протеаз (проэластаза и прокарбоксипептидазы
- 23. Специфичность действия протеаз Трипсин преимущественно гидролизует пептидные
- 24. Карбоксипептидазы А и В — цинксодержащие ферменты,
- 25. Аминопептидазы последовательно отщепляют N-концевые аминокислоты пептидной цепи.
- 26. Защита клеток от действия протеаз Клетки
- 27. Защита от действия протеаз В полости желудка
- 28. Механизм всасывания аминокислот в кишечнике
- 29. В настоящёе время известно по крайней мере
- 30. γ-Глутамильный цикл
- 31. Переваривание белков у жвачных Белки
- 32. КАТАБОЛИЗМ АМИНОКИСЛОТ Аминокислоты, образующиеся при переваривании белков
- 33. Трансаминирование Трансаминирование — реакция переноса α-аминогруппы с
- 34. Аминотрансферазы Аминотрансферазы обнаружены как в цитоплазме, так
- 35. Реакция трансаминирования
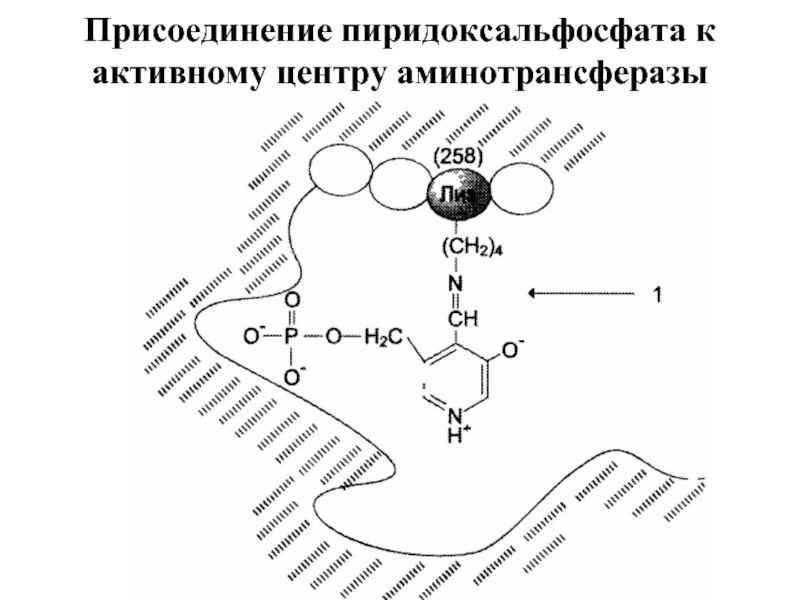
- 36. Присоединение пиридоксальфосфата к активному центру аминотрансферазы
- 37. Основной путь трансаминирования Чаще всего
- 38. Образование аминокислот из углеводов СН3СО ·
- 39. Аминотрансферазы обладают субстратной специфичностью к разным аминокислотам.
- 40. Аланинаминотрансфераза АЛТ (АлАТ) катализирует реакцию трансаминирования между
- 41. ACT (АсАТ) катализирует реакцию трансаминирования между аспартатом
- 42. Биологическое значение трансаминирования Реакции трансаминирования играют большую
- 43. Дезаминирование аминокислот Дезаминирование аминокислот — реакция отщепления
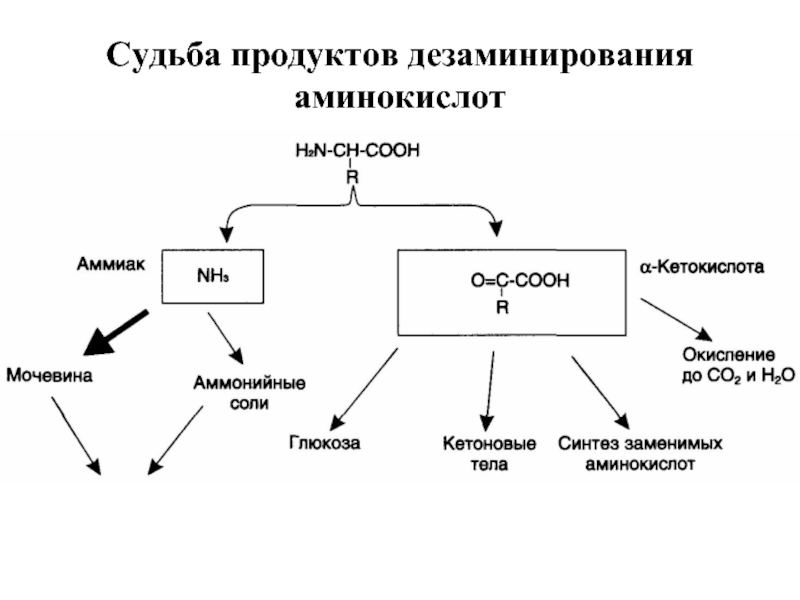
- 44. Судьба продуктов дезаминирования аминокислот
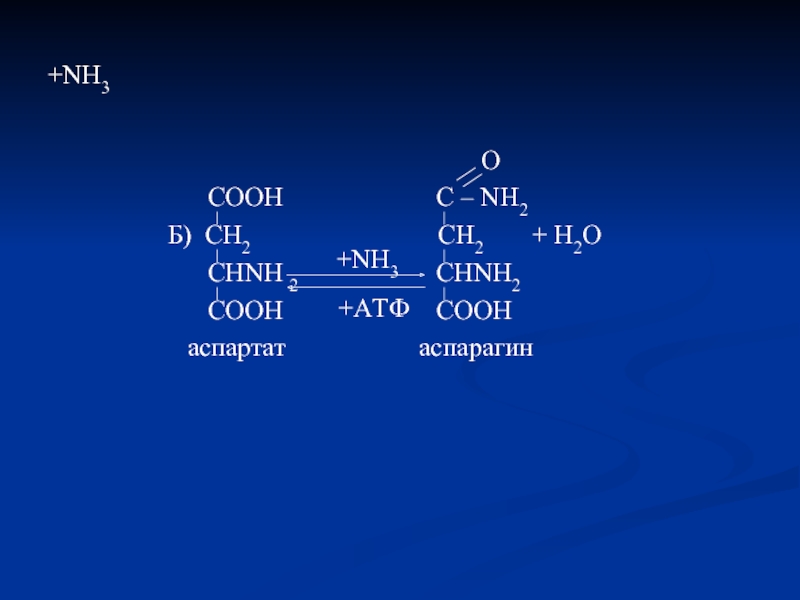
- 46. +NH3
- 47. Виды дезаминирования аминокислот 1. Гидролитическое 2. Окислительное 3. Восстановительное 4. Внутримолекулярное
- 48. Гидролитическое дезаминирование
- 49. Окислительное дезаминирование Окислительное дезаминирование может происходить при
- 50. Восстановительное дезаминирование
- 51. Внутримолекулярное дезаминирование
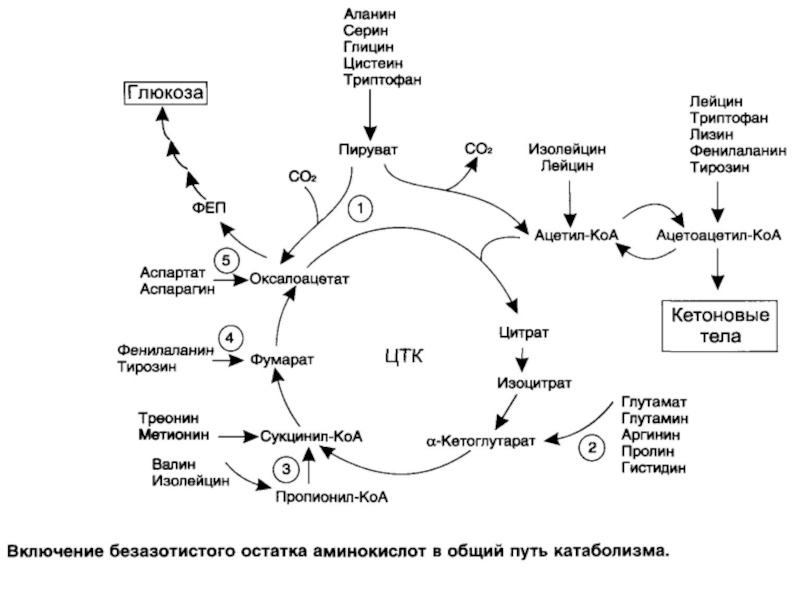
- 52. Большая часть безазотистых остатков аминокислот превращается в
- 53. ГЛИКОГЕННЫЕ и кетогенные АМИНОКИСЛОТЫ Катаболизм всех аминокислот
- 54. Пути использования безазотистого остатка аминокислот: 1. Окисляются
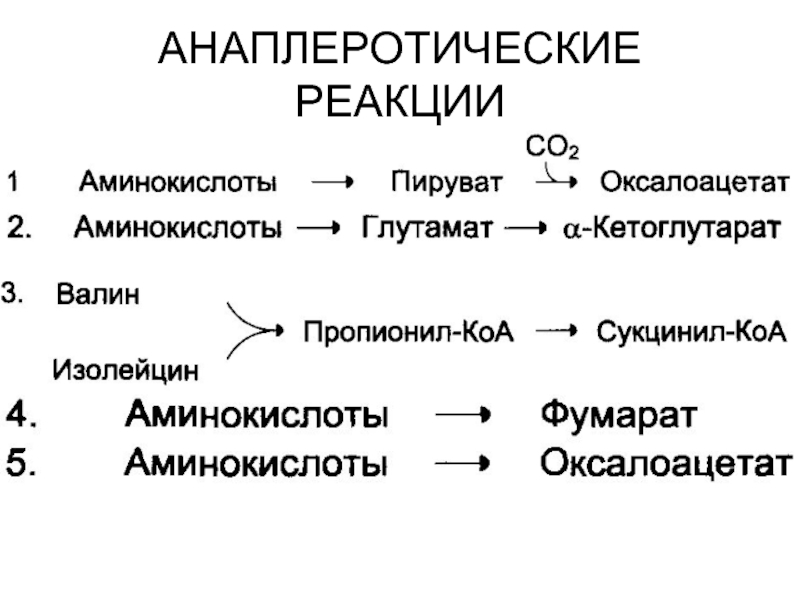
- 57. АНАПЛЕРОТИЧЕСКИЕ РЕАКЦИИ
- 59. БИОСИНТЕЗ ЗАМЕНИМЫХ АМИНОКИСЛОТ В организме человека возможен
- 60. Кроме восьми перечисленных заменимых аминокислот, в организме
- 61. Пути обезвреживания NH3 Временное - образование амидов
- 62. Окислительное дезаминирование Наиболее активно в тканях
- 63. Дезаминирование глутамата
- 64. Непрямое дезаминирование (трансдезаминирование) Большинство аминокислот не
- 65. трансдезаминирование непрямое дезаминироваше — основной способ дезаминирования
- 66. Обратимость трансдезаминирования
- 67. Неокислительное дезаминирование В печени человека присутствуют
- 68. Дезаминирование серина
- 69. Токсичность аммиака Аммиак легко проникает через мембраны
- 70. Токсичность аммиака Повышение концентрации аммиака в кро
- 71. Связывание аммиака Основной реакцией связывания аммиака, протекающей
- 72. Глутамин — основной донор азота в организме.
- 73. Орнитиновый цикл Мочевина — основной конечный
- 74. Орнитиновый цикл
- 75. Орнитиновый цикл
- 76. Орнитиновый цикл
- 77. Орнитиновый цикл
- 78. Орнитиновый цикл
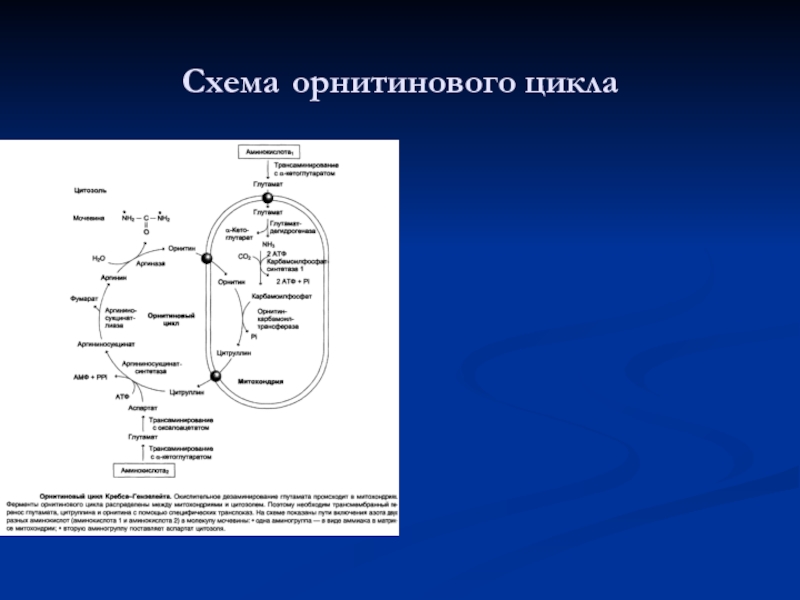
- 79. Схема орнитинового цикла
- 80. При образовании мочевины используется А) аммиак –
- 81. Кроме аминокислот источником аммиака в организме являются:
- 82. Временное обезвреживание NH3
- 83. Превращение белков в толстом кишечнике БЕЛКИ
- 84. Схема превращения веществ Исходные вещества углеводы
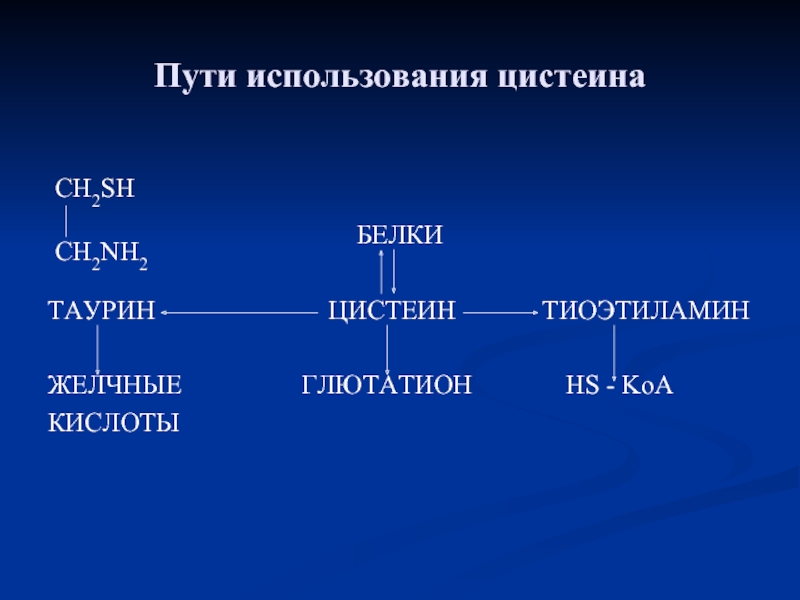
- 85. Пути использования цистеина БЕЛКИ
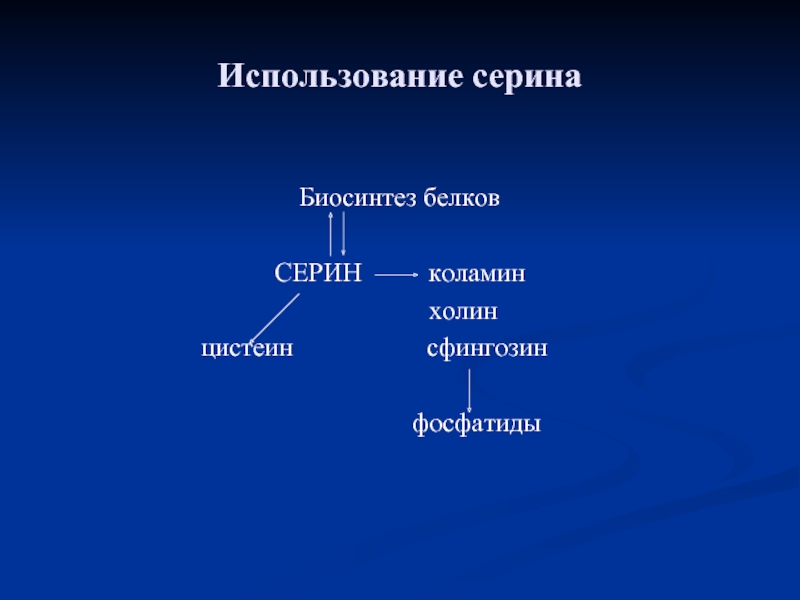
- 86. Использование серина Биосинтез белков СЕРИН
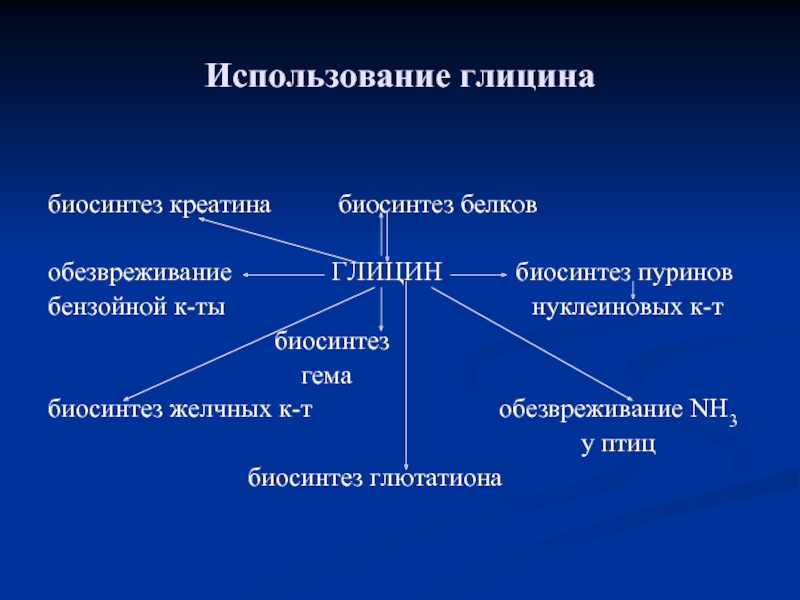
- 87. Использование глицина биосинтез креатина
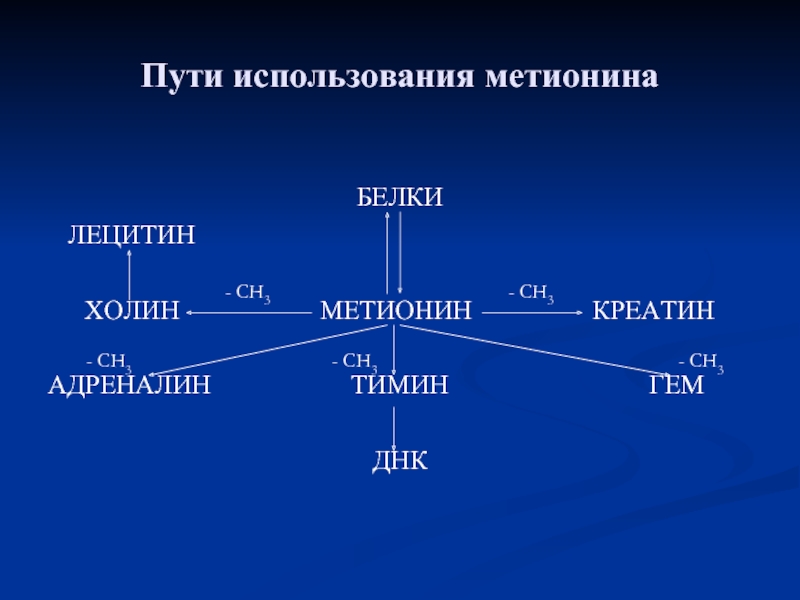
- 88. Пути использования метионина БЕЛКИ
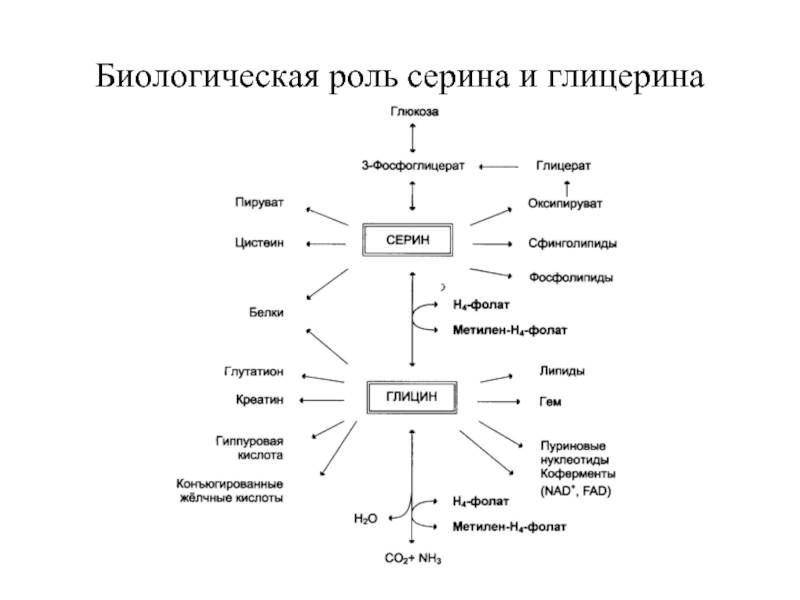
- 89. Биологическая роль серина и глицерина
Слайд 1Обмен белков и аминокислот
1.Роль белков
2.Азотистый баланс
3.Источники аминокислот и пути использования
4.Переваривание белков
5.Всасывание аминокислот
6.Особености переваривания белков у жвачных
7.Катаболизм аминокислот
8.Биосинтез заменимых аминокислот
9.Обезвреживание NH3
10.Превращение белков в толстом кишечнике
11.Взаимосвязь превращения веществ
Слайд 2АЗОТИСТЫЙ БАЛАНС
Азотистый баланс — разница между количеством азота, поступающего с пищей,
Аминокислоты (свободные и в составе белков) содержат почти 95% всего азота, поэтому именно они поддерживают азотистый баланс организма.
Слайд 3Если количество поступающего азота равно количеству выделяемого, то наступает азотистое равновесие.
Азотистое равновесие
Слайд 4Белковая недостаточность
Известно, что даже длительное исключение из рациона человека жиров или
Слайд 5В организме человека в сутки распадается на аминокислоты около 400 г
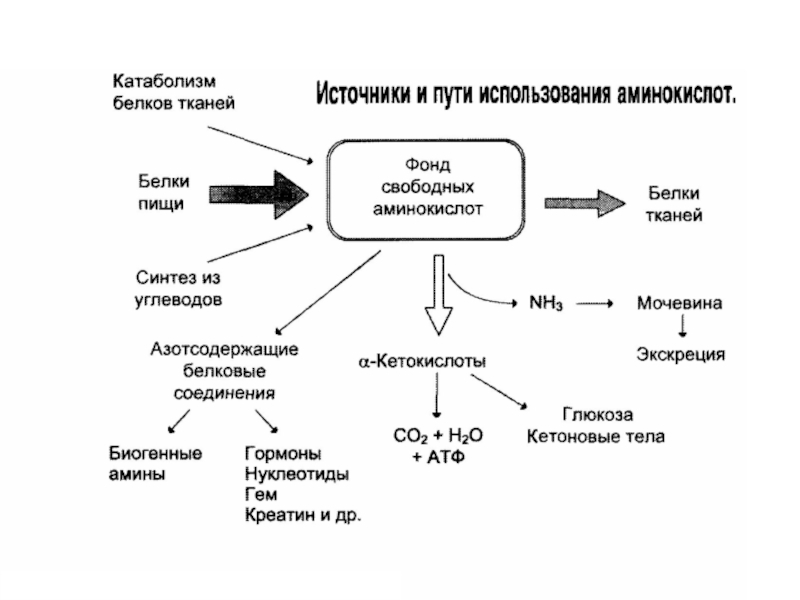
Источники аминокислот
Слайд 6Фонд свободных аминокислот организма составляет примерно 35 г. Содержание свободных аминокислот
Источники свободных аминокислот в клетках - белки пищи, собственные белки тканей и синтез аминокислот из углеводов.
Фонд свободных аминокислот
Слайд 7Источники аминокислот
1. Белки корма
2. Белки тканей при распаде в процессе их
3. Синтез заменимых аминокислот из других веществ
Слайд 8Пути использования аминокислот в организме
Биосинтез белков
Синтез биологически активных веществ
Синтез углеводов, липидов
Окисление
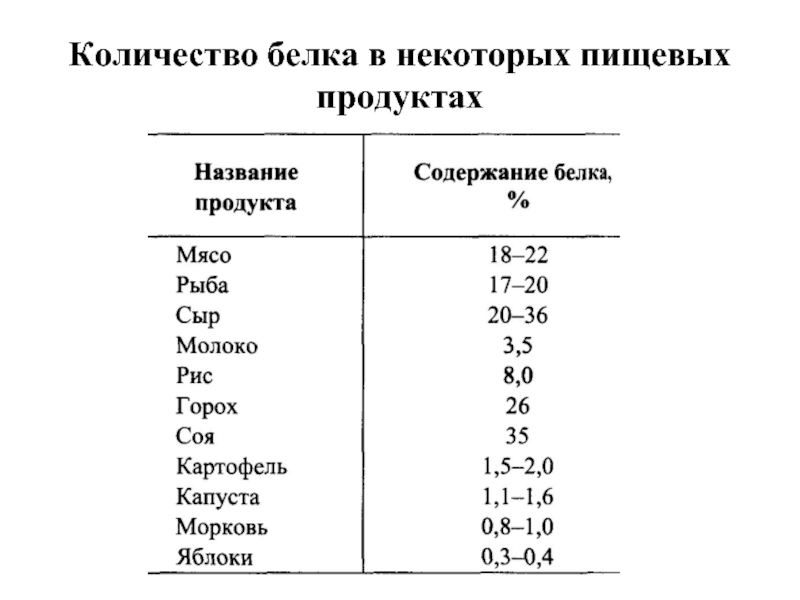
Слайд 11ПЕРЕВАРИВАНИЕ БЕЛКОВ
В пищевых продуктах содержание свободных аминокислот очень мало. Подавляющее их
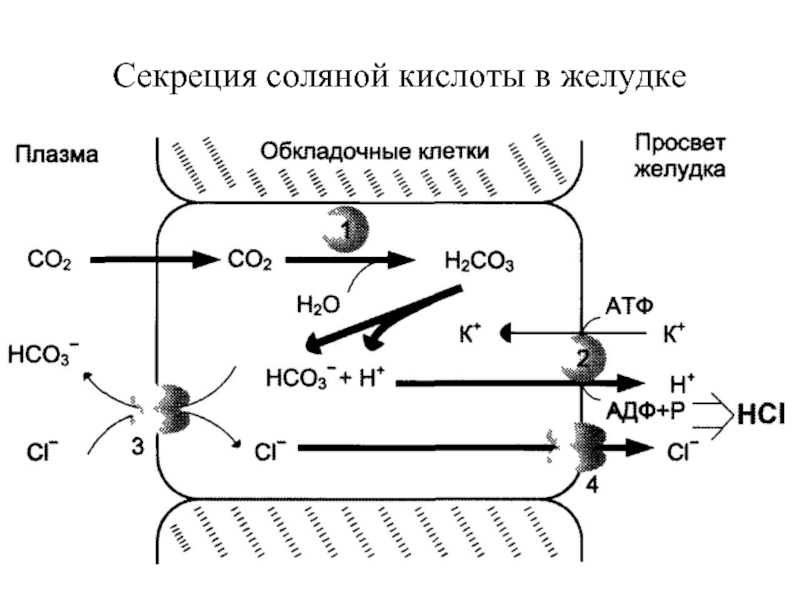
Слайд 12Переваривание белков в желудке
Желудочный сок — продукт нескольких типов клеток. Обкладочные
Слайд 13Под действием НС1 происходит денатурация белков пищи, не подвергшихся термической обработке,
Роль НС1 в пищеварении
Слайд 15Механизм активации пепсина
Под действием гастринов в главных клетках желудочных желёз стимулируются
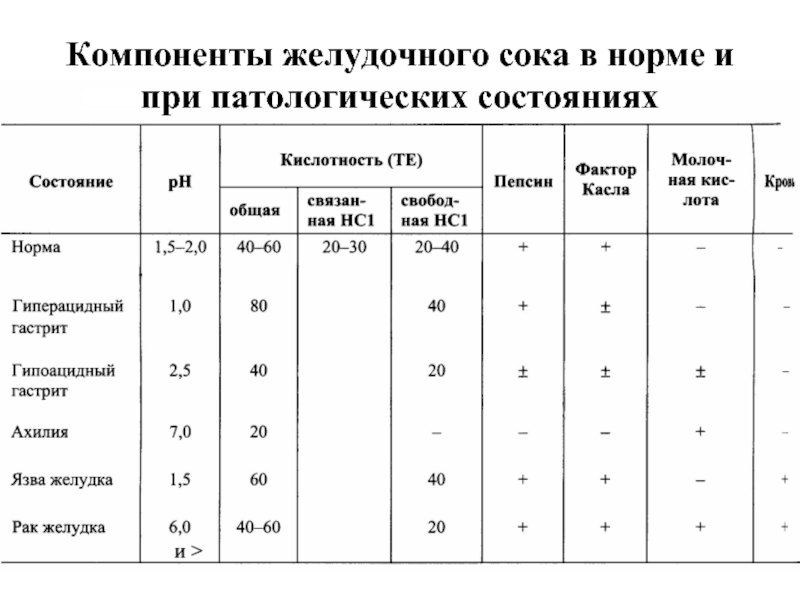
Слайд 16Особенности переваривания белков в желудке
У детей грудного возраста в желудке находится
В слизистой оболочке желудка человека найдена ещё одна протеаза — гастриксин. Все 3 фермента (пепсин, реннин и гастриксин) сходны по первичной структуре, что указывает на их происхождение от общего гена-предшественника.
Слайд 18Активация панкреатических ферментов
В поджелудочной железе синтезируются проферменты ряда протеаз: трипсиноген, химотрипсиноген,
Слайд 19Активация трипсиногена происходит под действием фермента эпителия кишечника энтериептидазы. Этот фермент
Слайд 20Образовавшийся трипсин активирует химотрипсиноген, из которого получается несколько активных ферментов. Химотрипсиноген
Активация химотрипсиногена
Слайд 22Остальные проферменты панкреатических протеаз (проэластаза и прокарбоксипептидазы А и В) также
Активация протеаз
Слайд 23Специфичность действия протеаз
Трипсин преимущественно гидролизует пептидные связи, образованные карбоксильными группами аргинина
Слайд 24Карбоксипептидазы А и В — цинксодержащие ферменты, отщепляют С-концевые остатки аминокислот.
Последний этап переваривания — гидролиз небольших пептидов, происходит под действием ферментов аминопептидаз и дипептидаз, которые синтезируются клетками тонкого кишечника в активной форме.
Специфичность действия протеаз
Слайд 25Аминопептидазы последовательно отщепляют N-концевые аминокислоты пептидной цепи. Наиболее известна лейцинаминопептидаза —
Дипептидазы расщепляют дипептиды на аминокислоты, но не действуют на трипептиды.
В результате последовательного действия всех пищеварительных протеаз большинство пищевых белков расщепляется до свободных аминокислот.
Места действия протеаз
Слайд 26Защита клеток от действия протеаз
Клетки поджелудочной железы защищены от действия пищеварительных
эти ферменты образуются в виде неактивных предшественников в клетках поджелудочной железы и активируются только после секреции в просвет кишечника. Таким образом, место синтеза и место действия этих ферментов пространственно разделены.
в клетках поджелудочной железы присутствует белок-ингибитор трипсина, образующий с активной формой фермента (в случае преждевременной активации) прочный комплекс.
Слайд 27Защита от действия протеаз
В полости желудка и кишечника протеазы не контактируют
Разрушение клеточных белков протеазами происходит при язвенной болезни желудка или двенадцатиперстной кишки. Однако начальные механизмы возникновения язвы ещё мало изучены.
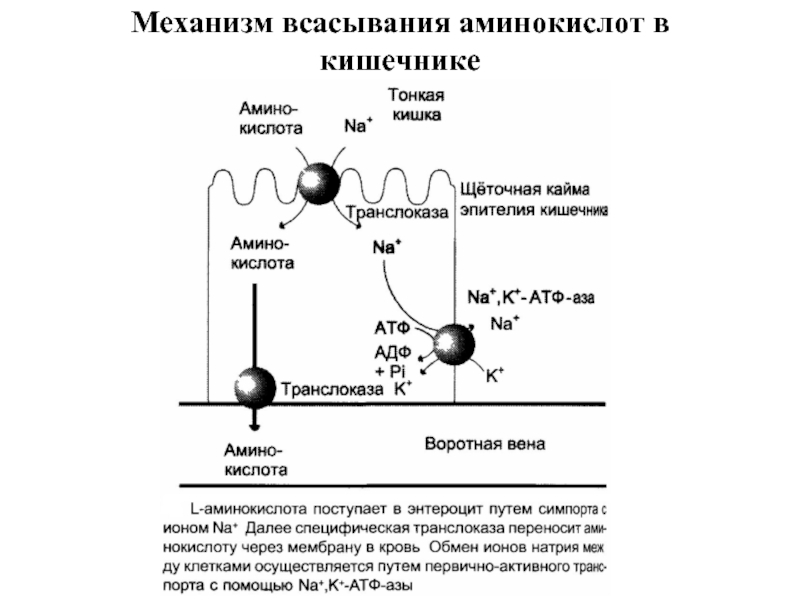
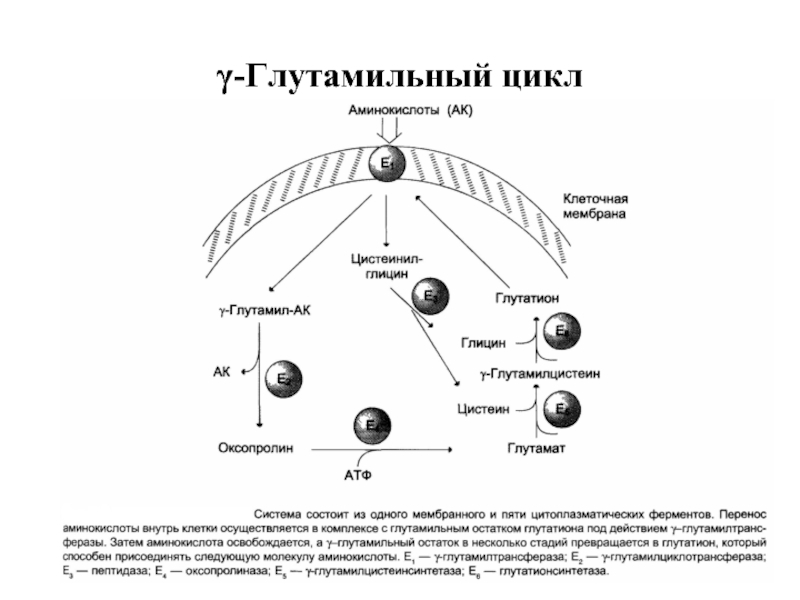
Слайд 29В настоящёе время известно по крайней мере пять специфических транспортных систем,
нейтральных, с короткой боковой цепью (аланин, серии, треонин);
нейтральных, с длинной или разветвлённой боковой цепью (валин, лейцин, изолейцин);
с катионными радикалами (лизин, аргинин);
с анионными радикалами (глутаминовая и аспарагиновая кислоты);
иминокислот (пролин, оксипролин).
Перенос аминокислот
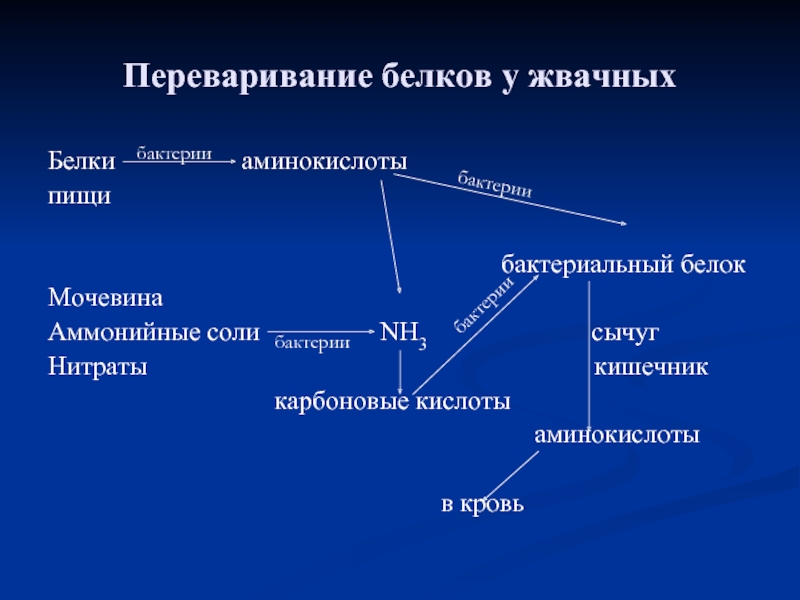
Слайд 31Переваривание белков у жвачных
Белки
пищи
бактериальный белок
Мочевина
Аммонийные соли NH3 сычуг
Нитраты кишечник
карбоновые кислоты
аминокислоты
в кровь
бактерии
бактерии
бактерии
бактерии
Слайд 32КАТАБОЛИЗМ АМИНОКИСЛОТ
Аминокислоты, образующиеся при переваривании белков и поступающие в клетки тканей,
Катаболизм большинства аминокислот начинается с отщепления α-аминогруппы. Аминокислота теряет аминогруппу в результате двух типов реакций: трансаминирования, дезаминирования или трансдезаминирования.
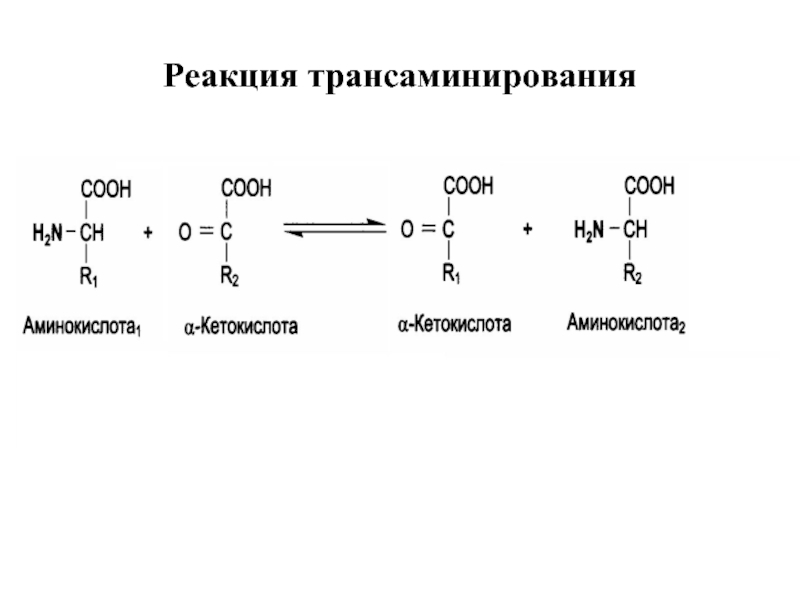
Слайд 33Трансаминирование
Трансаминирование — реакция переноса α-аминогруппы с аминокислоты на α-кетокислоту, в результате
Реакции катализируют ферменты аминотрансферазы, коферментом которых служит пиридоксальфосфат (ПФ) — производное витамина В6 (пиридоксина).
Слайд 34Аминотрансферазы
Аминотрансферазы обнаружены как в цитоплазме, так и в митохондриях клеток эукариот.
Слайд 37 Основной путь трансаминирования
Чаще всего в реакциях трансаминированиш участвуют аминокислоты, содержание
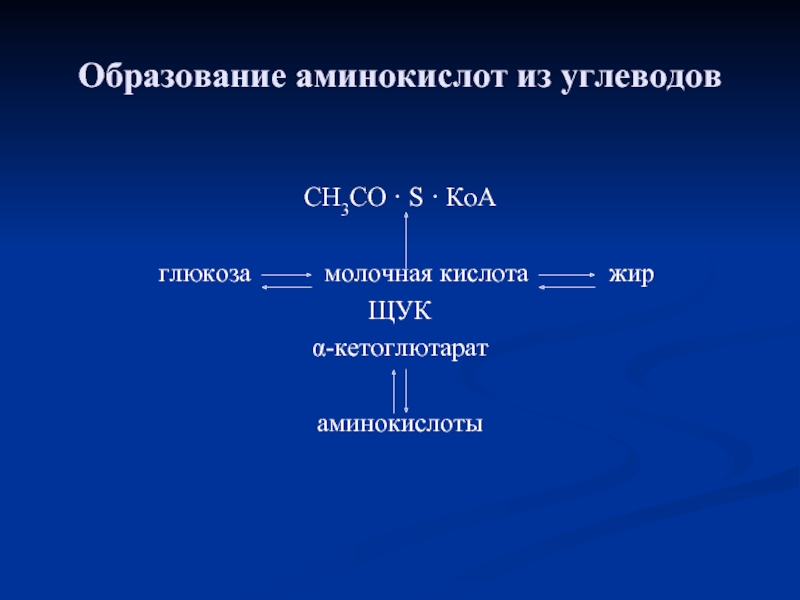
Акцептором аминогруппы любой аминокислоты, подвергающейся трансаминированию, служит α-кетоглутарат. Принимая аминогруппу, он превращается в глутамат, который способен передавать эту группу любой α-кетокислоте с образованием другой аминокислоты.
Слайд 38Образование аминокислот из углеводов
СН3СО · S · КоА
глюкоза
ЩУК
α-кетоглютарат
аминокислоты
Слайд 39Аминотрансферазы обладают субстратной специфичностью к разным аминокислотам. В тканях человека обнаружено
Специфичность аминотрансфераз
Слайд 40Аланинаминотрансфераза
АЛТ (АлАТ) катализирует реакцию трансаминирования между аланином и α-кетоглутаратом.
Локализован этот фермент
Слайд 41ACT (АсАТ) катализирует реакцию трансаминирования между аспартатом и α-кетоглутаратом аналогично предыдущей.
В
Так как наибольшее количество АЛТ и ACT сосредоточено в печени и миокарде, а содержание в крови очень низкое, можно говорить об органоспецифичности этих ферментов.
Аспаратаминотрансфераза
Слайд 42Биологическое значение трансаминирования
Реакции трансаминирования играют большую роль в обмене аминокислот. Поскольку
Трансаминирование - первая стадия дезаминирования большинства аминокислот, т.е. начальный этап их катаболизма.
Слайд 43Дезаминирование аминокислот
Дезаминирование аминокислот — реакция отщепления α-аминогруппы от аминокислоты, в
Аммиак токсичен для ЦНС, поэтому в организме человека и млекопитающих он превращается в нетоксичное хорошо растворимое соединение — мочевину.
Слайд 47Виды дезаминирования аминокислот
1. Гидролитическое
2. Окислительное
3. Восстановительное
4. Внутримолекулярное
Слайд 49Окислительное дезаминирование
Окислительное дезаминирование может происходить при участии ФМН и ФАД –зависимых
А)D-аминокислоты иминокислоты кетокислоты
Б) L-аминокислоты иминокислоты кетокислоты
-2Н
ФАД
+НОН
-NH3
ФАД
-2Н
+НОН
-NH3
Слайд 51Внутримолекулярное дезаминирование
СНNH2 СН
СООН СООН
(у бактерий)
У высших животных таким путем дезаминируется гистидин:
гистидин урокининовая кислота
- NH3
- NH3
Слайд 52Большая часть безазотистых остатков аминокислот превращается в пируват, либо в результате
Превращения остатков аминокислот
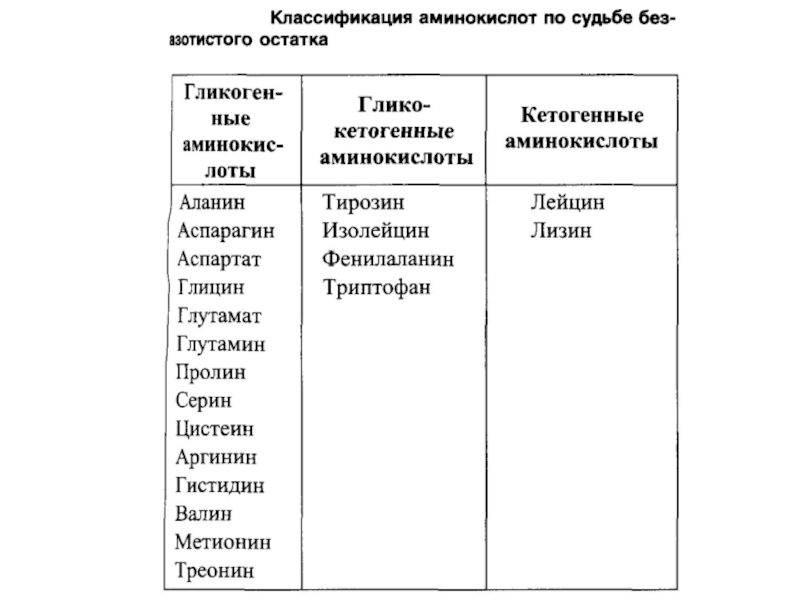
Слайд 53ГЛИКОГЕННЫЕ и кетогенные АМИНОКИСЛОТЫ
Катаболизм всех аминокислот сводится к образованию шести веществ,
Аминокислоты, которые превращаются в пируват и промежуточные продукты ЦТК (α-КГ, сукцинил-КоА, фумарат) и образуют в конечном итоге оксалоацетат, могут использоваться в процессе глюконеогенеза. Такие аминокислоты относят к группе глюкогенных аминокислот. Кетогенные аминокислоты образуют ацетоацетил-КоА, а затем ацетил-КоА и кетоновые тела.
Слайд 54Пути использования безазотистого остатка аминокислот:
1. Окисляются → энергия + Н2О +
2. Синтез углеводов → гликонеогенез
3. Синтез липидов
Основные конечные продукты обмена аминокислот: Н2О, СО2, NH3
NH3 – яд! Его необходимо обезвредить.
Слайд 59БИОСИНТЕЗ ЗАМЕНИМЫХ АМИНОКИСЛОТ
В организме человека возможен синтез восьми заменимых аминокислот: Ала,
Путём трансаминирования α-кетокислот, образующихся из глюкозы, синтезируются аминокислоты
Слайд 60Кроме восьми перечисленных заменимых аминокислот, в организме млекопитающих могут синтезироваться ещё
Частично заменимые аминокислоты Apr и Гис синтезируются сложным путём в небольших количествах. Большая их часть должна поступать с пищей.
Для синтеза условно заменимых аминокислот тирозина и цистеина требуются незаменимые аминокислоты фенилаланин и метионин соответственно.
Синтезируемые аминокислоты
Слайд 61Пути обезвреживания NH3
Временное - образование амидов аминокислот, образование аммонийных солей –
Окончательное – образование мочевины в печени – орнитиновый цикл.
Слайд 62Окислительное дезаминирование
Наиболее активно в тканях происходит деза-минирование глутаминовой кислоты. Реакцию катализирует
Слайд 64Непрямое дезаминирование (трансдезаминирование)
Большинство аминокислот не способно дезаминироваться в одну стадию, подобно
Слайд 65трансдезаминирование
непрямое дезаминироваше — основной способ дезаминирования большинства аминокислот. Обе стадии непрямого
Слайд 67Неокислительное дезаминирование
В печени человека присутствуют специфические ферменты, катализирующие реакции дезаминирования аминокислот
Неокислительное дезаминирование серина катализирует сериндегидратаза
Слайд 69Токсичность аммиака
Аммиак легко проникает через мембраны в клетки и в митохондриях
а-Кетоглутарат + NADH + Н+ + NH3 -» Глутамат + NAD+.
Уменьшение концентрации а-кетоглутарата вызывает:
угнетение обмена аминокислот (реакции транса-минирования) и, следовательно, синтеза из них нейромедиаторов (ацетилхолина, дофамина и др.);
гипоэнергетическое состояние в результате снижения скорости ЦТК.
Слайд 70Токсичность аммиака
Повышение концентрации аммиака в кро
ви сдвигает рН в щелочную сторону
• Высокие концентрации аммиака стимули руют синтез глутамина из глутамата в нервной ткани (при участии глутаминсинтетазы):
Глутамат + NH3 + АТФ —» Глутамин + АДФ + Н3Р04.
Накопление глутамина в клетках нейроглии приводит к повышению осмотического давления в них, набуханию астроцитов и в больших концентрациях может вызвать отёк мозга.
Слайд 71Связывание аммиака
Основной реакцией связывания аммиака, протекающей во всех тканях организма, является
Слайд 72Глутамин — основной донор азота в организме.
'Высокий уровень глутамина в крови
Слайд 73Орнитиновый цикл
Мочевина — основной конечный продукт азотистого обмена, в составе которого
Слайд 80При образовании мочевины используется
А) аммиак – одна молекула
Б) СО2 – одна
В) аминогруппа аспарагиновой кислоты – одна молекула
При образовании одной молекулы мочевины расходуется три молекулы АТФ.
Слайд 81Кроме аминокислот источником аммиака в организме являются:
А) биогенные амины – гистамин,
Б) пуриновые основания
В) пиримидиновые основания
Г) амиды аминокислот
Слайд 82Временное обезвреживание NH3
COOH C – NH2
CH2 CH2
A) CH2 CH2 + H2O
CHNH2 CHNH2
COOH COOH
ГЛУТАМАТ ГЛУТАМИН
+NH3
АТФ
Слайд 83Превращение белков в толстом кишечнике
БЕЛКИ
гнилостные
бактерии
ЯДОВИТЫЕ ВЕЩЕСТВА
аммиак, сероводород, путресцин, кадаверин, фенол, крезол,
скатол, др. вещества.
+НОН
гнилостные
бактерии
Слайд 84Схема превращения веществ
Исходные вещества
углеводы липиды
промежуточные продукты обмена
(пировиноградная к – та, кетокислоты, уксусная к – та)
Конечные продукты обмена
Н2О СО2 NH3
Слайд 85Пути использования цистеина
БЕЛКИ
ТАУРИН
ЖЕЛЧНЫЕ ГЛЮТАТИОН HS - KoA
КИСЛОТЫ
CH2SH
CH2NH2
Слайд 87Использование глицина
биосинтез креатина биосинтез белков
обезвреживание
бензойной к-ты нуклеиновых к-т
биосинтез
гема
биосинтез желчных к-т обезвреживание NH3
у птиц
биосинтез глютатиона
Слайд 88Пути использования метионина
БЕЛКИ
ЛЕЦИТИН
ХОЛИН
АДРЕНАЛИН ТИМИН ГЕМ
ДНК
- СН3
- СН3
- СН3
- СН3
- СН3