- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Нуклеиновые кислоты: структура и функции презентация
Содержание
- 1. Нуклеиновые кислоты: структура и функции
- 2. 1. Нуклеиновые кислоты: структура и функции
- 3. Основные положения молекулярной биологии: ДНК - носитель
- 4. Доказательства генетической роли ДНК Открытие нуклеиновых кислот
- 5. Химический состав нуклеиновых кислот. ДНК и РНК
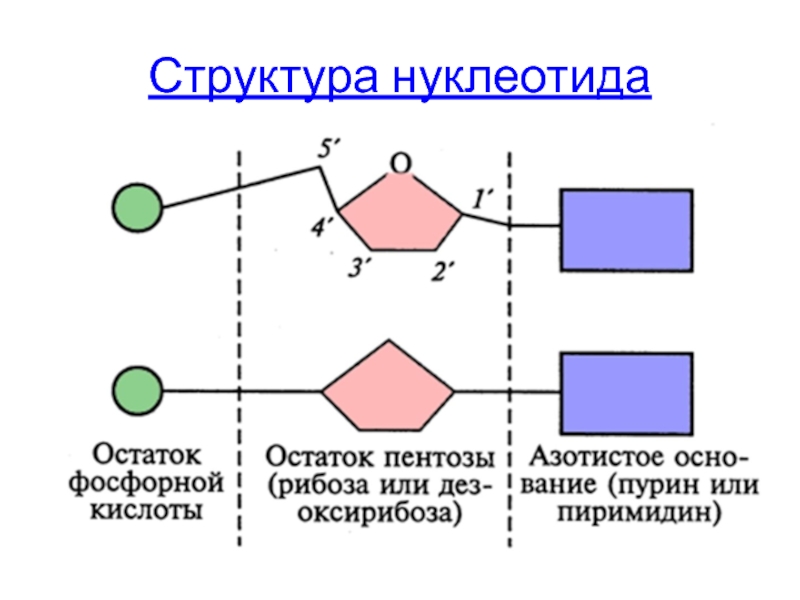
- 6. Структура нуклеотида
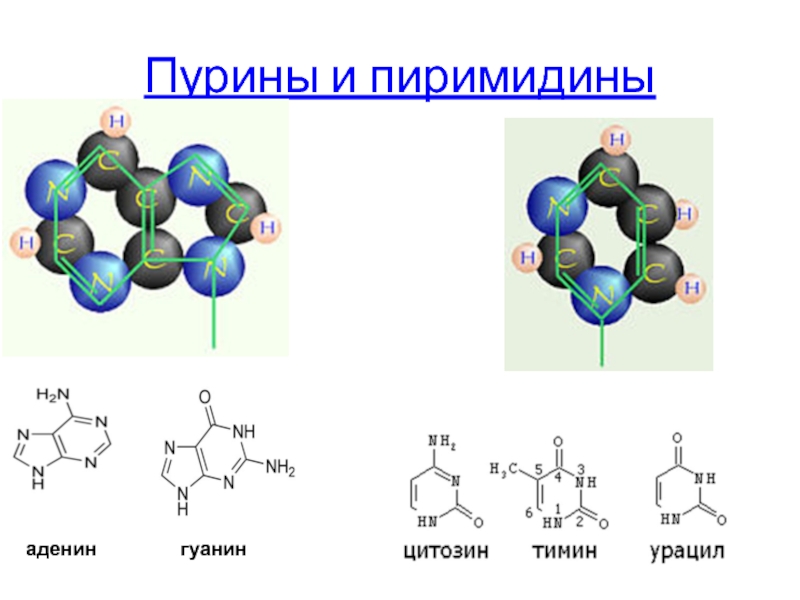
- 7. Пурины и пиримидины аденин гуанин
- 9. Первичная структура нуклеиновых кислот (ДНК и РНК)
- 10. Правила Э.Чаргаффа количество пуриновых оснований (A+Г) в
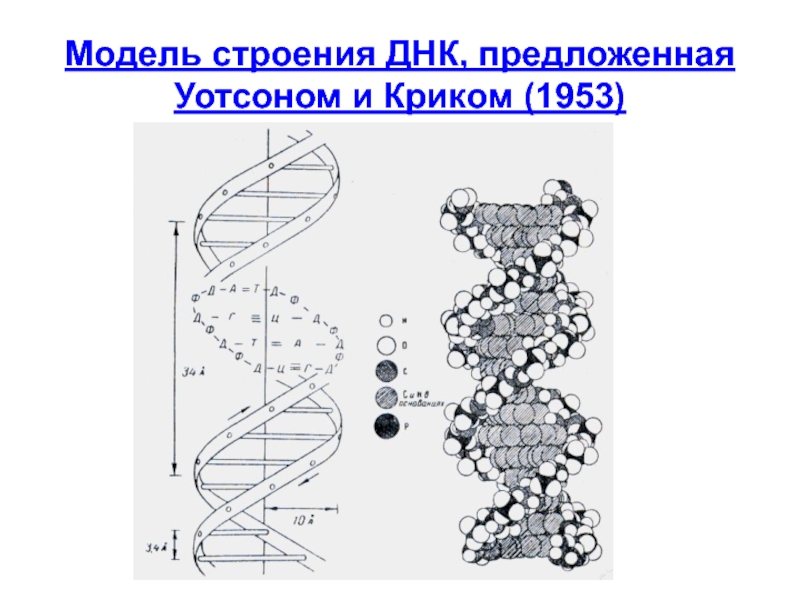
- 11. Модель строения ДНК, предложенная Уотсоном и Криком (1953)
- 12. Цепи в ДНК комплементарны и антипараллельны две
- 13. Цепи в ДНК комплементарны и антипараллельны
- 14. Химические связи, стабилизирующие вторичную структуру ДНК: Водородные
- 15. Биологические функции ДНК Хранение генетической информации
- 16. Отличия молекул ДНК и РНК
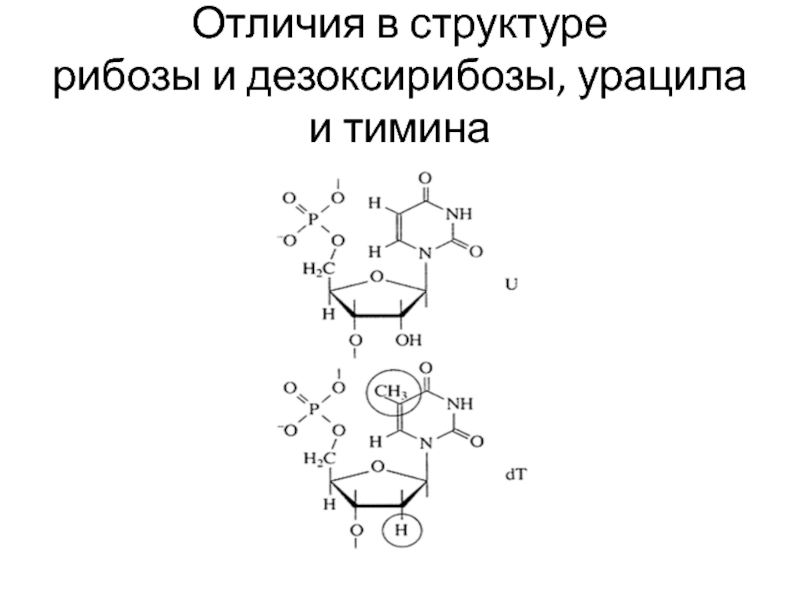
- 17. Отличия в структуре рибозы и дезоксирибозы, урацила и тимина
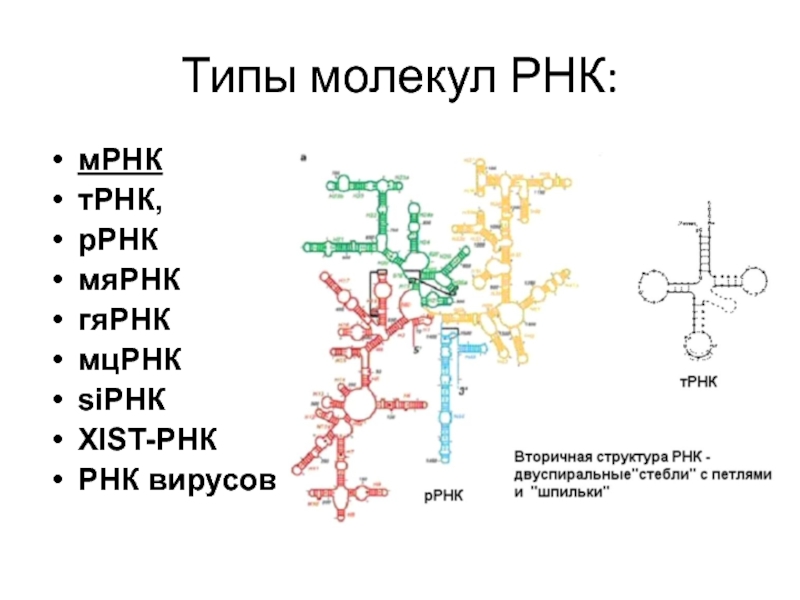
- 18. Типы молекул РНК: мРНК тРНК, рРНК
- 19. 2. Биосинтез ДНК Полуконсервативный механизм репликации
- 20. Полуконсервативный механизм репликации В основе процесса репликации
- 22. Синтез новых цепей ДНК катализируют ДНК-полимеразы
- 23. Реакция полимеризации нуклеотидов Суммарное уравнение реакции синтеза
- 24. ДНК-полимеразы имеют 2 субстрата: комплекс матрица-затравка и
- 25. Этапы синтеза ДНК Инициация – образование комплекса
- 26. Инициация синтеза ДНК Origin (Ori) - точка
- 27. Репликон – фрагмент молекулы ДНК от одной
- 28. Кольцевая ДНК прокариот имеет одну точку начала репликации (один репликон)
- 29. Репликоны эукариот
- 30. Репликация ДНК эукариотической хромосомы Показан один
- 32. Образование комплекса матрица-затравка ДНК-полимеразы не могут начать
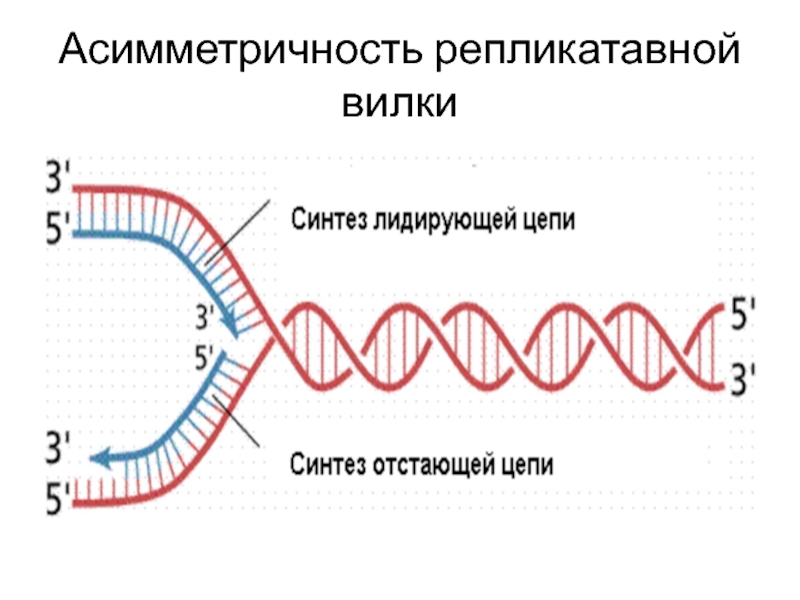
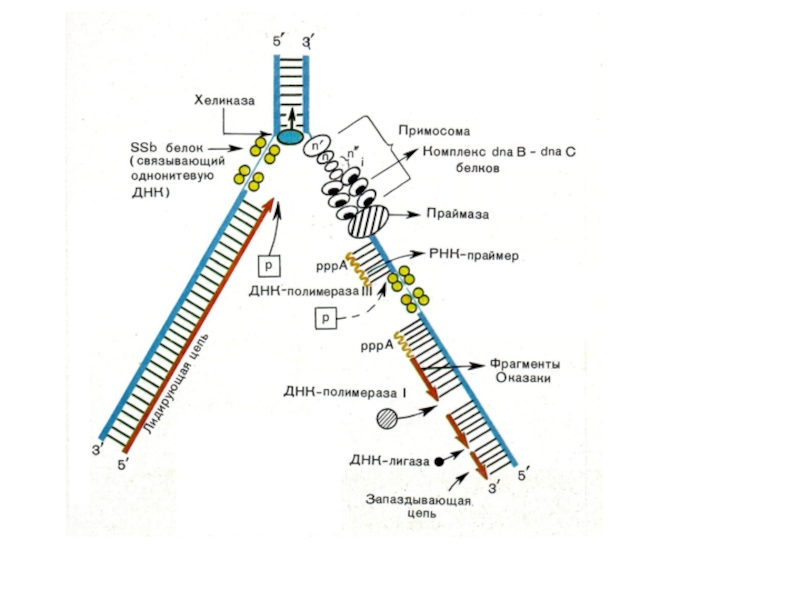
- 34. Асимметричность репликатавной вилки
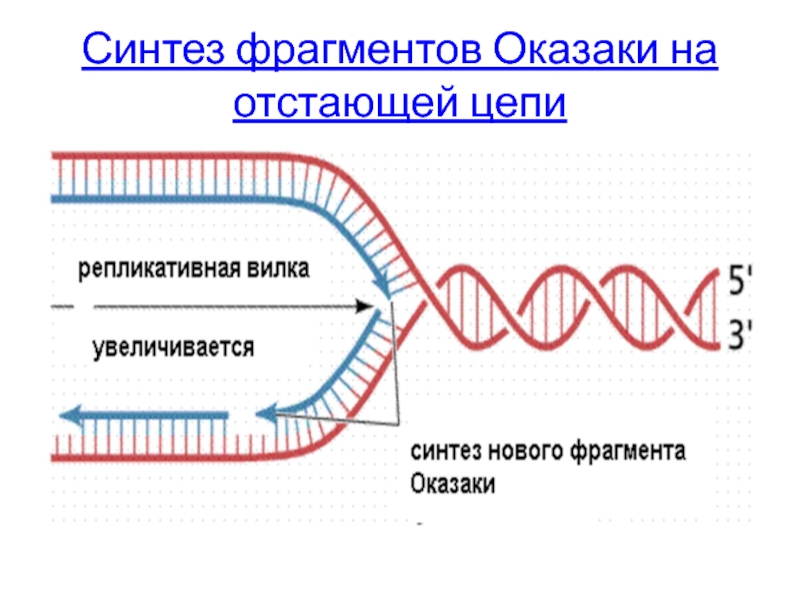
- 35. Синтез фрагментов Оказаки на отстающей цепи
- 36. ДНК-полимеразы прокариот ДНК полимераза I: Удаляет РНК-праймеры
- 37. Окончание синтеза ДНК РНК-полимераза I (прокариот), (РНКазаН
- 39. Отличия репликации в клетках прокариот и эукариот
- 40. ДНК- полимеразы эукариот Полимеразы α и δ
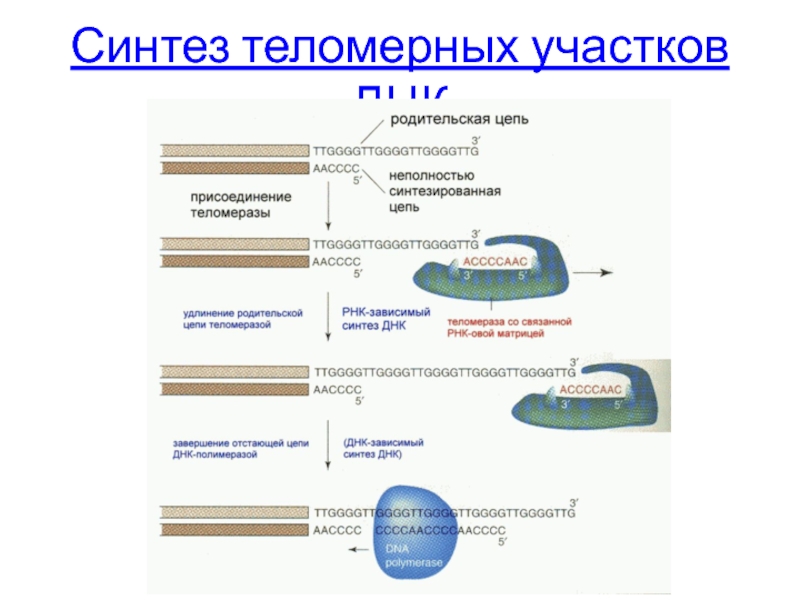
- 41. Синтез теломерных участков ДНК
- 42. 3. Молекулярные механизмы генных мутаций. Репарация ДНК
- 43. Основные понятия: Мутации - стойкие изменения структуры
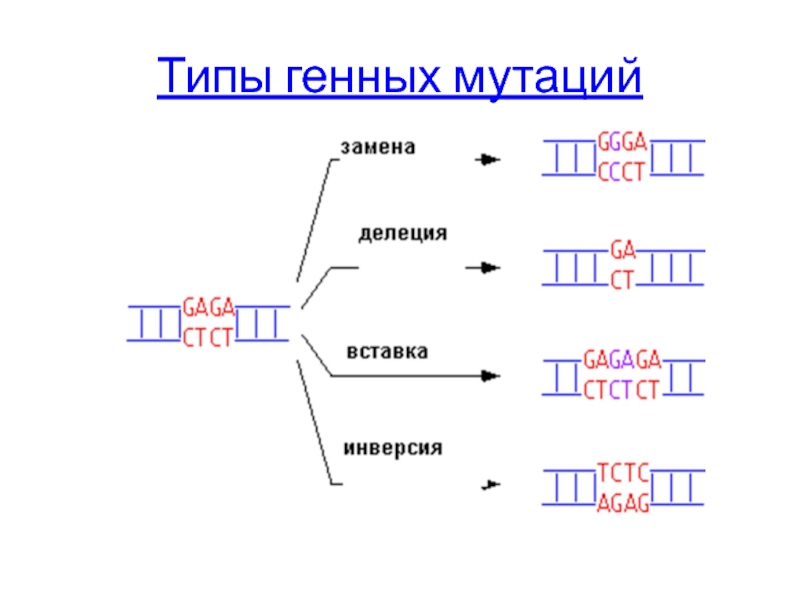
- 44. Типы генных мутаций
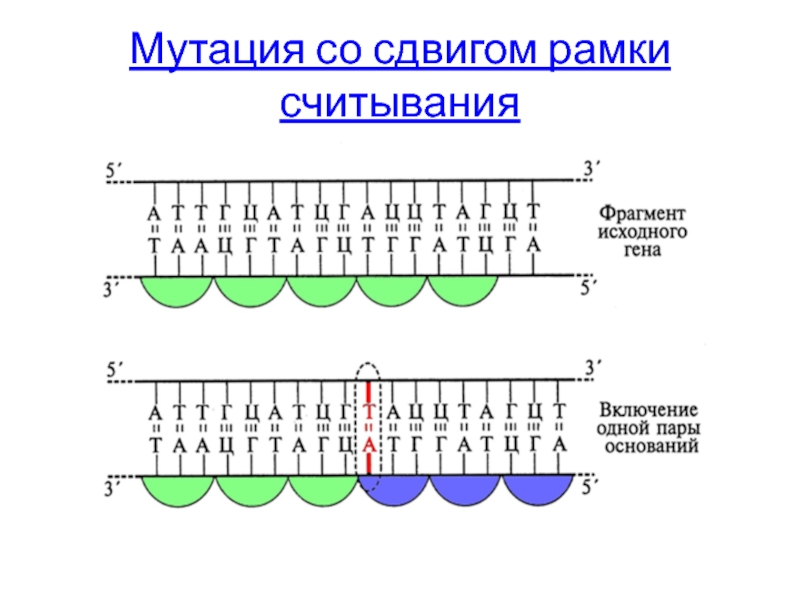
- 45. Мутация со сдвигом рамки считывания
- 46. Мутации типа замены оснований транзиции - замена
- 47. Эритроциты больного серповидно-клеточной анемией
- 48. Мутация в гене β-цепи гемоглобина
- 49. Факторы, индуцирующие мутации, называются мутагены Физические мутагены:
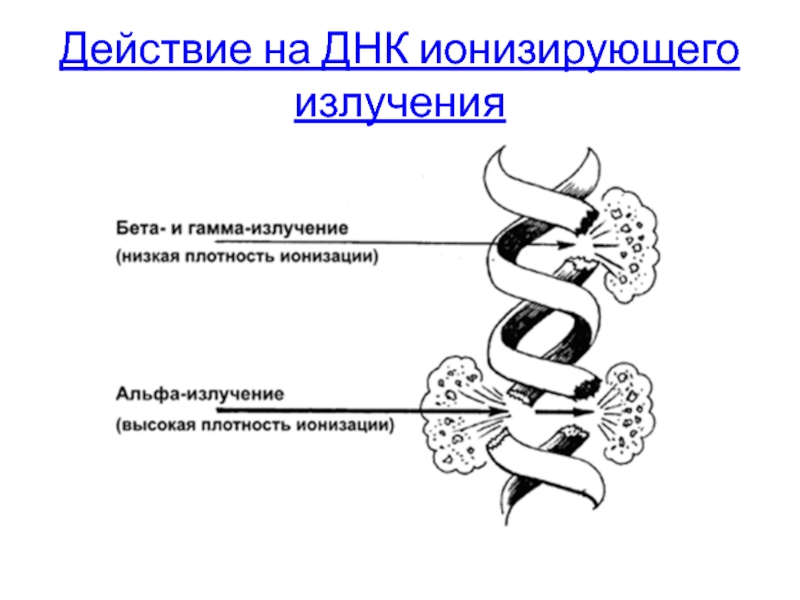
- 50. Действие на ДНК ионизирующего излучения
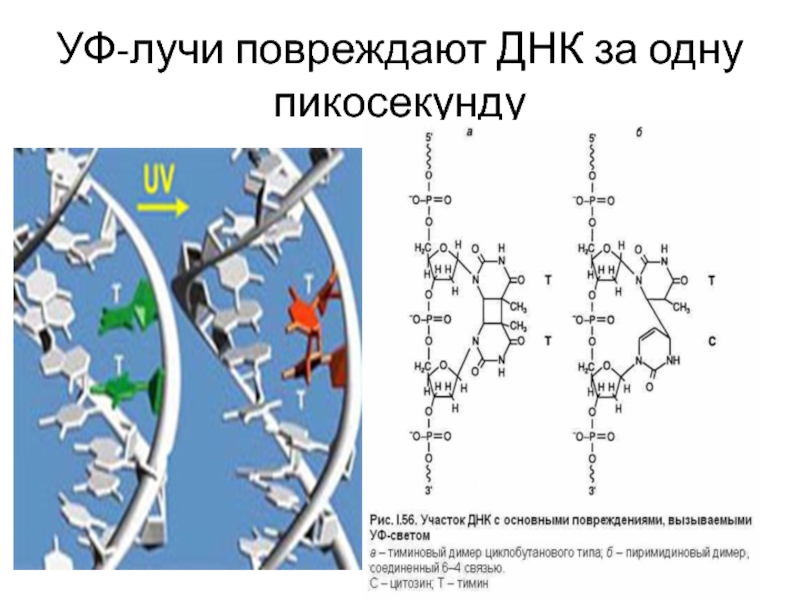
- 51. УФ-лучи повреждают ДНК за одну пикосекунду
- 52. Молекулярные механизмы генных мутаций Образование
- 53. Основные механизмы репарации: Репарация - это свойство
- 54. Прямое восстановление структуры ДНК: Прямая метилтрансферазная реактивация
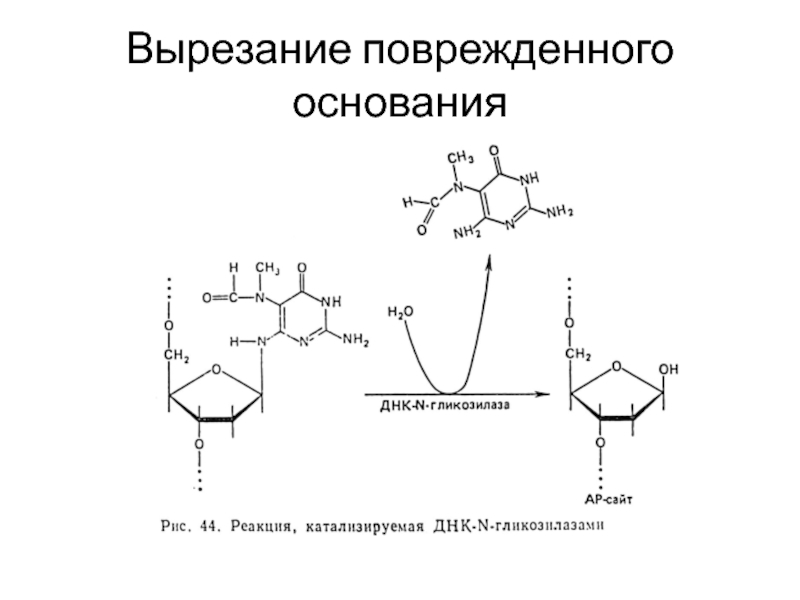
- 55. Вырезание поврежденного основания
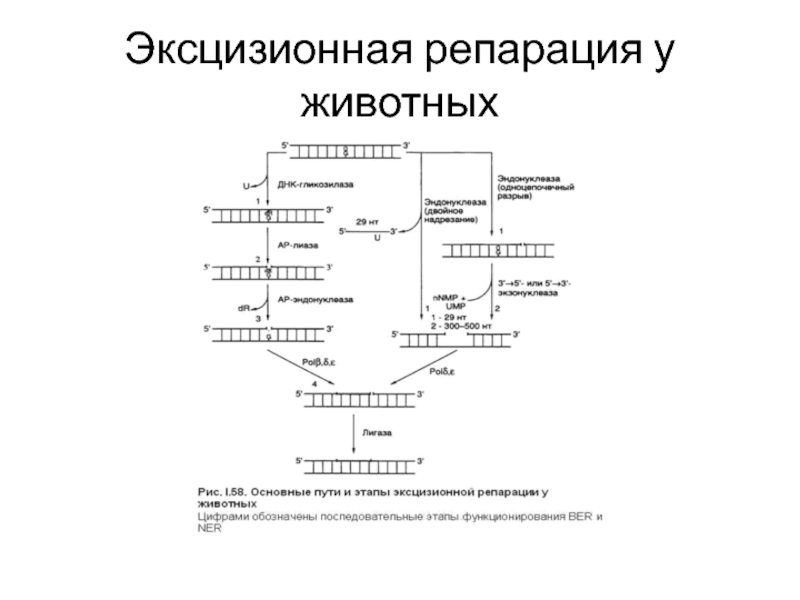
- 56. Эксцизионная репарация у животных
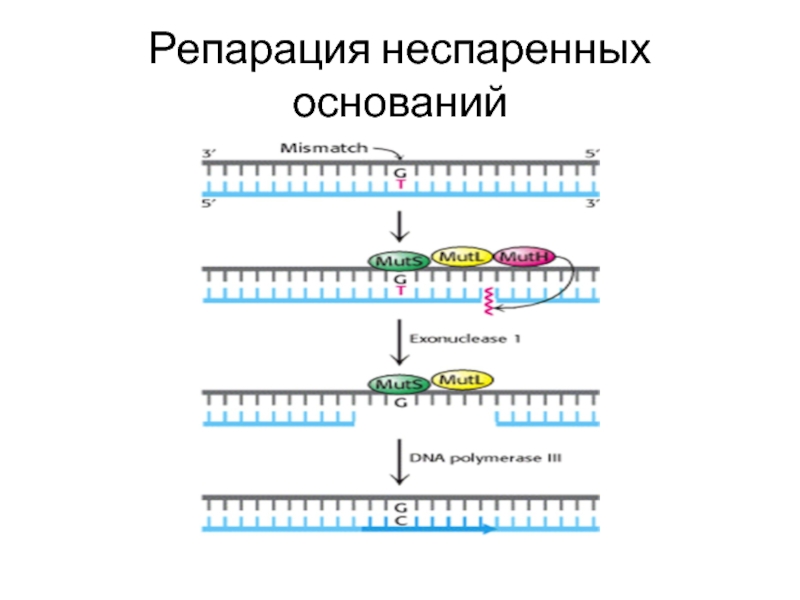
- 57. Репарация неспаренных оснований
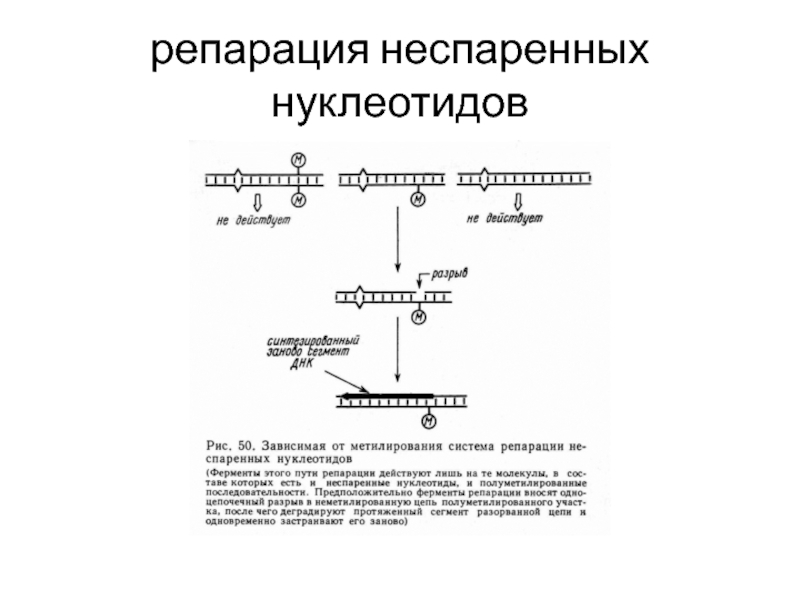
- 58. репарация неспаренных нуклеотидов
- 59. Пострепликативная репарация
- 60. SOS - индуцированная репарация Повреждения ДНК достигают
- 61. Нарушения системы репарации ДНК - причина наследственных
- 62. Болезни экспансии тринуклеотидов Хорея Хантингтона - аутосомно-доминантное
- 63. 4. Биосинтез молекул РНК. Транскрипция в клетках
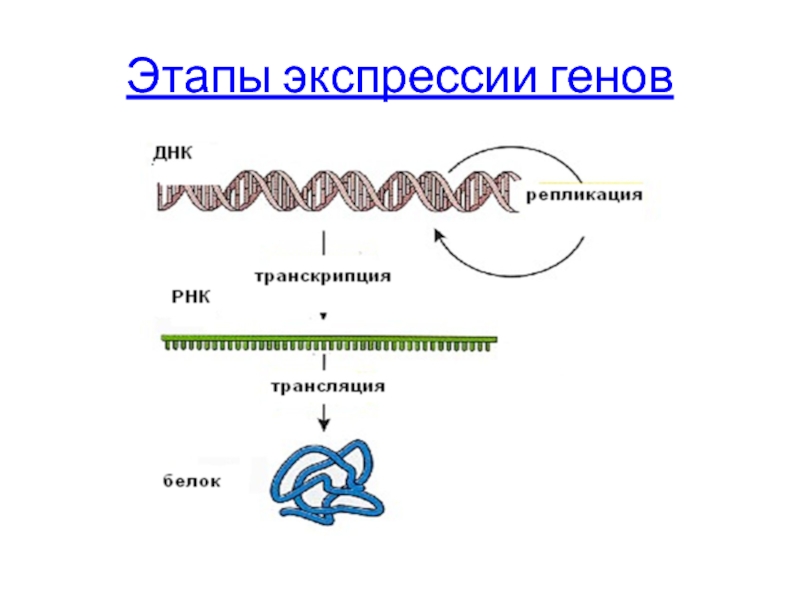
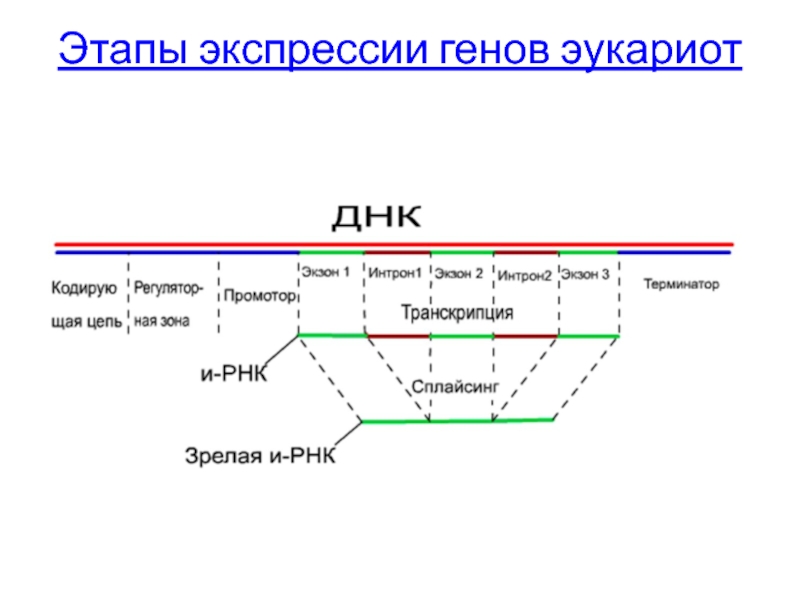
- 64. Этапы экспрессии генов
- 65. Принципы синтеза РНК на ДНК-матрице: комплементарность и антипараллельность
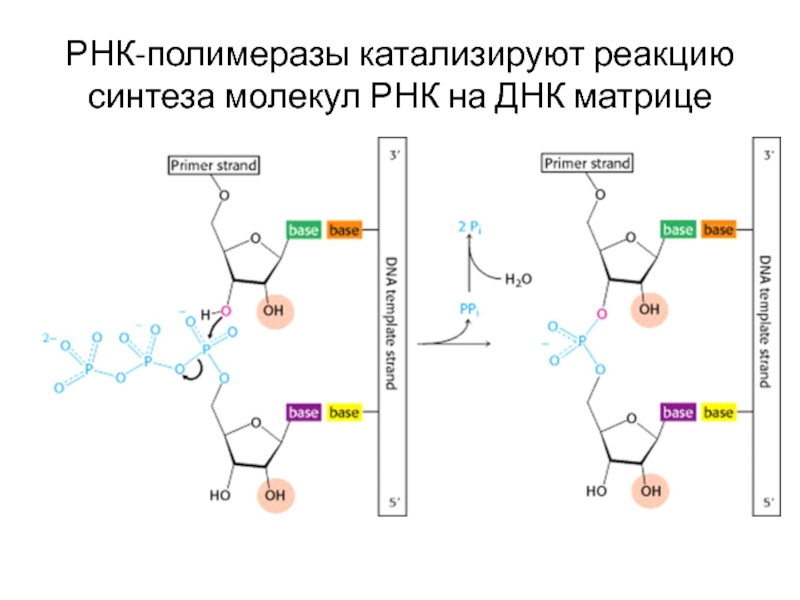
- 66. РНК-полимеразы катализируют реакцию синтеза молекул РНК на ДНК матрице
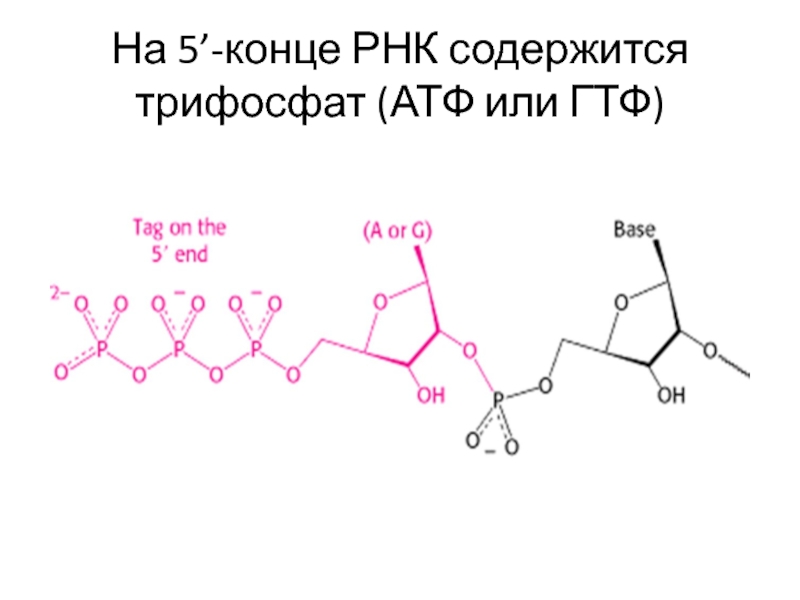
- 67. На 5’-конце РНК содержится трифосфат (АТФ или ГТФ)
- 68. Этапы транскрипции Связывание ДНК-матрицы – узнавание промотора,
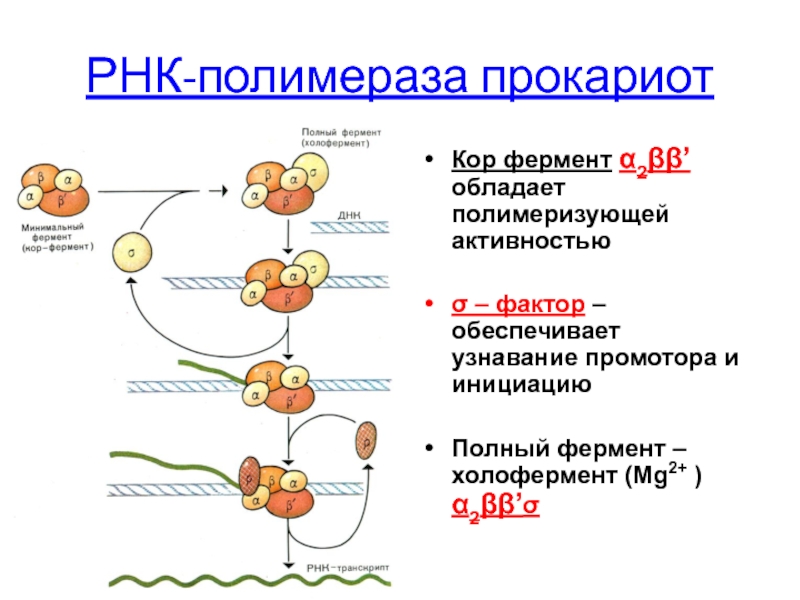
- 69. РНК-полимераза прокариот Кор фермент α2ββ’ обладает полимеризующей
- 70. Структура промоторов генов прокариот Промотор – специфическая
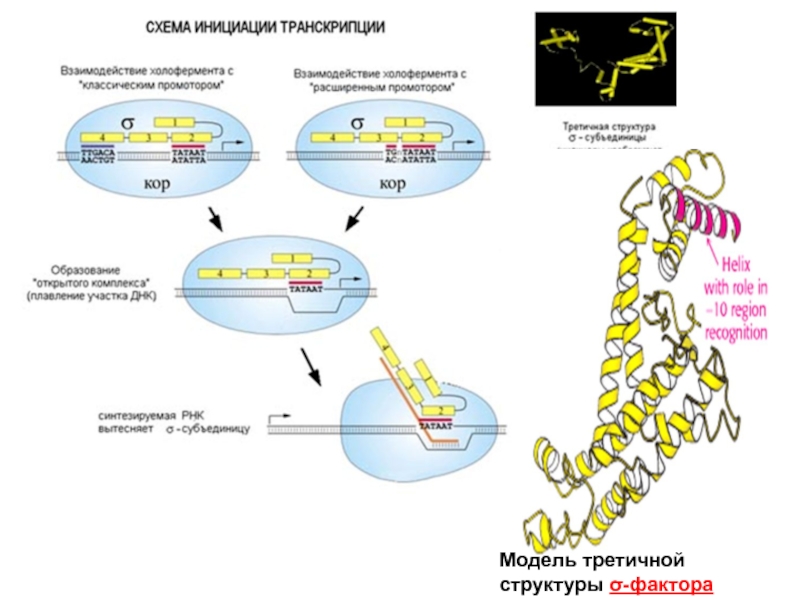
- 71. Стадии инициации транскрипции: образование «закрытого»
- 72. Модель третичной структуры σ-фактора
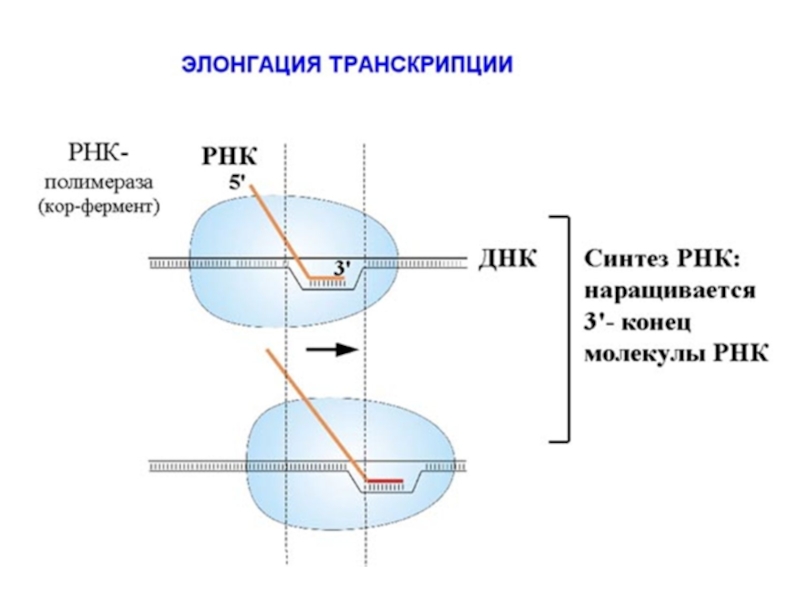
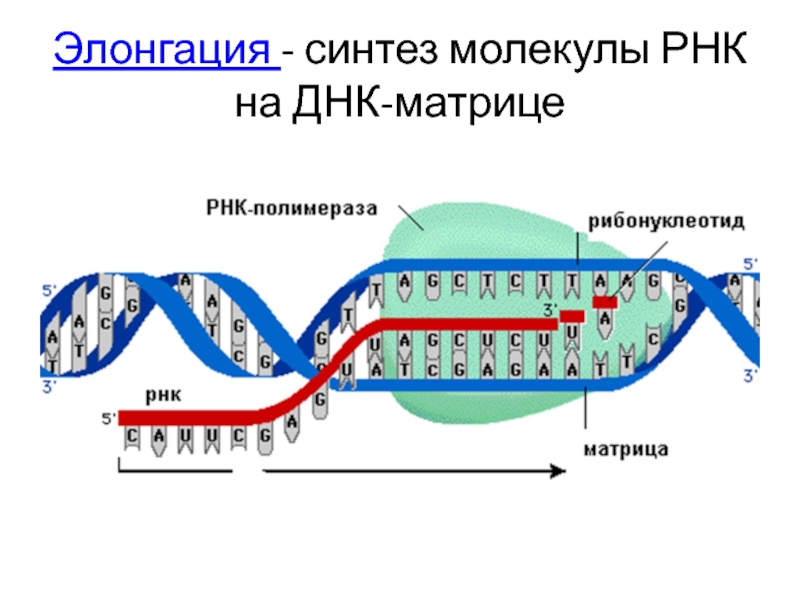
- 74. Элонгация - синтез молекулы РНК на ДНК-матрице
- 75. Терминация транскрипции прокариот
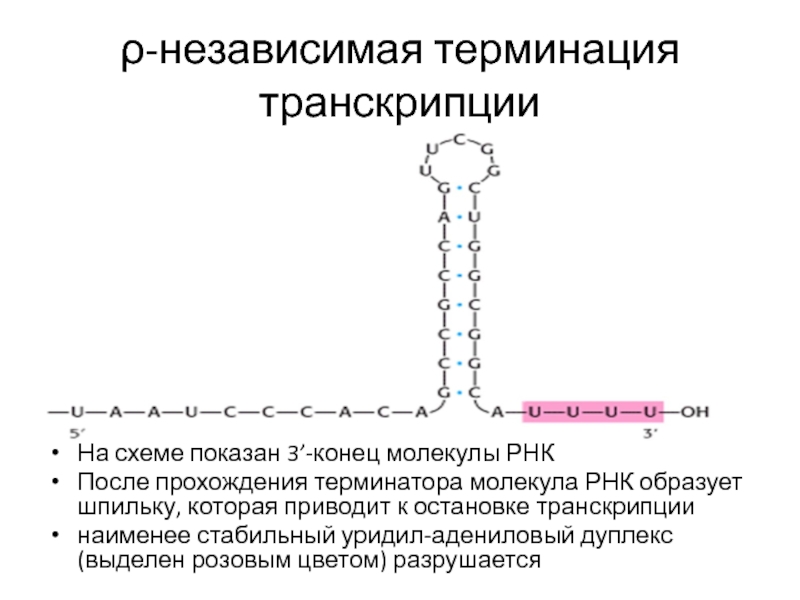
- 76. ρ-независимая терминация транскрипции На схеме показан 3’-конец
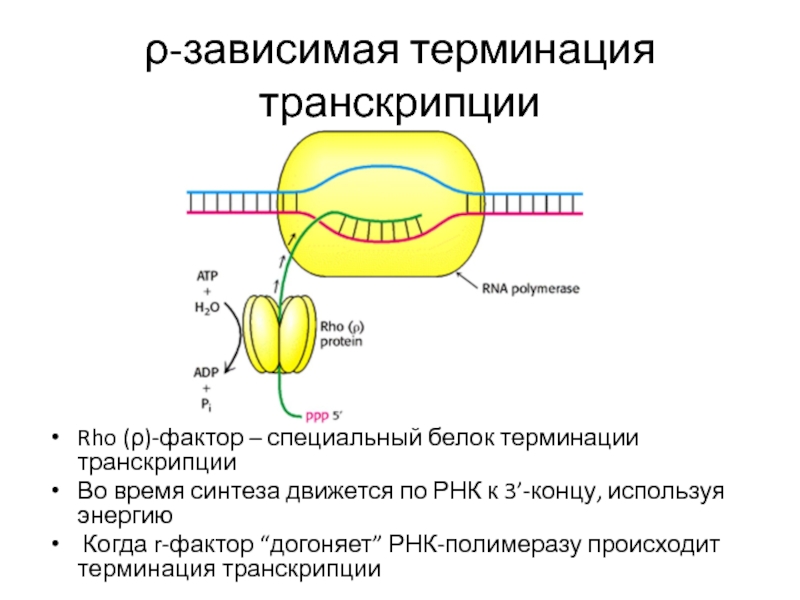
- 77. ρ-зависимая терминация транскрипции Rho (ρ)-фактор – специальный
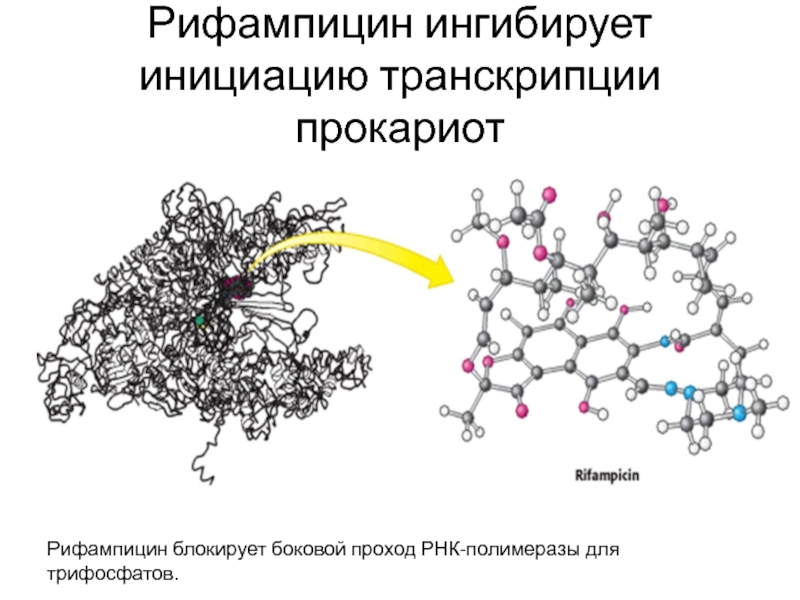
- 78. Рифампицин ингибирует инициацию транскрипции прокариот Рифампицин блокирует боковой проход РНК-полимеразы для трифосфатов.
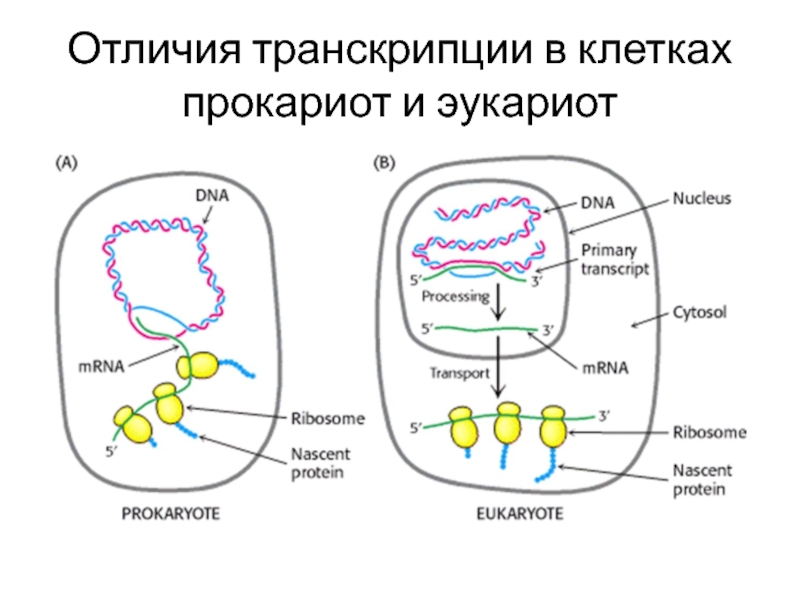
- 79. Отличия транскрипции в клетках прокариот и эукариот
- 80. РНК-полимеразы эукариот РНК-полимераза I – синтез рРНК
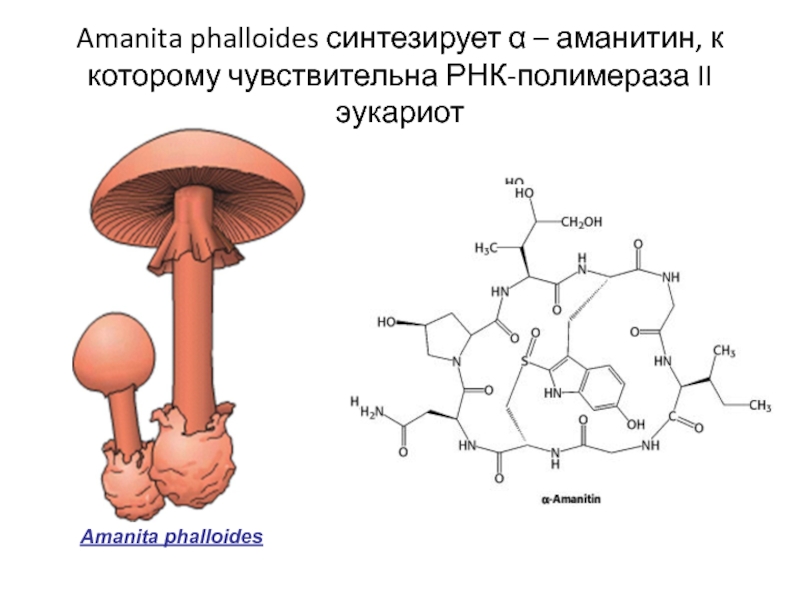
- 81. Amanita phalloides синтезирует α – аманитин, к которому чувствительна РНК-полимераза II эукариот Amanita phalloides
- 82. Для инициации синтеза РНК у эукариот необходимы
- 83. Универсальные последовательности промоторов класса II ТАТА-бокс (-25
- 84. Инициация транскрипции в зоне ТАТА-бокса должны
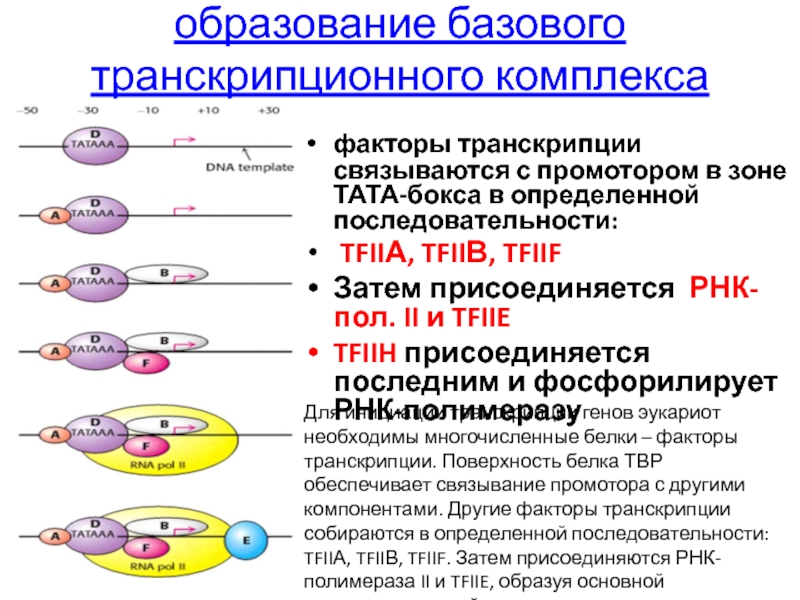
- 85. образование базового транскрипционного комплекса факторы транскрипции
- 86. Ключевым моментом инициации является узнавание ТАТА-бокса белком
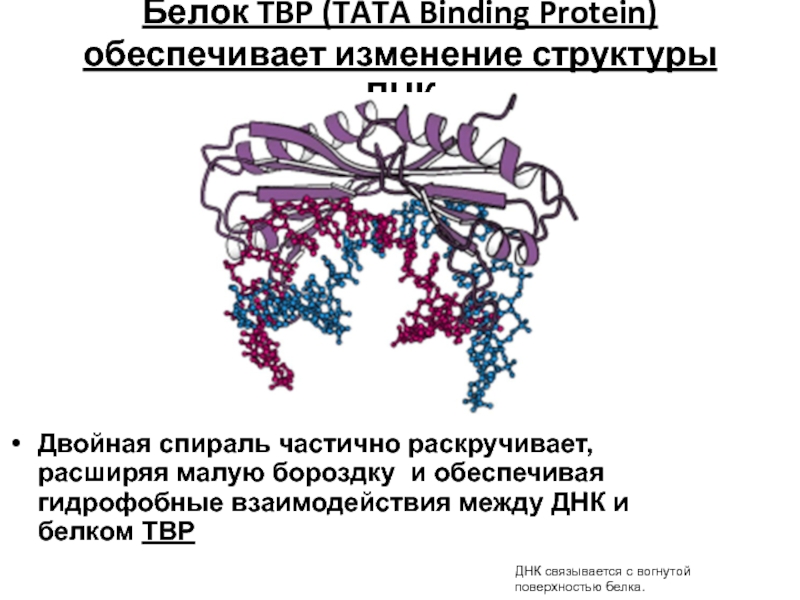
- 87. Белок TBP (TATA Binding Protein) обеспечивает изменение
- 88. Транскрипционный цикл для активации фермента и
- 89. 5. Процессинг РНК в клетках прокариот и
- 90. Этапы реализации генетической информации Транскрипция –
- 91. Процессинг пре- РНК эукариот происходит в ядре и в митохондриях
- 92. Процессинг РНК в клетках прокариот Ген
- 93. Процессинг рРНК и тРНК Зрелые молекулы
- 94. Гены рРНК и тРНК образуют транскрипционный
- 95. Процессинг тРНК и рРНК у прокариот Молекулы
- 96. Этапы процессинга тРНК прокариот: Модификация 5’
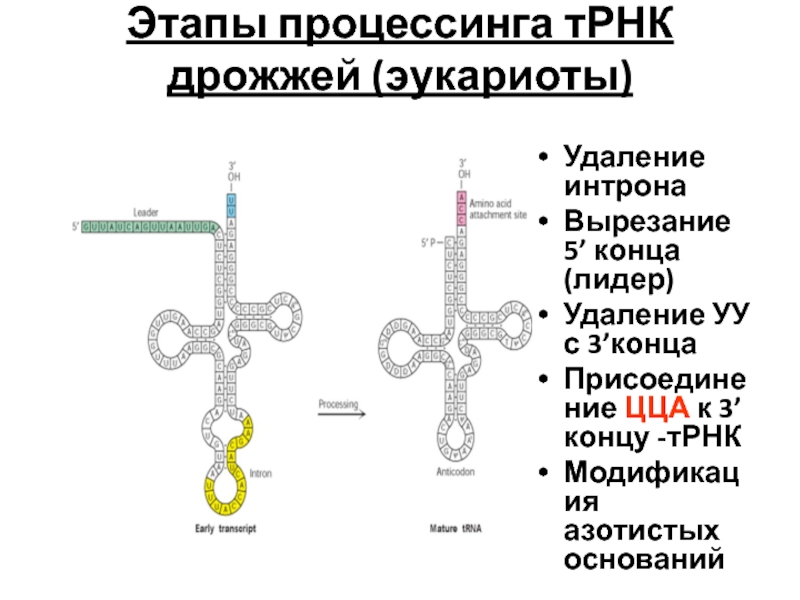
- 97. Этапы процессинга тРНК дрожжей (эукариоты) Удаление
- 98. Процессинг рРНК эукариот Транскрипционный блок содержит
- 99. Экзон-интронная структура генов эукариот Структура α-
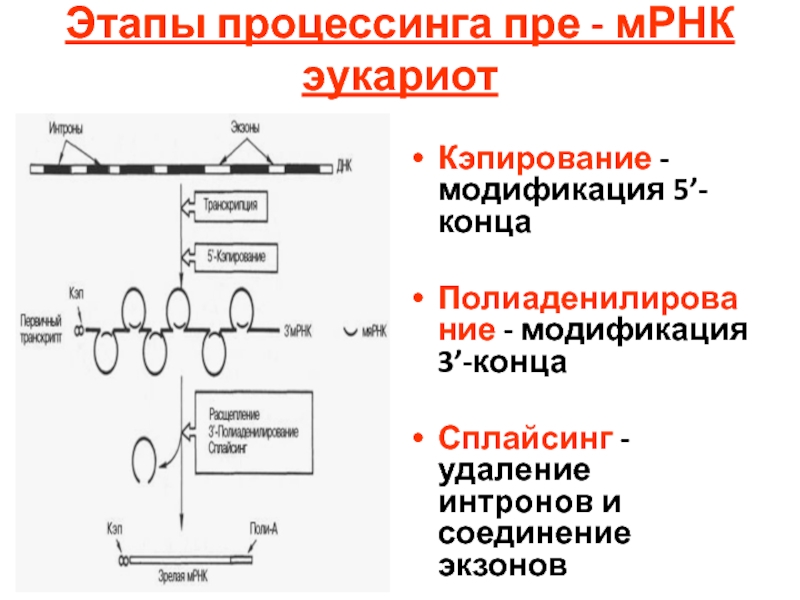
- 100. Этапы процессинга пре - мРНК эукариот
- 101. Этапы экспрессии генов эукариот
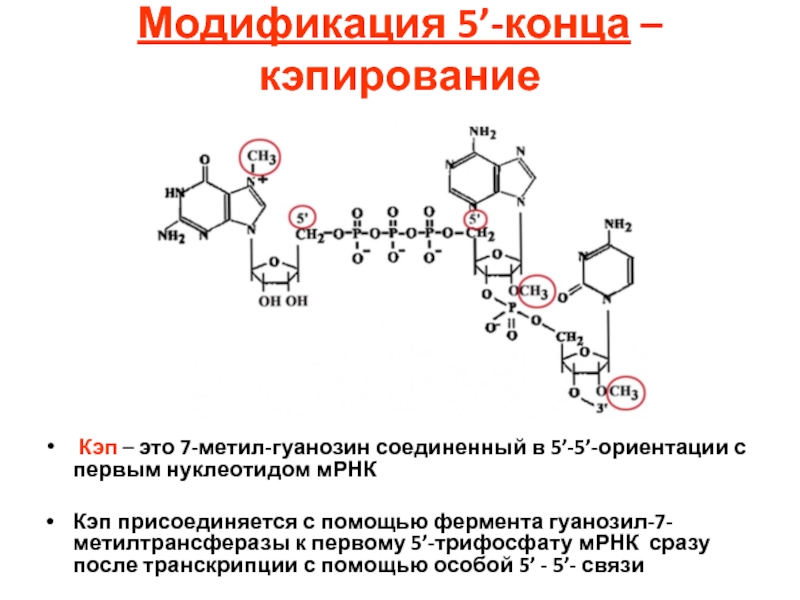
- 103. Модификация 5’-конца – кэпирование Кэп
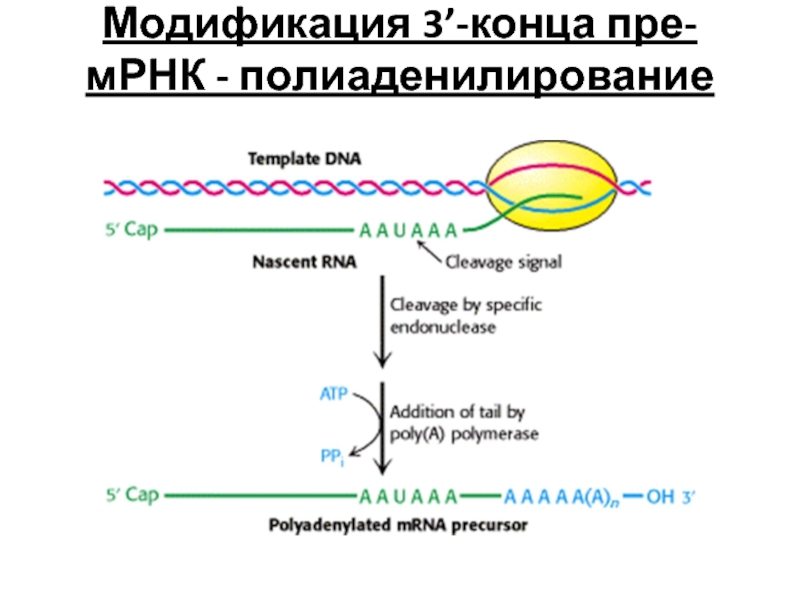
- 104. Модификация 3’-конца пре-мРНК - полиаденилирование
- 105. Модификация 3’-конца – полиаденилирование Последовательность ААУААА
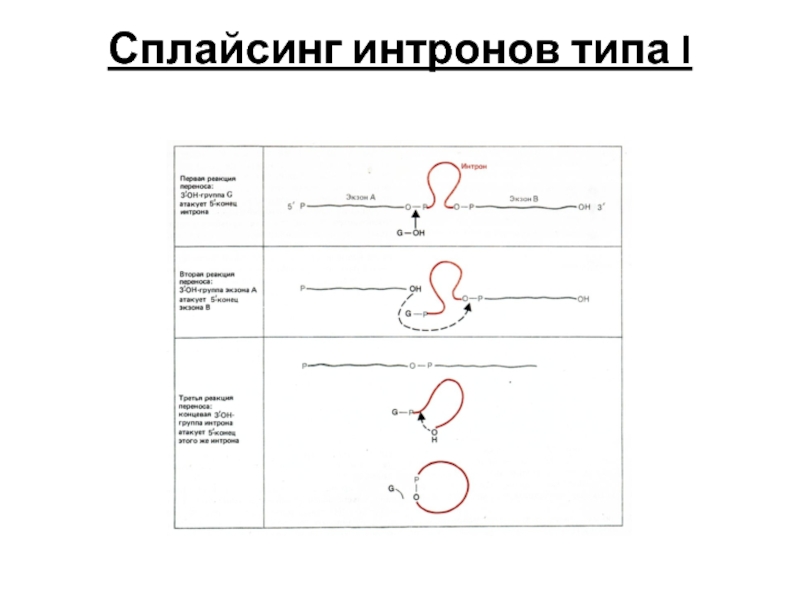
- 106. Механизмы сплайсинга интронов: Тип I -
- 107. Сплайсинг интронов типа I
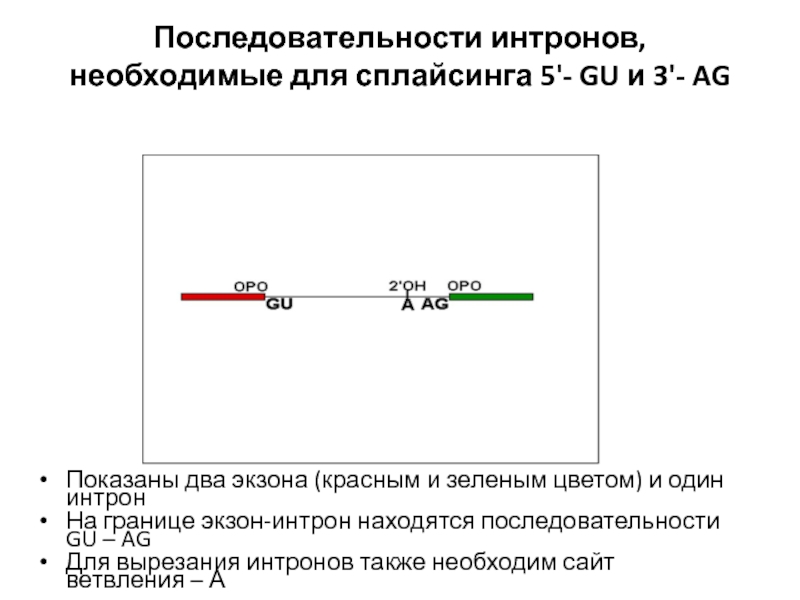
- 108. Последовательности интронов, необходимые для сплайсинга 5'- GU
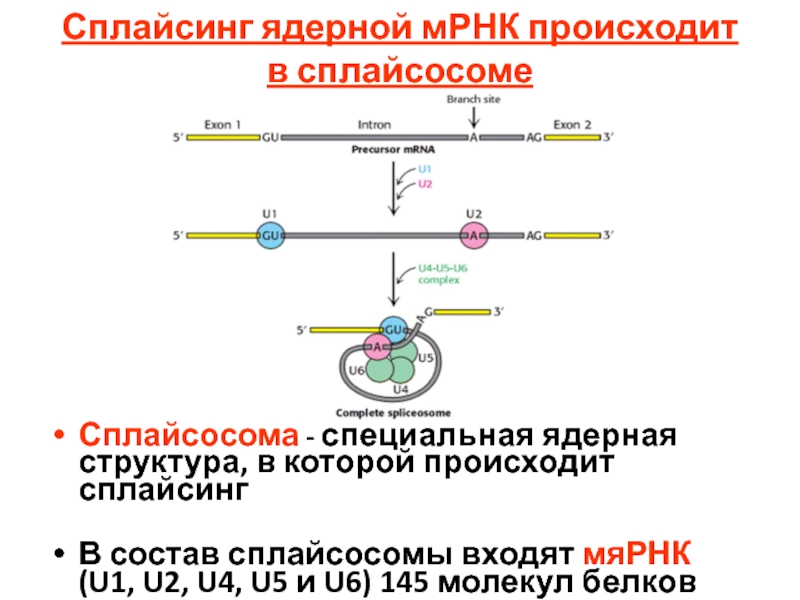
- 109. Сплайсинг ядерной мРНК происходит в сплайсосоме
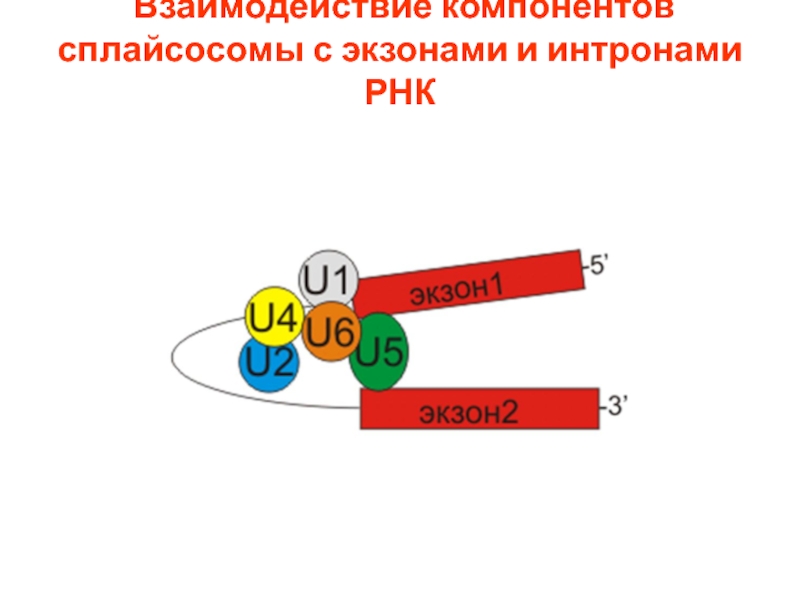
- 110. Взаимодействие компонентов сплайсосомы с экзонами и интронами РНК
- 111. Механизмы альтернативного сплайсинга: Альтернативный выбор промотора
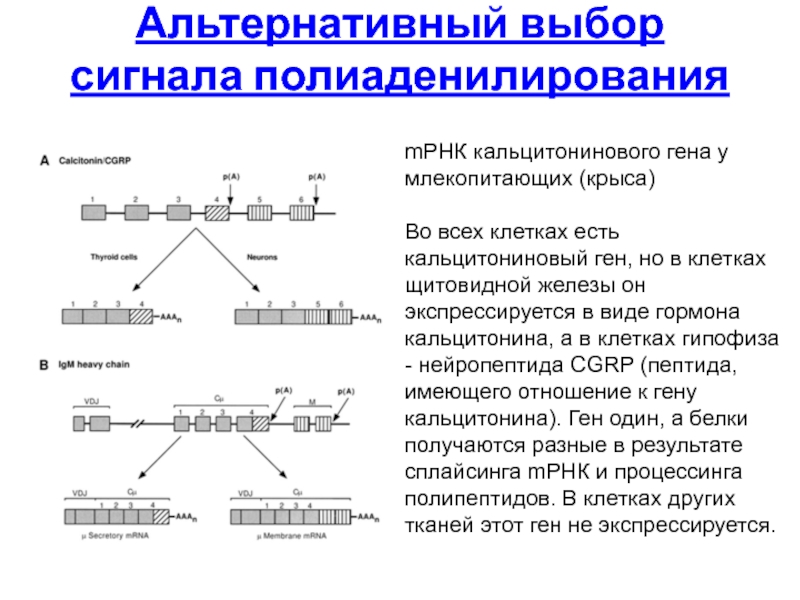
- 113. Альтернативный выбор сигнала полиаденилирования mРНК кальцитонинового
- 114. Структура мРНК прокариот Лидер - это
- 115. Строение мРНК эукариот 5’-кэп- 7метил-гуанозин Лидер
Слайд 1План проекта:
1. Нуклеиновые кислоты: структура и функции
2. Биосинтез ДНК
3. Молекулярные механизмы
4. Биосинтез молекул РНК. Транскрипция в клетках прокариот и эукариот
5. Процессинг РНК в клетках прокариот и эукариот
Слайд 21. Нуклеиновые кислоты: структура и функции
Основные положения молекулярной биологии
Доказательства генетической роли
Пурины и пиримидины
Химический состав нуклеиновых кислот.
Структура нуклеиновых кислот
Модель строения ДНК
Цепи в ДНК комплементарны и антипараллельны
Биологические функции ДНК
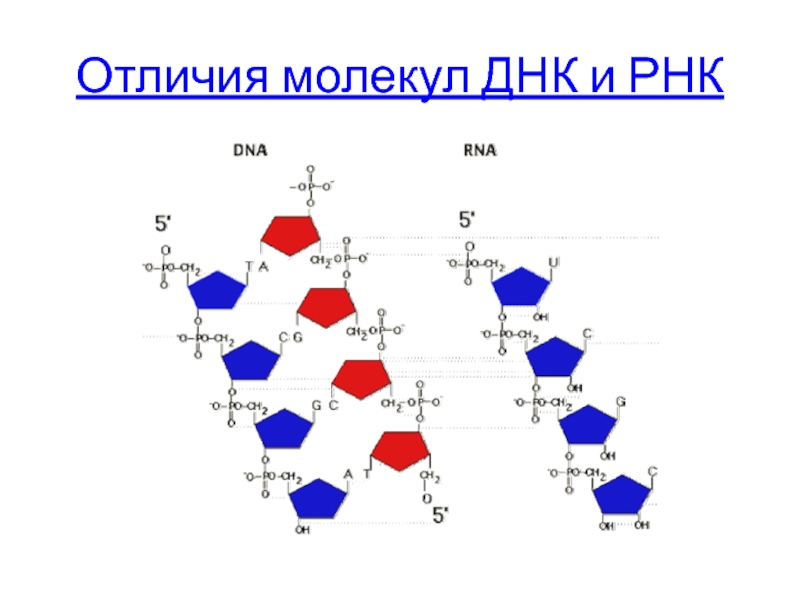
Отличия молекул ДНК и РНК
Слайд 3Основные положения молекулярной биологии:
ДНК - носитель генетической информации, реплицируется по принципу
РНК синтезируется на матрице ДНК, копируя определенный участок (ген)
Белок синтезируется на матрице РНК, последовательность аминокислот в белке определяется последовательностью нуклеотидов в мРНК
Слайд 4Доказательства генетической роли ДНК
Открытие нуклеиновых кислот –Ф.Мишер, 1869.
Трансформация бактерий – Ф.Гриффитс,
1944 г. - О. Эйвери, К. Мак-Леод и М. Мак-Карти доказали, что ДНК является генетическим материалом бактерий
1952 г – А. Херши и М. Чейз доказали, что ДНК является генетическим материалом бактериофагов
Слайд 5Химический состав нуклеиновых кислот.
ДНК и РНК – линейные полимеры, состоят из
мономеры ДНК - дезоксирибонуклеотиды
мономеры РНК - рибонуклеотиды
Слайд 9Первичная структура нуклеиновых кислот (ДНК и РНК)
определяется последовательностью нуклеотидов в полинуклеотидной
Нуклеотиды соединяются с помощью ковалентных 3’, 5’- фосфодиэфирных связей
за направление полинуклеотидной цепи принято направление от 5’ → к 3’-концу
Слайд 10Правила Э.Чаргаффа
количество пуриновых оснований (A+Г) в молекуле ДНК всегда равно количеству
количество аденина равно количеству тимина [А=Т, А/Т= 1]; количество гуанина равно количеству цитозина [Г=Ц, Г/Ц=1];
соотношение (Г+Ц)/(А+Т)=К, где К - коэффициент специфичности, является постоянным для каждого вида живых организмов
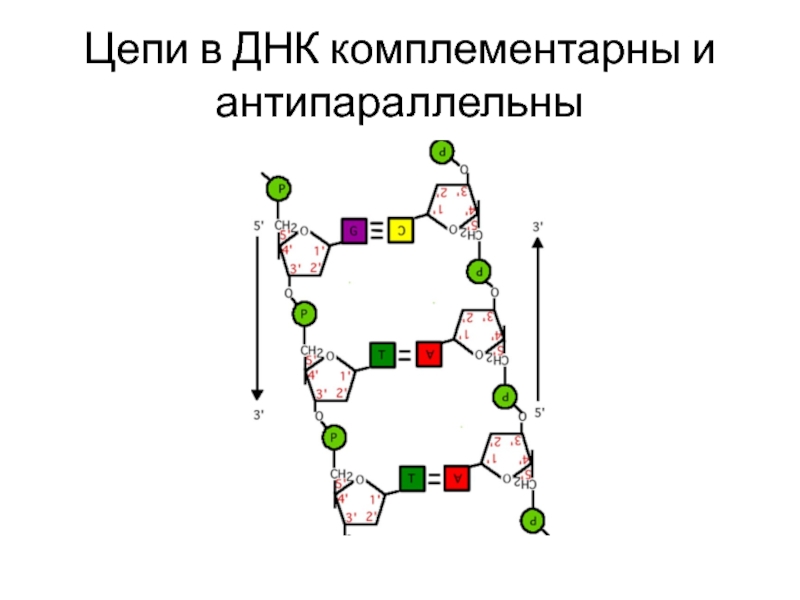
Слайд 12Цепи в ДНК комплементарны и антипараллельны
две цепи ДНК закручены в спираль
Цепи комплементарны и антипараллельны
основания находятся внутри молекулы ДНК,
снаружи находится сахаро-фосфатный скелет
диаметр спирали - 2 нм, каждые 10 п.н. составляют один виток спирали
Расстояние между нуклеотидами – 0,34 нм
Один виток спирали – 3,4 нм
Слайд 14Химические связи, стабилизирующие вторичную структуру ДНК:
Водородные связи – образуются между комплементарными
Стэкинг-взаимодействия – это гидрофобные связи, которые образуются между плоскими основаниями, которые расположены друг на другом в одной цепи ДНК
Слайд 15Биологические функции ДНК
Хранение генетической информации
Передача генетической информации
Реализация генетической информации
Изменение генетической информации
Слайд 192. Биосинтез ДНК
Полуконсервативный механизм репликации
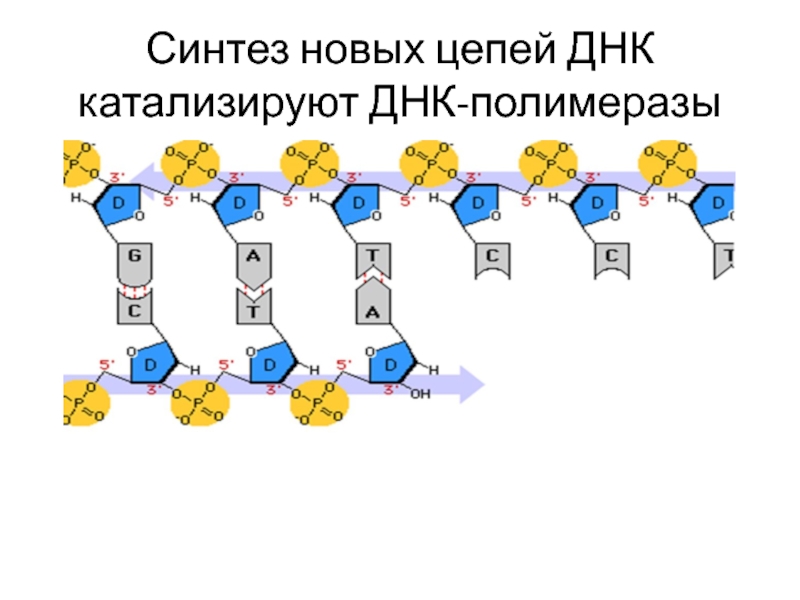
Синтез новых цепей ДНК катализируют ДНК-полимеразы
Реакция полимеризации
Этапы синтеза ДНК
Репликация. Репликон.
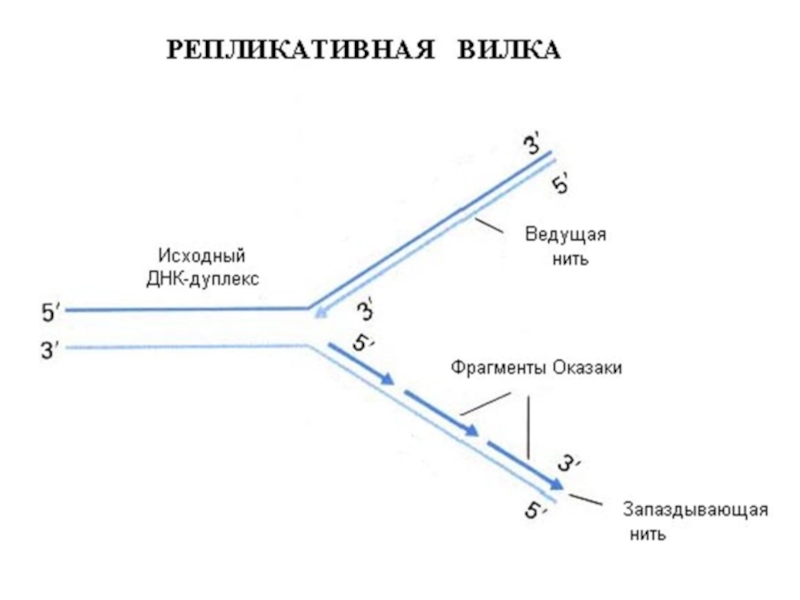
Синтез фрагмента Оказаки
Окончание синтеза ДНК
Синтез теломерных участков ДНК
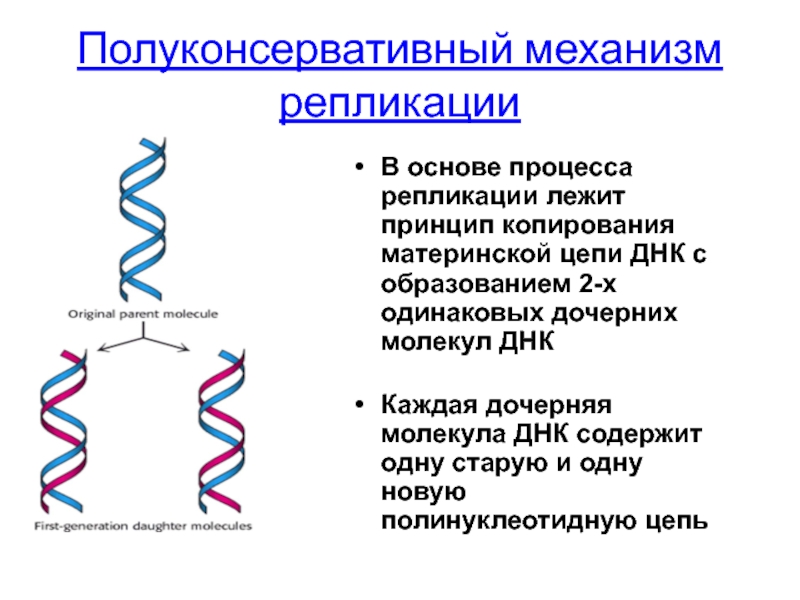
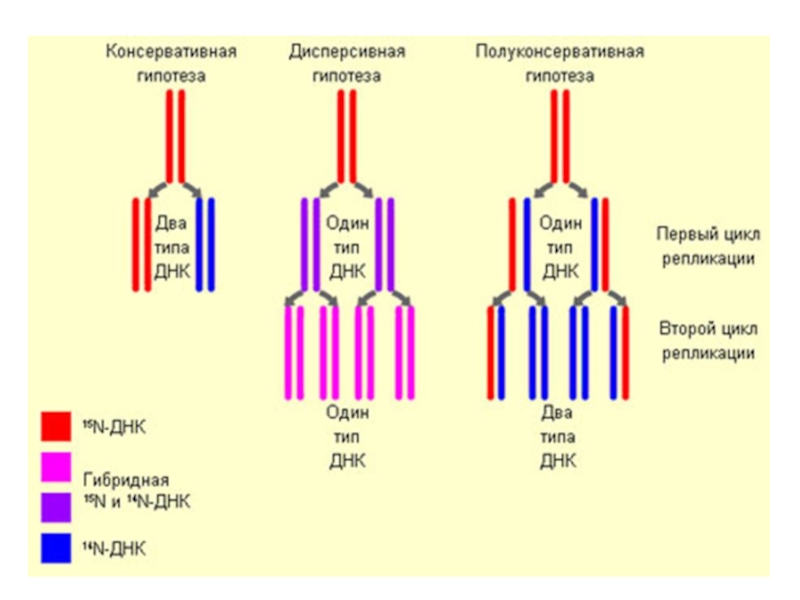
Слайд 20Полуконсервативный механизм репликации
В основе процесса репликации лежит принцип копирования материнской цепи
Каждая дочерняя молекула ДНК содержит одну старую и одну новую полинуклеотидную цепь
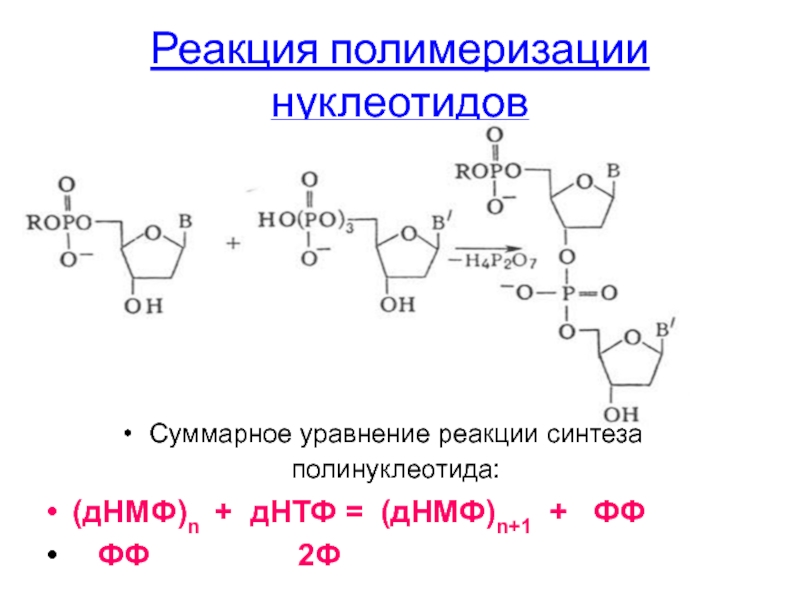
Слайд 23Реакция полимеризации нуклеотидов
Суммарное уравнение реакции синтеза полинуклеотида:
(дНМФ)n + дНТФ =
ФФ 2Ф
Слайд 24ДНК-полимеразы имеют 2 субстрата:
комплекс матрица-затравка и
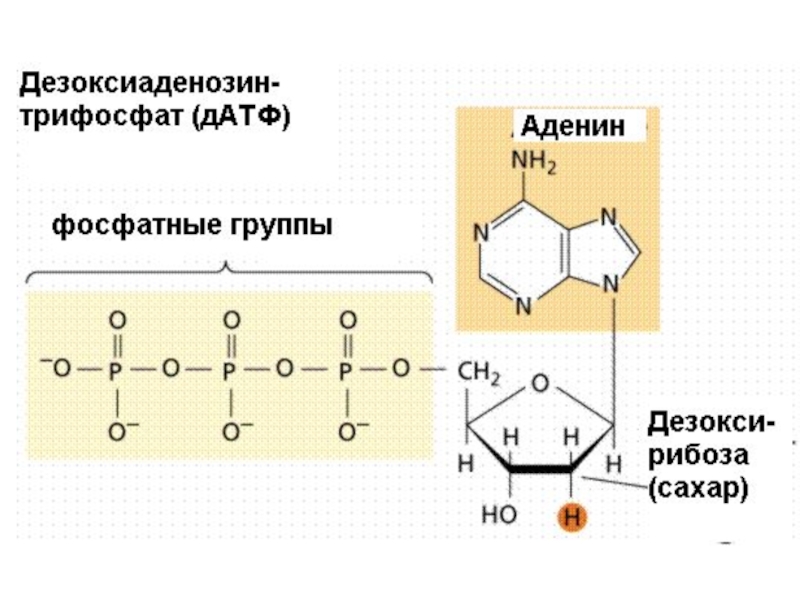
дНТФ (дезокси-нуклеозидтрифосфаты): дАТФ, дГТФ, дЦТФ,
Субстрат – это вещество, на которое действует фермент
Слайд 25Этапы синтеза ДНК
Инициация – образование комплекса матрица – затравка
Полимеризация – синтез
Терминация – окончание синтеза ДНК
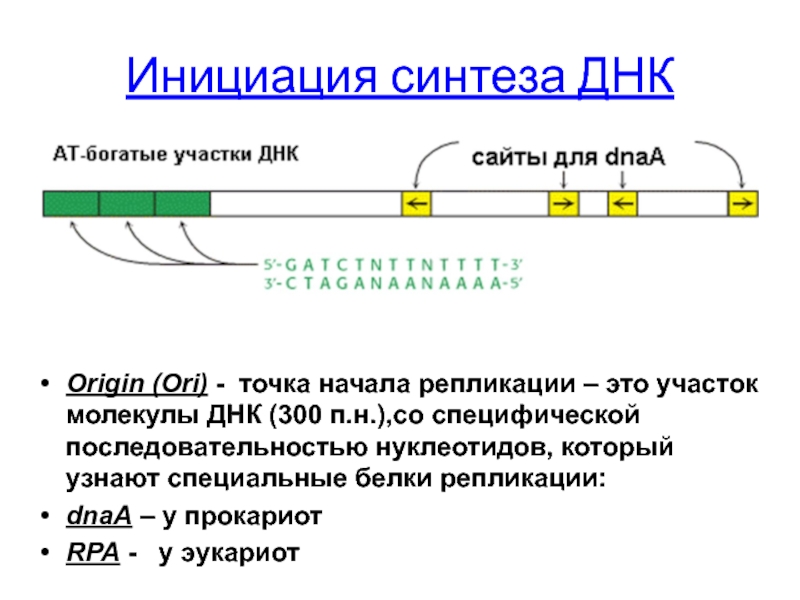
Слайд 26Инициация синтеза ДНК
Origin (Ori) - точка начала репликации – это участок
dnaA – у прокариот
RPA - у эукариот
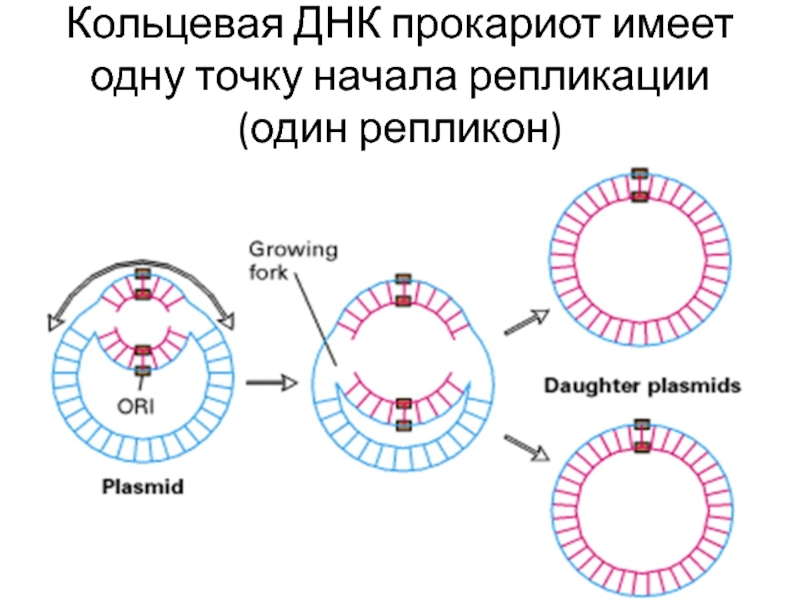
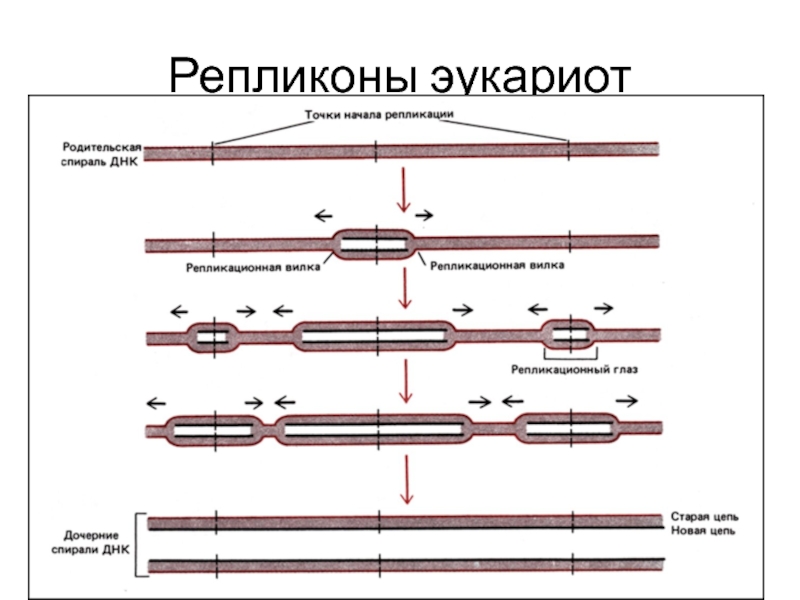
Слайд 27Репликон – фрагмент молекулы ДНК от одной точки начала репликации до
Геном прокариот содержит один репликон
Геномы эукариот – сотни и тысячи репликонов
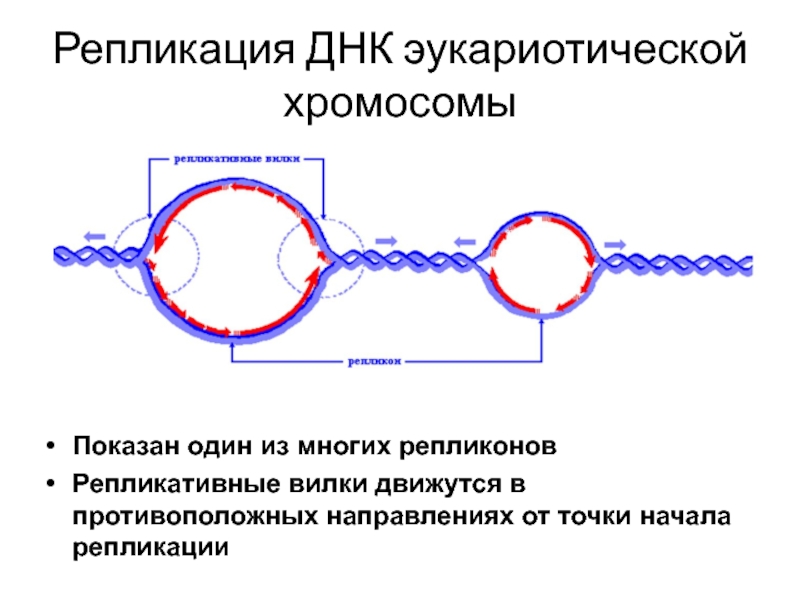
Слайд 30Репликация ДНК эукариотической хромосомы
Показан один из многих репликонов
Репликативные вилки
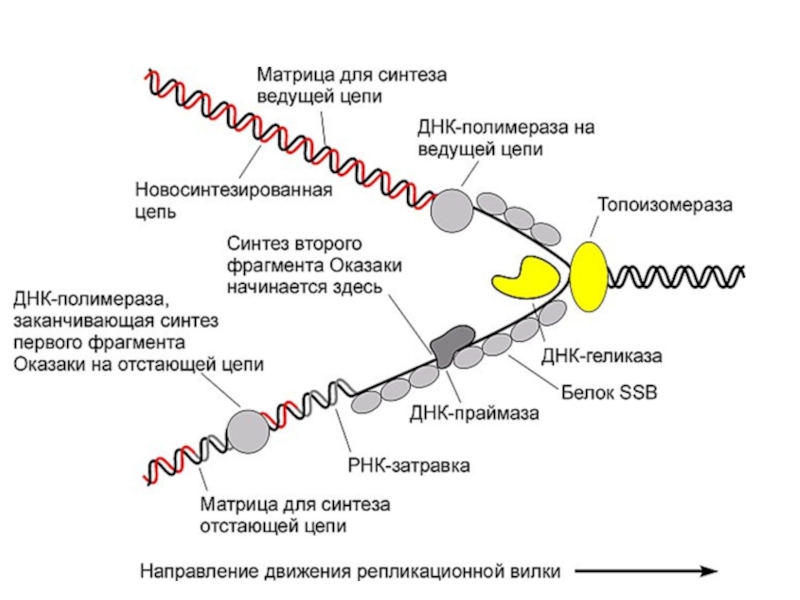
Слайд 32Образование комплекса матрица-затравка
ДНК-полимеразы не могут начать инициацию синтеза новой цепи на
Праймаза синтезирует РНК-праймер (primer),
ДНК-полимераза использует 3’-конец праймера для синтеза новой цепи ДНК
После окончания синтеза ДНК РНК-праймер удаляется с помощью экзонуклеаз
Слайд 36ДНК-полимеразы прокариот
ДНК полимераза I:
Удаляет РНК-праймеры (5’- 3’-экзонуклеазная активность)
Застраивает пробелы цепочкой ДНК
Коррегирующая 3’-5’- экзонуклеазная активность
Слайд 37Окончание синтеза ДНК
РНК-полимераза I (прокариот), (РНКазаН у эукариот) - удаляет РНК-праймеры
ДНК-лигаза
теломераза - синтез теломерных участков хромосом эукариот
Слайд 40ДНК- полимеразы эукариот
Полимеразы α и δ осуществляют инициацию (α) и элонгацию
Полимеразы β и ζ – участвуют в репарации ДНК
Полимераза γ –синтез мтДНК
Полимераза ε – возможно синтез отстающей цепи ДНК
Слайд 423. Молекулярные механизмы генных мутаций. Репарация ДНК
Типы генных мутаций
Мутация со сдвигом
Мутации типа замены оснований
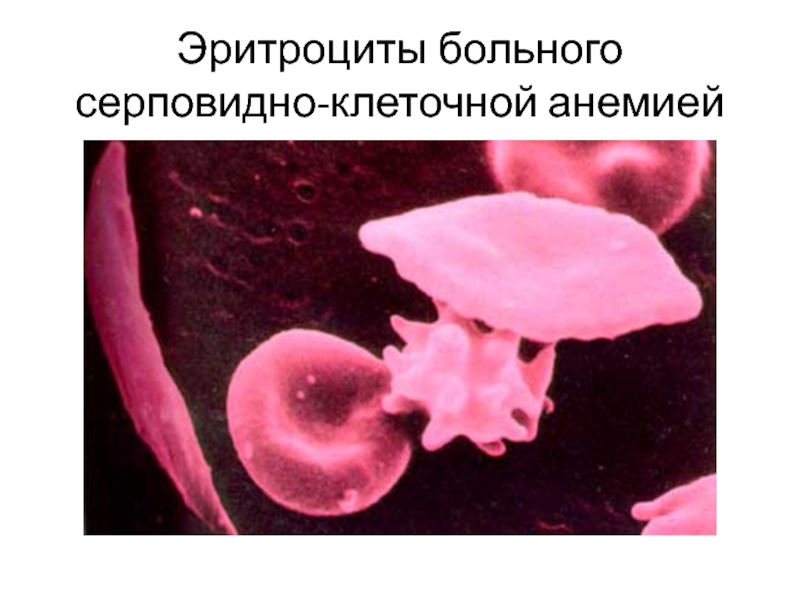
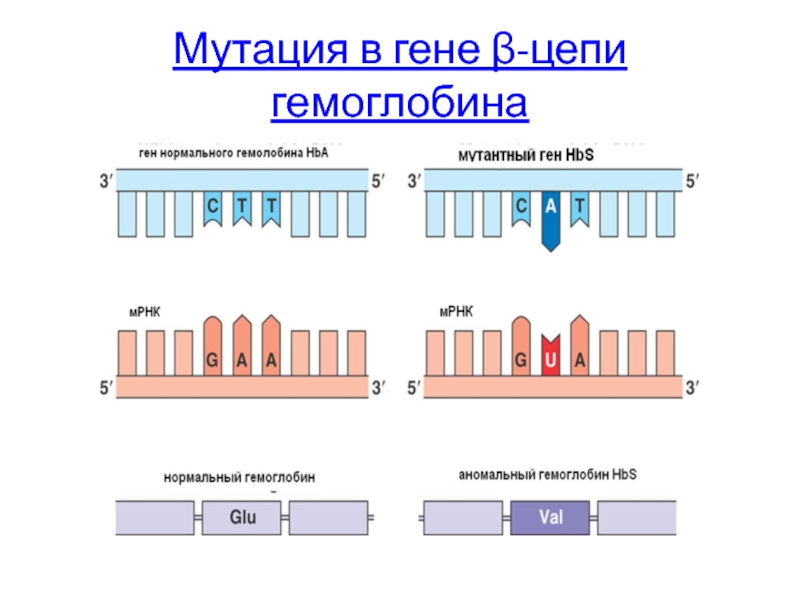
Мутация в гене β-цепи гемоглобина
Факторы, индуцирующие мутации, называются мутагены
Действие на ДНК ионизирующего излучения
Основные механизмы репарации
Молекулярные механизмы генных мутаций
Нарушения системы репарации ДНК
Болезни экспансии тринуклеотидов
Слайд 43Основные понятия:
Мутации - стойкие изменения структуры ДНК по сравнению с геномной
Генные мутации – изменение последовательности нуклеотидов в пределах гена
Хромосомные мутации - изменение структуры или количества хромосом в клетке
Мутон – наименьший участок ДНК, изменение которого приводит к мутации
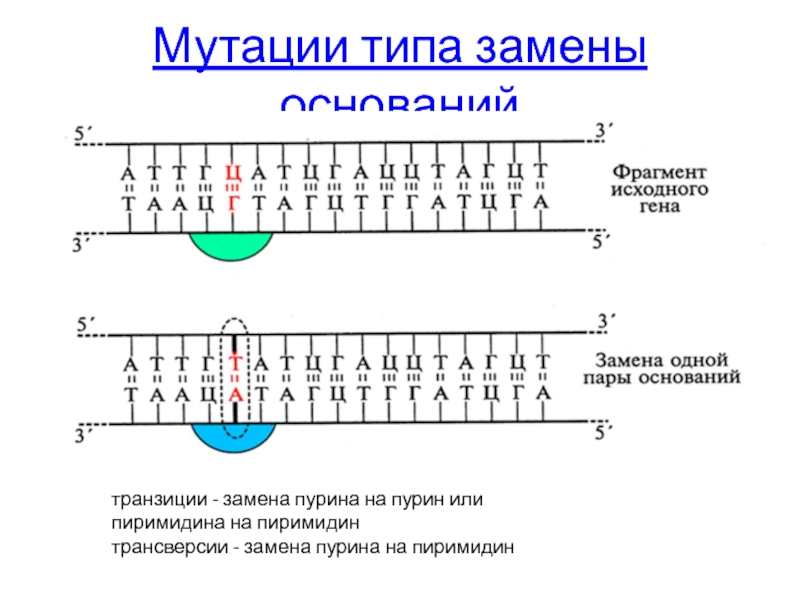
Слайд 46Мутации типа замены оснований
транзиции - замена пурина на пурин или пиримидина
трансверсии - замена пурина на пиримидин
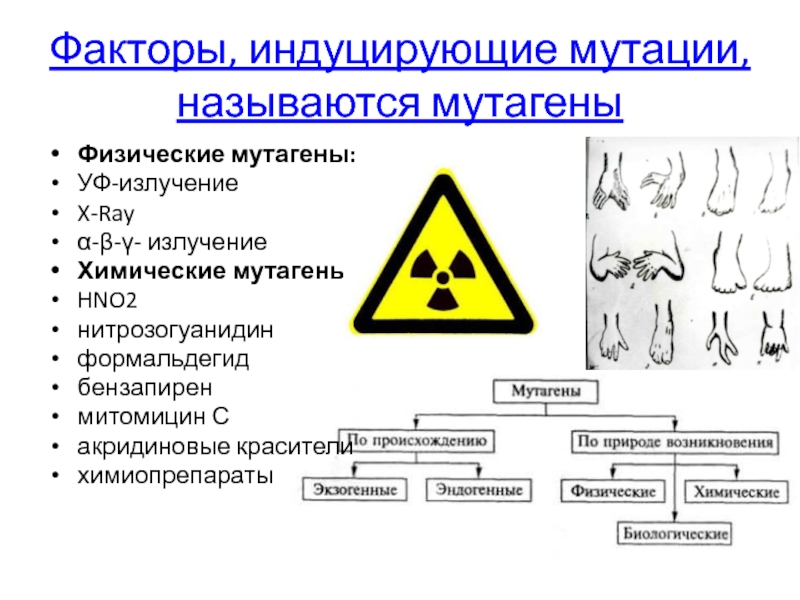
Слайд 49Факторы, индуцирующие мутации, называются мутагены
Физические мутагены:
УФ-излучение
X-Ray
α-β-γ- излучение
Химические мутагены:
HNO2
нитрозогуанидин
формальдегид
бензапирен
митомицин С
акридиновые красители
химиопрепараты
Слайд 52Молекулярные механизмы генных мутаций
Образование пиримидиновых димеров
Включение в ДНК
Явление таутомеризации
Некоторые типы повреждений ДНК: апуринизация - разрыв гликозидных связей между пурином и д-рибозой, образуется пробел в цепи ДНК (АP-сайт) – результат: делеция нуклеотида, Дезаминирование - потеря аминогруппы:цитозин в урацил, (алкилирование) - присоединение метильной группы к азотистому основанию –результат:
гуанин превращается в О6 - метилгуанозин (аналог аденина) - пара Г-Ц замещается на Т-А
Слайд 53Основные механизмы репарации:
Репарация - это свойство живых организмов восстанавливать повреждения ДНК,
Прямое восстановление исходной структуры ДНК. Репарация без репликации
Эксцизионная репарация: вырезание поврежденного основания или вырезание поврежденного участка ДНК
Репарация неспаренных оснований
SOS-индуцированная репарация
Пострепликативная репарация
Слайд 54Прямое восстановление структуры ДНК:
Прямая метилтрансферазная реактивация :
Корректирует метилирование оснований с
Фотореактивация
необходим фермент фотолиаза и видимый свет
корректирует тиминовые димеры без вырезания ДНК
*Система обнаружена у бактерий и растений, у млекопитающих не обнаружена.
Слайд 60SOS - индуцированная репарация
Повреждения ДНК достигают критического уровня
синтезируется белок RecA
Он связывается
Начинается синтез белков, которые осуществляют SOS-репарацию
Слайд 61Нарушения системы репарации ДНК - причина наследственных болезней
Пигментная ксеродерма (XP) -
Синдром Вернера - мутации гена WRN (8p12) приводят к неправильной репарации (быстрое старение, риск развития диабета и рака)
Синдром Линча - мутации генов hMSH2 hMLH1 приводят к нарушениям системы репарации неспаренных нуклеотидов (развитие рака прямой кишки)
*Нарушение системы репарации приводит к нестабильности генома и развитию онкологических заболеваний.
Слайд 62Болезни экспансии тринуклеотидов
Хорея Хантингтона - аутосомно-доминантное заболевание с поздней манифестацией (после
У здоровых людей ген хантигтин содержит от 8 до 31 повтора триплета ЦАГ, у больных - от 36 до 80
добавление триплетов ЦАГ приводит к синтезу аномального белка хантигтина, который вызывает апоптоз клеток мозга, нарушениям ЦНС и смерти
Слайд 634. Биосинтез молекул РНК. Транскрипция в клетках прокариот и эукариот
Этапы экспрессии
Принципы синтеза РНК на ДНК-матрице
Этапы транскрипции
РНК-полимераза прокариот
Стадии инициации транскрипции
Элонгация
Терминация транскрипции прокариот
РНК-полимеразы эукариот
Инициация транскрипции
образование базового транскрипционного комплекса
Транскрипционный цикл
Слайд 68Этапы транскрипции
Связывание ДНК-матрицы – узнавание промотора, образование открытого двойного комплекса
Инициация –
Элонгация – продолжение синтеза РНК
Терминация – завершение синтеза РНК
Слайд 69РНК-полимераза прокариот
Кор фермент α2ββ’ обладает полимеризующей активностью
σ – фактор – обеспечивает
Полный фермент –холофермент (Mg2+ ) α2ββ’σ
Слайд 70Структура промоторов генов прокариот
Промотор – специфическая последовательность ДНК, необходимая для образования
-10 последовательность - ТАТААТ (блок Прибнова)
-35 последовательность - ТТГАЦА
Стартовая точка (+1) – нуклеотид, с которого начинается синтез РНК
Слайд 71Стадии инициации транскрипции:
образование «закрытого» комплекса,
образования «открытого двойного» комплекса (с
образования «открытого тройного» комплекса (синтез коротких РНК без диссоциации σ-фактора)
После синтеза фрагмента РНК (9-12 нуклеотидов) σ-фактор покидает промотор и начинается стадия элонгации
Слайд 75
Терминация транскрипции прокариот
Терминация транскрипции прокариот может происходить двумя способами:
терминатор – это специфическая последовательность ДНК, на которой происходит терминация транскрипции
Слайд 76ρ-независимая терминация транскрипции
На схеме показан 3’-конец молекулы РНК
После прохождения терминатора молекула
наименее стабильный уридил-адениловый дуплекс (выделен розовым цветом) разрушается
Слайд 77ρ-зависимая терминация транскрипции
Rho (ρ)-фактор – специальный белок терминации транскрипции
Во время синтеза
Когда r-фактор “догоняет” РНК-полимеразу происходит терминация транскрипции
Слайд 78Рифампицин ингибирует инициацию транскрипции прокариот
Рифампицин блокирует боковой проход РНК-полимеразы для трифосфатов.
Слайд 80РНК-полимеразы эукариот
РНК-полимераза I – синтез рРНК (28S, 18S и 5,8S рРНК)
РНК-полимераза
РНК-полимераза III – синтез тРНК, 5S рРНК, некоторых мяРНК
РНК-полимераза митохондрий – состоит из одной субъединицы, ген которой находится в ядерной ДНК
Слайд 81Amanita phalloides синтезирует α – аманитин, к которому чувствительна РНК-полимераза II
Amanita phalloides
Слайд 82Для инициации синтеза РНК у эукариот необходимы
Специфические белки – факторы
Регуляторные последовательности ДНК (цис-элементы) – промоторы, энхансеры и сайленсеры
Слайд 83Универсальные последовательности промоторов класса II
ТАТА-бокс (-25 п.н.) (блок Хогнесса)
ЦААТ-боксы (-
ГЦ-мотивы (-300 п.н.)
Классический промотор класса II содержит ТАТА-бокс последовательность ТАТААА (блок Хогнесса)-, – точно определяют точку начала транскрипции.
Слайд 84Инициация транскрипции
в зоне ТАТА-бокса должны собраться факторы транскрипции TFII (Transcriptional Factors
TFIIA, TFIIB, TFIID, TFIIE, TFIIF и TFIIH
первым с ДНК связывается белок TFIID
TFIID – это комплекс белков, в состав которого входит белок TBP и TAF белки
Слайд 85образование базового транскрипционного комплекса
факторы транскрипции связываются с промотором в зоне ТАТА-бокса
TFIIА, TFIIВ, TFIIF
Затем присоединяется РНК-пол. II и TFIIE
TFIIH присоединяется последним и фосфорилирует РНК-полимеразу
Для инициации транскрипции генов эукариот необходимы многочисленные белки – факторы транскрипции. Поверхность белка ТВР обеспечивает связывание промотора с другими компонентами. Другие факторы транскрипции собираются в определенной последовательности: TFIIА, TFIIВ, TFIIF. Затем присоединяются РНК-полимераза II и TFIIE, образуя основной транскрипционный комплекс.
Слайд 86Ключевым моментом инициации является узнавание ТАТА-бокса белком TBP
Белок TBP (TATA Binding
TBP связывается с ТАТА боксом в 100000 раз прочнее, чем с другими последовательностями ДНК
Это связывание индуцирует пространственные изменения в молекуле ДНК.
Слайд 87Белок TBP (TATA Binding Protein) обеспечивает изменение структуры ДНК
Двойная спираль частично
ДНК связывается с вогнутой поверхностью белка.
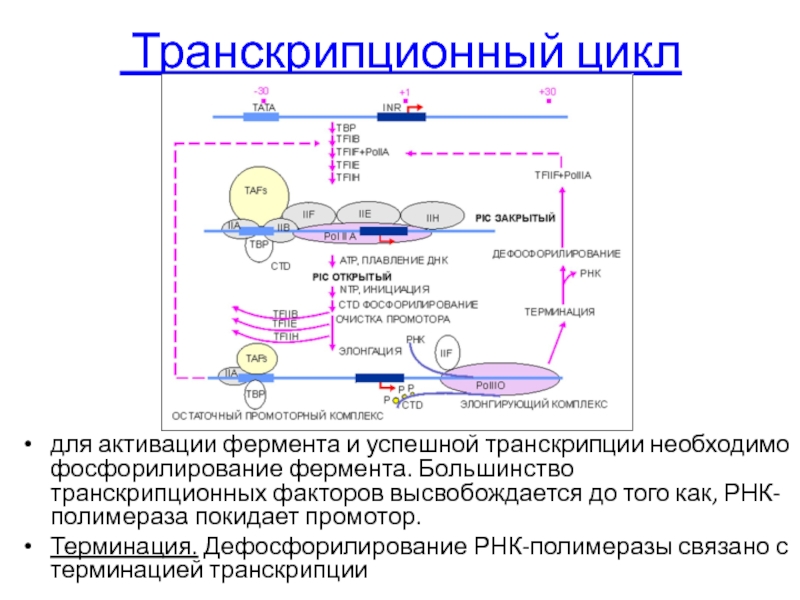
Слайд 88 Транскрипционный цикл
для активации фермента и успешной транскрипции необходимо фосфорилирование фермента.
Терминация. Дефосфорилирование РНК-полимеразы связано с терминацией транскрипции
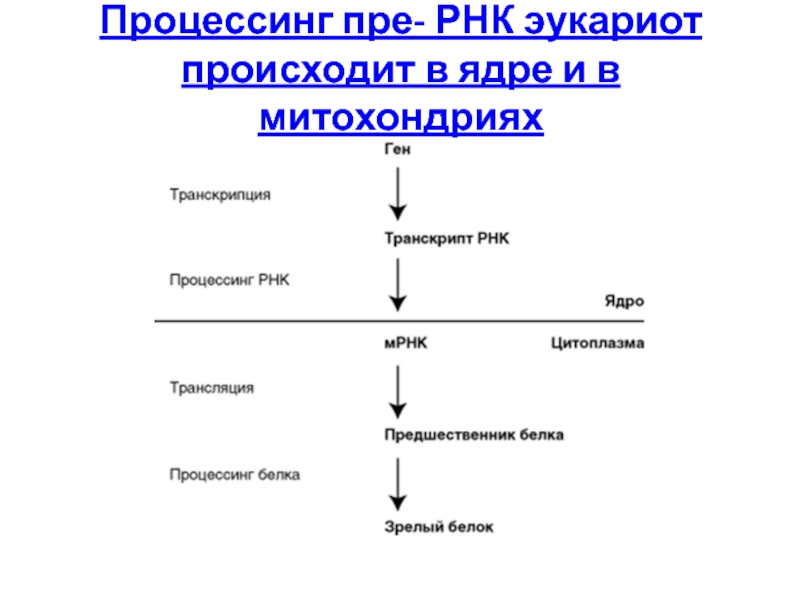
Слайд 895. Процессинг РНК в клетках прокариот и эукариот
Этапы реализации генетической информации
Процессинг
Процессинг рРНК и тРНК
Экзон
Этапы экспрессии генов эукариот
Полиаденилирование
Механизмы сплайсинга интронов:
Механизмы альтернативного сплайсинга:
Альтернативный выбор сигнала полиаденилирования
Слайд 90Этапы реализации генетической информации
Транскрипция – синтез молекул РНК, образование первичного транскрипта
Процессинг –модификация первичного транскрипта (пре-РНК) и образование зрелых молекул РНК
Слайд 92Процессинг РНК в клетках прокариот
Ген – это участок молекулы ДНК, кодирующий
Цистрон – участок молекулы мРНК, который кодирует синтез одной полипептидной цепи
Молекулы мРНК прокариот полицистронны, т.е. они служат матрицей для одновременного синтеза нескольких полипептидов
мРНК прокариот не процессируются
мРНК прокариот обычно являются Полицистронными , т.е. включают в себя последовательности нуклеотидов нескольких генов одного оперона мРНК бактерий при выполнении функций матричных РНК в трансляции не требуют разбиения на последовательности отдельных генов и могут транслироваться непосредственно рибосомами с образованием функционально активных белков
Слайд 93Процессинг рРНК и тРНК
Зрелые молекулы рРНК и тРНК образуются у прокариот
У эукариот в некоторых случаях вырезаются интроны из пре-рРНК и пре-тРНК
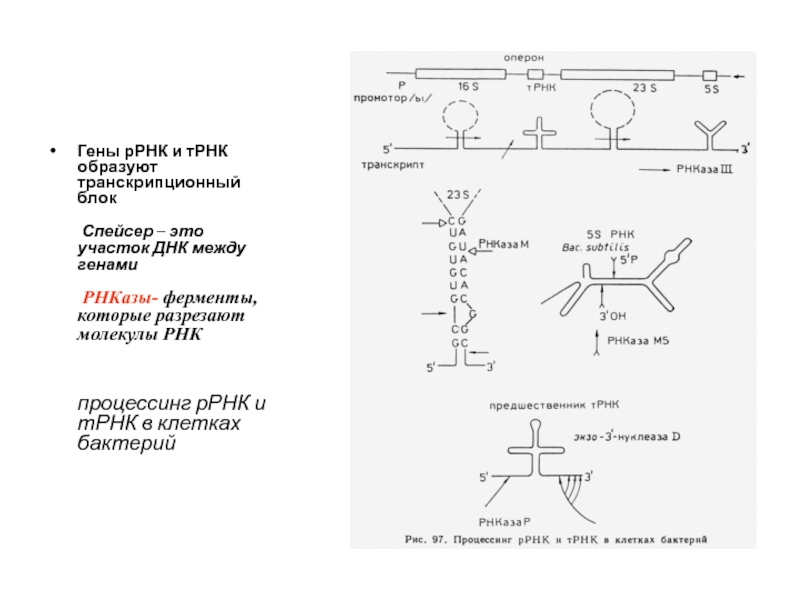
Слайд 94
Гены рРНК и тРНК образуют транскрипционный блок
Спейсер – это
Слайд 95Процессинг тРНК и рРНК у прокариот
Молекулы 5S, 16S и 23S рРНК
РНКаза III участвует в процессинге пре- рРНК у бактерий,
В процессинге пре- тРНК у бактерий участвует РНКаза P и РНКаза D
РНКаза Р является рибозимом, т.к. содержит собственную РНК, которая обладает эндонуклеазной активностью.
Некоторые РНК могут катализировать химические реакции
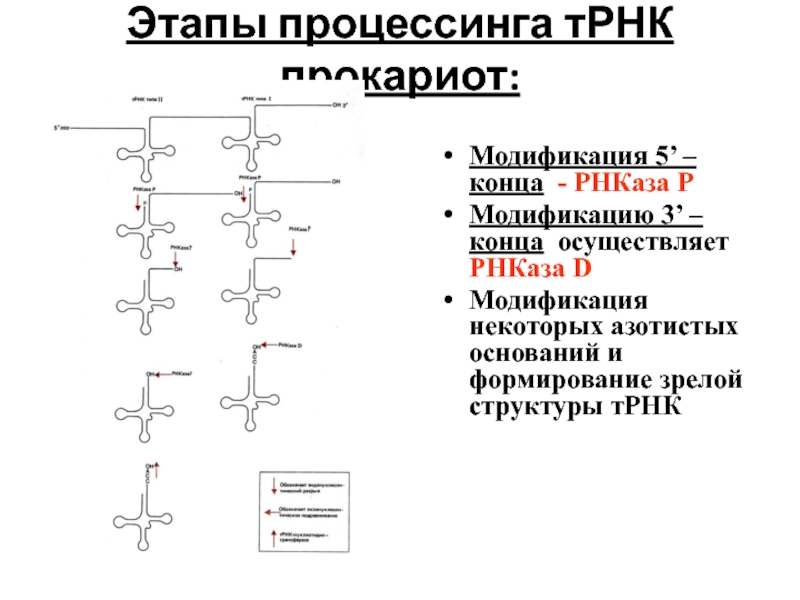
Слайд 96Этапы процессинга тРНК прокариот:
Модификация 5’ – конца - РНКаза Р
Модификацию 3’
Модификация некоторых азотистых оснований и формирование зрелой структуры тРНК
Слайд 97Этапы процессинга тРНК дрожжей (эукариоты)
Удаление интрона
Вырезание 5’ конца (лидер)
Удаление УУ с
Присоединение ЦЦА к 3’концу -тРНК
Модификация азотистых оснований
Слайд 98Процессинг рРНК эукариот
Транскрипционный блок содержит гены 18S ; 5,8S; 28S -
три зрелые молекулы рРНК образуются при расщеплении спейсеров эдонуклеазой
Некоторые эукариоты содержат интрон в 28S пре- рРНК, который вырезается (аутосплайсинг) и образуется 26S рРНК
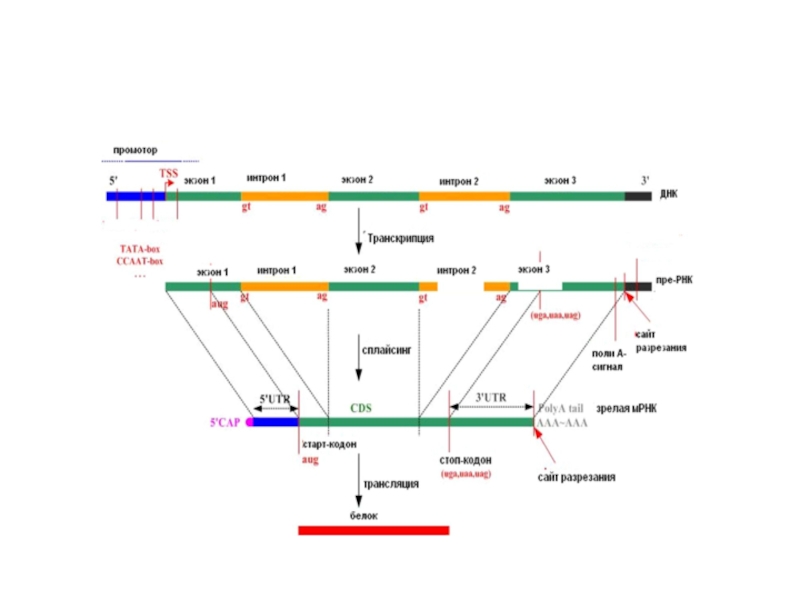
Слайд 99Экзон-интронная структура генов эукариот
Структура α- и β-глобиновых генов
Экзон-интронная структура характерна для
Экзоны (тёмно-красный цвет ), разделены интронами (голубой цвет). Цифры над генами указывают аминокислотные остатки кодируемого полипептида.
5’- 3’- не транслируемые области содержатся в первом и последнем экзонах (розовый цвет). Они присутствуют в зрелой мРНК, но не транслируются.
Слайд 100Этапы процессинга пре - мРНК эукариот
Кэпирование - модификация 5’-конца
Полиаденилирование - модификация
Сплайсинг - удаление интронов и соединение экзонов
Слайд 103Модификация 5’-конца – кэпирование
Кэп – это 7-метил-гуанозин соединенный в 5’-5’-ориентации
Кэп присоединяется с помощью фермента гуанозил-7-метилтрансферазы к первому 5’-трифосфату мРНК сразу после транскрипции с помощью особой 5’ - 5’- связи
Слайд 105Модификация 3’-конца – полиаденилирование
Последовательность ААУААА служит сигналом полиаденилирования
Специальная эндонуклеаза
Фермент поли(А)-полимераза добавляет 100 – 200 адениловых нуклеотидов к 3’-концу мРНК, образуя поли(A) «хвост»
Слайд 106Механизмы сплайсинга интронов:
Тип I - интроны подвергаются аутосплайсингу в присутствии только
Тип II – интроны подвергаются аутосплайсингу и имеют концевые последовательности 5’-GU_ AG-3’ (некоторые РНК митохондрий у дрожжей)
Тип III - интроны мРНК, имеющие концевые последовательности 5’GU_ AG3’, подвергаются сплайсингу в ядре с участием мяРНК
Слайд 108Последовательности интронов, необходимые для сплайсинга 5'- GU и 3'- AG
Показаны два
На границе экзон-интрон находятся последовательности GU – AG
Для вырезания интронов также необходим сайт ветвления – А
Слайд 109Сплайсинг ядерной мРНК происходит в сплайсосоме
Сплайсосома - специальная ядерная структура, в
В состав сплайсосомы входят мяРНК (U1, U2, U4, U5 и U6) 145 молекул белков
Слайд 111Механизмы альтернативного сплайсинга:
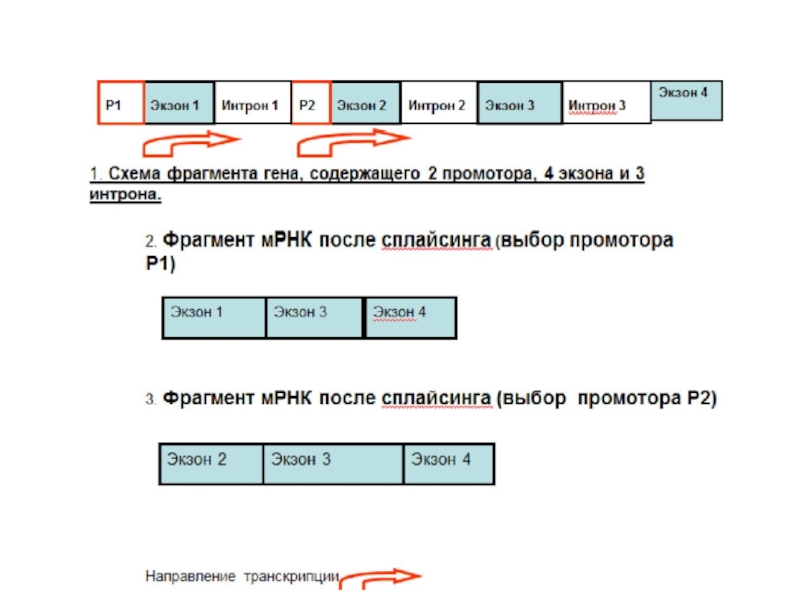
Альтернативный выбор промотора
Альтернативный выбор сигнала полиаденилирования
Альтернативный выбор разных наборов
Транс-сплайсинг
Слайд 113Альтернативный выбор сигнала полиаденилирования
mРНК кальцитонинового гена у млекопитающих (крыса)
Во всех клетках
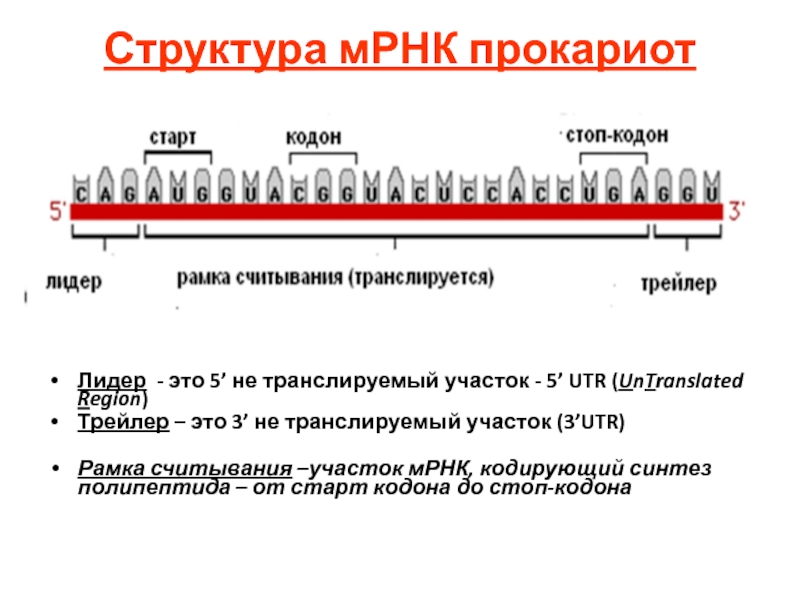
Слайд 114Структура мРНК прокариот
Лидер - это 5’ не транслируемый участок - 5’
Трейлер – это 3’ не транслируемый участок (3’UTR)
Рамка считывания –участок мРНК, кодирующий синтез полипептида – от старт кодона до стоп-кодона
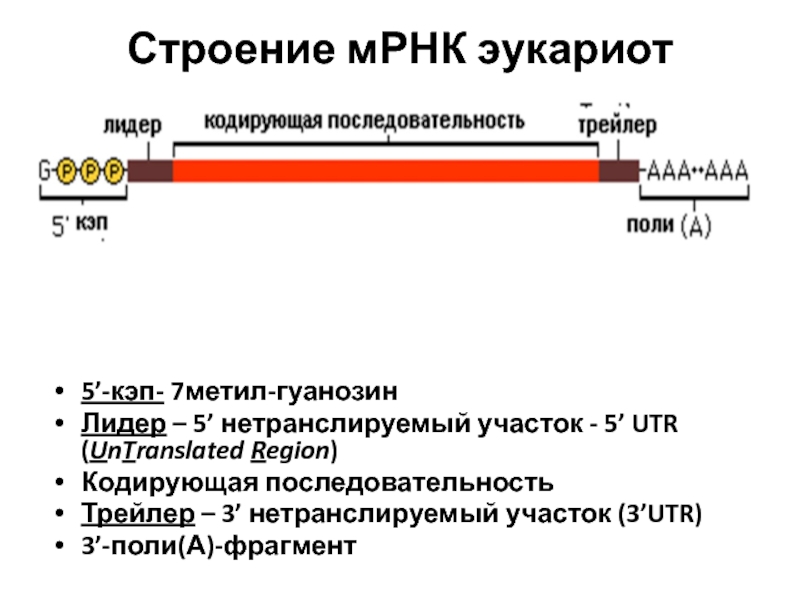
Слайд 115Строение мРНК эукариот
5’-кэп- 7метил-гуанозин
Лидер – 5’ нетранслируемый участок - 5’ UTR
Кодирующая последовательность
Трейлер – 3’ нетранслируемый участок (3’UTR)
3’-поли(А)-фрагмент