- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Моторные белки презентация
Содержание
- 1. Моторные белки
- 2. ОТКРЫТИЕ КИНЕЗИНА – НАЧАЛО НОВОЙ ЭРЫ ИССЛЕДОВАНИЙ
- 3. Кинезины (Kinesins)
- 4. МИОЗИН II ИЗ СКЕЛЕТНЫХ МЫШЦ шея
- 5. СЕМЕЙСТВО МИОЗИНОВ – 17 классов Моторный домен
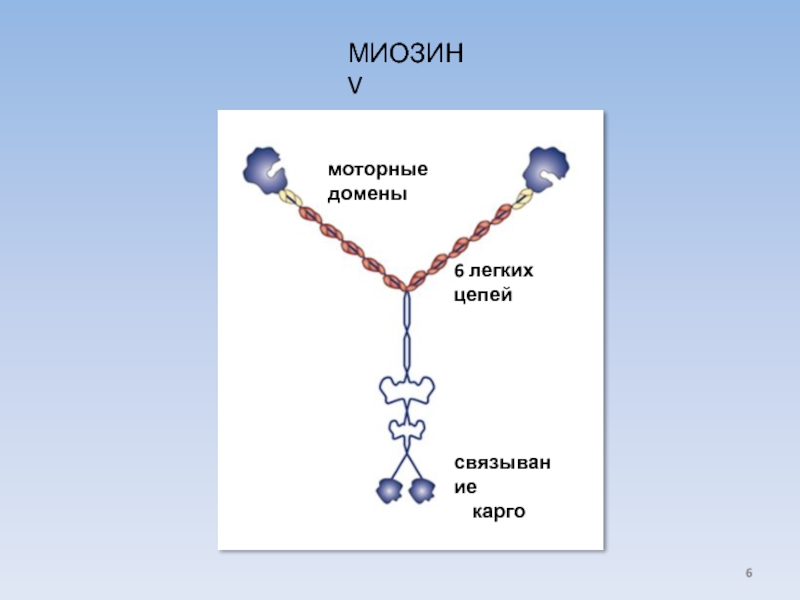
- 6. МИОЗИН V моторные домены 6 легких цепей связывание карго
- 7. МОЛЕКУЛА КИНЕЗИНА-1 - ГЕТЕРОТЕТРАМЕР легкие цепи
- 9. КИНЕЗИНЫ: ДОМЕННАЯ СТРУКТУРА кинезин-1 Моторный домен:
- 10. МОТОРНЫЕ ДОМЕНЫ КИНЕЗИНА И МИОЗИНА Нуклеотид-связывающий
- 11. МЕХАНОХИМИЧЕСКИЙ ЦИКЛ МЫШЕЧНОГО
- 12. Ron Vale’s lab
- 13. МЕХАНОХИМИЧЕСКИЙ ЦИКЛ
- 14. (Ron Vale’s lab)
- 15. ЦИТОПЛАЗМАТИЧЕСКИЙ ДИНЕИН: АТФаза ААА+ легкие цепи
- 16. СЕМЕЙСТВО ДИНЕИНОВ 7 классов на основе
- 17. реснички и
- 18. микротрубочка моторный домен динеина моторный домен
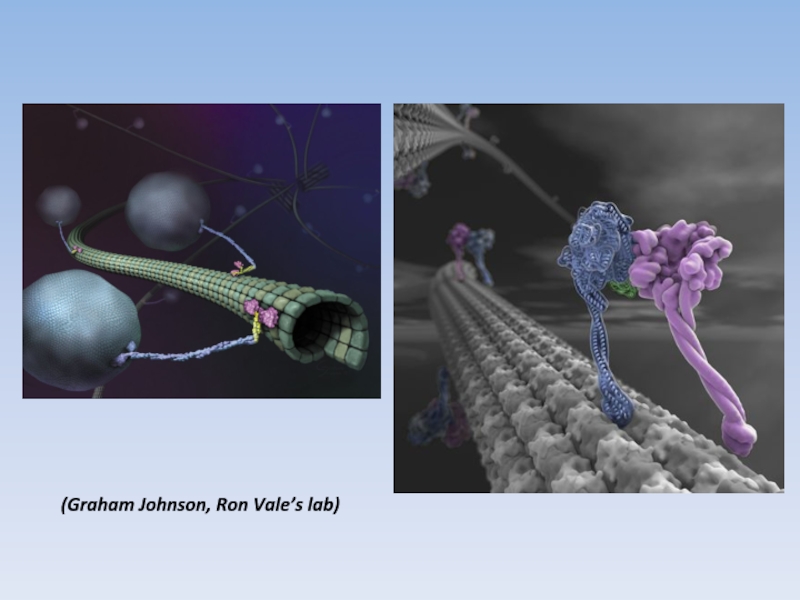
- 19. (Graham Johnson, Ron Vale’s lab)
- 20. СПОСОБЫ ИЗУЧЕНИЯ МОТОРНЫХ БЕЛКОВ Электронная
- 21. КАК РАБОТАЮТ МОЛЕКУЛЯРНЫЕ МОТОРЫ? Происходит ли изменение
- 22. МОЛЕКУЛЯРНЫЙ ДОКИНГ МИОЗИНА НА ФИЛАМЕНТЕ АКТИНА
- 23. МОЛЕКУЛЯРНЫЙ ДОКИНГ КИНЕЗИНА НА МИКРОТРУБОЧКЕ А –
- 24. АТОМНО-СИЛОВАЯ МИКРОСКОПИЯ ATOMIC FORCE
- 25. ПО СРАВНЕНИЮ С ЭЛЕКТРОННОЙ МИКРОСКОПИЕЙ AFM:
- 26. Кинезин-1 на микротрубочке in vitro в присутствии
- 27. ПРОВЕРКА «ШЕИ» НА ПРОЧНОСТЬ Coiled-coil
- 29. IN VITRO MOTILITY ASSAY Моторный белок
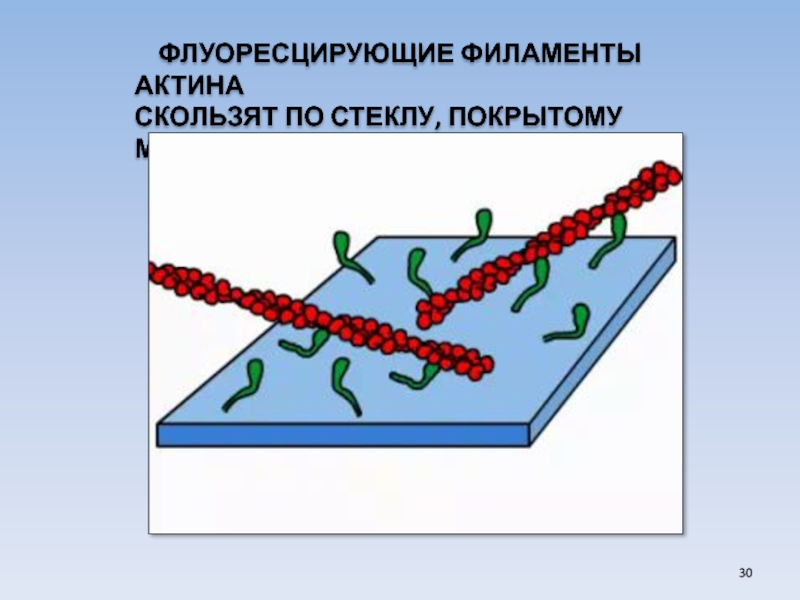
- 30. ФЛУОРЕСЦИРУЮЩИЕ ФИЛАМЕНТЫ АКТИНА СКОЛЬЗЯТ ПО СТЕКЛУ, ПОКРЫТОМУ МИОЗИНОМ
- 31. дифференциальный интерференционный контраст
- 32. (Andrew Carter’s lab)
- 33. ПРОЦЕССИВНОСТЬ МОТОРНЫХ БЕЛКОВ Плотность кинезина (мкм-2) Плотность
- 34. SINGLE MOLECULE FLUORESCENCE Синтетические флуорохромы
- 35. (Ron Vale’s homepage) Quantum Dots, покрытые динеином,
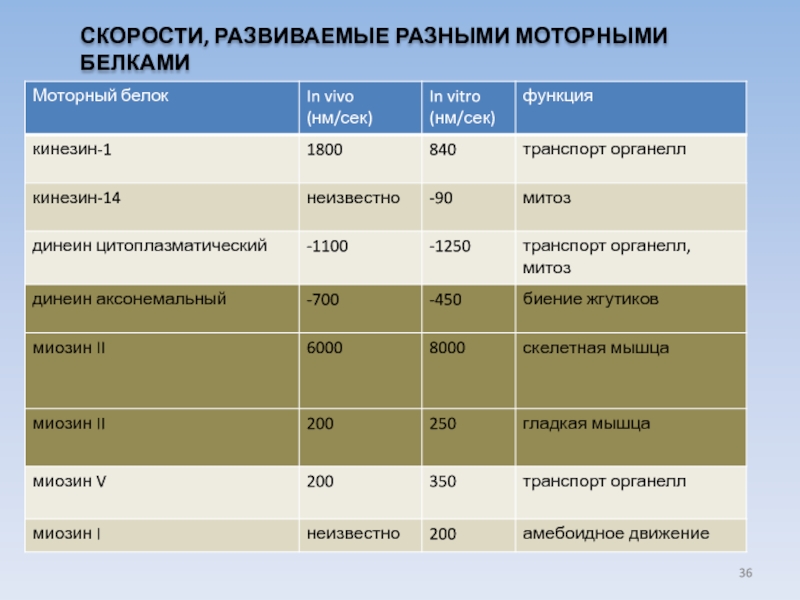
- 36. СКОРОСТИ, РАЗВИВАЕМЫЕ РАЗНЫМИ МОТОРНЫМИ БЕЛКАМИ
- 37. производство и регистрация сил - в диапазоне
- 38. КИНЕЗИН-1 НЕСЕТ МИКРОСФЕРУ ПО МИКРОТРУБОЧКЕ Свободное движение Движение в оптической ловушке (S. Block’s lab)
- 39. ВЛИЯНИЕ ПРИЛОЖЕННОЙ СИЛЫ НА ДВИЖЕНИЕ КИНЕЗИНА сила
- 40. КИНЕЗИН В ОПТИЧЕСКОЙ ЛОВУШКЕ время (сек)
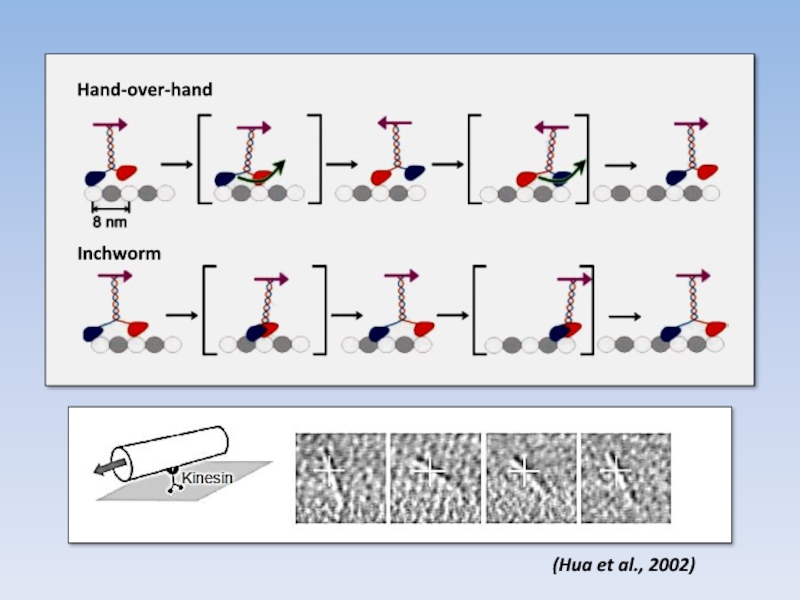
- 41. (Hua et al., 2002) Hand-over-hand Inchworm
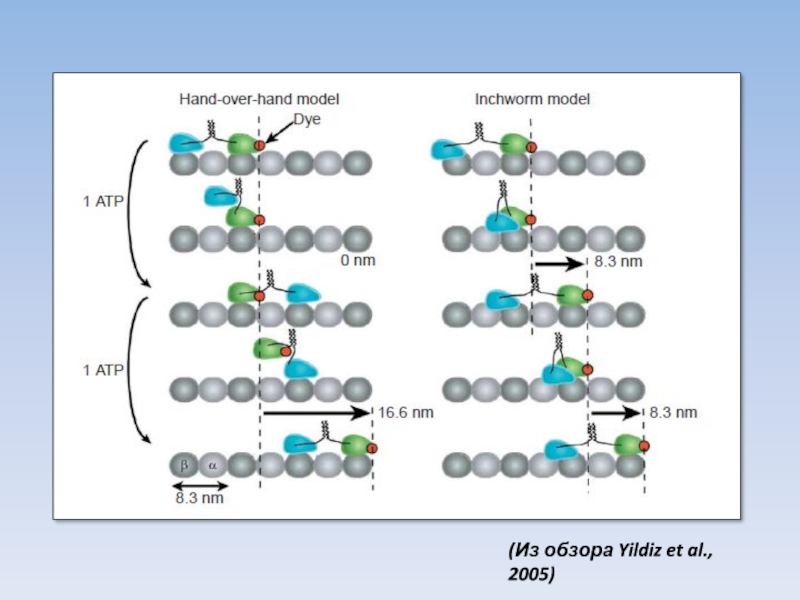
- 42. (Из обзора Yildiz et al., 2005)
- 43. МИКРОТРУБОЧКИ, СОБРАННЫЕ ИЗ ЧИСТОГО ТУБУЛИНА IN
- 44. КИНЕЗИН ДВИЖЕТСЯ ПО ПРОТОФИЛАМЕНТУ Опыт: скольжение
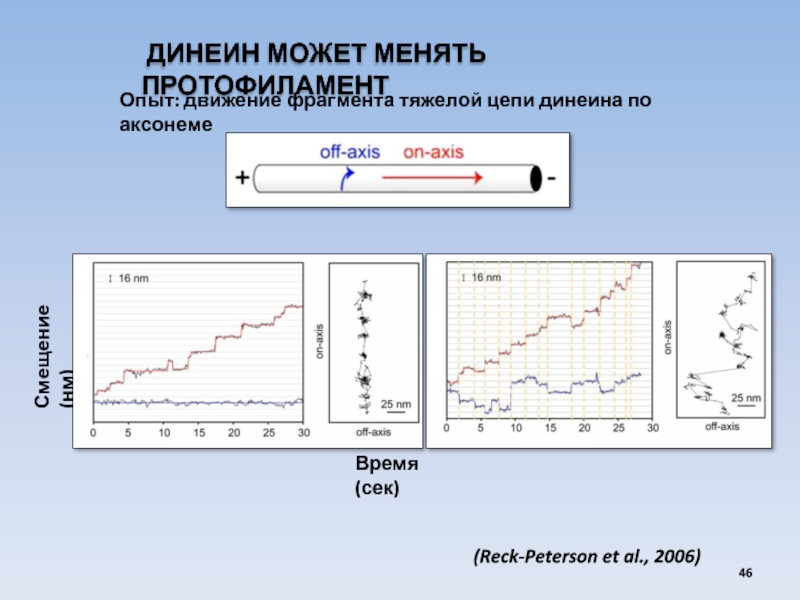
- 46. ДИНЕИН МОЖЕТ МЕНЯТЬ ПРОТОФИЛАМЕНТ (Reck-Peterson et
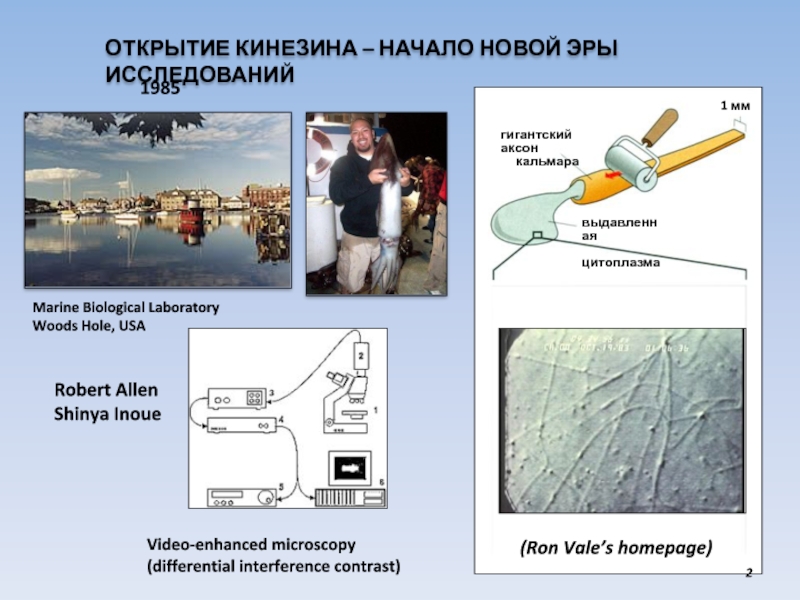
Слайд 2ОТКРЫТИЕ КИНЕЗИНА – НАЧАЛО НОВОЙ ЭРЫ ИССЛЕДОВАНИЙ
Marine Biological Laboratory
Woods Hole, USA
1
выдавленная
цитоплазма
гигантский аксон
кальмара
Video-enhanced microscopy
(differential interference contrast)
1985
(Ron Vale’s homepage)
Robert Allen
Shinya Inoue
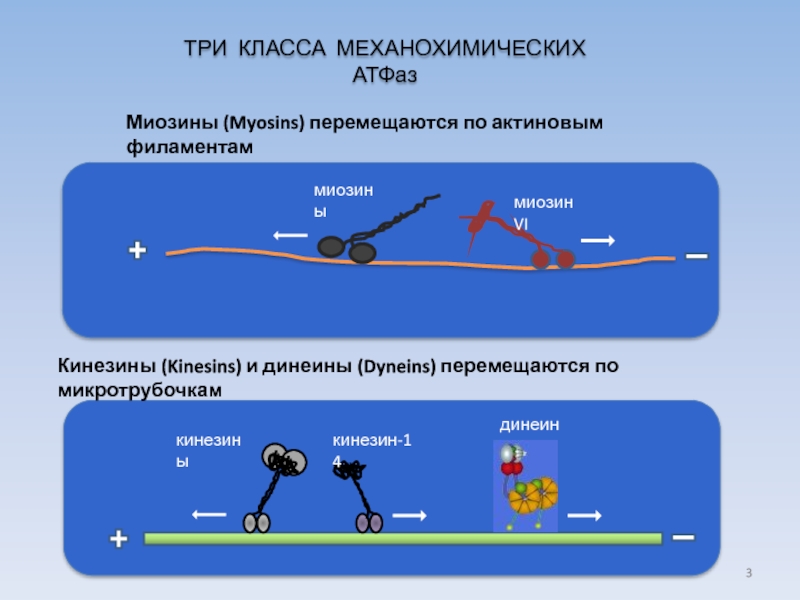
Слайд 3
Кинезины (Kinesins) и динеины (Dyneins) перемещаются по микротрубочкам
кинезины
кинезин-14
динеины
ТРИ КЛАССА МЕХАНОХИМИЧЕСКИХ АТФаз
Миозины
миозины
миозин VI
Слайд 4МИОЗИН II ИЗ СКЕЛЕТНЫХ МЫШЦ
шея
Coiled coil - хвост
Легкие цепи
Моторные головки
Область
перекрывания хвостов
Миозиновые головки
150 нм
500 нм
2 нм
Тяжелые цепи ~200 кДа
Легкие цепи ~ 20 кДа
R-LC
E-LC
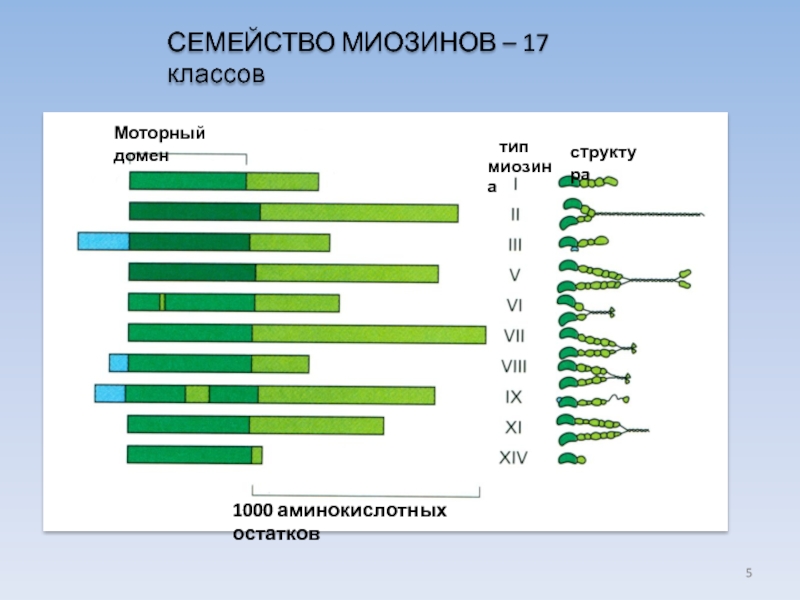
Слайд 5СЕМЕЙСТВО МИОЗИНОВ – 17 классов
Моторный домен
тип
миозина
структура
1000 аминокислотных остатков
Слайд 7МОЛЕКУЛА КИНЕЗИНА-1 - ГЕТЕРОТЕТРАМЕР
легкие цепи
~60 кДа
coiled coil стержень с изгибом
хвостовой
тяжелой цепи
80 нм
тяжелые цепи
~120 кДа
моторные
головки
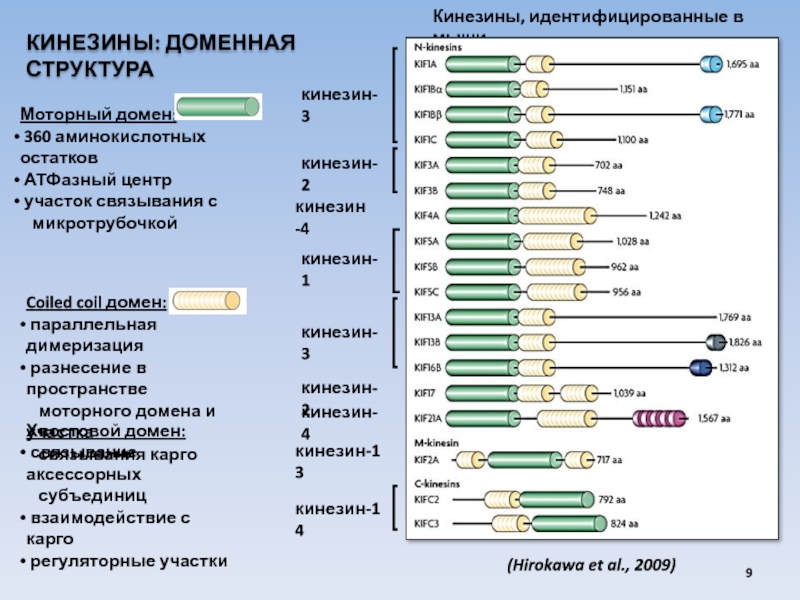
Слайд 9КИНЕЗИНЫ: ДОМЕННАЯ СТРУКТУРА
кинезин-1
Моторный домен:
360 аминокислотных остатков
АТФазный центр
участок
микротрубочкой
Кинезины, идентифицированные в мыши
(Hirokawa et al., 2009)
Coiled coil домен:
параллельная димеризация
разнесение в пространстве
моторного домена и участка
связывания карго
Хвостовой домен:
связывание аксессорных
субъединиц
взаимодействие с карго
регуляторные участки
кинезин-3
кинезин-2
кинезин -4
кинезин-13
кинезин-14
кинезин-3
кинезин-2
кинезин-4
Слайд 10МОТОРНЫЕ ДОМЕНЫ КИНЕЗИНА И МИОЗИНА
Нуклеотид-связывающий
Моторный домен кинезина
Участок
связывания
актина
Участок связывания
легких цепей(рычаг)
Конверторный
домен
Моторный домен
миозина
Нуклеотид-связывающий
карман
по данным рентгено-структурного анализа
«Core» =180 аминокислот
6 ß-изгибов
3 х 2 α-спиралей
(Rayment et al., 1993,
Kull et al., 1996)
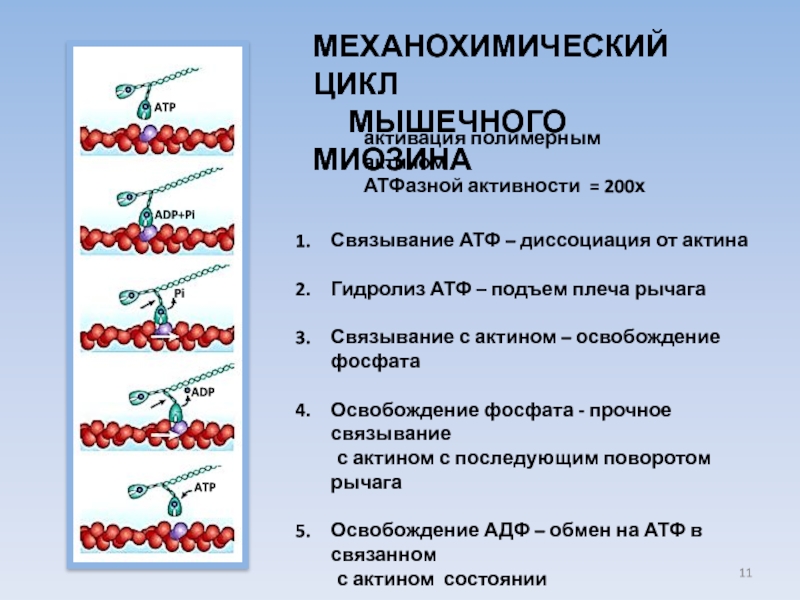
Слайд 11МЕХАНОХИМИЧЕСКИЙ ЦИКЛ
МЫШЕЧНОГО МИОЗИНА
Связывание АТФ – диссоциация от
Гидролиз АТФ – подъем плеча рычага
Связывание с актином – освобождение фосфата
Освобождение фосфата - прочное связывание
с актином с последующим поворотом рычага
Освобождение АДФ – обмен на АТФ в связанном
с актином состоянии
активация полимерным актином
АТФазной активности = 200х
ATP
ADP+Pi
Pi
ADP
ATP
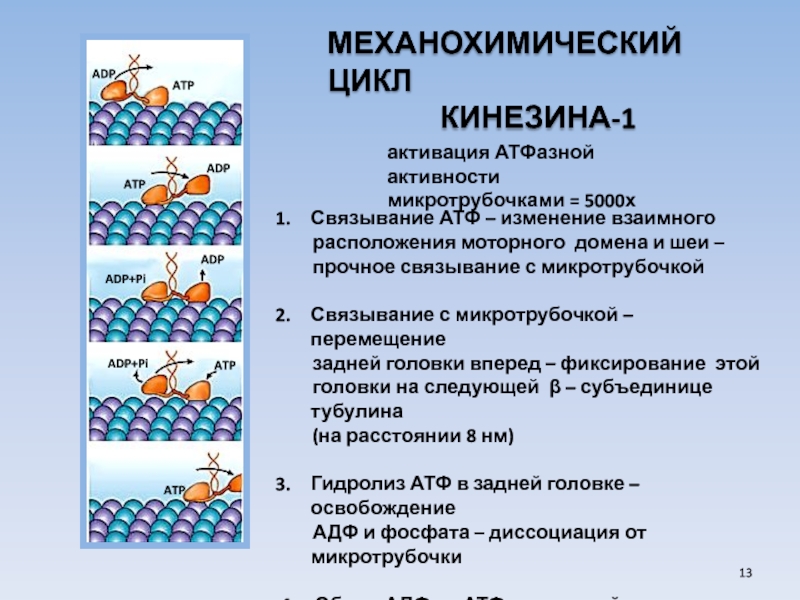
Слайд 13МЕХАНОХИМИЧЕСКИЙ ЦИКЛ
КИНЕЗИНА-1
Связывание
расположения моторного домена и шеи –
прочное связывание с микротрубочкой
Связывание с микротрубочкой – перемещение
задней головки вперед – фиксирование этой
головки на следующей β – субъединице тубулина
(на расстоянии 8 нм)
Гидролиз АТФ в задней головке – освобождение
АДФ и фосфата – диссоциация от микротрубочки
4. Обмен АДФ на АТФ в передней головке
активация АТФазной активности
микротрубочками = 5000х
ATP
ADP
ATP
ADP
ADP
ATP
ADP+Pi
ADP+Pi
ATP
Слайд 15
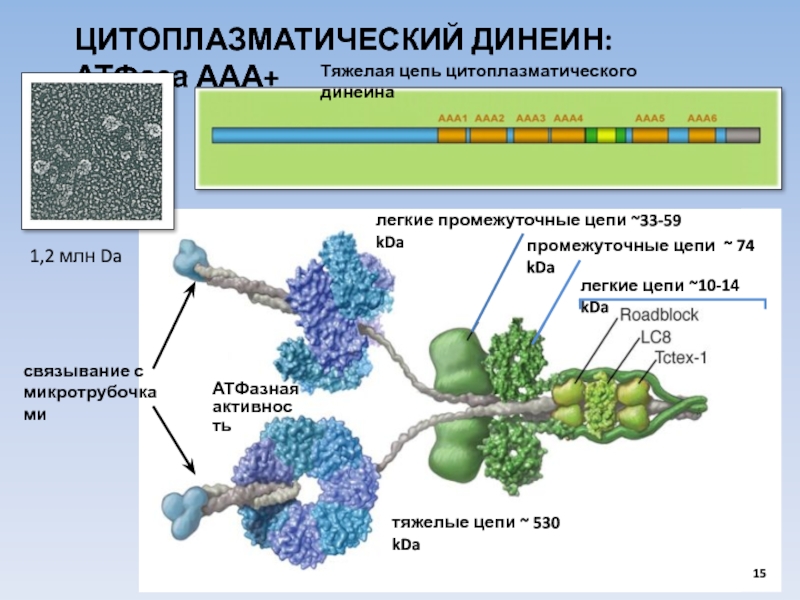
ЦИТОПЛАЗМАТИЧЕСКИЙ ДИНЕИН: АТФаза ААА+
легкие цепи ~10-14 kDa
тяжелые цепи ~ 530 kDa
легкие
промежуточные цепи ~ 74 kDa
Тяжелая цепь цитоплазматического динеина
связывание с
микротрубочками
АТФазная
активность
1,2 млн Da
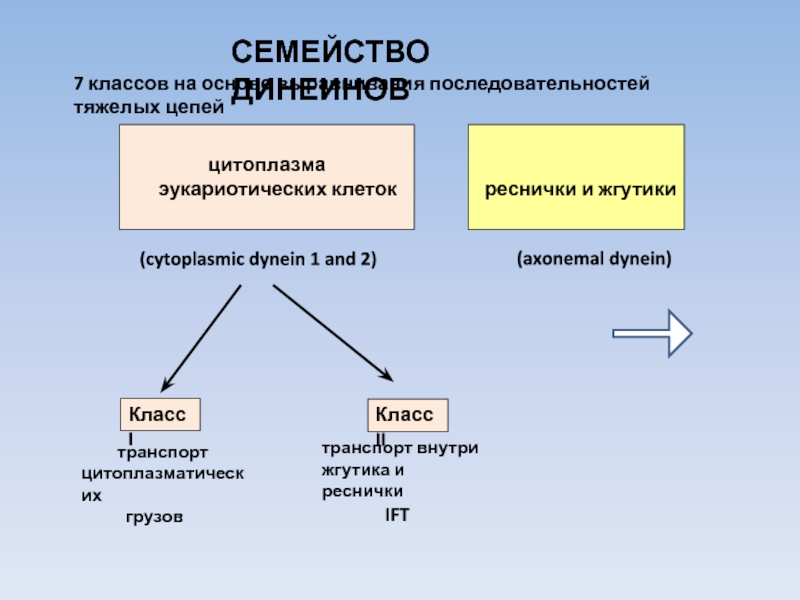
Слайд 16СЕМЕЙСТВО ДИНЕИНОВ
7 классов на основе выравнивания последовательностей тяжелых цепей
цитоплазма
эукариотических клеток
реснички и жгутики
(cytoplasmic dynein 1 and 2)
(axonemal dynein)
Класс I
Класс II
транспорт
цитоплазматических
грузов
транспорт внутри
жгутика и реснички
IFT
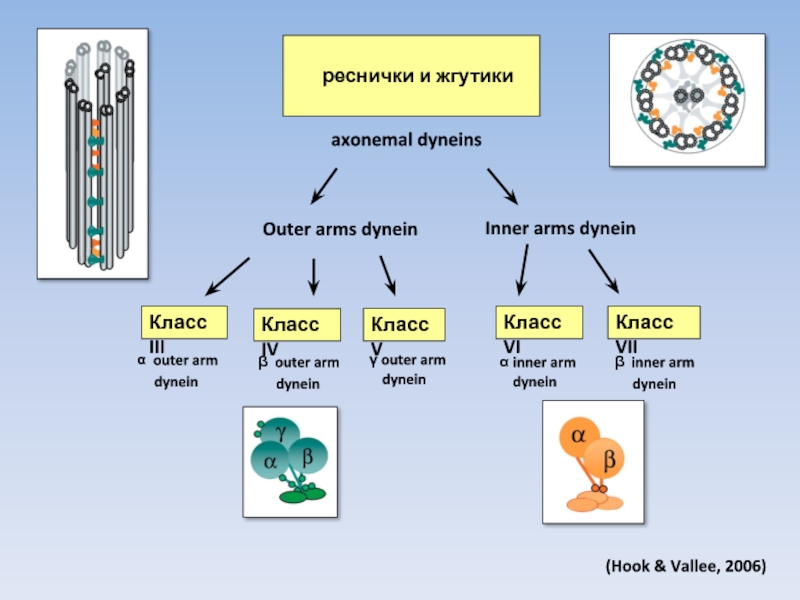
Слайд 17
реснички и жгутики
axonemal dyneins
Класс III
Класс IV
Класс V
Класс
Класс VII
Outer arms dynein
Inner arms dynein
(Hook & Vallee, 2006)
α outer arm
dynein
β outer arm
dynein
γ outer arm
dynein
α inner arm
dynein
β inner arm
dynein
Слайд 18микротрубочка
моторный домен динеина
моторный домен кинезина-1
(Carter et al., 2011; Spudich, 2011)
РАЗМЕР
Слайд 20СПОСОБЫ ИЗУЧЕНИЯ МОТОРНЫХ БЕЛКОВ
Электронная микроскопия отдельных молекул с напылением
Рентгеноструктурный анализ: трехмерная структура молекул
Криоэлектронная микроскопия: докинг моторных белков на треке
Атомно-силовая микроскопия: динамика взаимодействия мотора с треком
Генетические манипуляции: идентификация важных участков белковых цепей
In vitro motility assay + оптические ловушка и пинцет: измерение скоростей и сил
Слайд 21КАК РАБОТАЮТ МОЛЕКУЛЯРНЫЕ МОТОРЫ?
Происходит ли изменение конформации при гидролизе АТФ?
Как определяется
От чего зависит процессивность мотора?
Какова скорость движения мотора вдоль трека ?
Какую силу развивают моторные белки?
Шаги: как и на какое расстояние?
Траектория ?
------------------------------------------
Взаимодействие с треком?
Взаимодействие с карго?
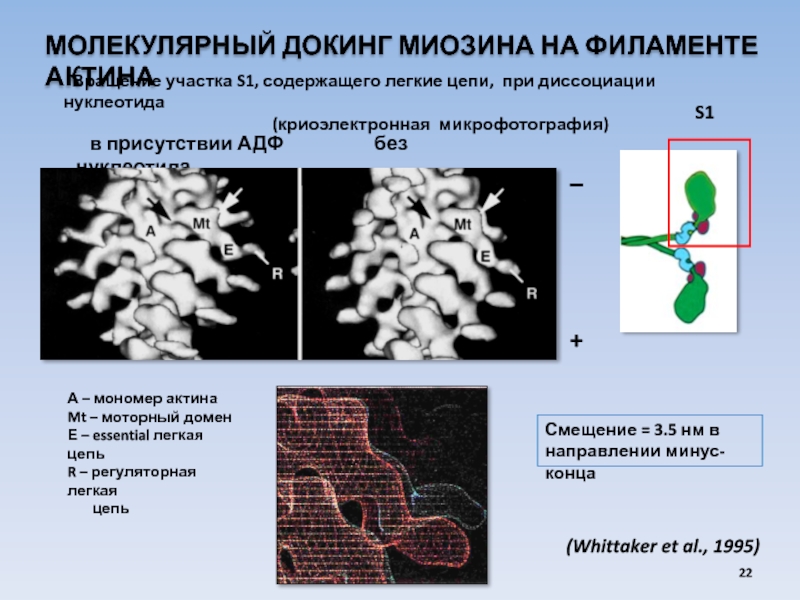
Слайд 22МОЛЕКУЛЯРНЫЙ ДОКИНГ МИОЗИНА НА ФИЛАМЕНТЕ АКТИНА
Вращение участка S1, содержащего легкие
(криоэлектронная микрофотография)
А – мономер актина
Mt – моторный домен
Е – essential легкая цепь
R – регуляторная легкая
цепь
(Whittaker et al., 1995)
в присутствии АДФ без нуклеотида
Смещение = 3.5 нм в
направлении минус-конца
S1
_
+
Слайд 23МОЛЕКУЛЯРНЫЙ ДОКИНГ КИНЕЗИНА НА МИКРОТРУБОЧКЕ
А – прикрепленная головка
F – свободная головка
(Arnal
Изменение взаимного расположения головок
димерного моторного домена кинезина-1
при связывании нуклеотида
без нуклеотида
AMP-PNP
Минимальный N-концевой
фрагмент тяжелой цепи,
способный димеризоваться
без нуклеотида
AMP-PNP
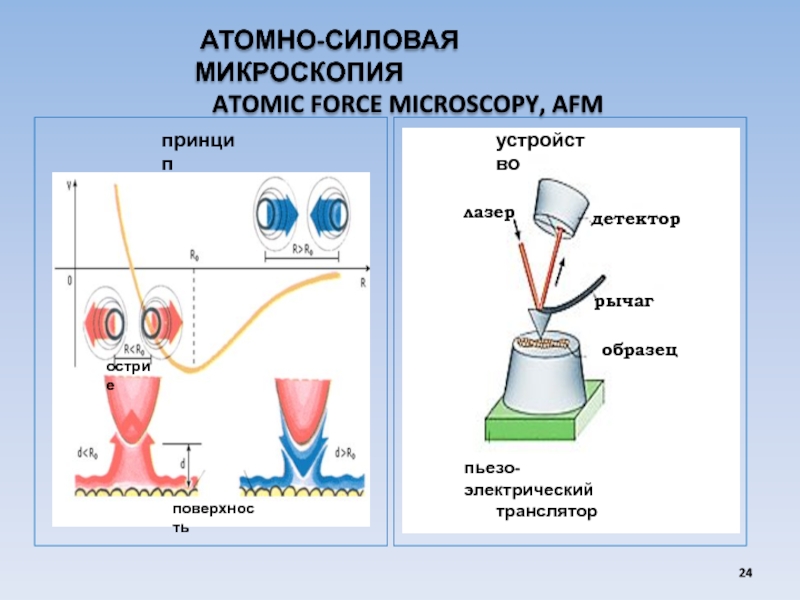
Слайд 24 АТОМНО-СИЛОВАЯ МИКРОСКОПИЯ
ATOMIC FORCE MICROSCOPY, AFM
принцип
устройство
лазер
образец
рычаг
пьезо-электрический
детектор
поверхность
острие
Слайд 25 ПО СРАВНЕНИЮ С ЭЛЕКТРОННОЙ МИКРОСКОПИЕЙ AFM:
имеет близкое и даже
дает трехмерное изображение объекта
не требует фиксирования образца
работает в водной или воздушной среде
-----------------------------------------------------------------------------
маленькая площадь сканирования –
всего 150 х 150 мкм2 при глубине в несколько мкм
низкая скорость сканирования
Слайд 26Кинезин-1 на микротрубочке
in vitro в присутствии AMPPNP
Миозин V шагает по
филаменту
ИЗОБРАЖЕНИЯ, ПОЛУЧЕННЫЕ С ПОМОЩЬЮ
АТОМНО-СИЛОВОЙ МИКРОСКОПИИ
(из обзора Veigel & Schmidt, 2011)
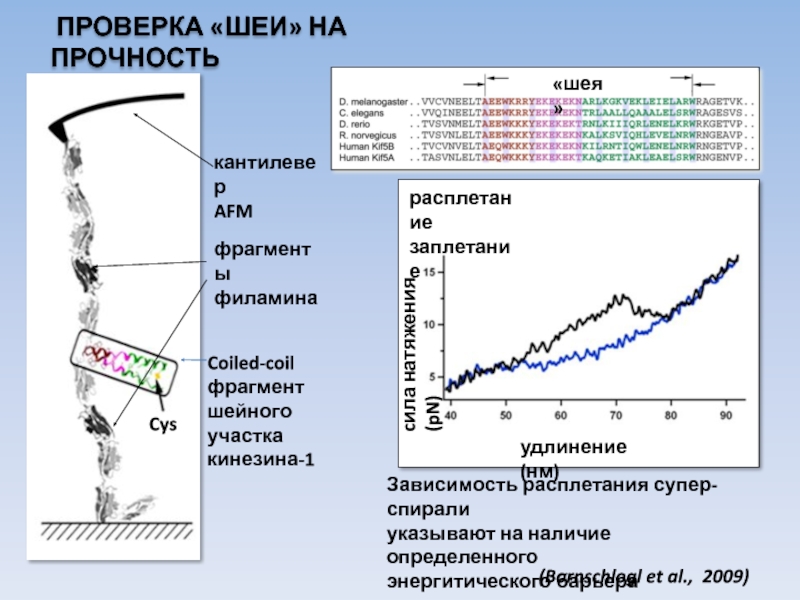
Слайд 27 ПРОВЕРКА «ШЕИ» НА ПРОЧНОСТЬ
Coiled-coil
фрагмент
шейного участка
кинезина-1
кантилевер
AFM
фрагменты
филамина
Cys
Зависимость расплетания
указывают на наличие определенного
энергитического барьера
(Bornschlogl et al., 2009)
расплетание
заплетание
cила натяжения (pN)
удлинение (нм)
«шея»
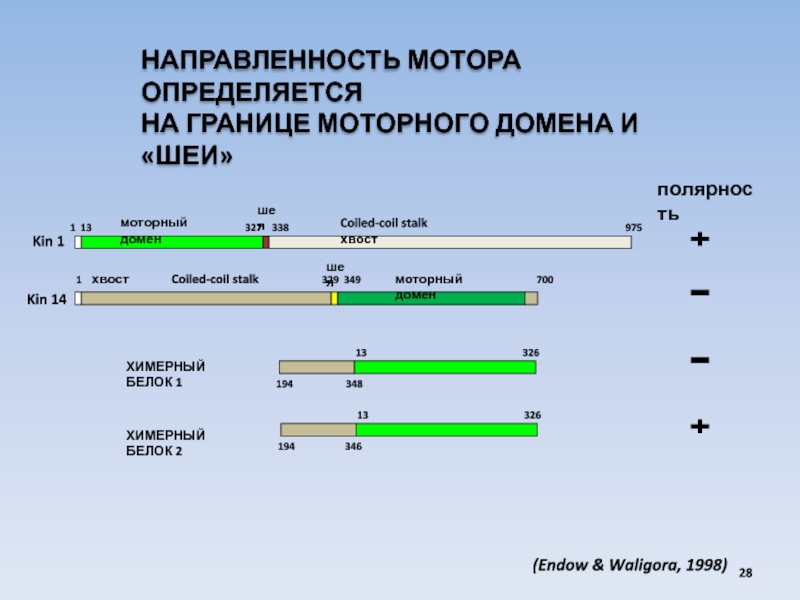
Слайд 28
Kin 14
Kin 1
полярность
1 13
1 хвост Coiled-coil stalk 329 349 700
моторный домен
Coiled-coil stalk хвост
моторный домен
шея
шея
НАПРАВЛЕННОСТЬ МОТОРА ОПРЕДЕЛЯЕТСЯ
НА ГРАНИЦЕ МОТОРНОГО ДОМЕНА И «ШЕИ»
13 326
ХИМЕРНЫЙ БЕЛОК 1
194 348
ХИМЕРНЫЙ БЕЛОК 2
13 326
194 346
(Endow & Waligora, 1998)
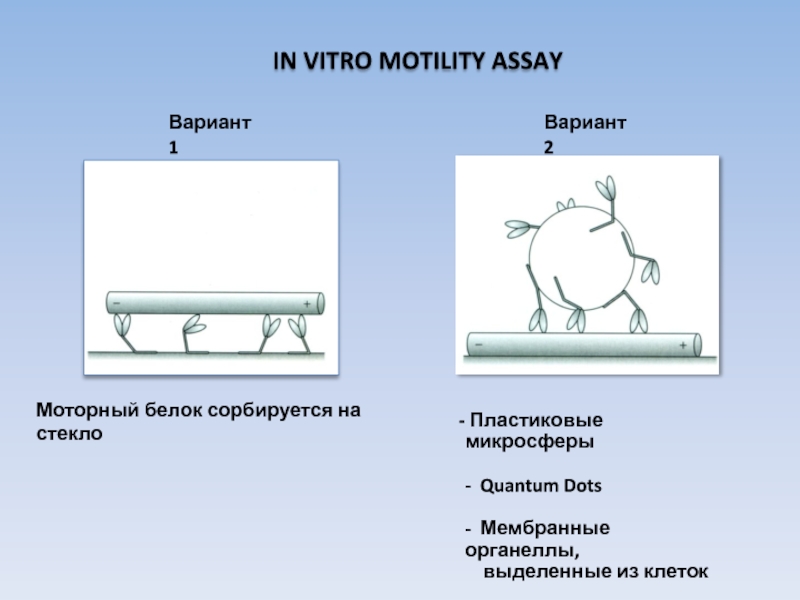
Слайд 29 IN VITRO MOTILITY ASSAY
Моторный белок сорбируется на стекло
Пластиковые микросферы
-
- Мембранные органеллы,
выделенные из клеток
Вариант 1
Вариант 2
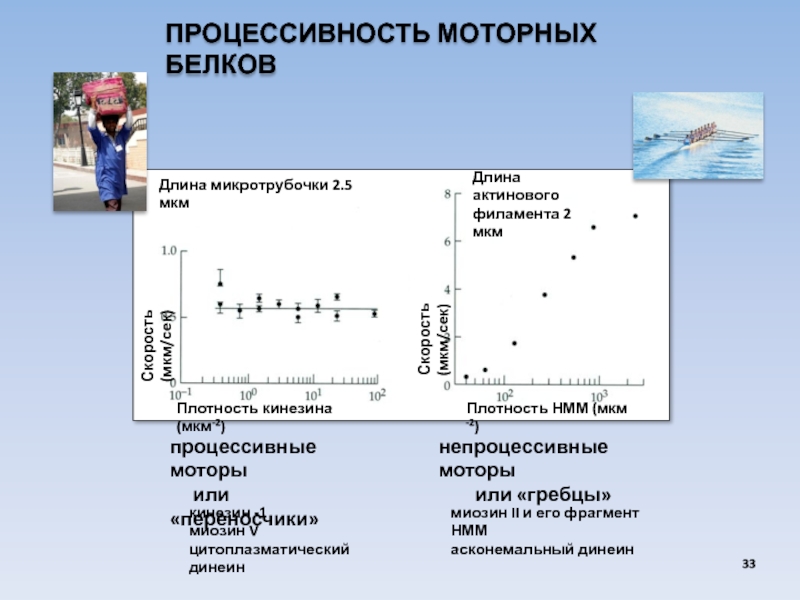
Слайд 33ПРОЦЕССИВНОСТЬ МОТОРНЫХ БЕЛКОВ
Плотность кинезина (мкм-2)
Плотность НММ (мкм -2)
Скорость (мкм/сек)
Скорость (мкм/сек)
Длина микротрубочки
Длина актинового
филамента 2 мкм
непроцессивные моторы
или «гребцы»
процессивные моторы
или «переносчики»
миозин II и его фрагмент НММ
асконемальный динеин
кинезин -1
миозин V
цитоплазматический динеин
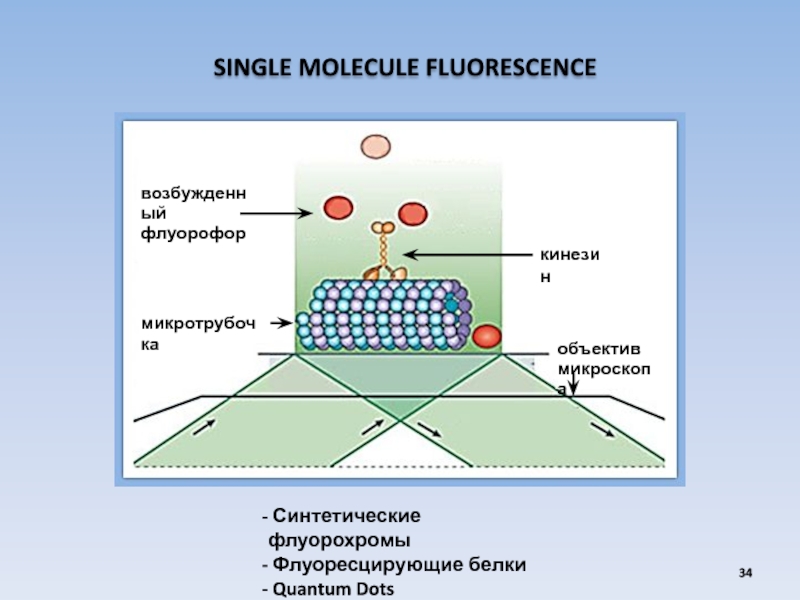
Слайд 34 SINGLE MOLECULE FLUORESCENCE
Синтетические флуорохромы
Флуоресцирующие белки
Quantum Dots
микротрубочка
объектив
микроскопа
кинезин
возбужденный
флуорофор
Слайд 35(Ron Vale’s homepage)
Quantum Dots, покрытые динеином,
скользят
Зеленый динеин и красный кинезин
скользят по аксонеме
(Andrew Carter’s lab)
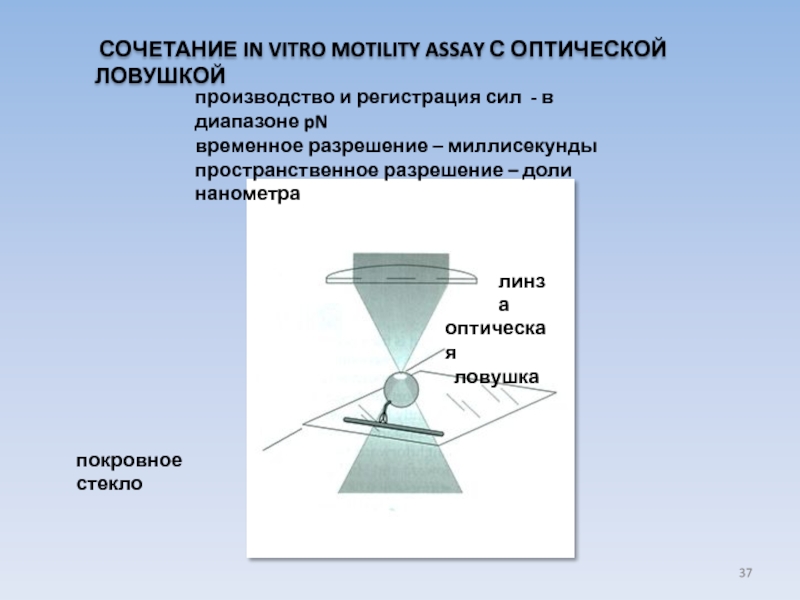
Слайд 37производство и регистрация сил - в диапазоне pN
временное разрешение – миллисекунды
пространственное
покровное стекло
оптическая
ловушка
линза
СОЧЕТАНИЕ IN VITRO MOTILITY ASSAY С ОПТИЧЕСКОЙ ЛОВУШКОЙ
Слайд 38 КИНЕЗИН-1 НЕСЕТ МИКРОСФЕРУ ПО МИКРОТРУБОЧКЕ
Свободное движение
Движение в оптической ловушке
(S. Block’s
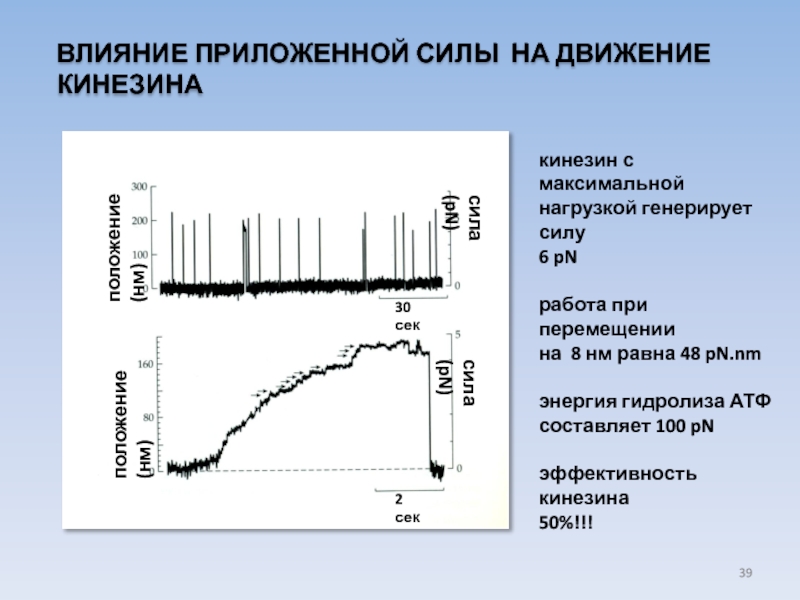
Слайд 39ВЛИЯНИЕ ПРИЛОЖЕННОЙ СИЛЫ НА ДВИЖЕНИЕ КИНЕЗИНА
сила (pN)
сила (pN)
положение (нм)
положение (нм)
30
2 сек
кинезин с максимальной
нагрузкой генерирует силу
6 pN
работа при перемещении
на 8 нм равна 48 pN.nm
энергия гидролиза АТФ
составляет 100 pN
эффективность кинезина
50%!!!
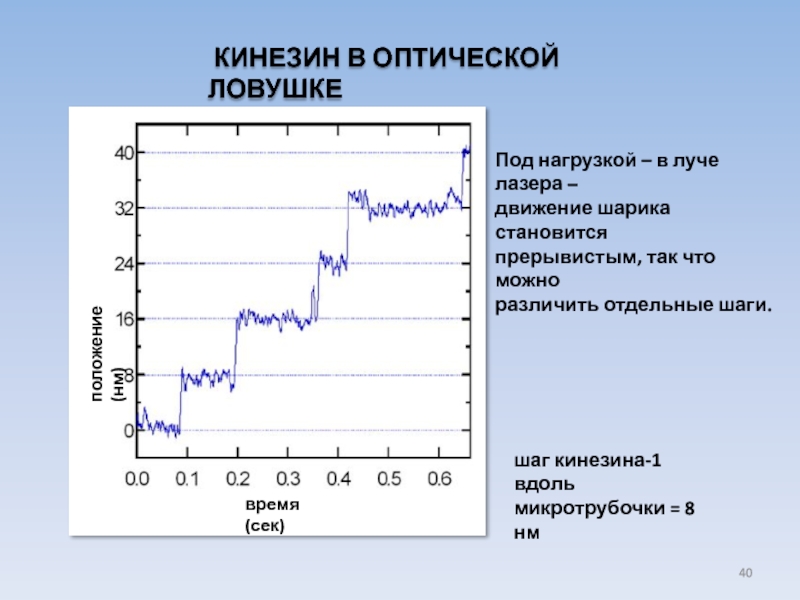
Слайд 40 КИНЕЗИН В ОПТИЧЕСКОЙ ЛОВУШКЕ
время (сек)
положение (нм)
шаг кинезина-1 вдоль
микротрубочки =
Под нагрузкой – в луче лазера –
движение шарика становится
прерывистым, так что можно
различить отдельные шаги.
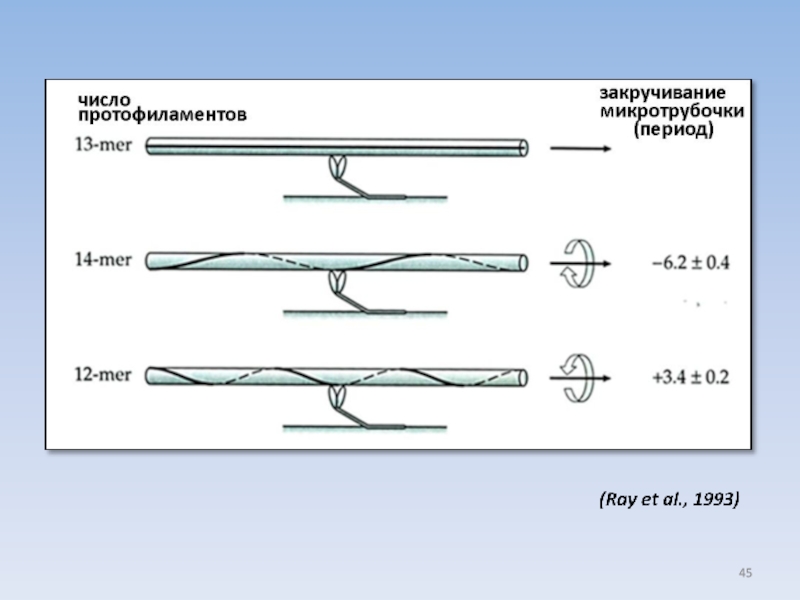
Слайд 43 МИКРОТРУБОЧКИ, СОБРАННЫЕ ИЗ ЧИСТОГО ТУБУЛИНА IN VITRO,
12 13 14
Слайд 44 КИНЕЗИН ДВИЖЕТСЯ ПО ПРОТОФИЛАМЕНТУ
Опыт: скольжение микротрубочек по стеклу, покрытому кинезином-1
Время
13
14
Слайд 46 ДИНЕИН МОЖЕТ МЕНЯТЬ ПРОТОФИЛАМЕНТ
(Reck-Peterson et al., 2006)
Смещение (нм)
Опыт: движение фрагмента
Время (сек)