- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Микробиологическое исследование рыбы презентация
Содержание
- 1. Микробиологическое исследование рыбы
- 2. Существуют следующие методы оценки качества рыбы: визуальная
- 3. Свежая рыба имеет красные жабры, светлые выпуклые
- 4. Несвежая рыба имеет темно-бурые жабры,
- 5. Перед микроскопическим исследованием рыбы кожу посередине спины
- 6. -в препаратах-отпечатках, приготовленных из свежей рыбы, не
- 8. Отбор проб Исследуемую рыбу и крупные экземпляры
- 9. Определение количества МАФАнМ 1 мл разведения переносят
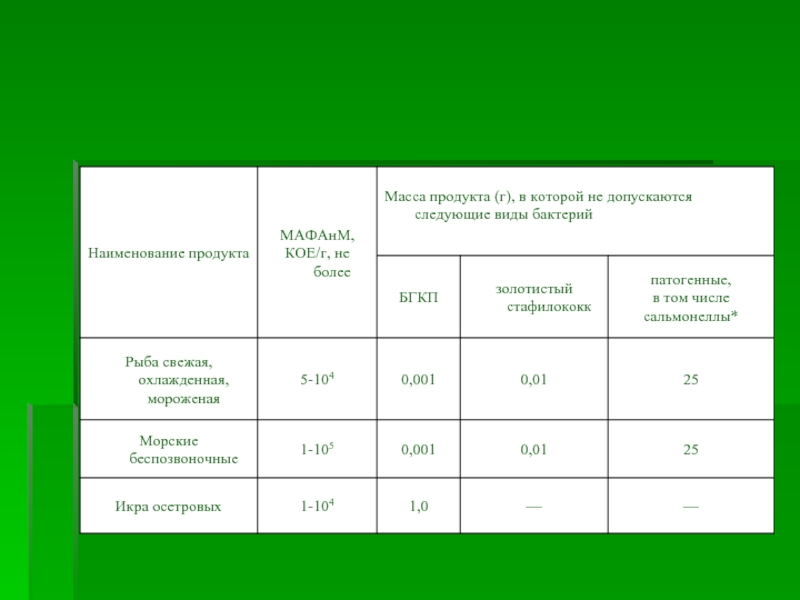
- 10. Количество микроорганизмов в 1 г (1 мл)
- 11. Индикация бактерий группы кишечных палочек Для индикации
- 12. Индикация наличия золотистого стафилоккока 1 г продукта
- 13. Реакция плазмокоагуляции. В пробирку с 0,5
- 14. Определения наличия бактерий рода сальмонелла Метод
- 15. Индикация парагемолитического вибриона Для исследования
- 16. Парагемолитические вибрионы — мезофильные грамотрицательные палочки, прямые
Слайд 2Существуют следующие методы оценки качества рыбы:
визуальная и органолептическая;
микроскопическое исследование;
микробиологическое исследование, которое
проводят при повышенной обсемененности продукции.
Слайд 3Свежая рыба имеет красные жабры, светлые выпуклые глаза, специфический запах. На
разрезе мышечная ткань эластична, плотной консистенции, ямка от надавливания быстро исчезает.
Слайд 4 Несвежая рыба имеет темно-бурые жабры, мутные запавшие глаза, дряблую
консистенцию, гнилостный запах, распавшиеся внутренние органы, лизированный кишечник.
Слайд 5Перед микроскопическим исследованием рыбы кожу посередине спины или ближе к голове
освобождают от чешуи и прижигают раскаленным скальпелем.
Затем вырезают кусочки мышечной ткани рыбы площадью около 1,5 см2 и толщиной 1,5-2,0 см: один из них берут из поверхностных слоев мышц, расположенных под кожей, другой — из мышечной ткани глубоких слоев, находящихся около позвоночника.
Вырезанным кусочком делают препарат-отпечаток на предметном стекле, препарат фиксируют, окрашивают простым методом и просматривают не менее 10 полей зрения
Затем вырезают кусочки мышечной ткани рыбы площадью около 1,5 см2 и толщиной 1,5-2,0 см: один из них берут из поверхностных слоев мышц, расположенных под кожей, другой — из мышечной ткани глубоких слоев, находящихся около позвоночника.
Вырезанным кусочком делают препарат-отпечаток на предметном стекле, препарат фиксируют, окрашивают простым методом и просматривают не менее 10 полей зрения
Слайд 6-в препаратах-отпечатках, приготовленных из свежей рыбы, не заметны остатки разложившейся мышечной
ткани; при микроскопии препаратов из поверхностных слоев бактерий нет или видны единичные кокки и палочки;
- у рыбы сомнительной свежести в мазках из поверхностных слоев мышц находят 80-60 кокков и палочек; в препаратах из глубоких слоев — 10-20 бактерий в одном поле зрения. На стекле заметны следы распавшейся ткани мышц; препарат окрашен удовлетворительно.
В рыбе, непригодной в пищу, в поле зрения как из поверхностных, так и из глубинных слоев, видны сотни палочек.
- у рыбы сомнительной свежести в мазках из поверхностных слоев мышц находят 80-60 кокков и палочек; в препаратах из глубоких слоев — 10-20 бактерий в одном поле зрения. На стекле заметны следы распавшейся ткани мышц; препарат окрашен удовлетворительно.
В рыбе, непригодной в пищу, в поле зрения как из поверхностных, так и из глубинных слоев, видны сотни палочек.
Слайд 8Отбор проб
Исследуемую рыбу и крупные экземпляры нерыбных объектов морского промысла отбирают
в количестве не более 3 шт. От каждого экземпляра из нескольких мест вырезают кусочки с кожей и мышцами, не затрагивая кишечник (за исключением отбора проб на определение наличия парагемолитических вибрионов), площадью около 4 см2, толщиной 4-5 мм. Эти кусочки помещают во взвешенный стакан; вновь взвешивают и по разности весов устанавливают массу отобранной пробы. Пробу измельчают и заливают стерильной жидкостью так, чтобы получить конечное разведение 1:10.
Слайд 9Определение количества МАФАнМ
1 мл разведения переносят в пробирку с 9 мл
стерильного раствора для дальнейшего разведения В результате исследуемый продукт оказывается разведенным в 10, 100 и более раз.
Посев проводят по следующей методике: из двух последних разведений в чашки Петри вносят по 1 мл разведенного материала, заливают 15 мл агара, перемешивают (из каждого разведения делают одновременно посев в 2-3 чашки). После застывания МПА чашки переворачивают вверх дном и помещают в термостат при температуре +30°С на 72 ч.
Посев проводят по следующей методике: из двух последних разведений в чашки Петри вносят по 1 мл разведенного материала, заливают 15 мл агара, перемешивают (из каждого разведения делают одновременно посев в 2-3 чашки). После застывания МПА чашки переворачивают вверх дном и помещают в термостат при температуре +30°С на 72 ч.
Слайд 10Количество микроорганизмов в 1 г (1 мл) продукта определяют по формуле:
где
К — количество микроорганизмов в 1 г, КОЕ/г; а — среднее арифметическое число колоний в чашке; b — степень разведения; с — масса, объем, поверхность (г, мл).
Слайд 11Индикация бактерий группы кишечных палочек
Для индикации БГКП в исследуемом материале 10
г продукта и 10 мл исходного разведения продукта помещают во флаконы со 100 и 50 мл питательной среды соответственно.
Слайд 12Индикация наличия золотистого стафилоккока
1 г продукта и 1 мл разведения засевают
в пробирку с 6-7 мл среды обогащения (солевого рыбопептонного бульона, содержащего 7% NaCl).
Посевы помещают в термостат при температуре +37°С на 24 ч. Из сред обогащения (солевого, глюкозного бульонов) проводят посев на элективные среды: желточно- или молочно-солевой агар или среду Байрд-Паркер. Посевы выдерживают при температуре +37°С в течение 24 ч.
Посевы помещают в термостат при температуре +37°С на 24 ч. Из сред обогащения (солевого, глюкозного бульонов) проводят посев на элективные среды: желточно- или молочно-солевой агар или среду Байрд-Паркер. Посевы выдерживают при температуре +37°С в течение 24 ч.
Слайд 13
Реакция плазмокоагуляции. В пробирку с 0,5 мл кроличьей плазмы, разведенной физраствором
в соотношении 1:5(1 мл плазмы + 4 мл физраствора), вносят петлю суточной культуры стафилококка. Для контроля одну пробирку с плазмой оставляют незасеянной. Пробирки помещают в термостат при температуре +37°С. Учет реакции плазмокоагуляции проводят через 2, 4 ч. Реакция считается положительной, если сгусток образовался в течение 24 ч.
Слайд 14Определения наличия бактерий рода сальмонелла
Метод основан на способности бактерий рода
сальмонелла расти на дифференциально-диагностических средах и давать реакцию агглютинации со специфическими сальмонеллезными сыворотками.
Навесок продукта в количестве 25 г засевают в 100 мл среды обогащения (магниевую или селенитовый бульон). Посевы помещают на 18-20 ч в термостат при температуре +37°С.
Навесок продукта в количестве 25 г засевают в 100 мл среды обогащения (магниевую или селенитовый бульон). Посевы помещают на 18-20 ч в термостат при температуре +37°С.
Слайд 15
Индикация парагемолитического вибриона
Для исследования пробы сырья отбирают с частью кишечника и
жабер.
Для установления наличия парагемолитических вибрионов, пробу в количестве 25 г переносят в 100 мл жидкой среды обогащения.
Посевы помещают в термостат при температуре +37°С, через 24 ч проводят пересев на поверхность плотного ДДА. Чашки инкубируют при температуре +37°С в течение 24 ч, выявляют типичные колонии парагемолитических вибрионов.
Для установления наличия парагемолитических вибрионов, пробу в количестве 25 г переносят в 100 мл жидкой среды обогащения.
Посевы помещают в термостат при температуре +37°С, через 24 ч проводят пересев на поверхность плотного ДДА. Чашки инкубируют при температуре +37°С в течение 24 ч, выявляют типичные колонии парагемолитических вибрионов.
Слайд 16Парагемолитические вибрионы — мезофильные грамотрицательные палочки, прямые или слегка изогнутые, не
образующие спор, активно подвижные, содержат цитохромоксидазу, не расщепляют лактозу и сахарозу, растут на питательных средах с содержанием хлорида натрия от 3 до 8%,
Для идентификации бактерий делают пересев с ДДА в 1%-ную пептонную воду с 3% хлорида натрия, на которой при наличии парагемолитического вибриона появляется помутнение с образованием нежной голубой пленки.
Готовят мазки, окрашивают их по Граму, и изучают морфологию клеток.
Подвижность изучают под фазово-контрастным микроскопом в раздавленной капле или при посеве в полужидкий МПА. Подвижные формы образуют диффузное помутнение, слабоподвижные - вырастают по ходу укола.
Для идентификации бактерий делают пересев с ДДА в 1%-ную пептонную воду с 3% хлорида натрия, на которой при наличии парагемолитического вибриона появляется помутнение с образованием нежной голубой пленки.
Готовят мазки, окрашивают их по Граму, и изучают морфологию клеток.
Подвижность изучают под фазово-контрастным микроскопом в раздавленной капле или при посеве в полужидкий МПА. Подвижные формы образуют диффузное помутнение, слабоподвижные - вырастают по ходу укола.