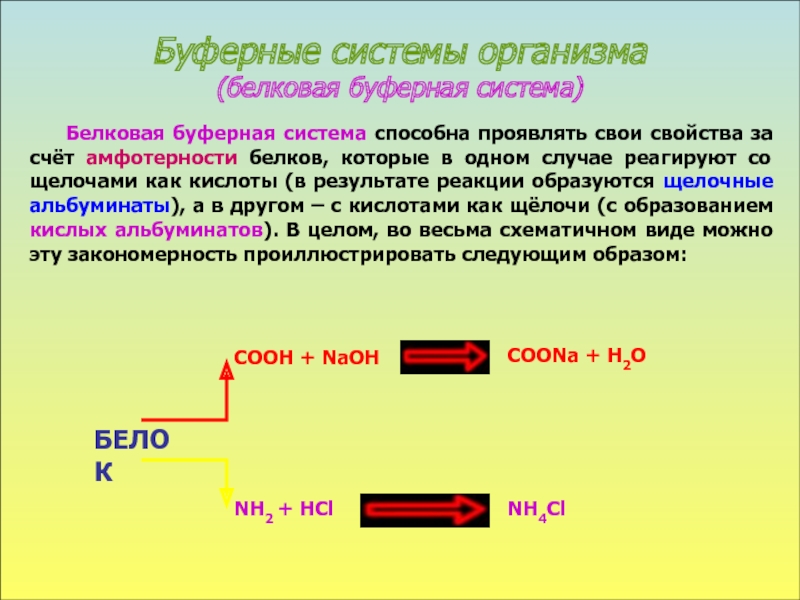
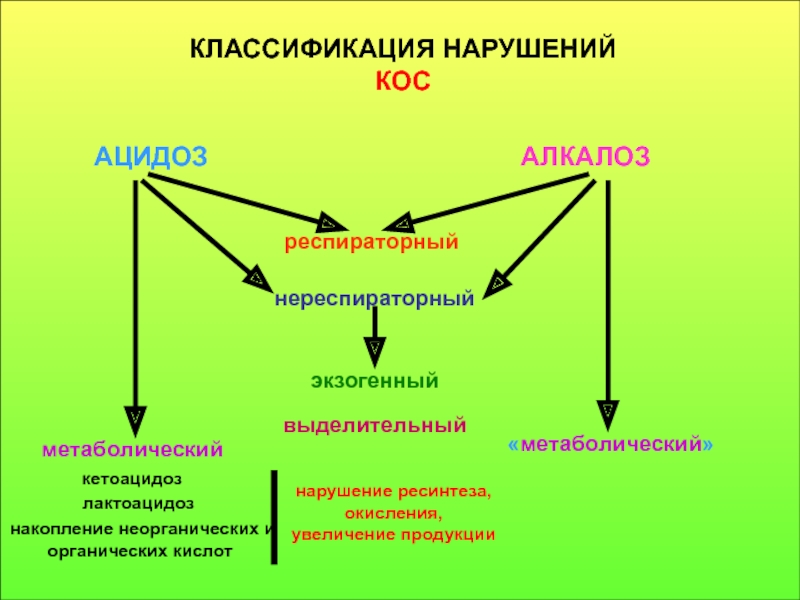
вещества, способные отдавать протон, называются кислотами, способные принимать его - основаниями, а компонент внутреннего равновесного состояния организма, именно концентрации Н+ ионов, назван КОС
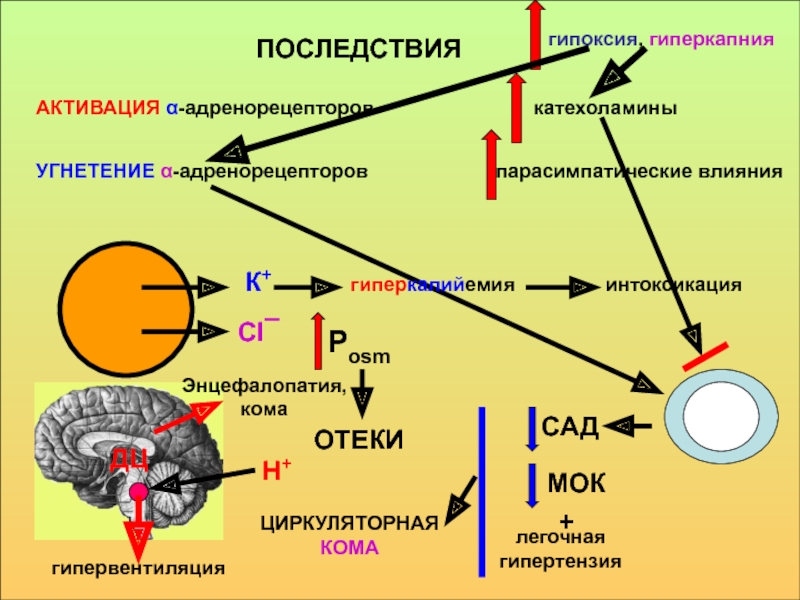
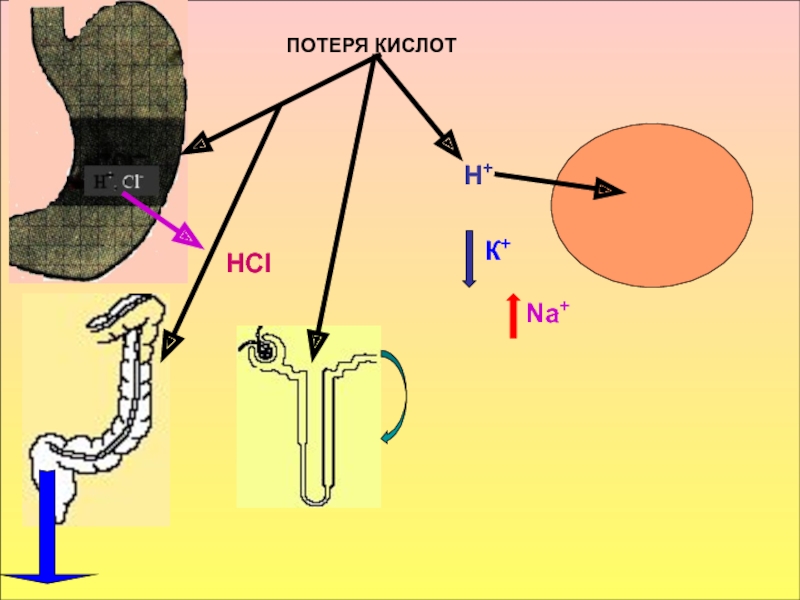
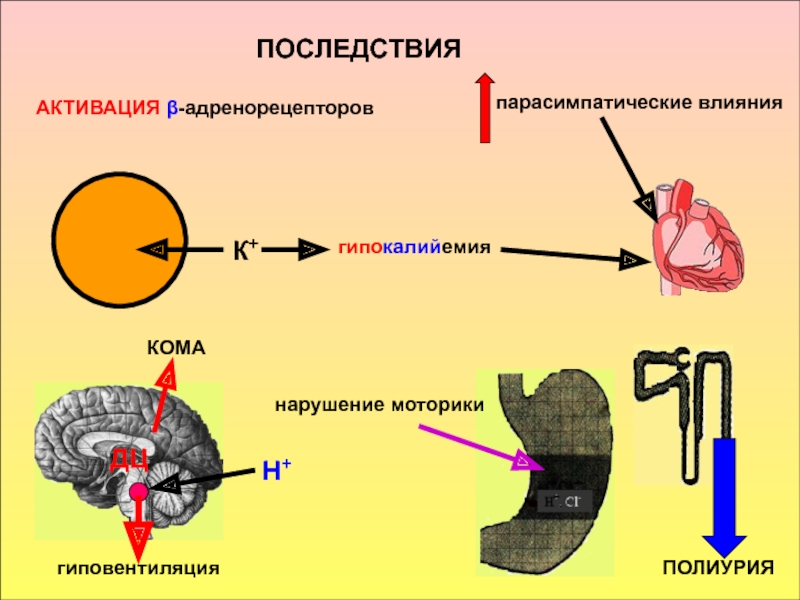
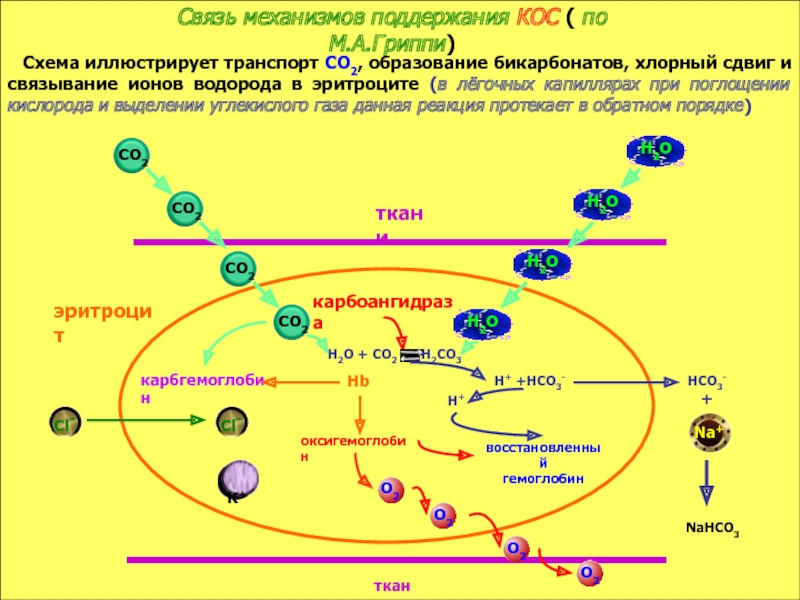
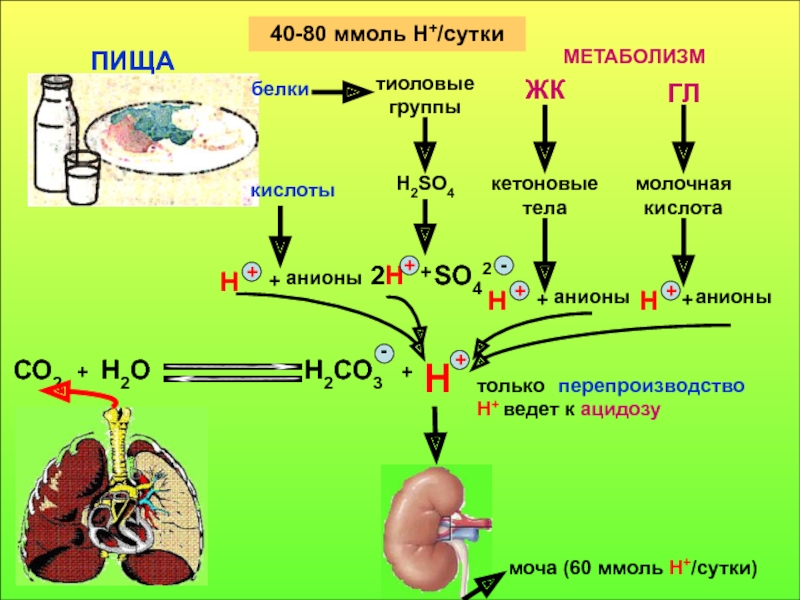
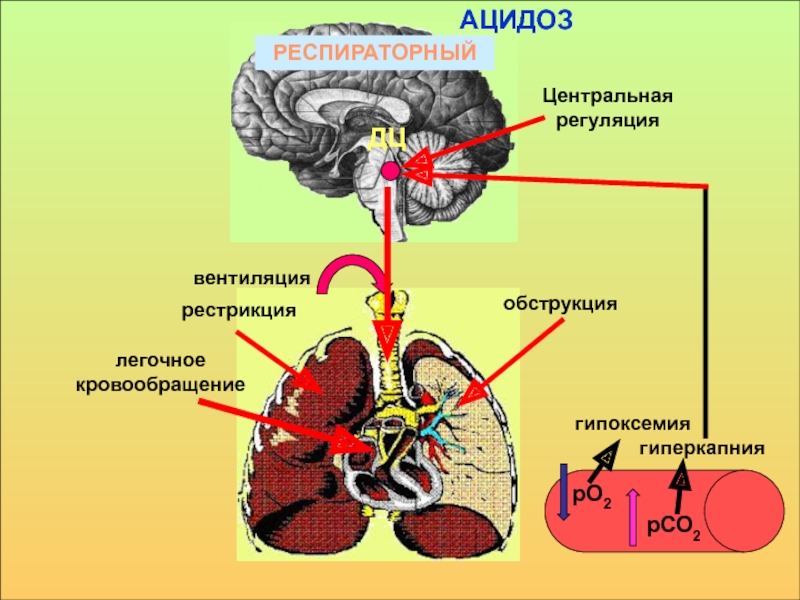
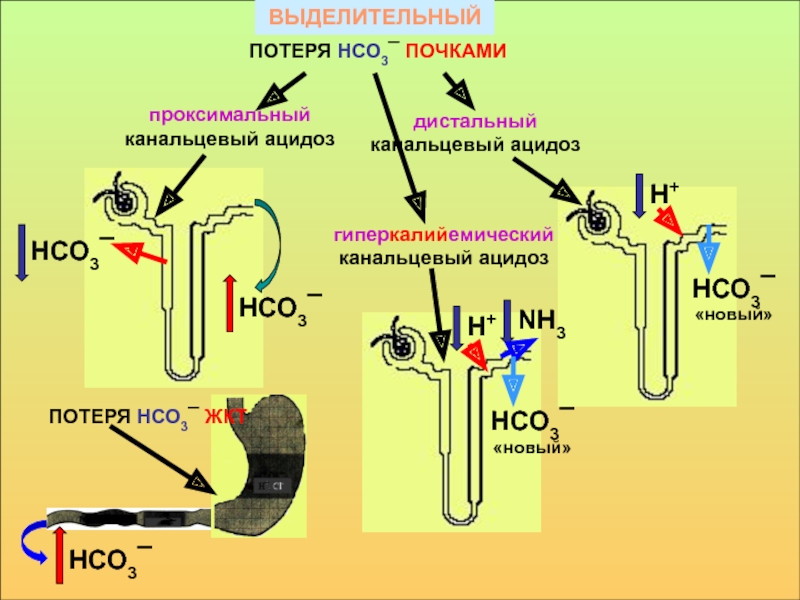
в компенсации сдвигов рН всегда участвует внеклеточное пространство. Сюда из клетки удаляются избытки недоокисленных продуктов появившиеся в результате интенсивного распада субстратов или недостаточного поступления О2. Это перемещение обеспечивается градиентом концентраций Н+ с обеих сторон клеточной мембраны
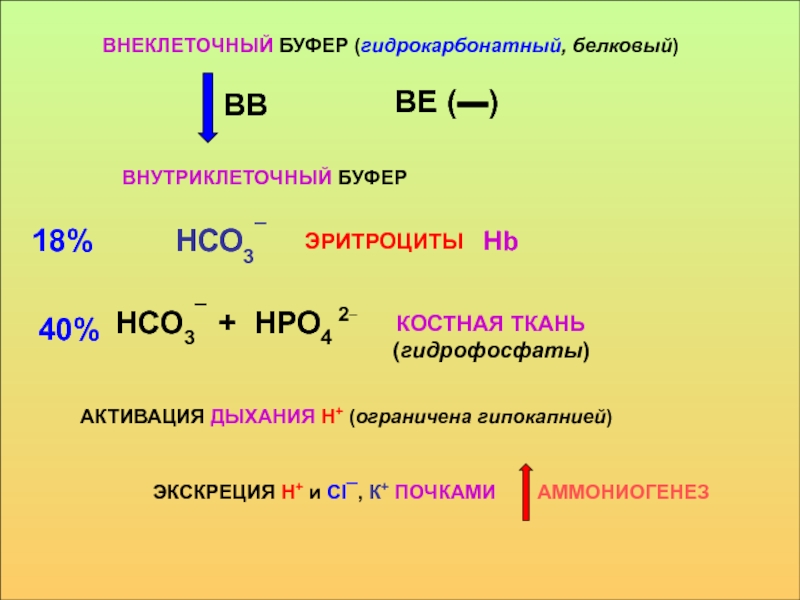
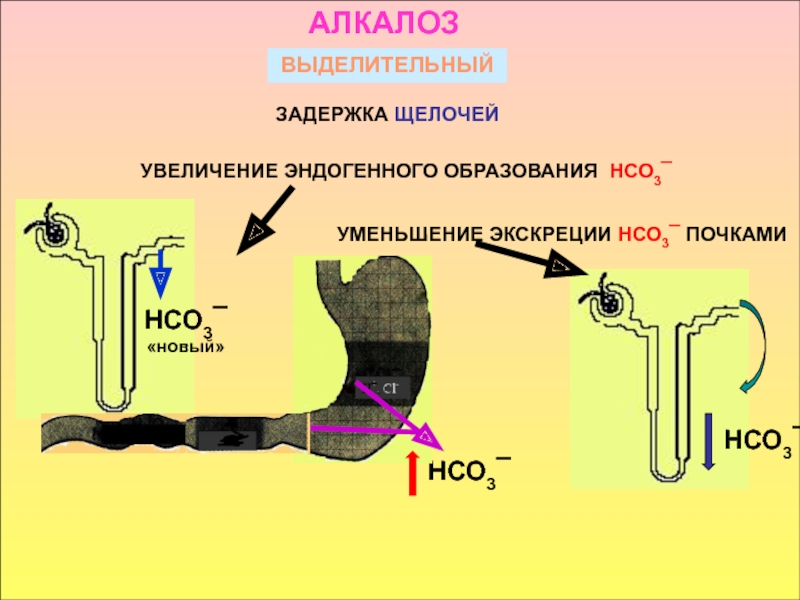
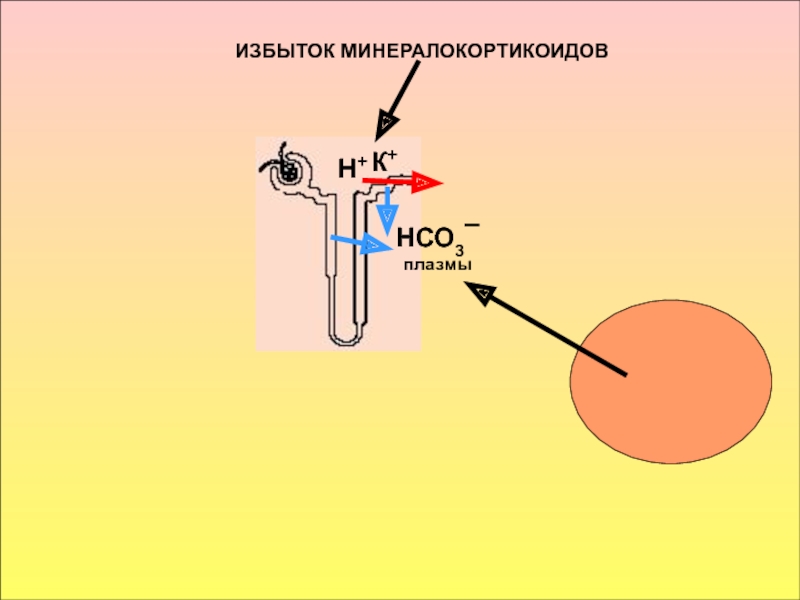
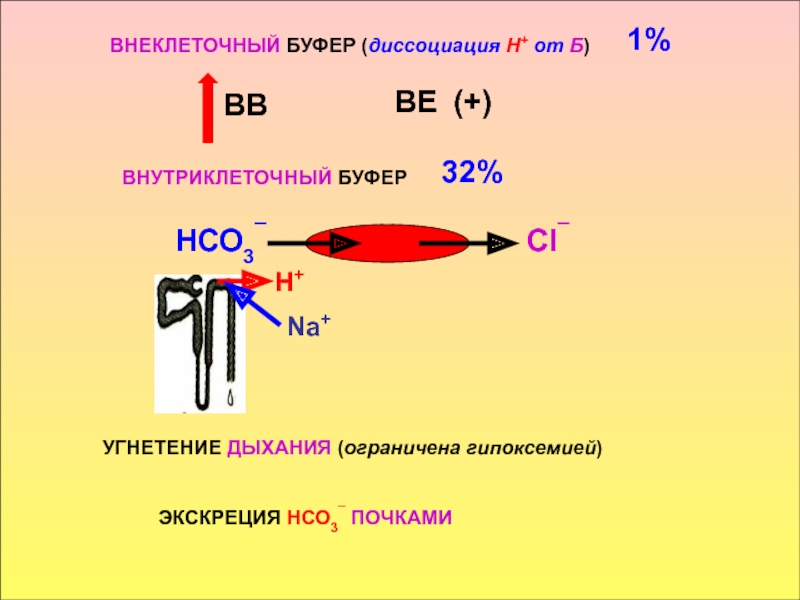
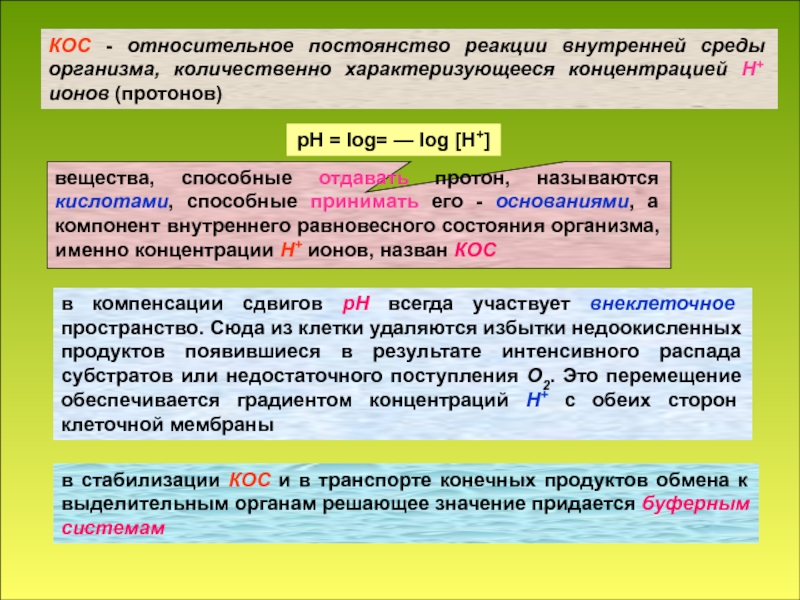
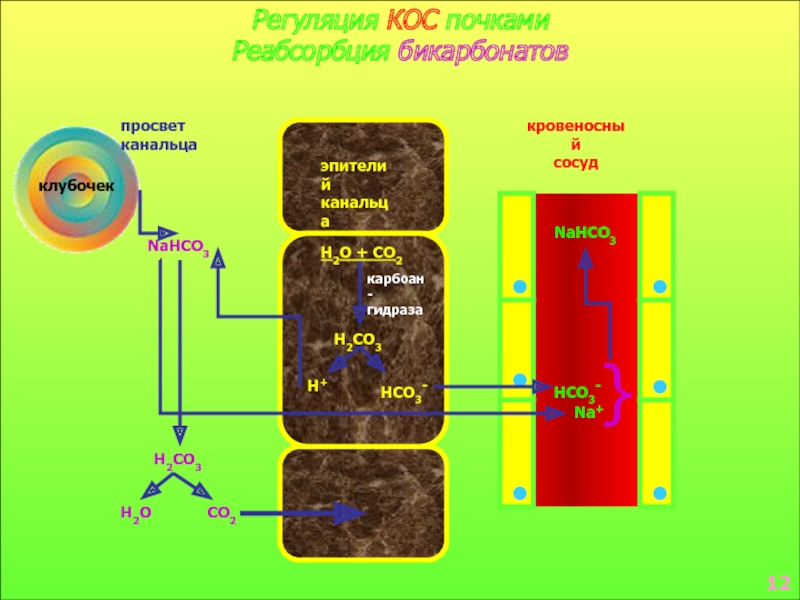
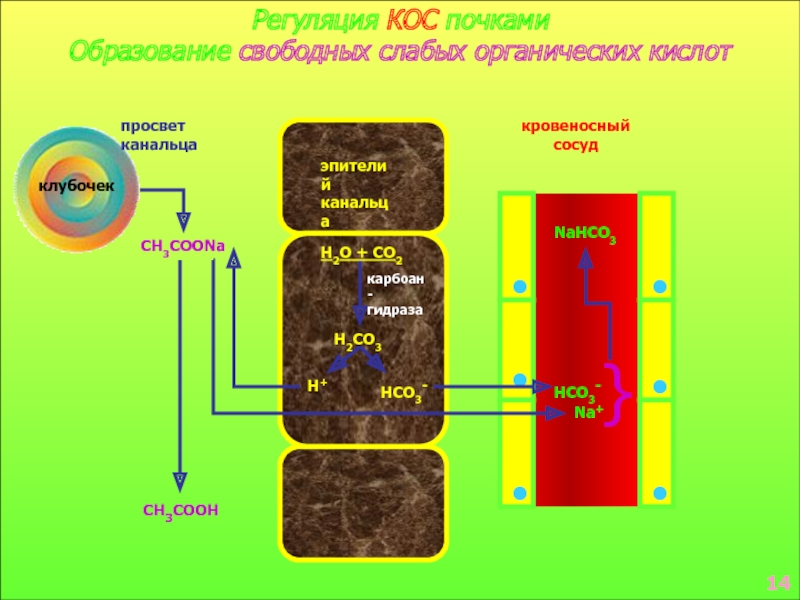
в стабилизации КОС и в транспорте конечных продуктов обмена к выделительным органам решающее значение придается буферным системам
рН = log= — log [H+]






![МетаболическийМетаболическийГазовыйГазовый[HCO3][HCO3]АЦИДОЗАЦИДОЗАЛКАЛОЗАЛКАЛОЗ[HCO3][HCO3][H2CO3][H2CO3]Рсо2Рсо2](/img/tmb/3/273284/b7906704ca79a8c65052d5fdedba0849-800x.jpg)

![РosmNa+БН+гипоосмолярная жидкость([Na+ + [K+] — [Cl-] + [HCO3-])анионной разницыгиперосмолярная гипогидратациягиперхлоремическийНСО3¯Сl¯К+диссоциация солей](/img/tmb/3/273284/1ac94e3cbdbade217e34d55cde3f4eea-800x.jpg)
![Компенсаторные реакции при основных формах нарушения КОСМетаболический ацидоз[НСО3][НСО3]Рсо2Рсо2Рсо2Рсо2[НСО3][НСО3]Респираторный ацидоз«Метаболический» алкалозРеспираторный алкалоз](/img/tmb/3/273284/ae67e54fa4758767325d0428f7c722a2-800x.jpg)