- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химические соединения растительного и животного мира - углеводы презентация
Содержание
- 1. Химические соединения растительного и животного мира - углеводы
- 2. УГЛЕВОДЫ
- 3. гетерофункциональные соединения, которые содержат одну карбонильную
- 4. МОНОСАХАРИДЫ: ПРЕДСТАВИТЕЛИ
- 5. МОНОСАХАРИДЫ: ИЗОМЕРИЯ
- 6. МОНОСАХАРИДЫ: ИЗОМЕРИЯ
- 7. свежеприготовленный раствор глюкозы [α]D
- 8. МОНОСАХАРИДЫ: СПОСОБЫ ИЗОБРАЖЕНИЯ
- 9. МОНОСАХАРИДЫ: СПОСОБЫ ИЗОБРАЖЕНИЯ
- 10. МОНОСАХАРИДЫ: ТАУТОМЕРНОЕ РАВНОВЕСИЕ В РАСТВОРЕ
- 11. МОНОСАХАРИДЫ: ТАУТОМЕРНОЕ РАВНОВЕСИЕ В РАСТВОРЕ
- 12. полуацетальный гидроксил (в любой из циклических
- 13. МОНОСАХАРИДЫ: РЕАКЦИИ ПО ПОЛУАЦЕТАЛЬНОМУ
- 14. МОНОСАХАРИДЫ: РЕАКЦИИ ПО ПОЛУАЦЕТАЛЬНОМУ ГИДРОКСИЛУ
- 15. МОНОСАХАРИДЫ: РЕАКЦИИ ПО СПИРТОВЫМ ГИДРОКСИЛАМ
- 16. МОНОСАХАРИДЫ: РЕАКЦИИ ПО КАРБОНИЛЬНОЙ ГРУППЕ 1. ПРИСОЕДИНЕНИЕ СИНИЛЬНОЙ КИСЛОТЫ синтез Фишера-Килиани – удлинение цепи
- 17. МОНОСАХАРИДЫ: РЕАКЦИИ ПО ОТКРЫТОЙ ФОРМЕ 2.
- 18. МОНОСАХАРИДЫ: РЕАКЦИИ ПО
- 19. МОНОСАХАРИДЫ: OX-RED ПРОЦЕССЫ 1. ВОССТАНОВЛЕНИЕ –
- 20. 2. МЯГКОЕ ОКИСЛЕНИЕ –
- 21. 3. ЖЕСТКОЕ ОКИСЛЕНИЕ – получение гликАРОВЫХ (сахарных) кислот МОНОСАХАРИДЫ: OX-RED ПРОЦЕССЫ
- 22. 4. ЖЕСТКОЕ ОКИСЛЕНИЕ С ПРЕДВАРИТЕЛЬНОЙ ЗАЩИТОЙ
- 23. ДИСАХАРИДЫ: КЛАССИФИКАЦИЯ ВОССТАНАВЛИВАЮЩИЕ:
- 24. ДИСАХАРИДЫ: КЛАССИФИКАЦИЯ Трегалоза (грибной
- 25. ДИСАХАРИДЫ: СВОЙСТВА алкилирование ацилирование гидролиз Вне зависимости от типа для дисахаридов характерны:
- 26. ДИСАХАРИДЫ: СВОЙСТВА окисление кольчато-цепная таутомерия (мутаротация) Только для восстанавливающих дисахаридов характерны:
- 27. ГОМОПОЛИСАХАРИДЫ ЦЕЛЛЮЛОЗА (клетчатка) – полимер D-глюкозы,
- 28. ГОМОПОЛИСАХАРИДЫ КРАХМАЛ – основное
- 29. ГЕТЕРОПОЛИСАХАРИДЫ Важнейшая составная часть межклеточного
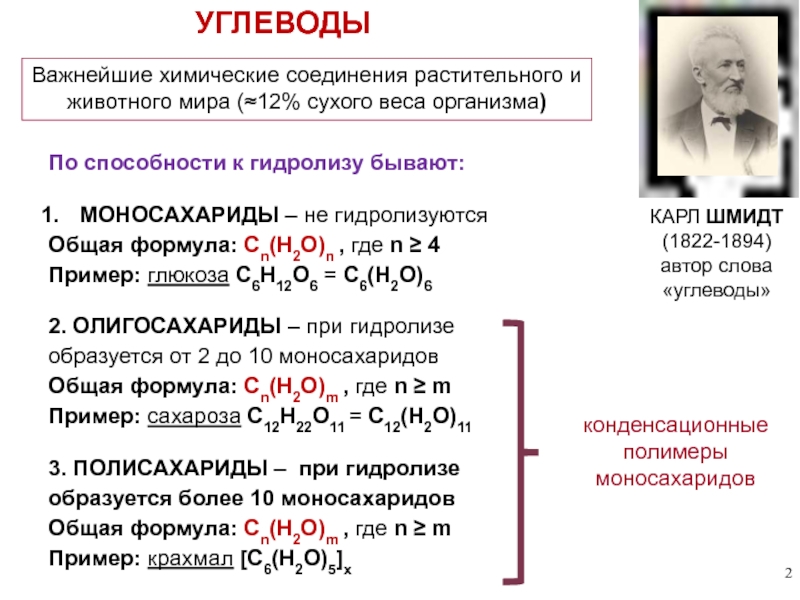
Слайд 2УГЛЕВОДЫ
Важнейшие химические соединения
животного мира (≈12% сухого веса организма)
МОНОСАХАРИДЫ – не гидролизуются
Общая формула: Сn(H2O)n , где n ≥ 4
Пример: глюкоза С6Н12О6 = С6(Н2О)6
2. ОЛИГОСАХАРИДЫ – при гидролизе
образуется от 2 до 10 моносахаридов
Общая формула: Сn(H2O)m , где n ≥ m
Пример: сахароза С12Н22О11 = С12(Н2О)11
КАРЛ ШМИДТ
(1822-1894)
автор слова «углеводы»
По способности к гидролизу бывают:
конденсационные
полимеры
моносахаридов
3. ПОЛИСАХАРИДЫ – при гидролизе
образуется более 10 моносахаридов
Общая формула: Сn(H2O)m , где n ≥ m
Пример: крахмал [С6(H2O)5]x
Слайд 3гетерофункциональные соединения, которые содержат
одну карбонильную группу и несколько гидроксильных групп
общее
МОНОСАХАРИДЫ
Классификация моносахаридов
По типу карбонильной группы:
альдегид - альдоза,
кетон - кетоза
2. По числу атомов С в скелете:
5 - пентоза,
6 - гексоза и т.п.
Можно объединить два критерия:
альдопентоза
кетогексоза
Слайд 4МОНОСАХАРИДЫ: ПРЕДСТАВИТЕЛИ
количество оптических
где n – число асимметрических (хиральных) атомов углерода
Слайд 5
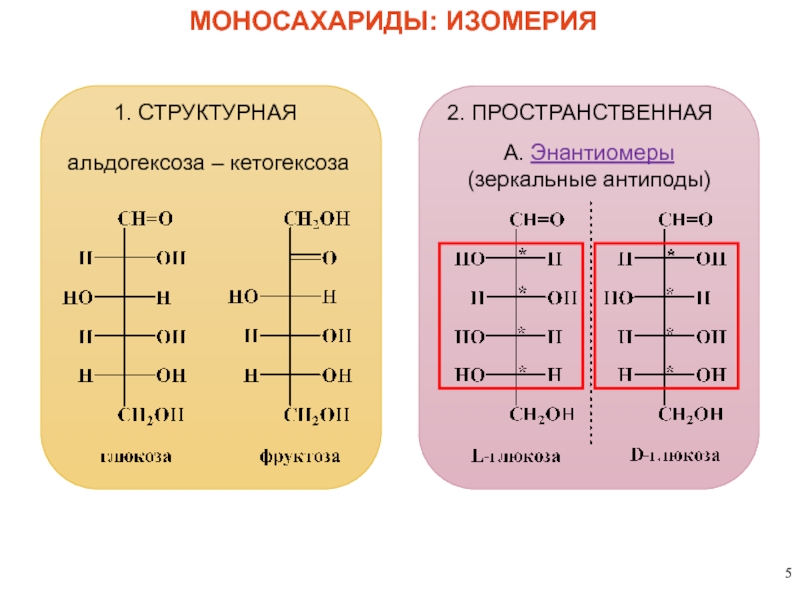
МОНОСАХАРИДЫ: ИЗОМЕРИЯ
1. СТРУКТУРНАЯ
альдогексоза – кетогексоза
2. ПРОСТРАНСТВЕННАЯ
А. Энантиомеры
(зеркальные антиподы)
Слайд 6
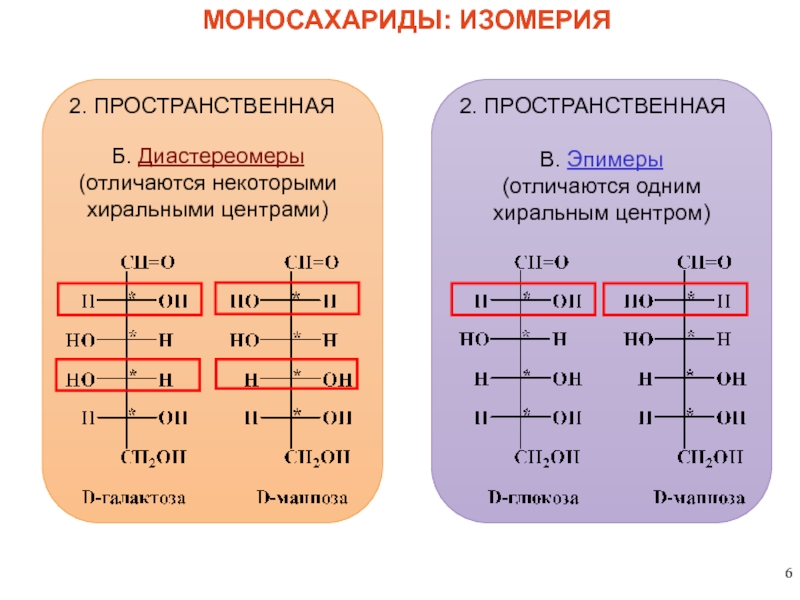
МОНОСАХАРИДЫ: ИЗОМЕРИЯ
2. ПРОСТРАНСТВЕННАЯ
Б. Диастереомеры
(отличаются некоторыми
хиральными центрами)
2. ПРОСТРАНСТВЕННАЯ
В. Эпимеры
(отличаются одним
хиральным центром)
Слайд 7
свежеприготовленный раствор глюкозы
[α]D = + 112º
1. МУТАРОТАЦИЯ – изменение угла
МОНОСАХАРИДЫ: СВОЙСТВА
раствор глюкозы
после длительной выдержки
[α]D = + 52,5º
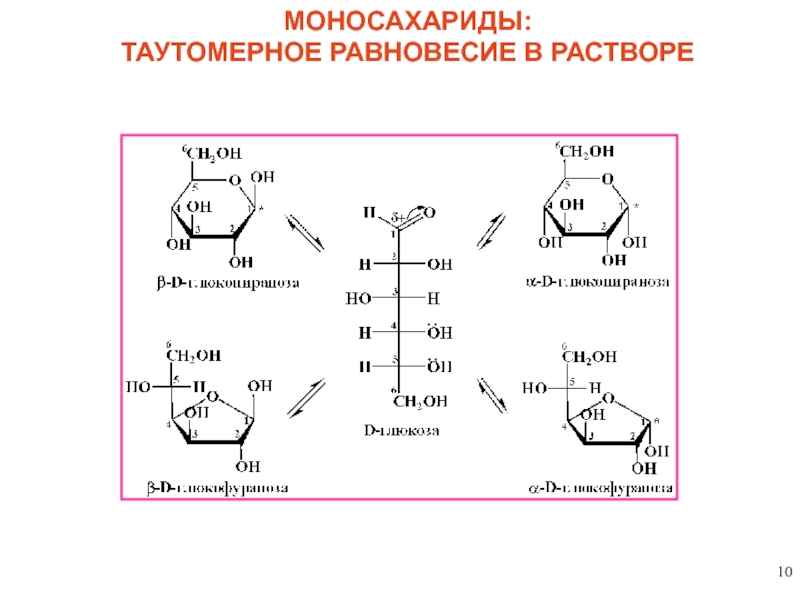
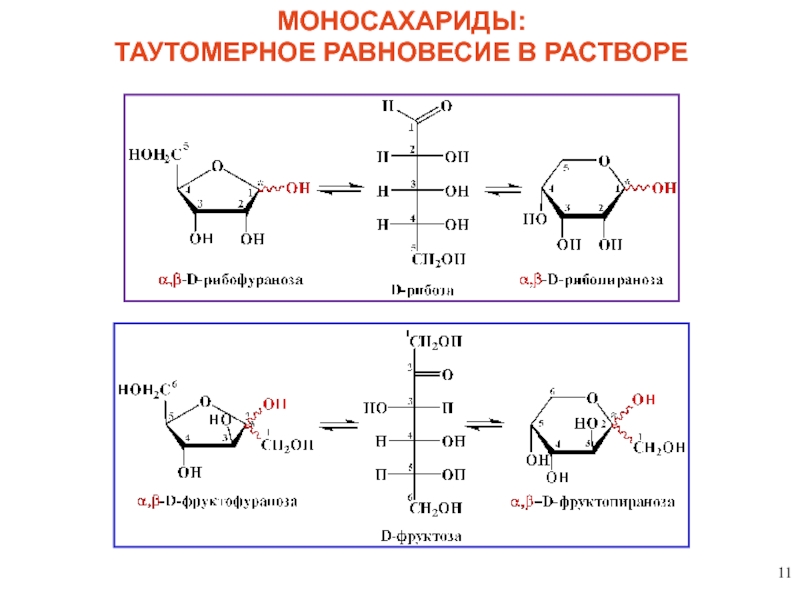
2. КОЛЬЧАТО-ЦЕПНАЯ (оксикарбонил-полуацетальная) таутомерия – динамическое равновесие в растворе
полуацетальный
(гликозидный)
гидроксил
аномерный центр
Слайд 8
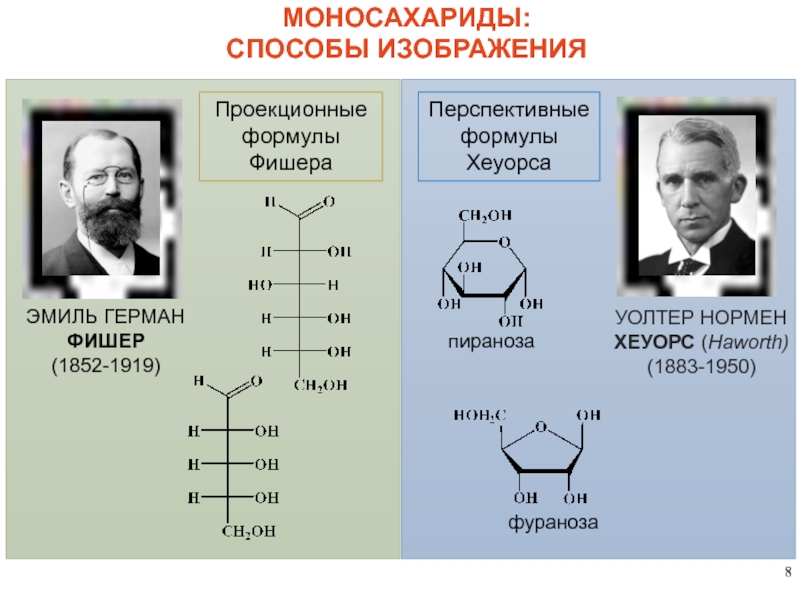
МОНОСАХАРИДЫ:
СПОСОБЫ ИЗОБРАЖЕНИЯ
Проекционные
формулы
Фишера
Перспективные
формулы
Хеуорса
ЭМИЛЬ ГЕРМАН
ФИШЕР
(1852-1919)
УОЛТЕР НОРМЕН
ХЕУОРС (Haworth)
(1883-1950)
пираноза
фураноза
Слайд 9
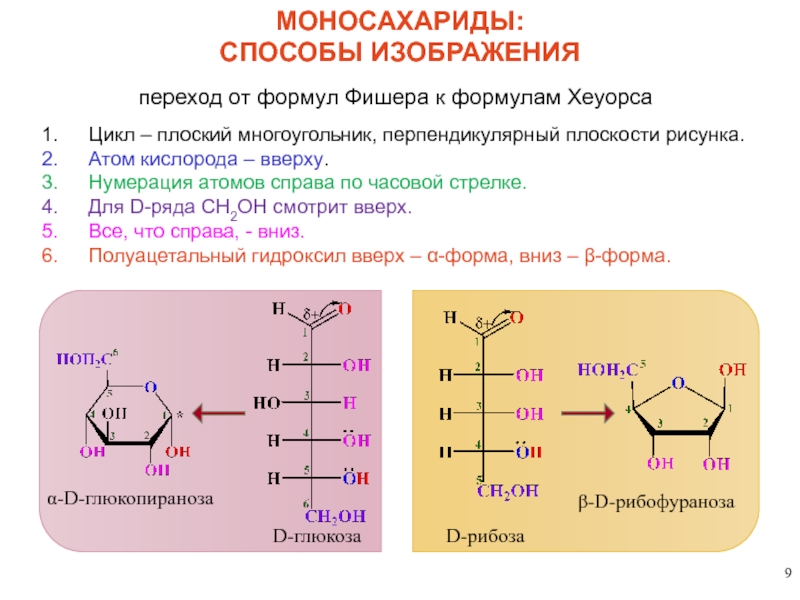
МОНОСАХАРИДЫ:
СПОСОБЫ ИЗОБРАЖЕНИЯ
переход от
Цикл – плоский многоугольник, перпендикулярный плоскости рисунка.
Атом кислорода – вверху.
Нумерация атомов справа по часовой стрелке.
Для D-ряда CH2OH смотрит вверх.
Все, что справа, - вниз.
Полуацетальный гидроксил вверх – α-форма, вниз – β-форма.
α-D-глюкопираноза
D-рибоза
D-глюкоза
β-D-рибофураноза
Слайд 12
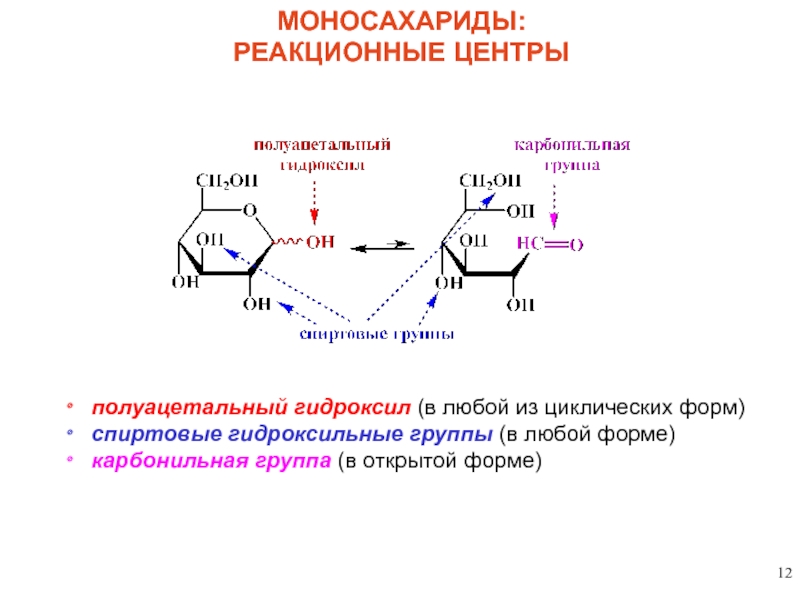
полуацетальный гидроксил (в любой из циклических форм)
спиртовые гидроксильные группы (в любой
карбонильная группа (в открытой форме)
МОНОСАХАРИДЫ:
РЕАКЦИОННЫЕ ЦЕНТРЫ
Слайд 13
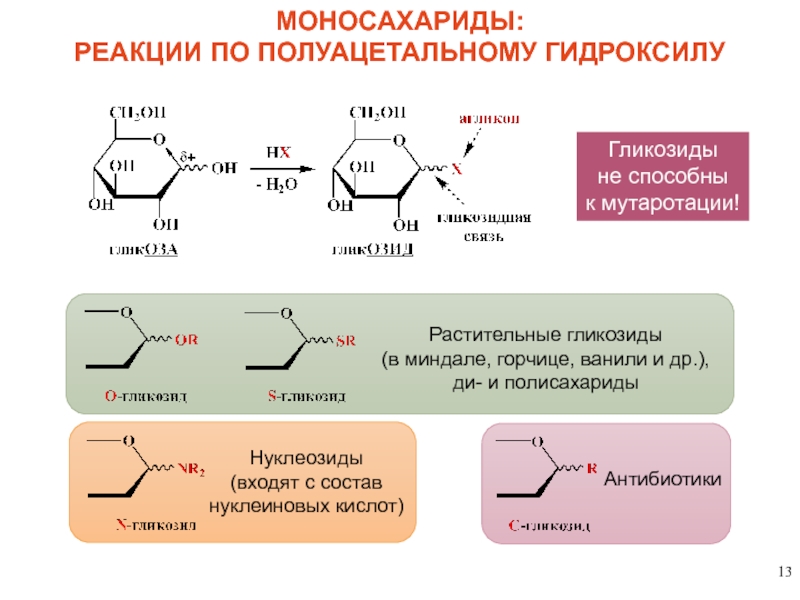
МОНОСАХАРИДЫ:
РЕАКЦИИ ПО ПОЛУАЦЕТАЛЬНОМУ ГИДРОКСИЛУ
Растительные
(в миндале, горчице, ванили и др.),
ди- и полисахариды
Нуклеозиды
(входят с состав
нуклеиновых кислот)
Антибиотики
Гликозиды
не способны
к мутаротации!
Слайд 14
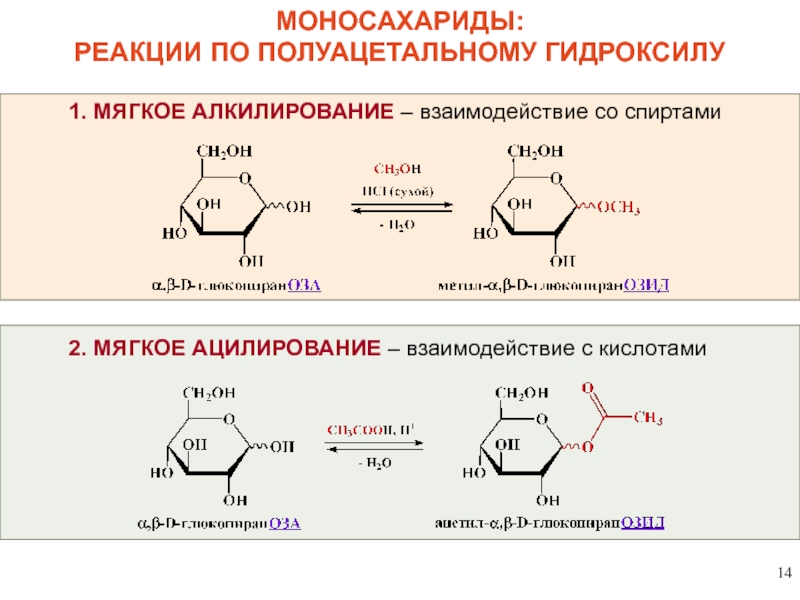
МОНОСАХАРИДЫ:
РЕАКЦИИ ПО ПОЛУАЦЕТАЛЬНОМУ ГИДРОКСИЛУ
1.
2. МЯГКОЕ АЦИЛИРОВАНИЕ – взаимодействие с кислотами
Слайд 15
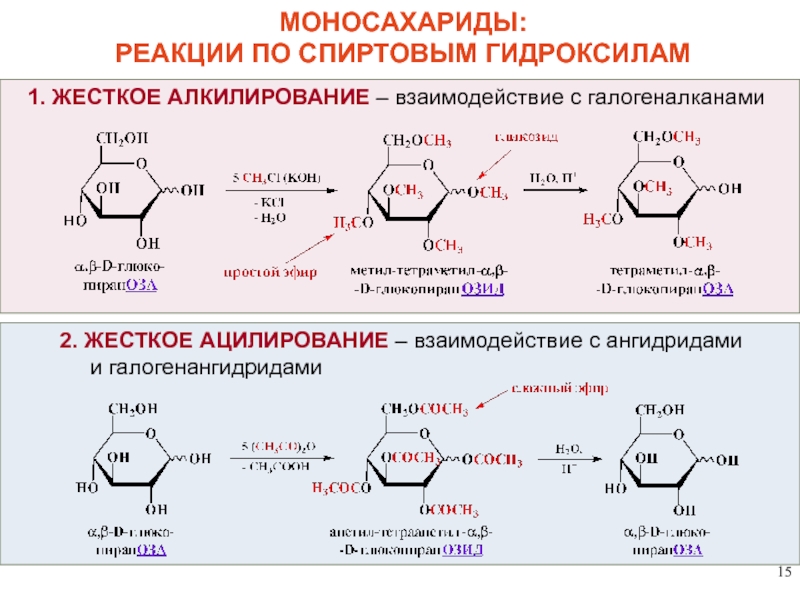
МОНОСАХАРИДЫ:
РЕАКЦИИ ПО СПИРТОВЫМ ГИДРОКСИЛАМ
1. ЖЕСТКОЕ АЛКИЛИРОВАНИЕ – взаимодействие с галогеналканами
2. ЖЕСТКОЕ
Слайд 16
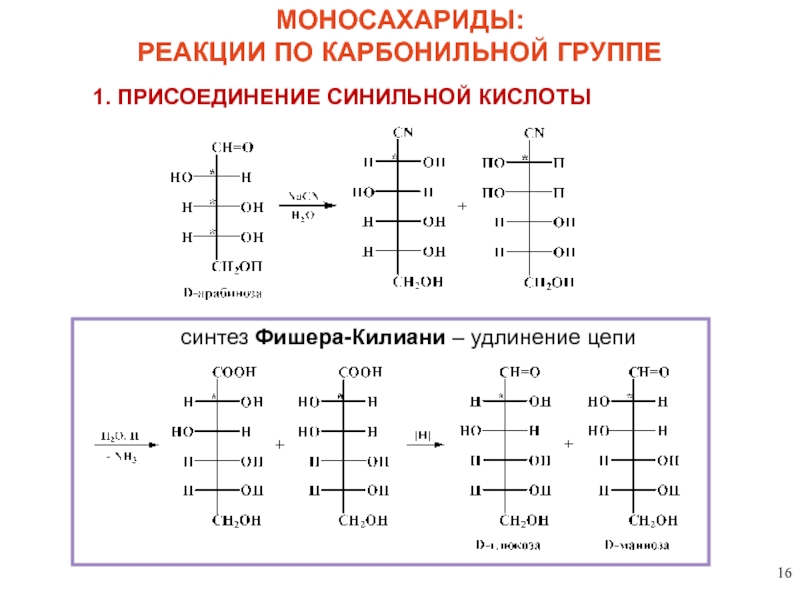
МОНОСАХАРИДЫ:
РЕАКЦИИ ПО КАРБОНИЛЬНОЙ ГРУППЕ
1. ПРИСОЕДИНЕНИЕ СИНИЛЬНОЙ КИСЛОТЫ
синтез Фишера-Килиани – удлинение цепи
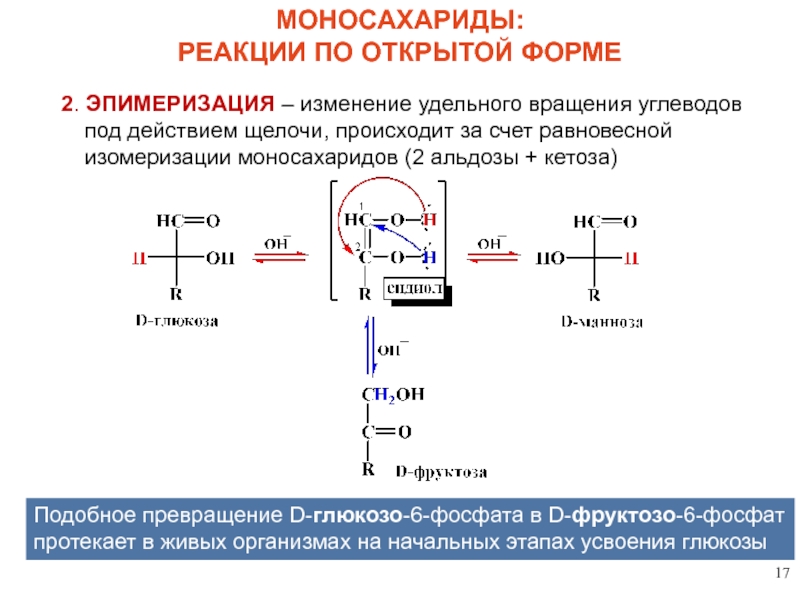
Слайд 17МОНОСАХАРИДЫ:
РЕАКЦИИ ПО ОТКРЫТОЙ ФОРМЕ
2. ЭПИМЕРИЗАЦИЯ – изменение удельного вращения углеводов под
Подобное превращение D-глюкозо-6-фосфата в D-фруктозо-6-фосфат протекает в живых организмах на начальных этапах усвоения глюкозы
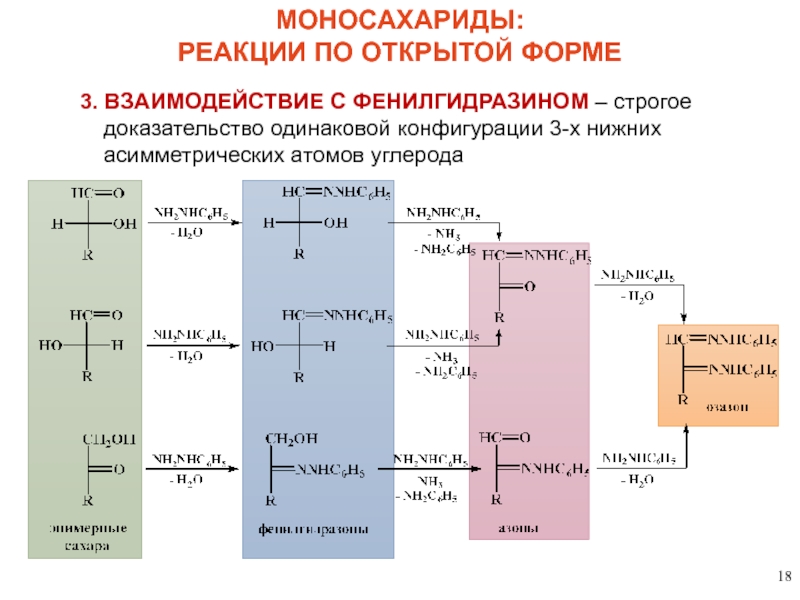
Слайд 18
МОНОСАХАРИДЫ:
РЕАКЦИИ ПО ОТКРЫТОЙ ФОРМЕ
3. ВЗАИМОДЕЙСТВИЕ С ФЕНИЛГИДРАЗИНОМ – строгое доказательство одинаковой
Слайд 19
МОНОСАХАРИДЫ:
OX-RED ПРОЦЕССЫ
1. ВОССТАНОВЛЕНИЕ – получение сахарных спиртов
[H]: а) Н2, Pt, tº
б)
Слайд 20
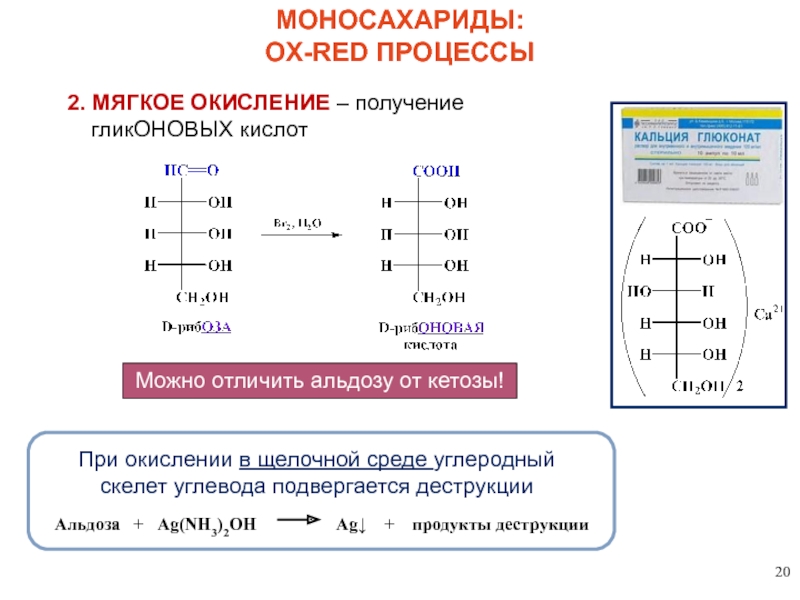
2. МЯГКОЕ ОКИСЛЕНИЕ – получение гликОНОВЫХ кислот
Можно отличить альдозу от кетозы!
При
Альдоза + Ag(NH3)2OH Ag↓ + продукты деструкции
МОНОСАХАРИДЫ:
OX-RED ПРОЦЕССЫ
Слайд 22
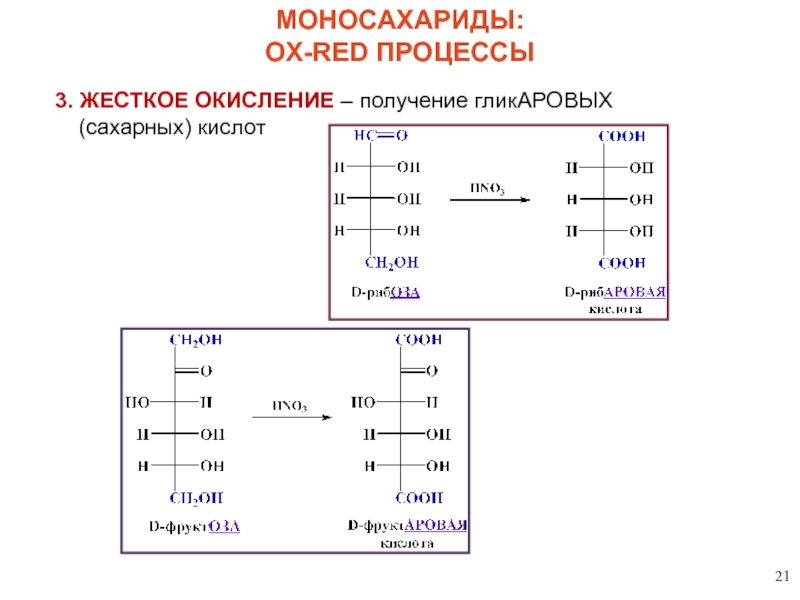
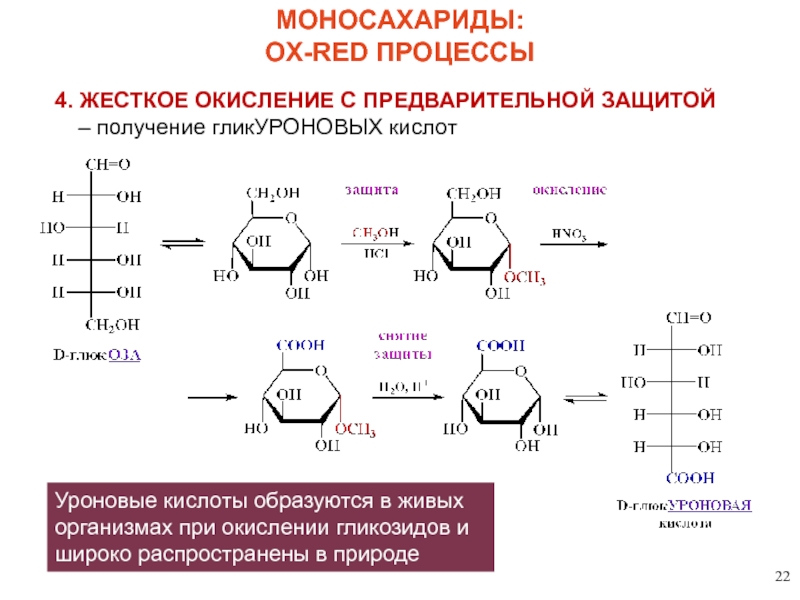
4. ЖЕСТКОЕ ОКИСЛЕНИЕ С ПРЕДВАРИТЕЛЬНОЙ ЗАЩИТОЙ – получение гликУРОНОВЫХ кислот
МОНОСАХАРИДЫ:
OX-RED ПРОЦЕССЫ
Уроновые
Слайд 23
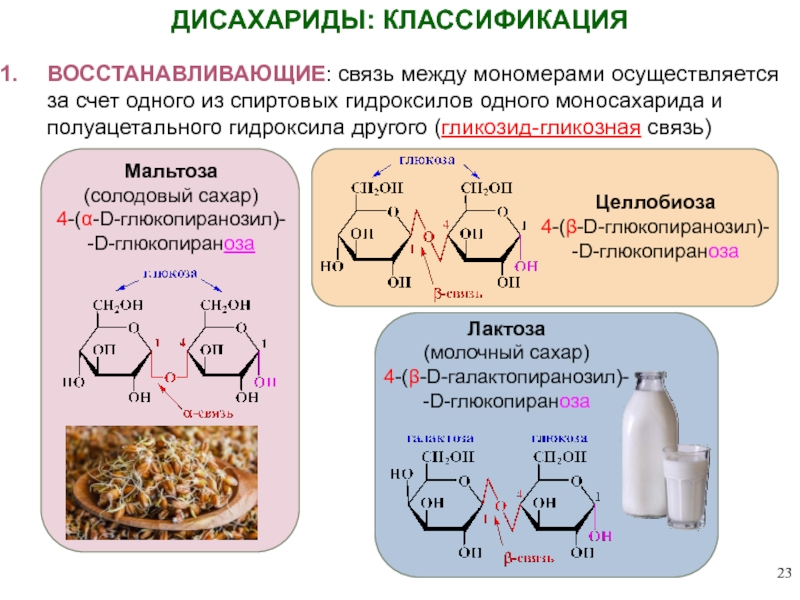
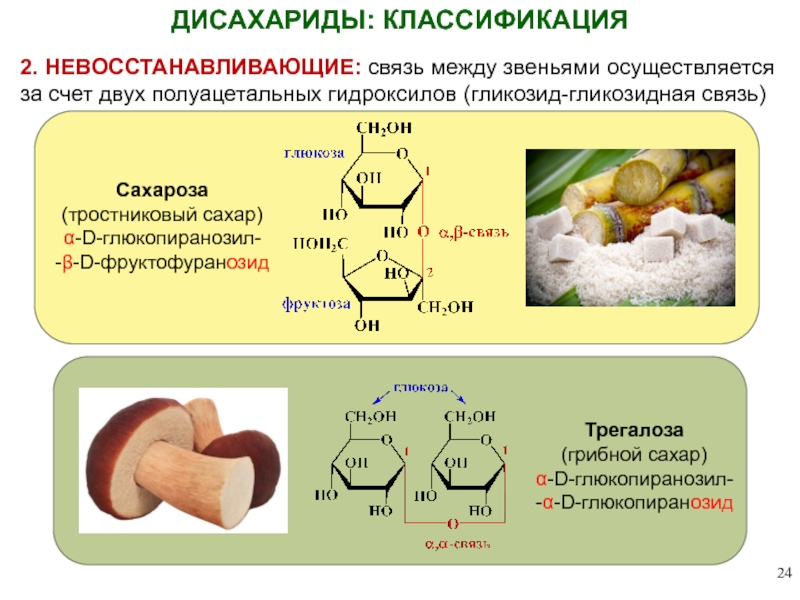
ДИСАХАРИДЫ: КЛАССИФИКАЦИЯ
ВОССТАНАВЛИВАЮЩИЕ: связь между мономерами осуществляется за счет одного из спиртовых
Мальтоза
(солодовый сахар)
4-(α-D-глюкопиранозил)-
-D-глюкопираноза
Целлобиоза
4-(β-D-глюкопиранозил)-
-D-глюкопираноза
Лактоза
(молочный сахар)
4-(β-D-галактопиранозил)-
-D-глюкопираноза
Слайд 24
ДИСАХАРИДЫ: КЛАССИФИКАЦИЯ
Трегалоза
(грибной сахар)
α-D-глюкопиранозил-
-α-D-глюкопиранозид
2. НЕВОССТАНАВЛИВАЮЩИЕ: связь между звеньями осуществляется за счет
Сахароза
(тростниковый сахар)
α-D-глюкопиранозил-
-β-D-фруктофуранозид
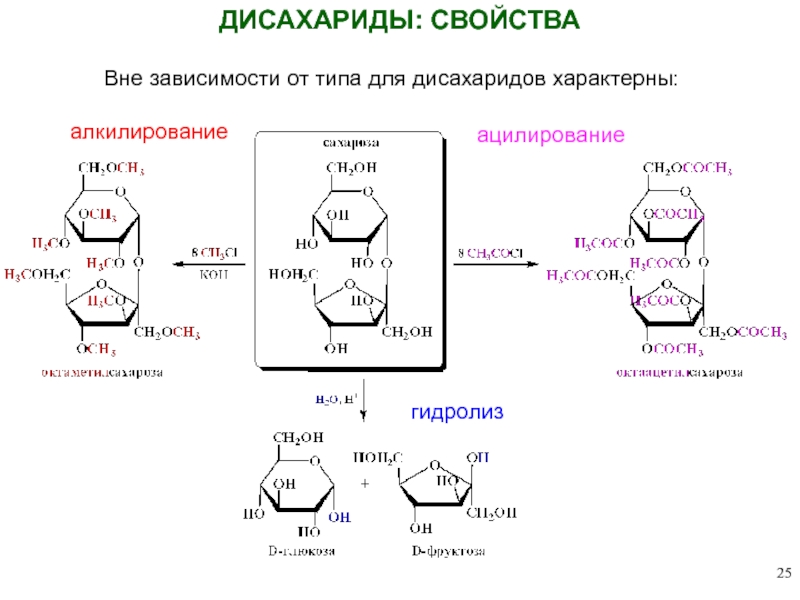
Слайд 25ДИСАХАРИДЫ: СВОЙСТВА
алкилирование
ацилирование
гидролиз
Вне зависимости от типа для дисахаридов характерны:
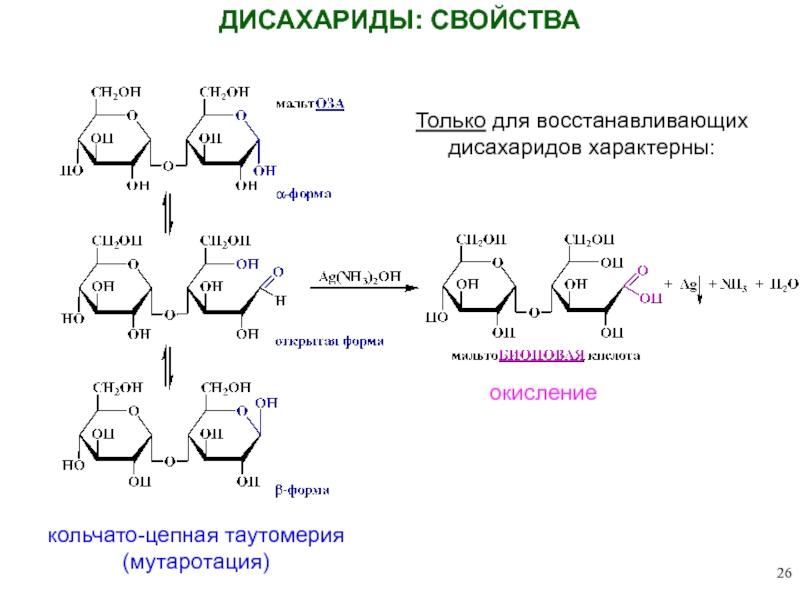
Слайд 26ДИСАХАРИДЫ: СВОЙСТВА
окисление
кольчато-цепная таутомерия
(мутаротация)
Только для восстанавливающих
дисахаридов характерны:
Слайд 27ГОМОПОЛИСАХАРИДЫ
ЦЕЛЛЮЛОЗА (клетчатка) – полимер D-глюкозы, остатки которой соединены β-(1-4)-гликозидными связями.
Имеет строго линейное нитевидное строение.
Структурный полисахарид.
Не переваривается большинством живых организмов.
Слайд 28
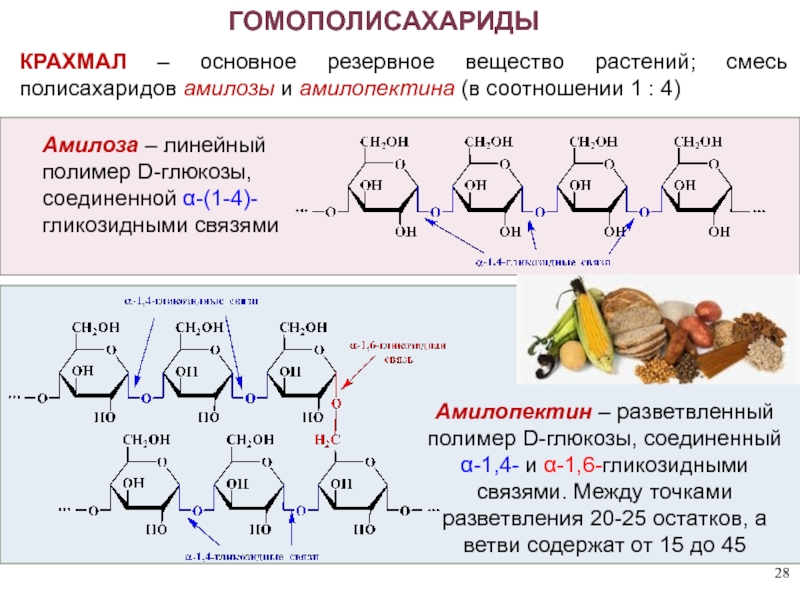
ГОМОПОЛИСАХАРИДЫ
КРАХМАЛ – основное резервное вещество растений; смесь полисахаридов амилозы и
Амилопектин – разветвленный полимер D-глюкозы, соединенный α-1,4- и α-1,6-гликозидными связями. Между точками разветвления 20-25 остатков, а ветви содержат от 15 до 45
Амилоза – линейный полимер D-глюкозы, соединенной α-(1-4)-гликозидными связями
Слайд 29
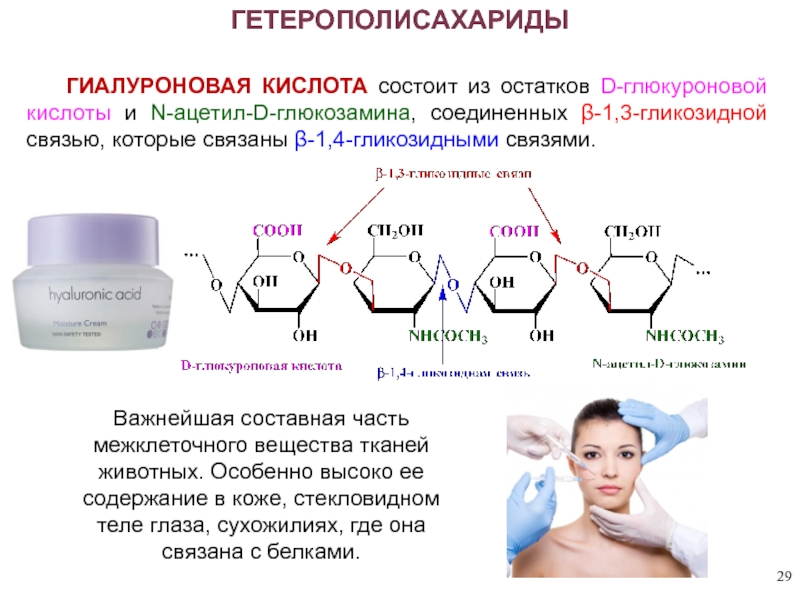
ГЕТЕРОПОЛИСАХАРИДЫ
Важнейшая составная часть межклеточного вещества тканей животных. Особенно высоко ее
ГИАЛУРОНОВАЯ КИСЛОТА состоит из остатков D-глюкуроновой кислоты и N-ацетил-D-глюкозамина, соединенных β-1,3-гликозидной связью, которые связаны β-1,4-гликозидными связями.



![свежеприготовленный раствор глюкозы [α]D = + 112º1. МУТАРОТАЦИЯ – изменение угла вращения плоскости поляризованного света](/img/tmb/1/66853/943dc30eb8e3fd434e9047e5b9ecf216-800x.jpg)
![МОНОСАХАРИДЫ:OX-RED ПРОЦЕССЫ1. ВОССТАНОВЛЕНИЕ – получение сахарных спиртов[H]: а) Н2, Pt, tºб) гидриды металлов](/img/tmb/1/66853/d3762051483def502bd5af3a41299215-800x.jpg)