- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Генетика. Инбридинг и гетерозис. Методы получения трансгенных животных и растений презентация
Содержание
- 1. Генетика. Инбридинг и гетерозис. Методы получения трансгенных животных и растений
- 2. Инбридинг и аутбридинг Аутбридинг – скрещивание
- 3. Инбридинг При инбридинге родители являются родственниками и
- 4. Инбредные линии и селекционные работы Инбридинг
- 5. Инбредная депрессия При близкородственном скрещивании (или
- 6. Гетерозис (гибридная сила) Примеры: мул = лошадь
- 7. Типы гетерозиса по А.Густаффсону Репродуктивный гетерозис
- 8. Объяснения явления гетерозиса. Теория доминирования Теория доминирования,
- 9. Объяснения явления гетерозиса. Теория сверхдоминирования В
- 10. Тотипотентность генома. Тотипотентность — клеточная характеристика способности
- 11. Тотипотентность генома растений В исследованиях растений проблема
- 12. Трансплантация ядра клетки эпителия кишечника головастика шпорцевой
- 13. Опыты Ди Берардино и Хофнера В
- 14. Клонирование появление естественным путём или получение
- 15. Эксперимент Яна Вилмута, 1997 г В феврале
- 16. История успешных клонирований 1970 - успешное
- 17. Методы получения трансгенных животных и растений Линии
- 18. Первые трансгенные животные В 1974 г. Р.
- 19. Использование ретровирусов Инфицирование предымплантированных эмбрионов рекомбинантными ретровирусами
- 20. Клетки тератокарциномы мыши (TCC) TCC способны размножаться
- 21. Использование плюрипотентных эмбриональных стволовых клеток При
- 22. Микроиньекция ооцитов Донорных мышей-самок с экспериментальной суперовуляцией
- 23. Трансгенная технология в фундаментальных научных исследований
- 24. Трансгенные растения Растения имеют очень важное преимущество
- 25. ПЕРЕНОС ГЕНОВ В РАСТЕНИЯ ИЗ БАКТЕРИЙ РОДА
- 26. ПЕРЕНОС ГЕНОВ В РАСТЕНИЯ ИЗ БАКТЕРИЙ РОДА
- 27. Прямой метод введение трансгена
- 28. Использование трансгенных растений Синтез в растениях
- 29. Применение методов молекулярной генетики в криминалистике В
- 30. Генетическая дактилоскопия 1985 статья профессора Лестерского
- 31. Анализ полиморфизма длины рестриктазных фрагментов ДНК В
- 32. Анализ полиморфизма длины амплифицированных фрагментов ДНК Гипервариабельные
- 33. Анализ полиморфизма нуклеотидных последовательностей ДНК В результате
- 34. ПЦР в этнографии В середине 80-х годов
- 35. Секвенирование в этнографии Важной вехой в развитии
Слайд 1Генетика.
Лекция № 5.
ИНБРИДИНГ И ГЕТЕРОЗИС. МЕТОДЫ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ ЖИВОТНЫХ И
Слайд 2Инбридинг и аутбридинг
Аутбридинг – скрещивание особей, неродственных между собой. Аутбридинг
Инбридинг– скрещивание особей, находящихся между собой в близком родстве. У растений этот тип скрещивания называют также инцухт. Инбридинг – нормальный способ оплодотворения для самоопыляющихся растений: мягкая пшеница, рис, ячмень, горох, фасоль, сорго и др.
Слайд 3Инбридинг
При инбридинге родители являются родственниками и поэтому имеют много одинаковых аллелей.
Слайд 4Инбредные линии и селекционные работы
Инбридинг приводит к повышению постоянства фенотипических
Инбридинг широко используется селекционерами для усиления целевых характеристик породы или сорта. Наиболее распространённая разновидность инбридинга, которая используется при селекции, называется лайнбридингом. При лайнбридинге потомки спариваются с каким-либо своим предком.
Слайд 5Инбредная депрессия
При близкородственном скрещивании (или самоопылении у растений) может возникать
Вредные последствия инбридинга.
Происходит снижение плодовитости животных (до бесплодия).
Снижение жизнеспособность.
Снижение продуктивности.
Ухудшение развития животных, происходит измельчение потомства.
Появление уродов.
Слайд 6Гетерозис (гибридная сила)
Примеры: мул = лошадь + осел.
Этот межвидовой
Гетерозис - это свойство помесей и гибридов первого поколения превосходить по биологическим и хозяйственно-полезным признакам исходные родительские формы.
Слайд 7Типы гетерозиса по А.Густаффсону
Репродуктивный гетерозис – повышение фертильности: большая продуктивность
Соматический гетерозис – более мощное развитие вегетативных частей растения.
Приспособительный (адаптивный) – повышенная жизнеспособность гибридов (устойчивость к высоким и низким температурам, засухе, болезням и вредителям).
Одновременное проявление всех типов гетерозиса практически не наблюдается.
Слайд 8Объяснения явления гетерозиса. Теория доминирования
Теория доминирования, основывается на гипотезе, что в
Слайд 9Объяснения явления гетерозиса. Теория сверхдоминирования
В этой ситуации невелика вероятность того,
отталкиваемся от того, что у гибридов высока гетерозиготность (доля локусов, несущих разные аллели, среди всех локусов)
Существуют локусы, гетерозиготность по которым ценна сама по себе, поскольку приводит к фенотипу, который «лучше», чем фенотип обеих гомозигот. В природных популяциях велика доля полиморфных локусов, и вероятно, что сбалансированный полиморфизм поддерживается именно благодаря превосходству гетерозигот.
Слайд 10Тотипотентность генома.
Тотипотентность — клеточная характеристика способности к формированию всех клеточных типов
Исходные предположения:
Специализация клеток животных сопровождается утратой генов, которые далее не понадобятся для данного типа клеток.
Во всех клетках сохраняются все гены, однако в тех клетках, где их деятельность не нужна, они находятся в неактивном состоянии.
Слайд 11Тотипотентность генома растений
В исследованиях растений проблема тотипотентности не возникла, как как
Слайд 12Трансплантация ядра клетки эпителия кишечника головастика шпорцевой лягушки в неоплодотворенное яйцо
Опыт Гердона
Слайд 13Опыты Ди Берардино и Хофнера
В данных работах использовали для трансплантации
Цитоплазма ооцитов амфибий содержит факторы, восстанавливающие тотипотентность ядер дифференцированных соматических клеток. Эти факторы реактивируют репрессированные участки генома.
Слайд 14Клонирование
появление естественным путём или получение нескольких генетически идентичных организмов путём
получение нескольких идентичных копий наследственных молекул (молекулярное клонирование).
биотехнологические методы, используемые для искусственного получения клонов организмов, клеток или молекул.
Группа генетически идентичных организмов или клеток — клон.
Слайд 15Эксперимент Яна Вилмута, 1997 г
В феврале І997 прошла первая успешная трансплантация
Овечка Долли
Из 277 экспериментально полученных зигот только одна прошла все стадии развития вплоть до рождения ягненка, который был беломордым. Тот факт, что овечка выросла из яйцеклетки с ядром из взрослого животного, доказывает отсутствие необратимых модификаций генетическопо материала в ходе дифференцировки клеток.
Слайд 16История успешных клонирований
1970 - успешное клонирование лягушки
1985 - клонирование костных
1996 — овечка Долли.
1997 — первая мышь.
1998 — первая корова.
1999 — первый козёл.
2001 — первая кошка.
2002 — первый кролик.
2003 — первые бык, мул, олень.
2004 — первый опыт клонирования с коммерческими целями (кошки).
2005 — первая собака (афганская борзая по кличке Снуппи).
2006 — первый хорёк
2007 - вторая собака
2008 — третья собака (лабрадор по кличке Чейс). Клонирована по государственному заказу. Начало коммерческого клонирования собак
2009 г. — первое успешное клонирование верблюда
2011 г. — восемь клонированных щенков койота.
Слайд 17Методы получения трансгенных животных и растений
Линии животных и растений, полученные введением
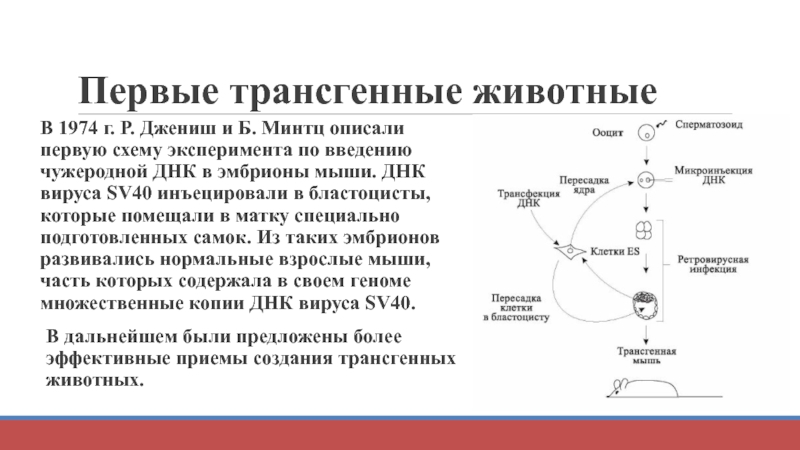
Слайд 18Первые трансгенные животные
В 1974 г. Р. Джениш и Б. Минтц описали
В дальнейшем были предложены более эффективные приемы создания трансгенных животных.
Слайд 19Использование ретровирусов
Инфицирование предымплантированных эмбрионов рекомбинантными ретровирусами - относительно несложная процедура, не
Слайд 20Клетки тератокарциномы мыши (TCC)
TCC способны размножаться в культуре, а после инъекции
Слайд 21Использование плюрипотентных эмбриональных стволовых клеток
При создании трансгенных животных используют также
Слайд 22Микроиньекция ооцитов
Донорных мышей-самок с экспериментальной суперовуляцией скрещивают с самцами-производителями, через 12
Слайд 23Трансгенная технология в фундаментальных научных исследований
анализ цис-действующих контролирующих элементов, ответственных
анализ физиологических последствий (на уровне целого организма) различных отклонений в экспрессии генов, в том числе онкогенов;
получение случайных новых мутантов, возникающих в популяции трансгенных мышей в результате внедрения трансгена в последовательность того или иного функционального гена (мутировавший ген можно выделить, используя трансген в качестве гибридизационной пробы);
получение мутантов с направленно инактивированными генами — так называемых нокаутных (от англ. knock out — выбить) животных.
Слайд 24Трансгенные растения
Растения имеют очень важное преимущество перед животными в экспериментальной биологии.
Ключевую роль в развитии генетической инженерии растений сыграло изучение механизмов переноса специфичных фрагментов плазмидной ДНК из бактерии Agrobacterium tumefaciens в ядро растительной клетки с последующей их интеграцией в хромосомную ДНК. Выяснение основных закономерностей этого процесса позволило создать относительно простую и надежную систему введения чужеродных генов в клетки растений с последующей селекцией растений, содержащих целевой трансген.
Слайд 25ПЕРЕНОС ГЕНОВ В РАСТЕНИЯ ИЗ БАКТЕРИЙ РОДА AGROBACTERIUM
А. tumefaciens являются грамотрицательными
Вскоре была выдвинута гипотеза о том, что растительные клетки трансформируются в результате того, что бактерия вводит в них некий агент, индуцирующий опухоль. Изучение природы индуктора опухолей A. tumefaciens позволило установить, что опухолеродным агентом у этой бактерии является плазмида Ti.
Слайд 26ПЕРЕНОС ГЕНОВ В РАСТЕНИЯ ИЗ БАКТЕРИЙ РОДА AGROBACTERIUM
Т-ДНК, способна передаваться в
Экспериментально установлено, что последовательность ДНК, заключенная между TL и TR, никак не влияет на эффективность переноса Т-ДНК из агробактерии в клетку растения. Это позволило предположить, что Т-ДНК можно использовать для переноса чужеродных генов из A. tumefaciens в геном растительных клеток.
Слайд 27Прямой метод введение трансгена в растения
Метод бомбардирования микрочастицами.
Вводимые методом бомбардирования плазмиды обычно содержат гены, необходимые для размножения и селекции гибридных плазмид в бактериальных клетках, а также селективный и целевой гены, находящиеся под контролем промоторов и терминаторов транскрипции, функционирующих в растениях.
Слайд 28Использование трансгенных растений
Синтез в растениях чужеродных белков медицинского назначения
Терапевтические
Съедобные вакцины
Получение трансгенных растений с новыми биотехнологическими свойствами (устойчивость к гербицидам, к насекомым, к вирусам, к неблагоприятным природным факторам, изменение окраски в декоративных целях)
Трансгенные растения в сельском хозяйстве (генетически модифицированные источники пищи).
Слайд 29Применение методов молекулярной генетики в криминалистике
В криминалистике практические идентификационные исследования предполагают
Индивидуализирующие возможности маркерных систем зависят от степени их вариабельности и количества вариантов в популяции. Чем эти величины больше, тем выше специфичность маркера, а значит, его способность выделять конкретный объект среди других, даже сходных по иным признакам.
У всех известных биохимических маркеров индивидуализирующий потенциал оказывается недостаточно высок для точной идентификации. Например, некоторые биологические характеристики, выявляемые классическими серологическими маркерами - эритроцитарными антигенами системы АВО, встречаются у каждого третьего или четвертого индивидуума.
Слайд 30Генетическая дактилоскопия
1985 статья профессора Лестерского университета в Англии А. Джеффриса «Индивидуально-специфичные
“Судебно-экспертное использование "отпечатков пальцев" ДНК”
Генетическая дактилоскопия или ДНК-дактилоскопия - система научных методов биологической идентификации индивидуумов на основе уникальности последовательности чередования нуклеотидов в цепочке ДНК каждого живого существа (за исключением однояйцевых близнецов), своеобразного «генетического отпечатка», остающегося индивидуальным и неизменным на протяжении всей жизни индивидуума (организма).
Открытие феномена локального генетического гиперполиморфизма высокоэффективных молекулярных зондов типа минисателлитной ДНК предоставили новые возможности для решения проблемы индивидуализации человека и установления кровнородственных связей.
Слайд 31Анализ полиморфизма длины рестриктазных фрагментов ДНК
В результате различных мутаций в молекулах
Схема расположения на гомологичных хромосомах соседних участков узнавания (ai и ai+1; bi и bi+1) двух рестриктаз (I и II), зачерненный участок - область гомологии зонда; справа - схематическая картина результата блот-гибридизации с данным зондом суммарной ДНК, гидролизованной рестриктазами I и II
Слайд 32Анализ полиморфизма длины амплифицированных фрагментов ДНК
Гипервариабельные локусы VNTR-типа содержат различное число
Электрофореграмма (окрашивание серебром)
амплифицированных фрагментов ДНК - аллелей
хромосомного локуса ApoB-3'VNTR (2р24-р23) восьми неродственных индивидуумов
Слайд 33Анализ полиморфизма нуклеотидных последовательностей ДНК
В результате различных мутаций ряд локусов имеют
Выявление нуклеотидных замен в митохондриальной ДНК методом прямого флуоресцентного секвенирования