Слайд 1Фотосинтез: что делать, когда все, что можно, уже окислилось?
а/ умереть от
отсутствия энергии
б/ найти способ «регенерации» восстановленных соединений :
СО2 + Н2О → (СН2О) + О2
Для этого необходимо:
1. Найти «псевдонеиссякаемый» источник энергии (вспоминая первую лекцию – безотказного кредитора для безнадежной игры…)
2. Придумать систему трансформации этой энергии в энергию восстановленных соединений.
Псевдонеиссякаемый источник энергии на Земле –
только энергия звезды по имени Солнце…
Таким образом, основные задачи:
поймать энергию солнечных квантов
преобразовать ее в энергию
восстановленных соединений.
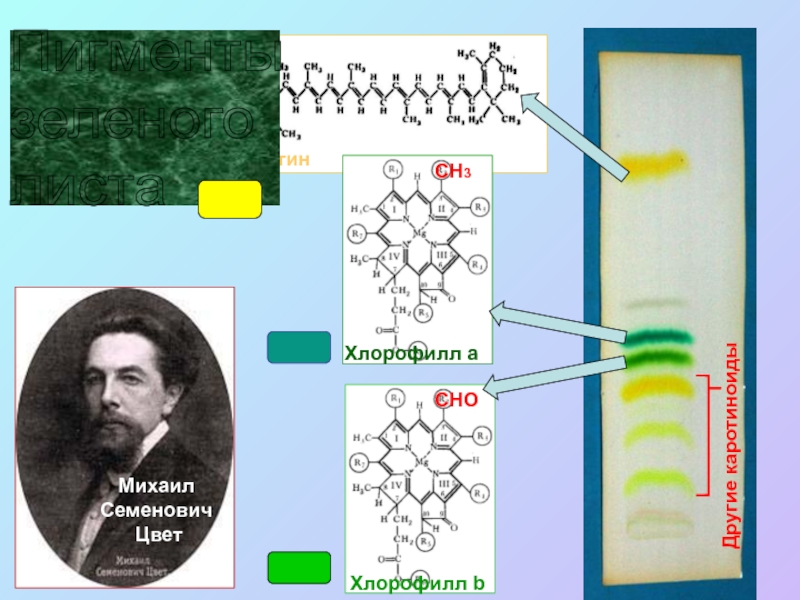
Слайд 2
Другие каротиноиды
Пигменты
зеленого
листа
Слайд 3Хлорофилл: двуликий Янус Red-Ox реакций
Хлорофиллов >10:
Хл. а, b, c1, с2,
d, e;
Б-хл. a, b, c, d.
Единственная
молекула которая
может:
1. Поглощать hν и
трансформировать
эту энергию в е-*
2. Обратимо
окисляться, т.е.
отдавать е-* с
последующим
заполнением
«дырки»
Т.о. иметь два Еo’
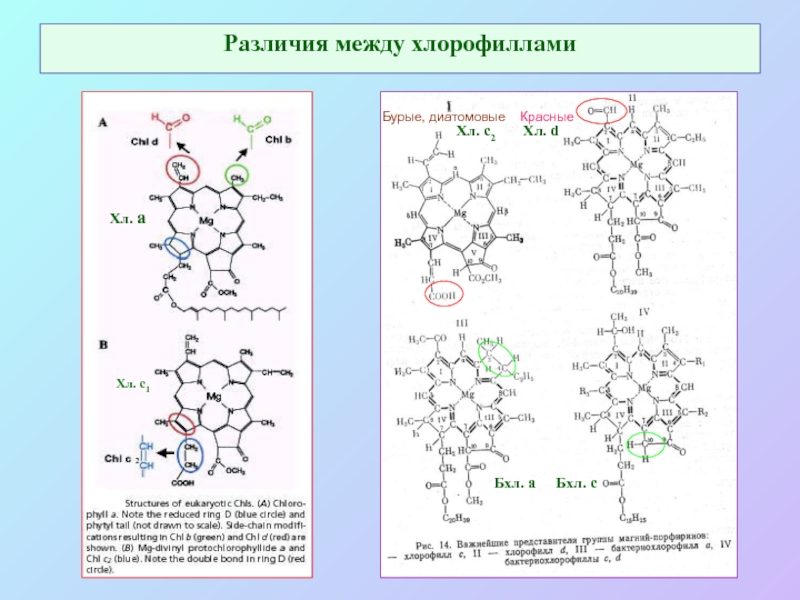
Слайд 4Различия между хлорофиллами
Хл. а
Хл. с2 Хл. d
Бхл. а
Бхл. с
Хл. с1
2
Бурые, диатомовые Красные
Слайд 5Основные структурные особенности молекулы хлорофилла
Конъюгированная система двойных связей: основная 18-членная π-система
+ дополнителные в I, II, V кольцах.
Mg – минимум электроотрицательности; изменяет симметрию молекулы хлорофилла; «активирует» электроны пиррольных азотов
V-кольцо – «форбиновая структура»: две важных группы: карбонильная при С9 (участвует в n – π переходах) и кетоэфирная при С10 – транс- (хл-л а) или цис- (хл-л а’).
Гидрофобный «хвост» (обычно С20 – фитол). Структурная роль.
Слайд 6δ-амнолевулиновая кислота – проедшественник гема и хлорофиллов.
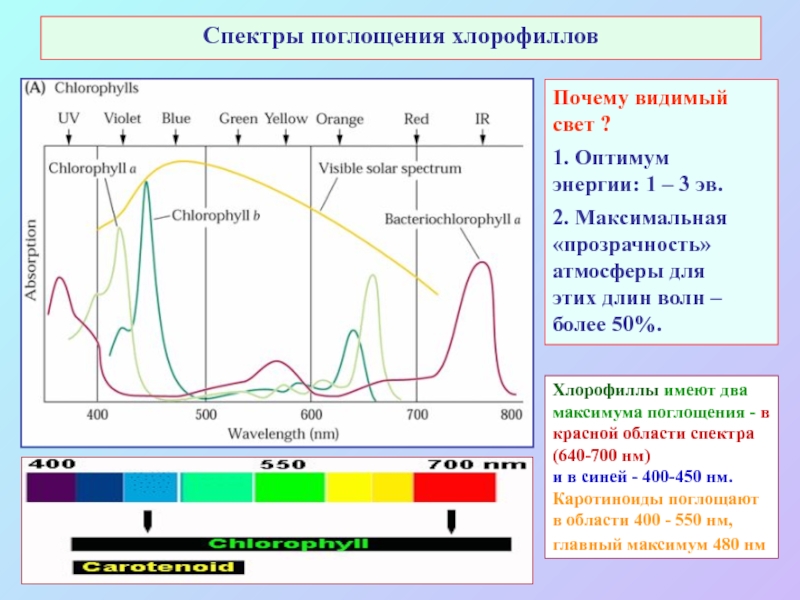
Слайд 7Спектры поглощения хлорофиллов
Почему видимый
свет ?
1. Оптимум
энергии: 1 – 3
эв.
2. Максимальная
«прозрачность»
атмосферы для
этих длин волн –
более 50%.
Хлорофиллы имеют два максимума поглощения - в красной области спектра (640-700 нм)
и в синей - 400-450 нм. Каротиноиды поглощают в области 400 - 550 нм,
главный максимум 480 нм
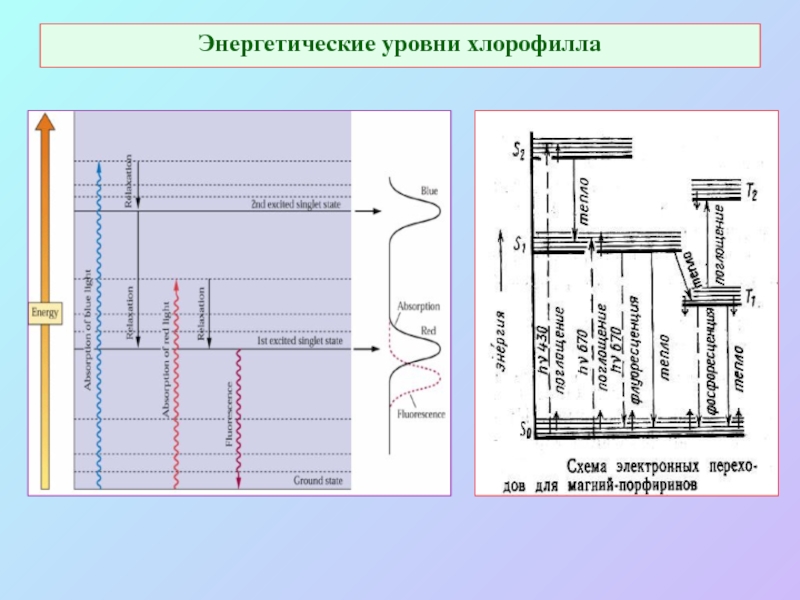
Слайд 8Энергетические уровни хлорофилла
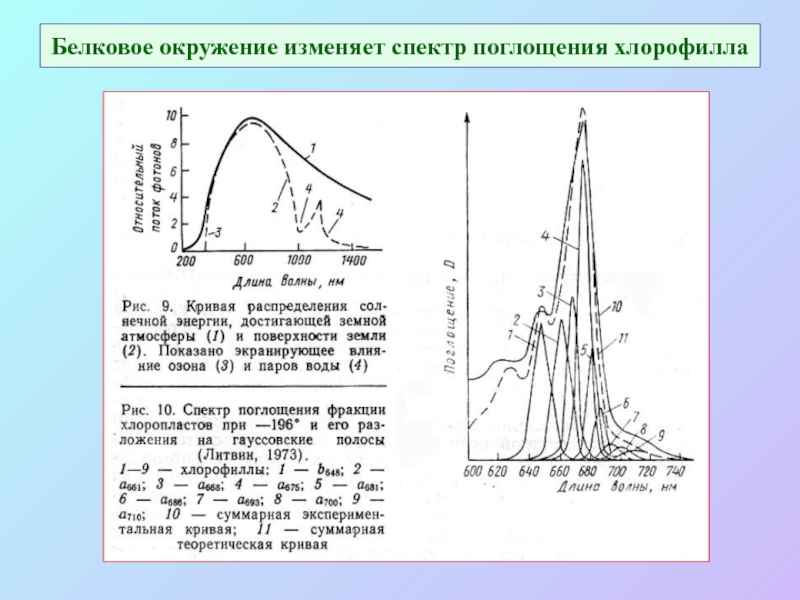
Слайд 9Белковое окружение изменяет спектр поглощения хлорофилла
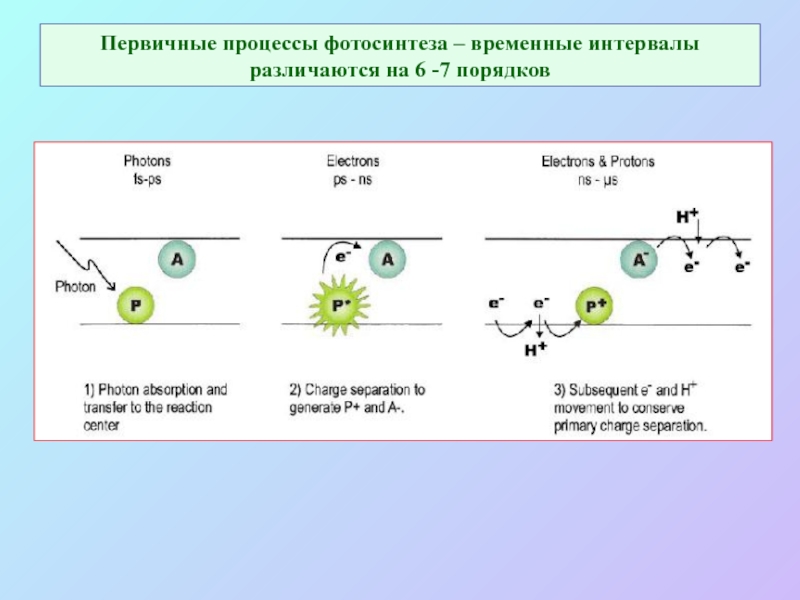
Слайд 10Первичные процессы фотосинтеза – временные интервалы различаются на 6 -7 порядков
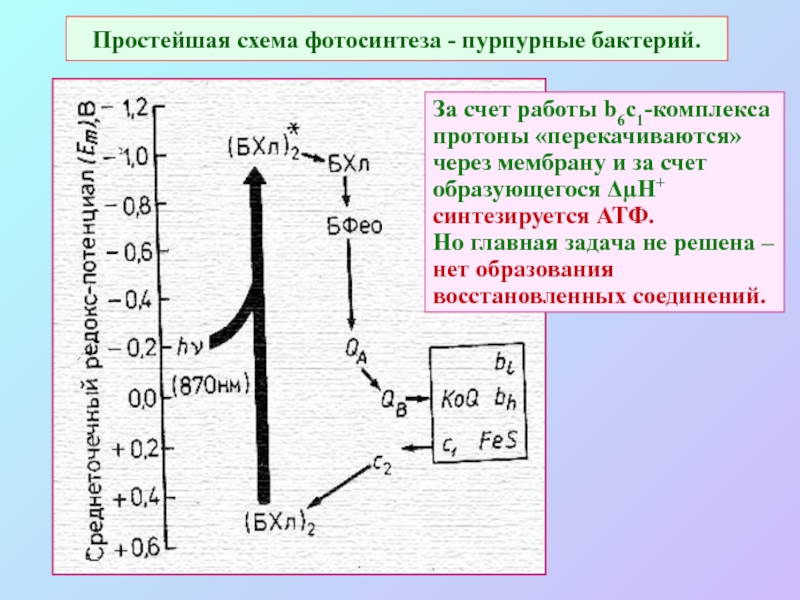
Слайд 11Простейшая схема фотосинтеза - пурпурные бактерий.
За счет работы b6c1-комплекса протоны
«перекачиваются» через мембрану и за счет образующегося ΔµН+ синтезируется АТФ.
Но главная задача не решена – нет образования восстановленных соединений.
Слайд 12 Вторая простейшая схема фотосинтеза - серные зеленые бактерий.
Восстановленные
соединения образуются!
+0,3
0
-0,3
-0,6
-0,9
-1,2
Em
Слайд 13 Основные требования к донору электронов:
Ео’ меньше Ео’ хл+ (т.е. может отдавать
е- на хл+)
Продукты окисления нетоксичны (желательно)
Его должно быть много
Н2S – хорош по всем параметрам, кроме последнего:
1. Ео’н2S = -0,23 – электрон достаточно легко «забрать»
2. Продукт окисления (сера) - легко уводится из реакции
Н2О – отвратителен по всем параметрам, кроме последнего:
1. Ео’н2о = +0,82 – очень много, электрон «оторвать» трудно
2. Продукт окисления (кислород) - очень токсичен.
Но последний фактор оказался решающим.
Очередная проблема: где взять источник (донор) электронов (окисляемое соединение)?
Слайд 14Как решить проблемы водички в качестве донора электрона? Энергия квантов видимого
света.
400нм (синий свет) - 700нм (красный свет)
λ энергия фотона ΔЕо’ 1 моль фотонов
700нм 0,28 аттодж. 1,77 э-в 1,7 в 171 кдж
640нм 0,31 аттодж. 1,94 э-в 1,9 в 187 кдж
500нм 0,40 аттодж. 2,48 э-в 2,4 в 239 кдж
400нм 0,50 аттодж 3,1 э-в 3.0 в 299 кдж
Энергии кванта света (с учетом затрат на стабилизацию - ~50%) не хватает, чтобы и окислить
воду, и восстановить НАДФ+. Что делать?
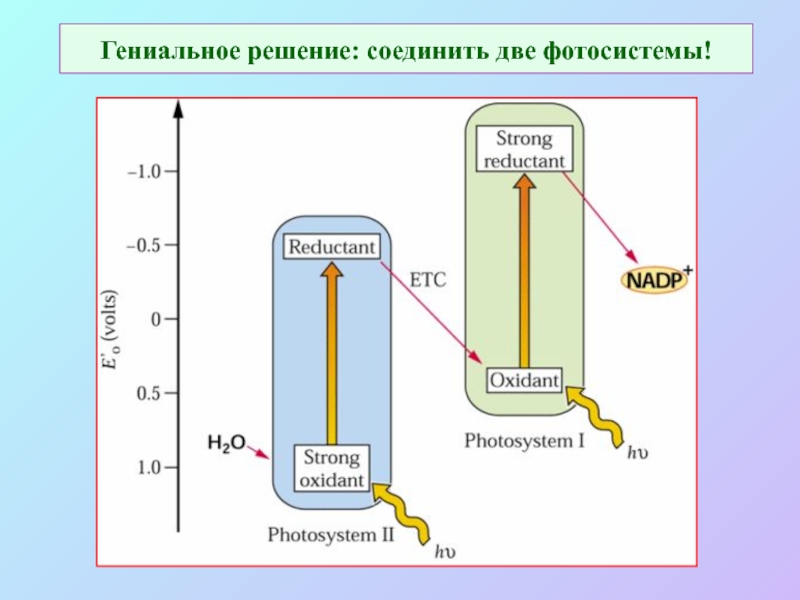
Слайд 15Гениальное решение: соединить две фотосистемы!
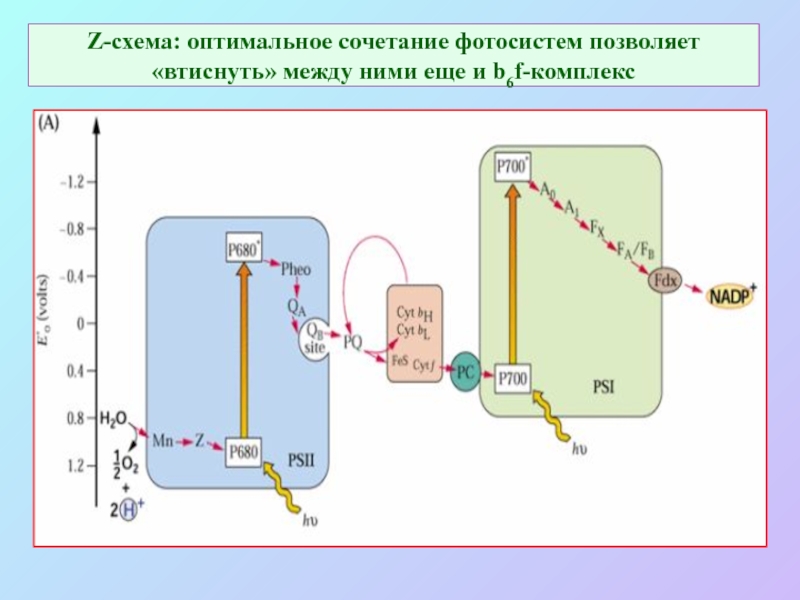
Слайд 16Z-схема: оптимальное сочетание фотосистем позволяет «втиснуть» между ними еще и b6f-комплекс
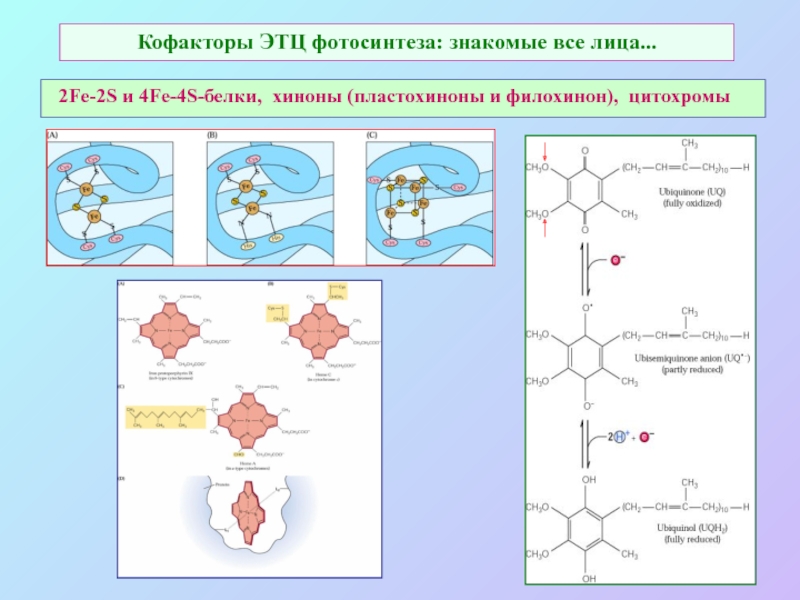
Слайд 17Кофакторы ЭТЦ фотосинтеза: знакомые все лица...
2Fe-2S и 4Fe-4S-белки, хиноны (пластохиноны
Слайд 18Z-схема фотосинтеза.
Расположение
кофакторов
И «механический» аналог - для наглядности...
мономерный хла
филохинон (вит.К)
Слайд 19Red-Ox потенциалы компонентов ЭТЦ хлоропластов
ФСII
P680*
- 0.7
Pheo - 0.6
QA - 0.1
QB ~ 0
cytb559 L + 0.08
cytb559 H + 0.38
H2O/O2 + 0.82
P680 +1.12
ФСI
P700* ~ 1.2
A0 (P695) - 1.10
A1 (вит К) - 0.88
Fx - 0.73
FA - 0.59
FB - 0.55
P700 + 0.52
Cyt b/f
CytbL - 0.15
CytbH - 0.05
FeSРиске + 0.30
Cytf + 0.34
PQ ~ 0
Fd - 0.42
FMN - 0.36
NADPH - 0.32
PC +0.37
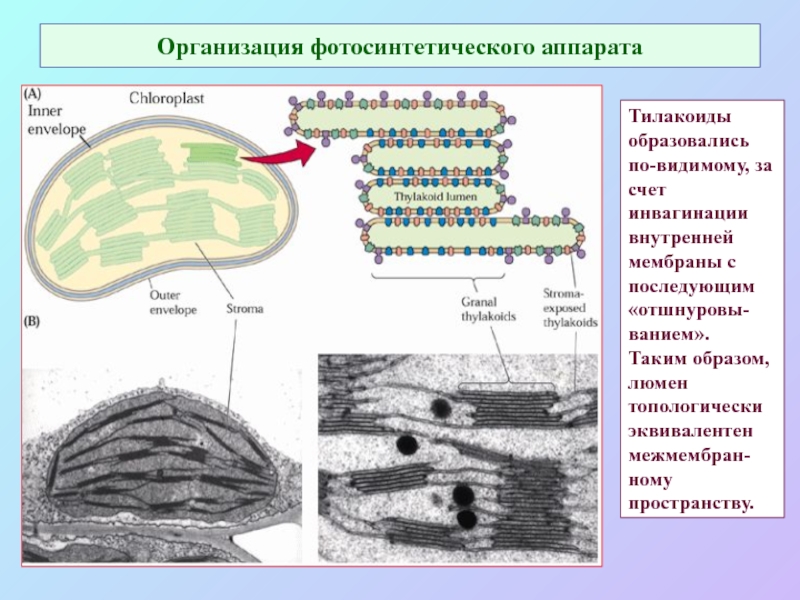
Слайд 20Организация фотосинтетического аппарата
Тилакоиды образовались по-видимому, за счет инвагинации внутренней мембраны с
последующим «отшнуровы-ванием».
Таким образом, люмен топологически эквивалентен межмембран-ному пространству.
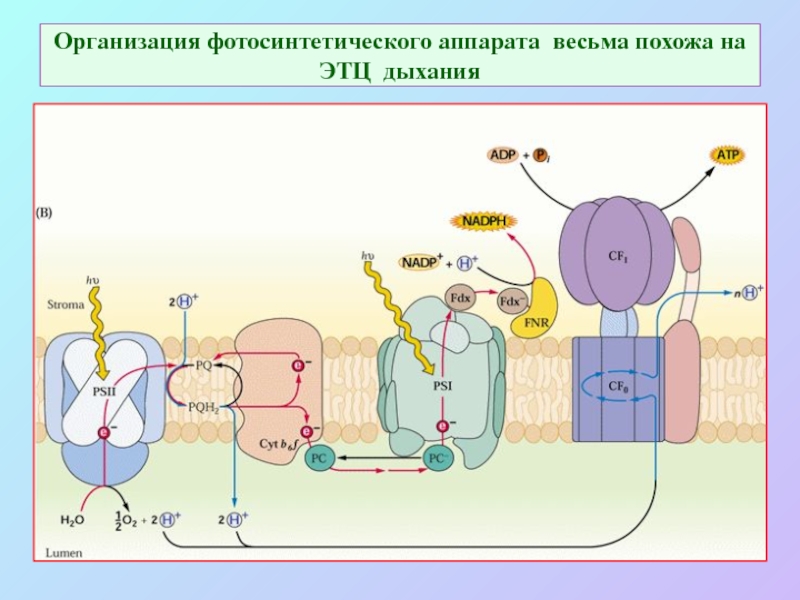
Слайд 21Организация фотосинтетического аппарата весьма похожа на ЭТЦ дыхания
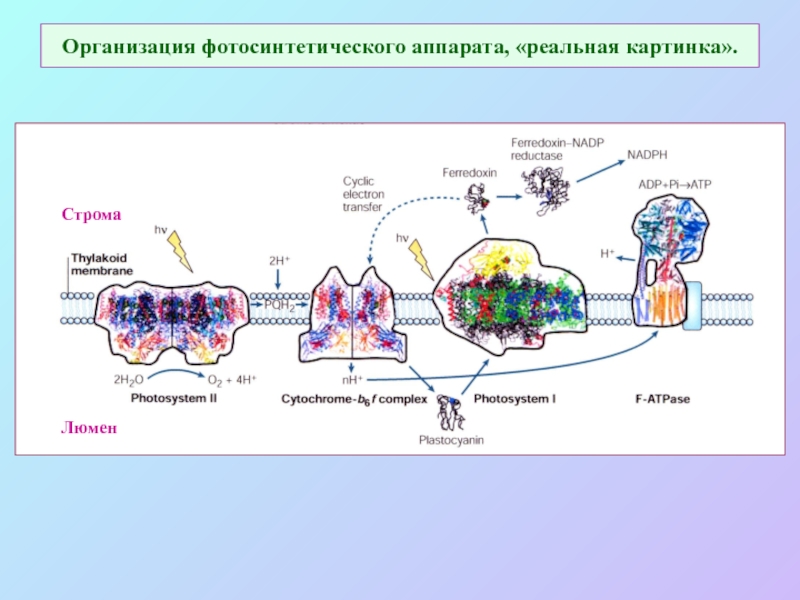
Слайд 22Организация фотосинтетического аппарата, «реальная картинка».
Строма
Люмен
Слайд 23В6f-комплекс: два такта работы Q-цикла. Как в митохондриях…
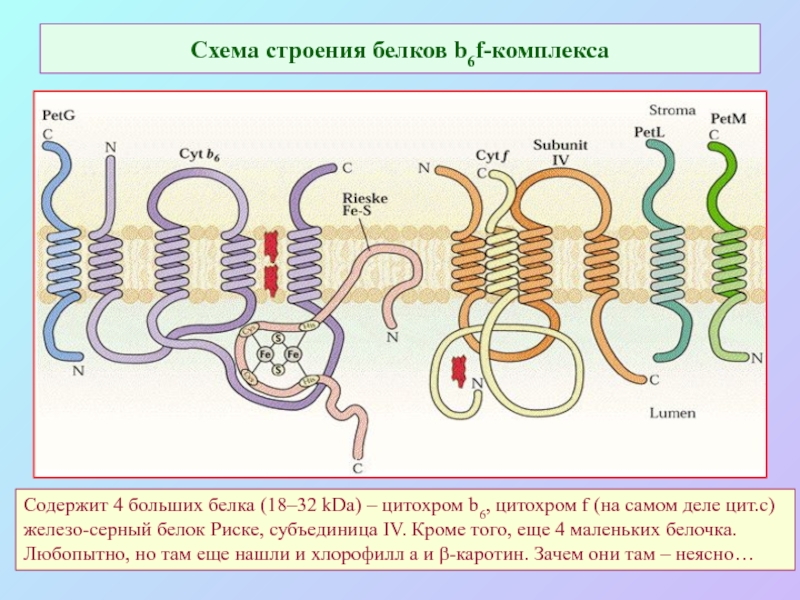
Слайд 24Схема строения белков b6f-комплекса
Содержит 4 больших белка (18–32 kDa) – цитохром
b6, цитохром f (на самом деле цит.с)
железо-серный белок Риске, субъединица IV. Кроме того, еще 4 маленьких белочка.
Любопытно, но там еще нашли и хлорофилл а и β-каротин. Зачем они там – неясно…
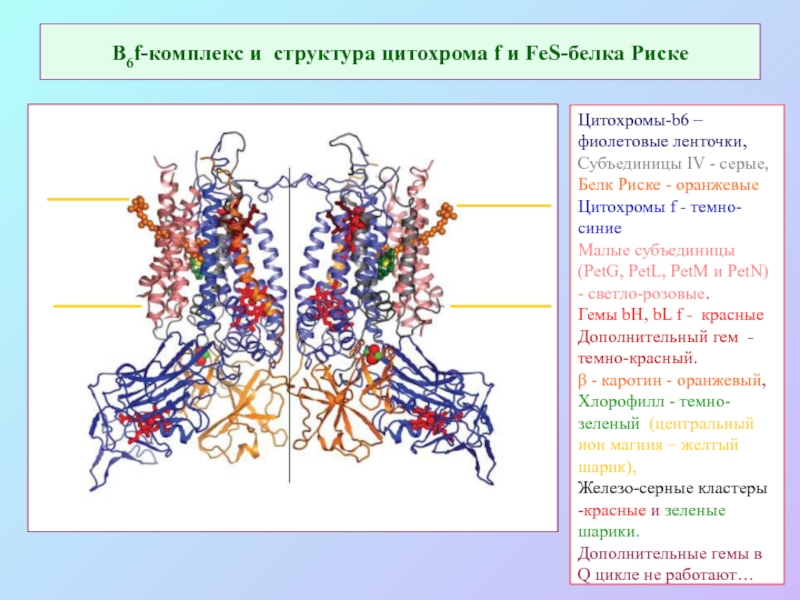
Слайд 25В6f-комплекс и структура цитохрома f и FeS-белка Риске
Цитохромы-b6 – фиолетовые ленточки,
Субъединицы IV - серые,
Белк Риске - оранжевые
Цитохромы f - темно-синие
Малые субъединицы (PetG, PetL, PetM и PetN) - светло-розовые.
Гемы bH, bL f - красные Дополнительный гем - темно-красный.
β - каротин - оранжевый,
Хлорофилл - темно-зеленый (центральный ион магния – желтый шарик),
Железо-серные кластеры -красные и зеленые шарики.
Дополнительные гемы в Q цикле не работают…
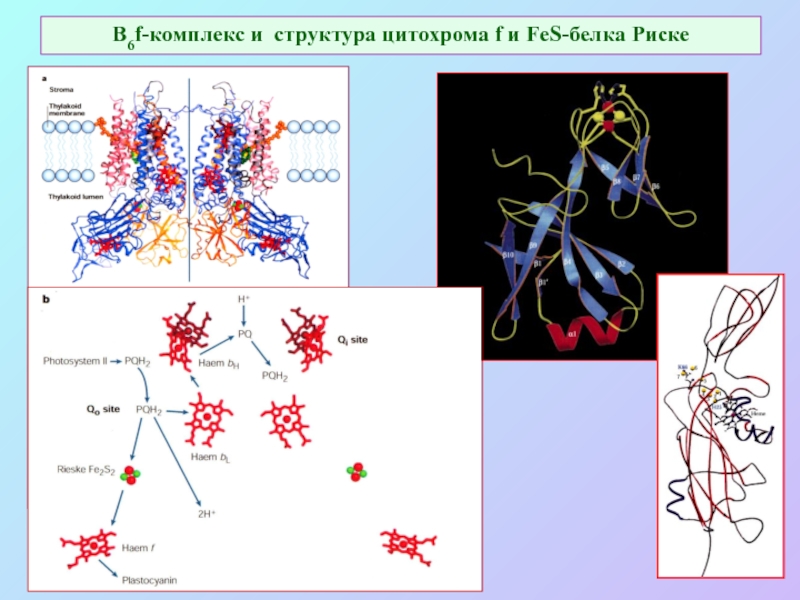
Слайд 26В6f-комплекс и структура цитохрома f и FeS-белка Риске
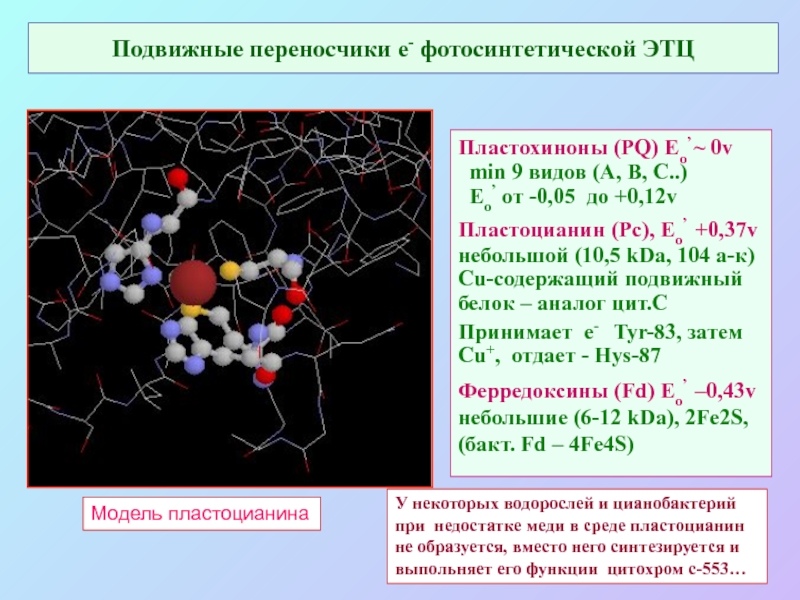
Слайд 27Подвижные переносчики е- фотосинтетической ЭТЦ
Пластохиноны (PQ) Eo’ ~ 0v
min 9
видов (А, В, С..)
Eo’ от -0,05 до +0,12v
Пластоцианин (Pc), Eo’ +0,37v
небольшой (10,5 kDa, 104 а-к)
Cu-содержащий подвижный
белок – аналог цит.С
Принимает е- Tyr-83, затем
Cu+, отдает - Hys-87
Ферредоксины (Fd) Eo’ –0,43v
небольшие (6-12 kDa), 2Fe2S,
(бакт. Fd – 4Fe4S)
Модель пластоцианина
У некоторых водорослей и цианобактерий при недостатке меди в среде пластоцианин не образуется, вместо него синтезируется и выпольняет его функции цитохром с-553…
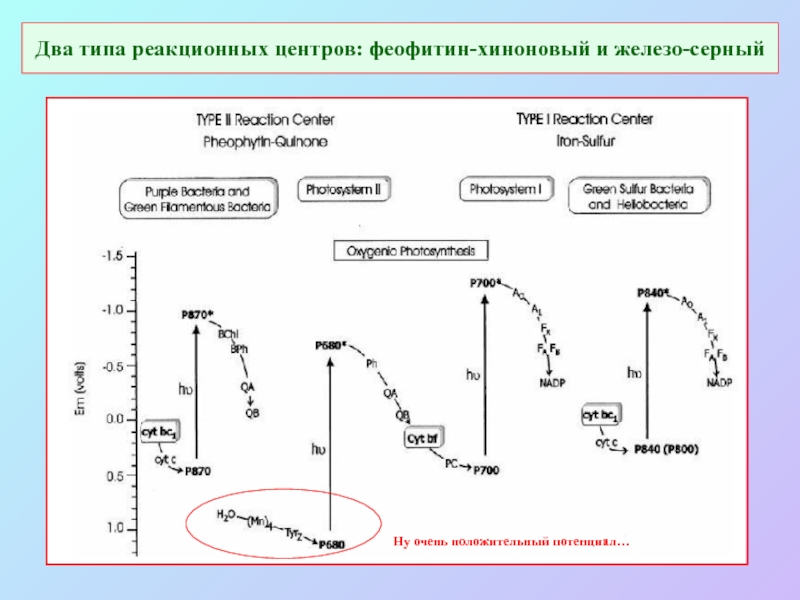
Слайд 28Два типа реакционных центров: феофитин-хиноновый и железо-серный
Ну очень положительный потенциал…
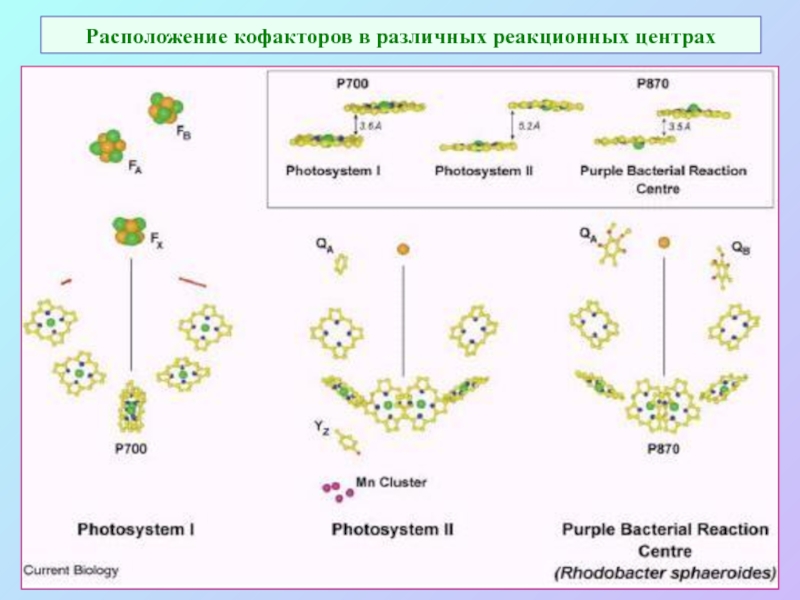
Слайд 29Расположение кофакторов в различных реакционных центрах
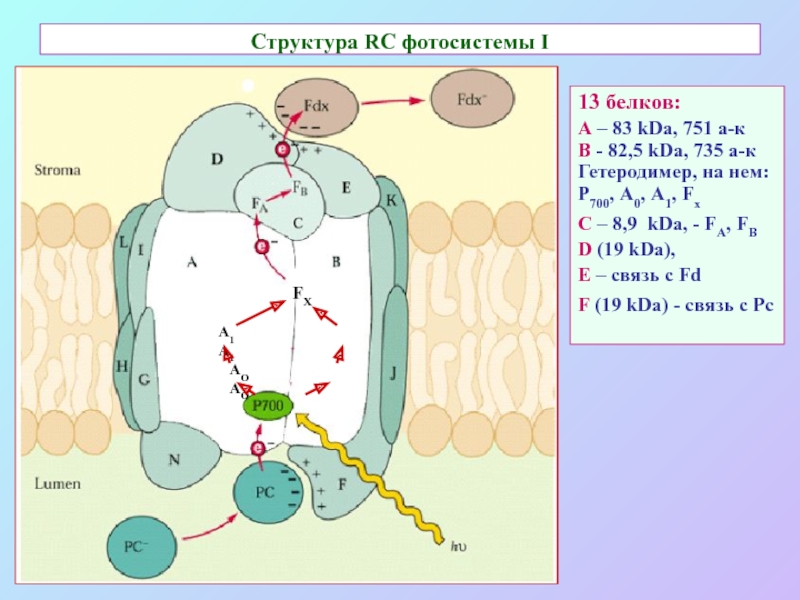
Слайд 30Структура RC фотосистемы I
13 белков:
А – 83 kDa, 751 a-к
В -
82,5 kDa, 735 a-к
Гетеродимер, на нем:
Р700, А0, А1, Fx
С – 8,9 kDa, - FA, FB
D (19 kDa),
E – связь с Fd
F (19 kDa) - связь с Pc
AO AO
A1 A1
FX
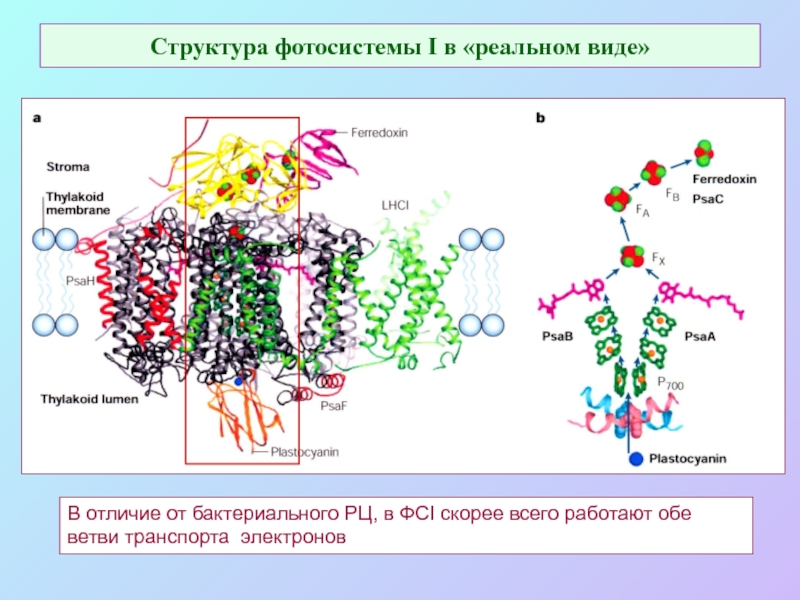
Слайд 31Структура фотосистемы I в «реальном виде»
В отличие от бактериального РЦ, в
ФСI скорее всего работают обе ветви транспорта электронов
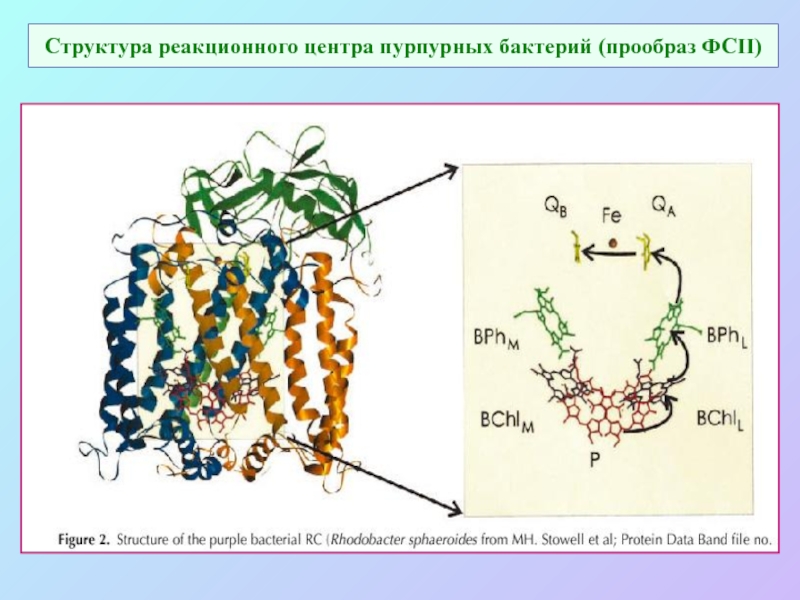
Слайд 32Структура реакционного центра пурпурных бактерий (прообраз ФСII)
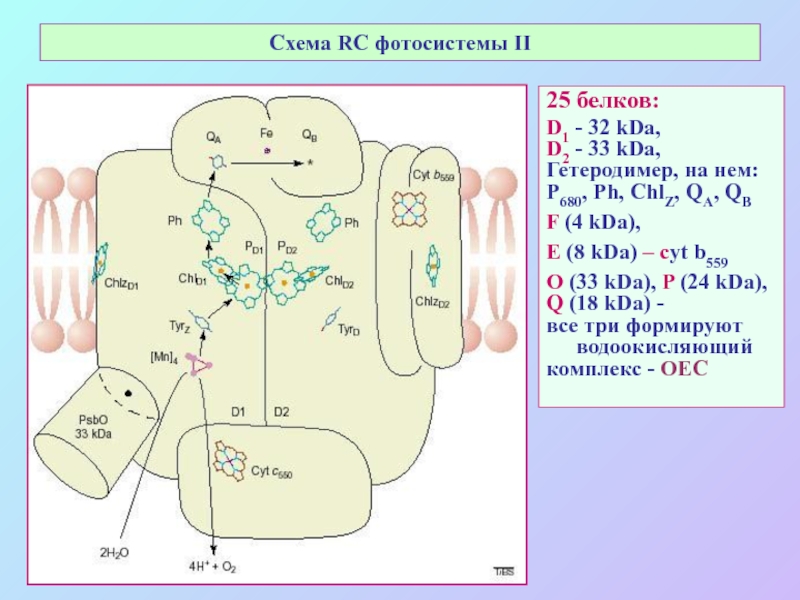
Слайд 33Схема RC фотосистемы II
25 белков:
D1 - 32 kDa,
D2 - 33
kDa,
Гетеродимер, на нем:
Р680, Ph, ChlZ, QA, QB
F (4 kDa),
E (8 kDa) – сyt b559
O (33 kDa), P (24 kDa),
Q (18 kDa) -
все три формируют водоокисляющий
комплекс - OEC
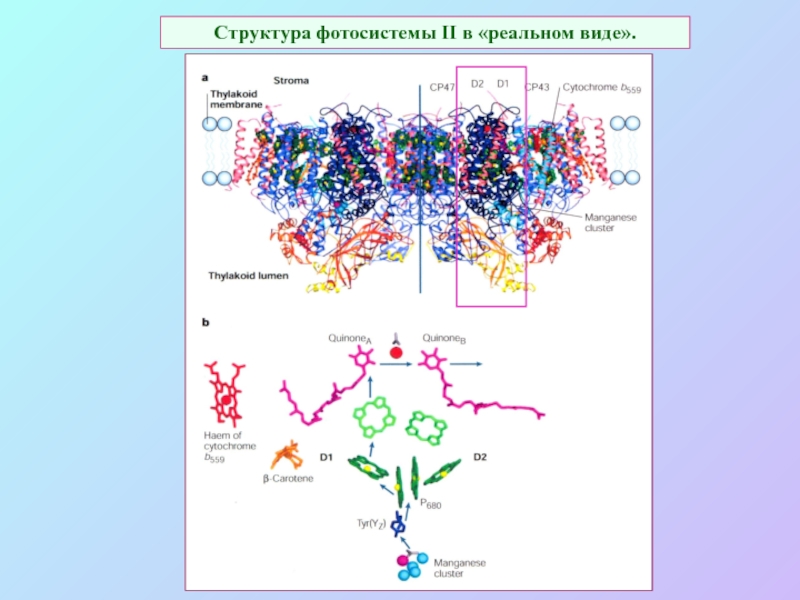
Слайд 34Структура фотосистемы II в «реальном виде».
Слайд 35Структура белка D1 RC фотосистемы II
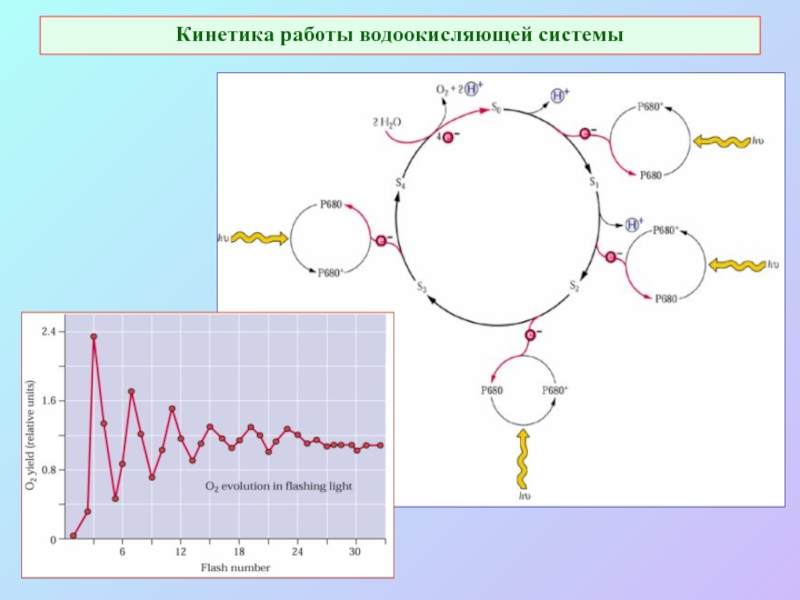
Слайд 36Кинетика работы водоокисляющей системы
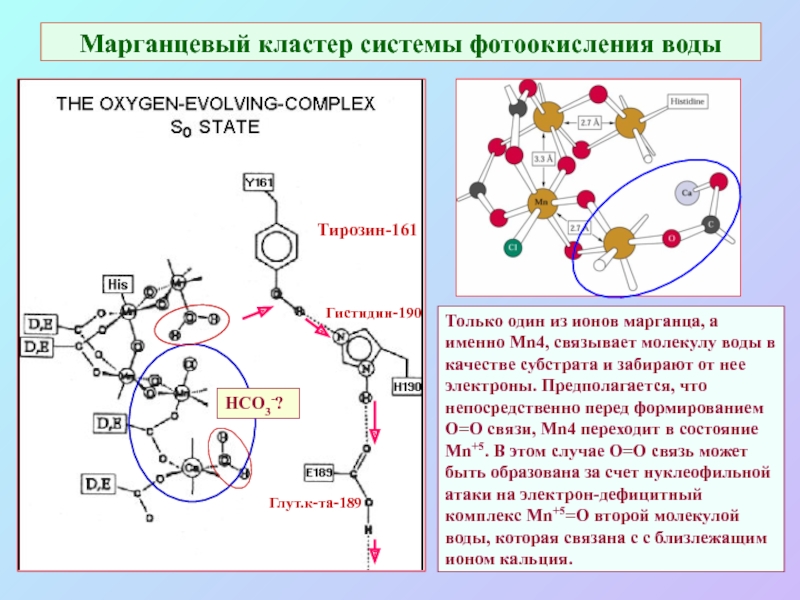
Слайд 37Марганцевый кластер системы фотоокисления воды
Тирозин-161
Гистидин-190
Глут.к-та-189
Только один из ионов марганца, а именно
Mn4, связывает молекулу воды в качестве субстрата и забирают от нее электроны. Предполагается, что непосредственно перед формированием O=O связи, Mn4 переходит в состояние Мn+5. В этом случае O=O связь может быть образована за счет нуклеофильной атаки на электрон-дефицитный комплекс Мn+5=O второй молекулой воды, которая связана с с близлежащим ионом кальция.
HCO3-?
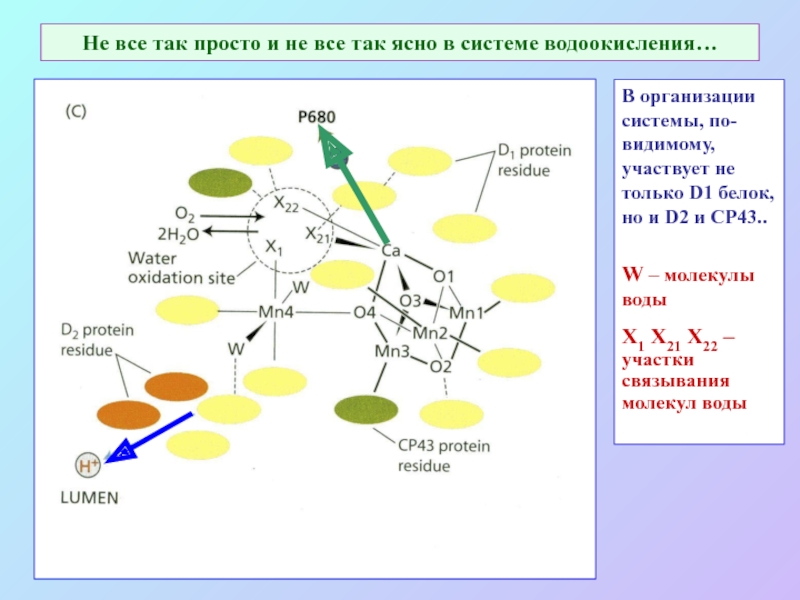
Слайд 38Не все так просто и не все так ясно в системе
водоокисления…
В организации системы, по-видимому, участвует не только D1 белок, но и D2 и CP43..
W – молекулы воды
Х1 Х21 Х22 –участки связывания молекул воды
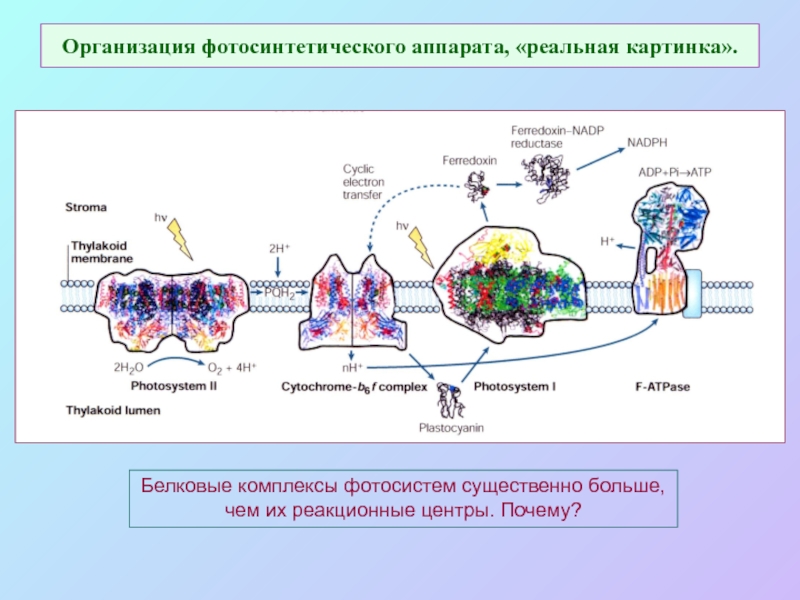
Слайд 39Организация фотосинтетического аппарата, «реальная картинка».
Белковые комплексы фотосистем существенно больше,
чем их
реакционные центры. Почему?
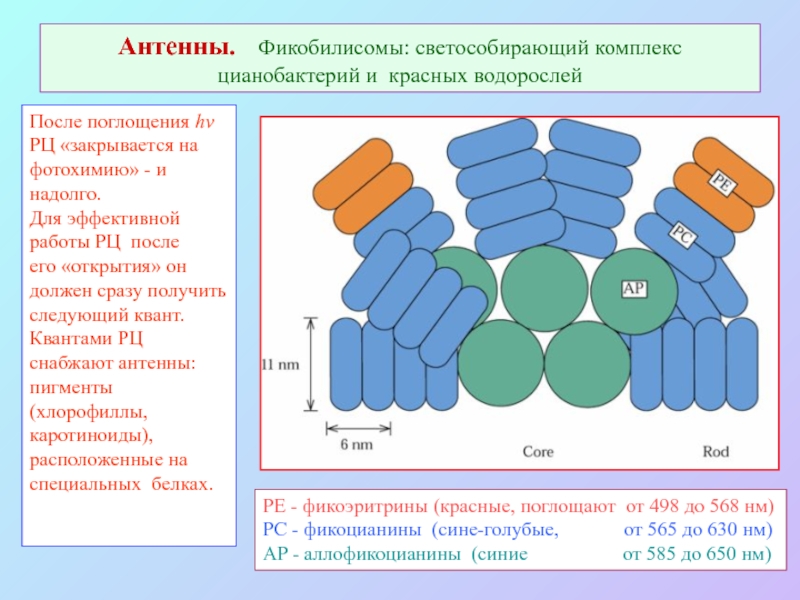
Слайд 40Антенны. Фикобилисомы: светособирающий комплекс цианобактерий и красных водорослей
После поглощения hν
РЦ
«закрывается на
фотохимию» - и
надолго.
Для эффективной
работы РЦ после
его «открытия» он
должен сразу получить
следующий квант.
Квантами РЦ
снабжают антенны:
пигменты
(хлорофиллы,
каротиноиды),
расположенные на
специальных белках.
PE - фикоэритрины (красные, поглощают от 498 до 568 нм)
PC - фикоцианины (сине-голубые, от 565 до 630 нм)
AP - аллофикоцианины (синие от 585 до 650 нм)
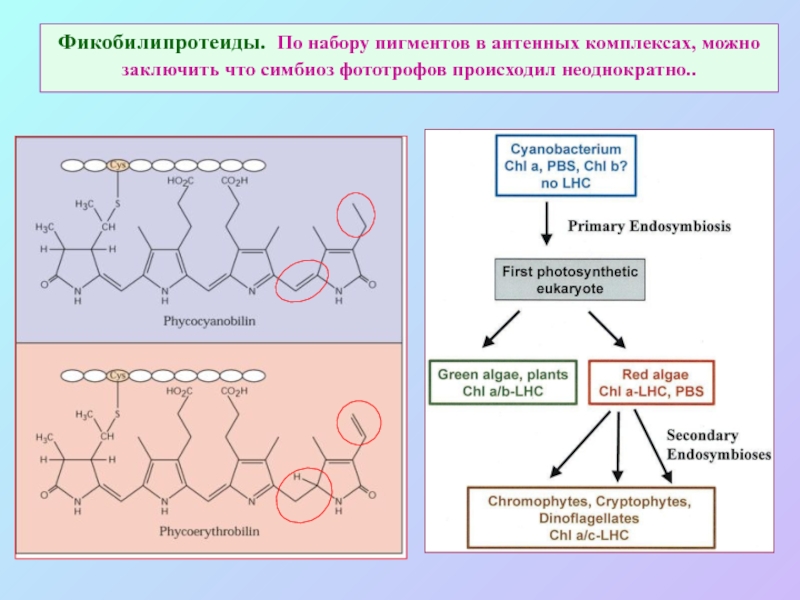
Слайд 41Фикобилипротеиды. По набору пигментов в антенных комплексах, можно заключить что симбиоз
фототрофов происходил неоднократно..
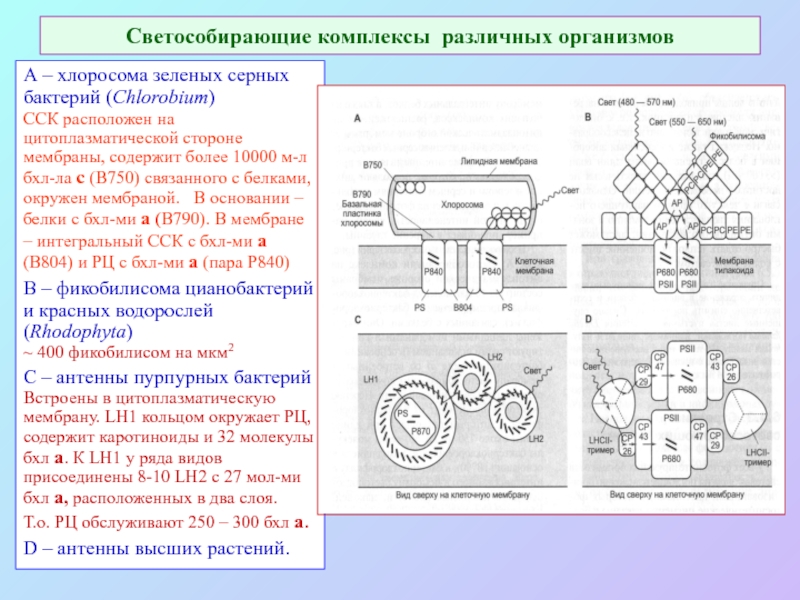
Слайд 42Светособирающие комплексы различных организмов
А – хлоросома зеленых серных бактерий (Chlorobium)
ССК расположен
на цитоплазматической стороне мембраны, содержит более 10000 м-л бхл-ла с (В750) связанного с белками, окружен мембраной. В основании –белки с бхл-ми а (В790). В мембране – интегральный ССК с бхл-ми а (B804) и РЦ с бхл-ми а (пара P840)
B – фикобилисома цианобактерий и красных водорослей (Rhodophyta)
~ 400 фикобилисом на мкм2
C – антенны пурпурных бактерий Встроены в цитоплазматическую мембрану. LH1 кольцом окружает РЦ, содержит каротиноиды и 32 молекулы бхл а. К LH1 у ряда видов присоединены 8-10 LH2 с 27 мол-ми бхл а, расположенных в два слоя.
Т.о. РЦ обслуживают 250 – 300 бхл а.
D – антенны высших растений.
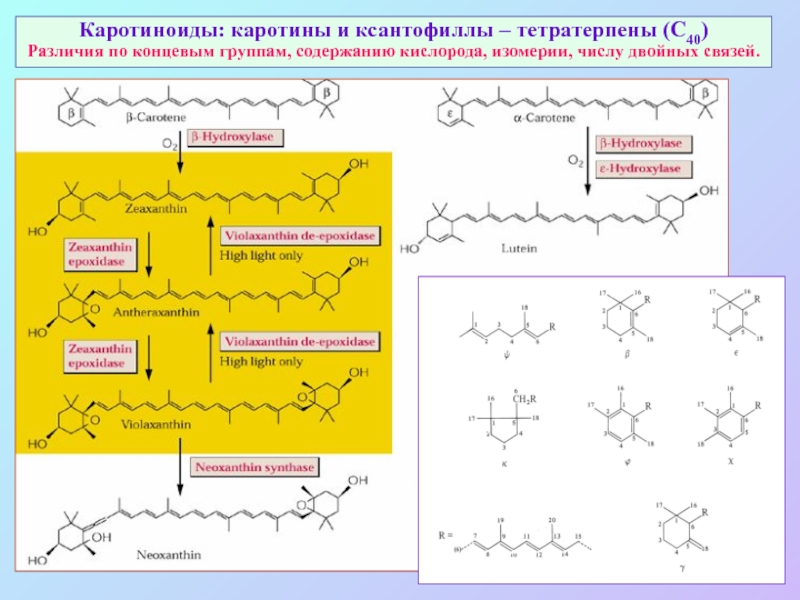
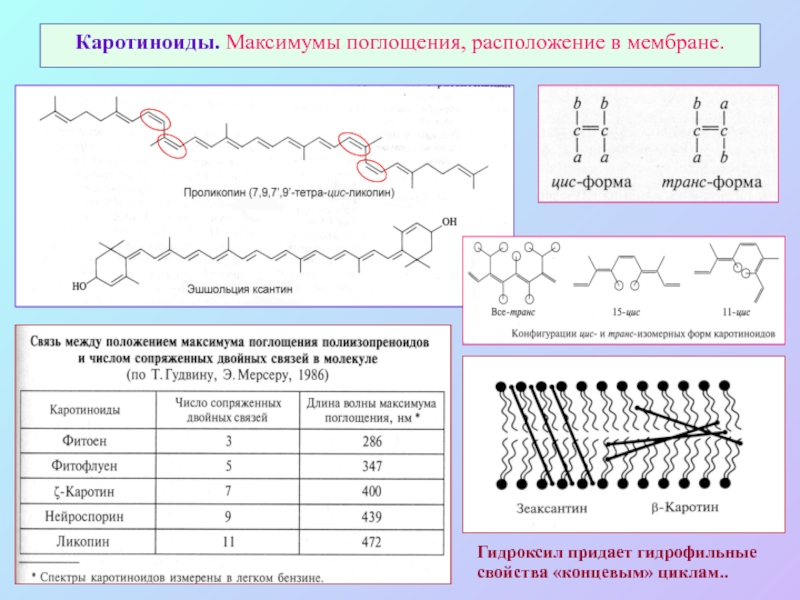
Слайд 43Каротиноиды: каротины и ксантофиллы – тетратерпены (С40)
Различия по концевым группам, содержанию
кислорода, изомерии, числу двойных связей.
Слайд 44Каротиноиды. Максимумы поглощения, расположение в мембране.
Гидроксил придает гидрофильные свойства «концевым» циклам..
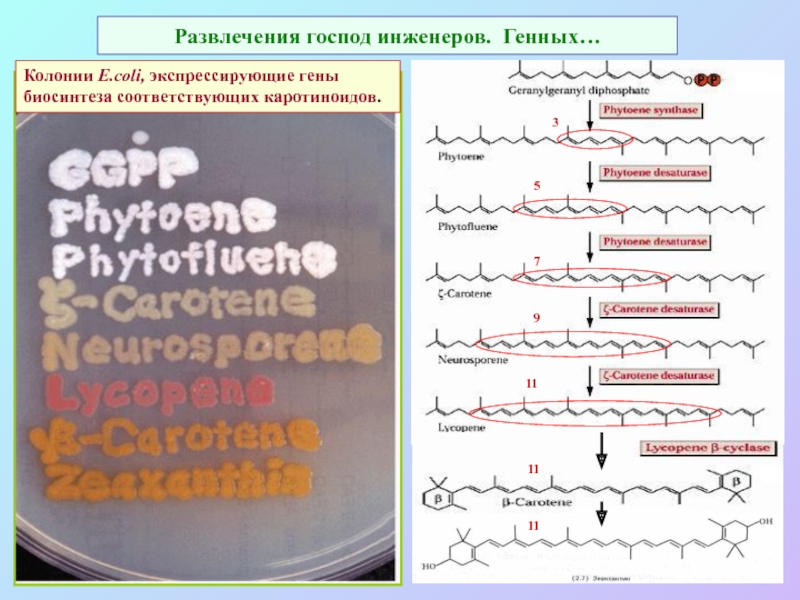
Слайд 45Развлечения господ инженеров. Генных…
Колонии E.coli, экспрессирующие гены биосинтеза соответствующих каротиноидов.
5
7
9
11
11
11
3
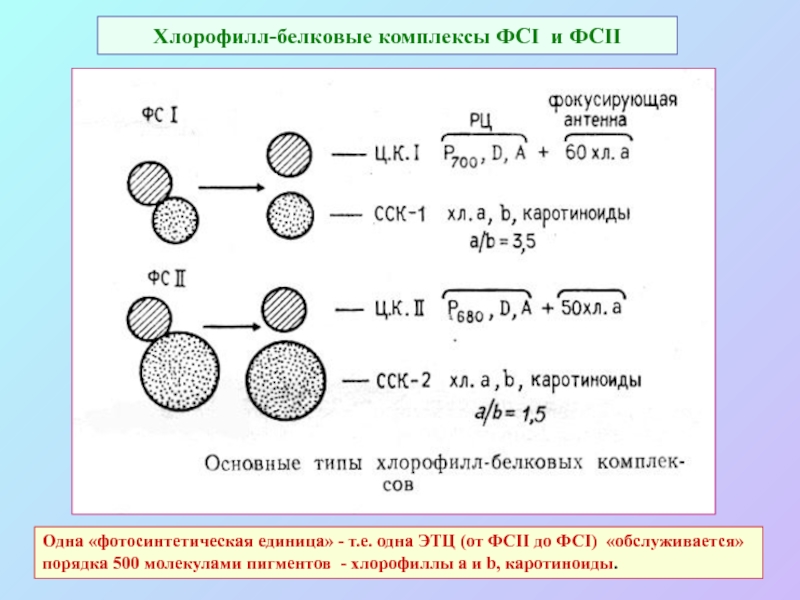
Слайд 46Хлорофилл-белковые комплексы ФСI и ФСII
Одна «фотосинтетическая единица» - т.е. одна ЭТЦ
(от ФСII до ФСI) «обслуживается»
порядка 500 молекулами пигментов - хлорофиллы a и b, каротиноиды.
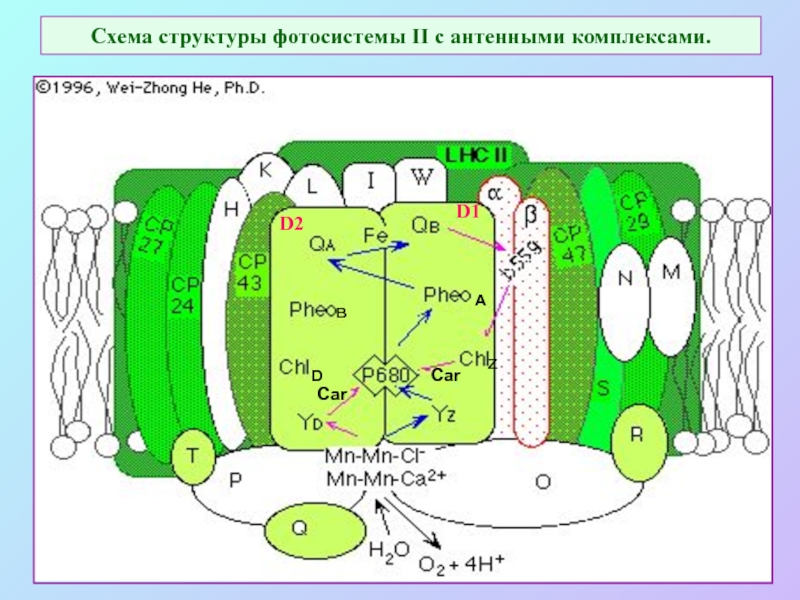
Слайд 47Схема структуры фотосистемы II с антенными комплексами.
в
А
D
z
Car
Car
D2
D1
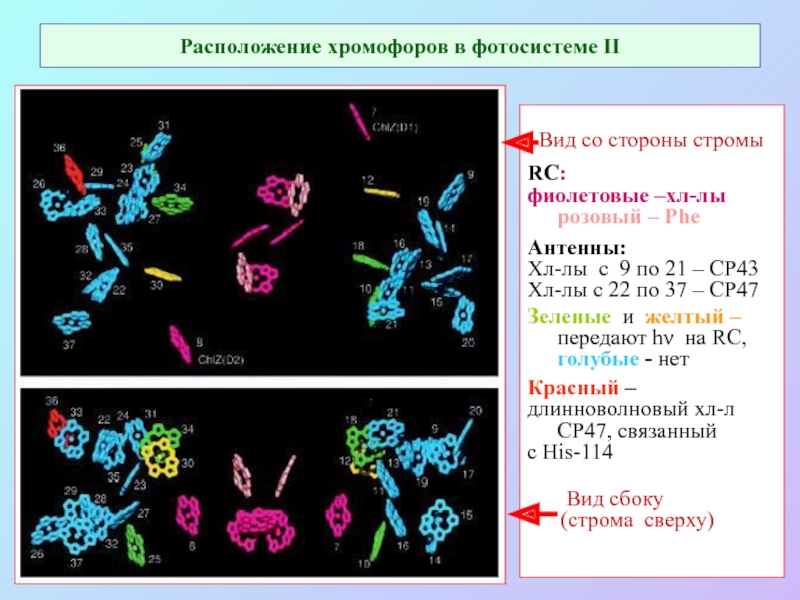
Слайд 48Расположение хромофоров в фотосистеме II
Вид со стороны стромы
RC:
фиолетовые
–хл-лы розовый – Phe
Антенны:
Хл-лы с 9 по 21 – СР43
Хл-лы с 22 по 37 – СР47
Зеленые и желтый – передают hν на RC, голубые - нет
Красный –
длинноволновый хл-л СР47, связанный
с His-114
Вид сбоку
(строма сверху)
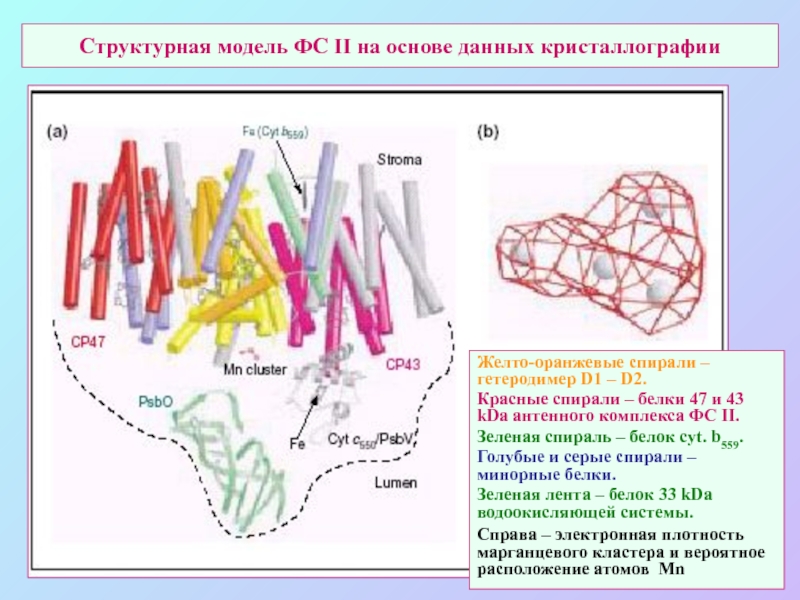
Слайд 49Структурная модель ФС II на основе данных кристаллографии
Желто-оранжевые спирали – гетеродимер
D1 – D2.
Красные спирали – белки 47 и 43 kDa антенного комплекса ФС II.
Зеленая спираль – белок cyt. b559.
Голубые и серые спирали – минорные белки.
Зеленая лента – белок 33 kDa водоокисляющей системы.
Справа – электронная плотность марганцевого кластера и вероятное расположение атомов Mn
Слайд 50Светособирающий комплекс LHC II (Lhcb 1&2) : мономер и тример
Каждый белок
содержит 7 молекул хлорофилла a, 5 молекул хлорофилла b и 2 молекулы лютеина. Молекулы хлорофилла b находятся на периферии белка, хлорофилла a – в центре белка. Расстояние между хлорофиллами – 0,5 – 3 нм.
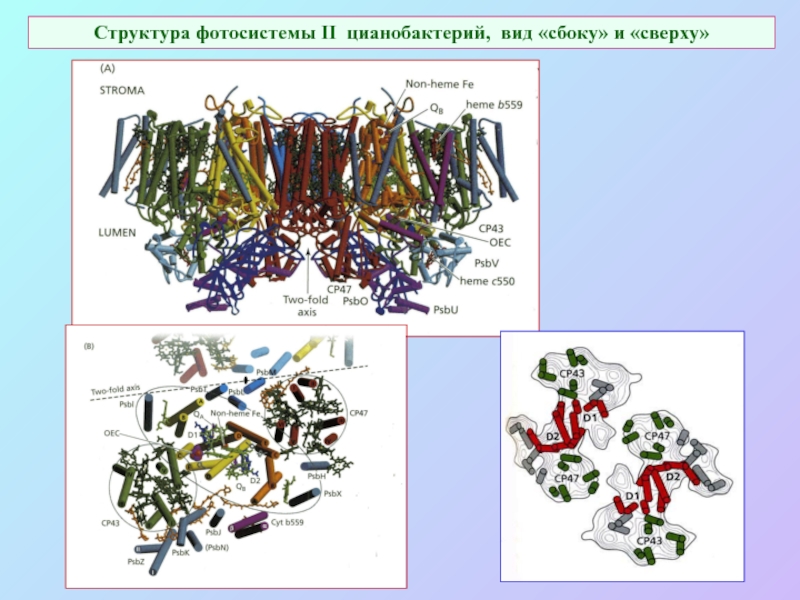
Слайд 51Структура фотосистемы II цианобактерий, вид «сбоку» и «сверху»
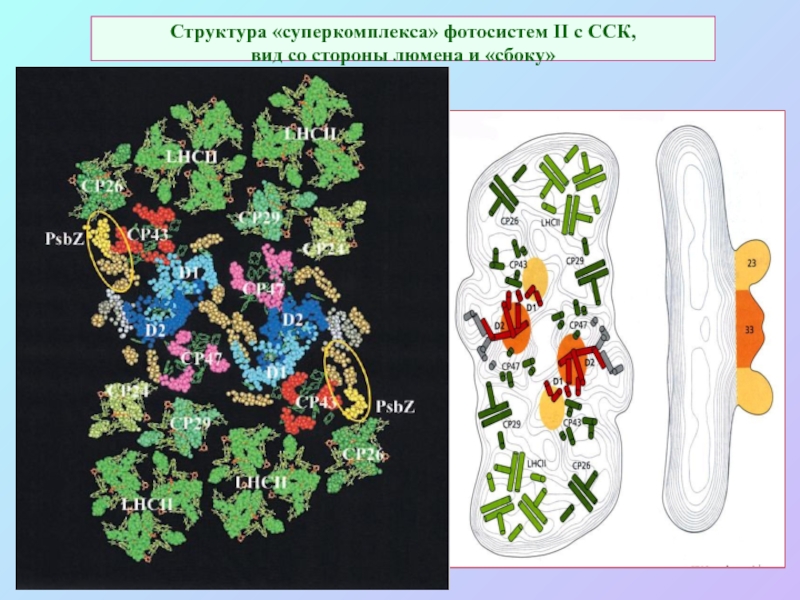
Слайд 52Структура «суперкомплекса» фотосистем II c ССК,
вид со стороны люмена и
«сбоку»
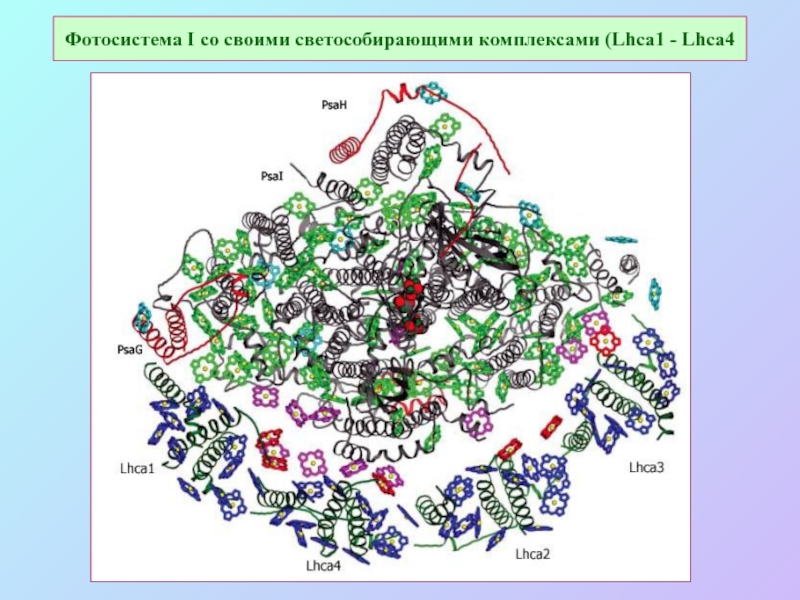
Слайд 53Фотосистема I со своими светособирающими комплексами (Lhca1 - Lhca4
Слайд 54Фотосистема I скорее всего существует в виде тримера
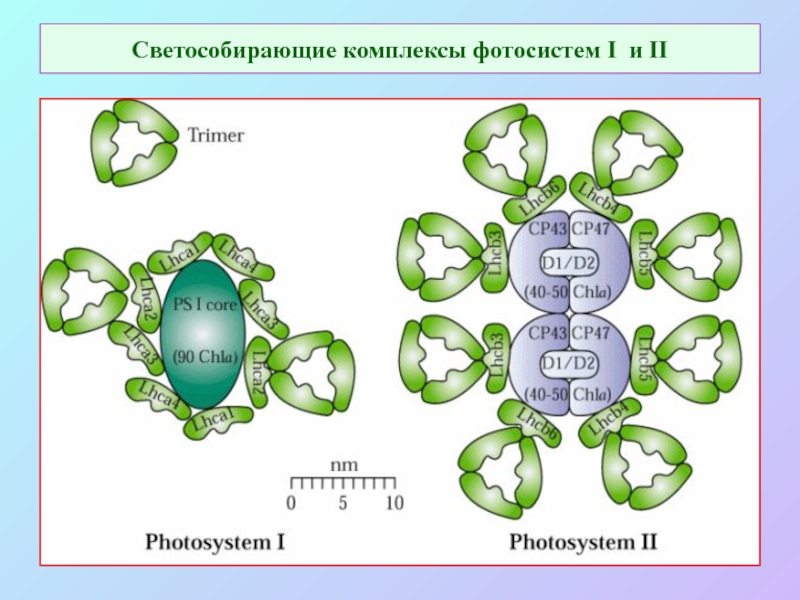
Слайд 55Светособирающие комплексы фотосистем I и II
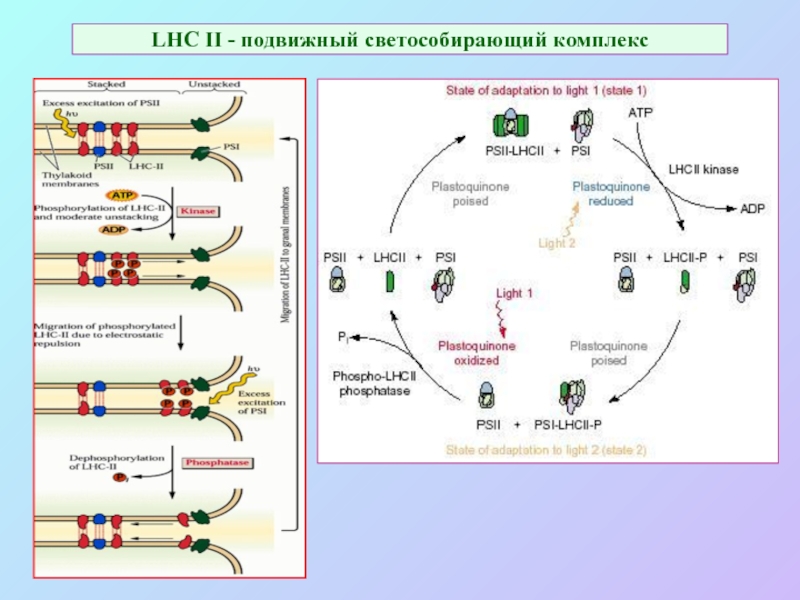
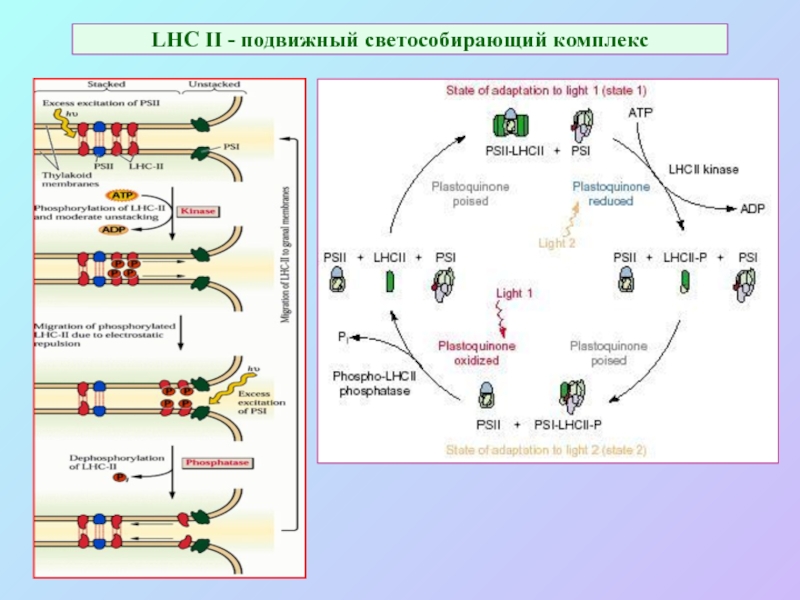
Слайд 56LHC II - подвижный светособирающий комплекс
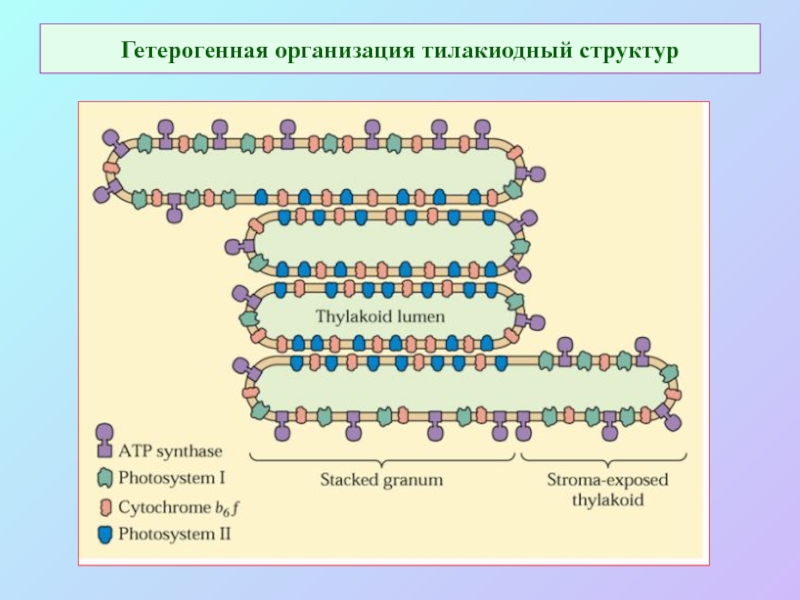
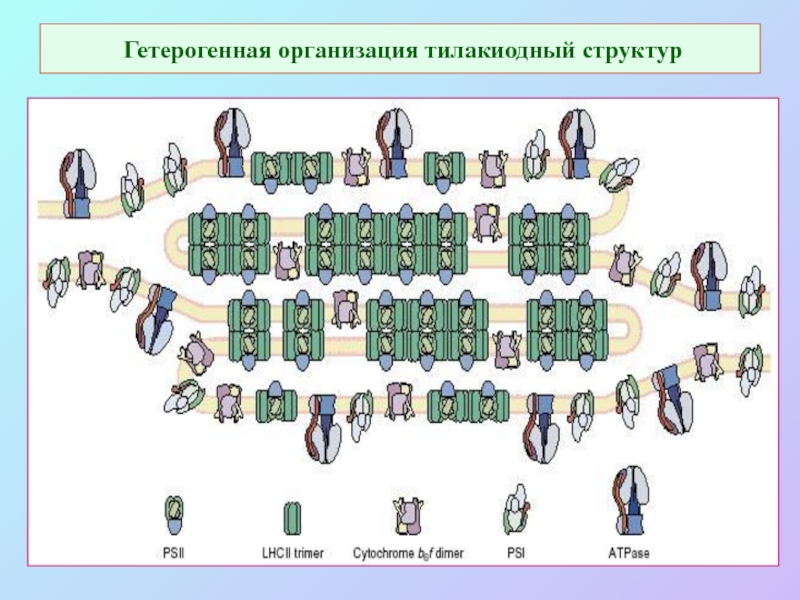
Слайд 57Гетерогенная организация тилакиодный структур
Слайд 58Гетерогенная организация тилакиодных структур
Слайд 59 Гетерогенная организация тилакиодный структур
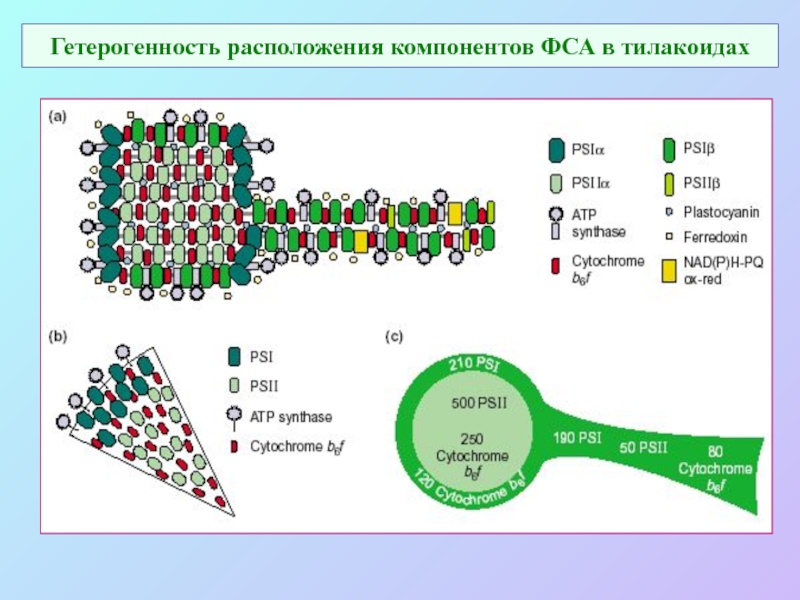
Слайд 60Гетерогенность расположения компонентов ФСА в тилакоидах
Слайд 61Hosta
‘Piedmont Gold’
Hosta sieboldiana
‘Elegans’
Hosta
‘Golden Haze’
Фотовыцветание
Слайд 62Механизмы регулирования и защиты ФСII от фотодеструкции
нециклический поток, регулирование мобильными антеннами;
циклические
потоки вокруг каждой фотосистемы;
псевдоциклический транспорт электронов
Хлоропластное дыхание - ?
виолоксантиновый цикл
«тушение» триплетного состояния хлорофилла каротиноидами
«обезвреживание» активных форм кислорода каротиноидами
каротиноиды «на заклание»
замена D1-белка
Слайд 63LHC II - подвижный светособирающий комплекс
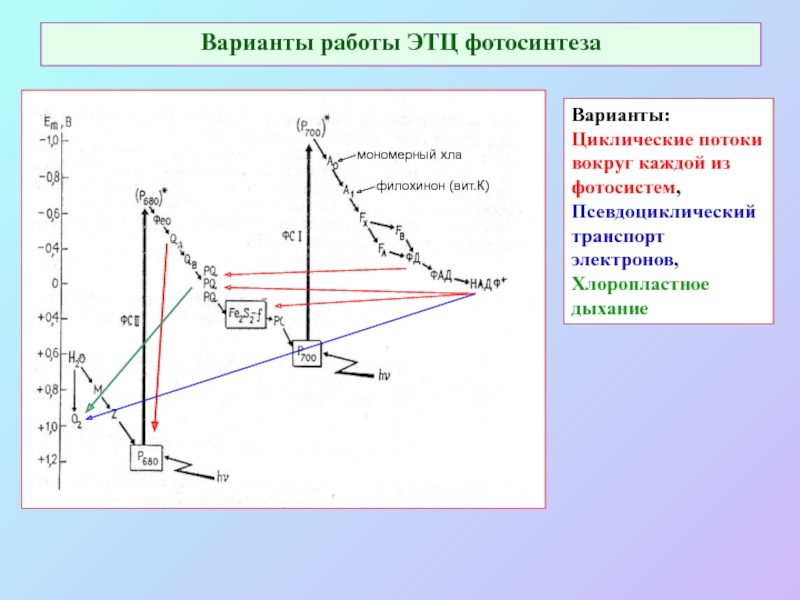
Слайд 64Варианты работы ЭТЦ фотосинтеза
мономерный хла
филохинон (вит.К)
Варианты:
Циклические потоки вокруг каждой из фотосистем,
Псевдоциклический
транспорт электронов,
Хлоропластное дыхание
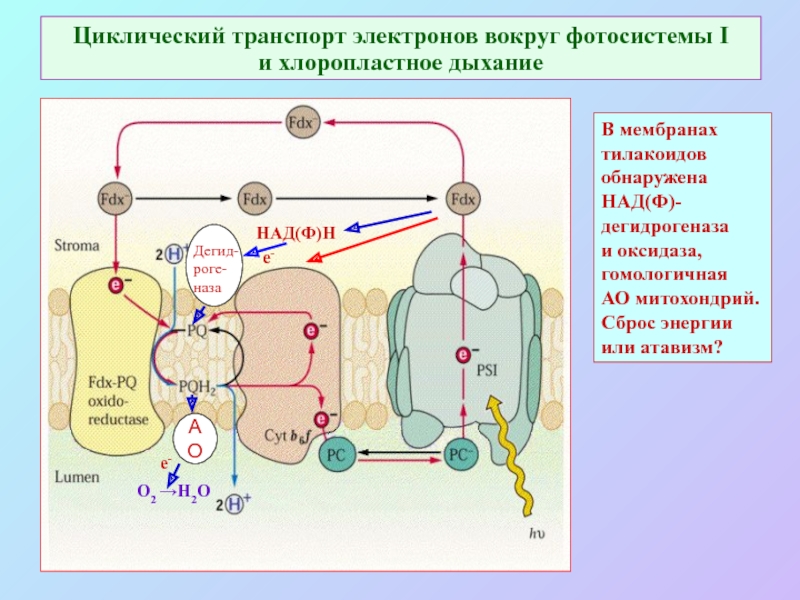
Слайд 65Циклический транспорт электронов вокруг фотосистемы I и хлоропластное дыхание
НАД(Ф)Н
Дегид-
роге-
наза
АО
О2
→Н2О
е-
е-
В мембранах
тилакоидов
обнаружена
НАД(Ф)-
дегидрогеназа
и оксидаза,
гомологичная
АО митохондрий.
Сброс энергии
или атавизм?
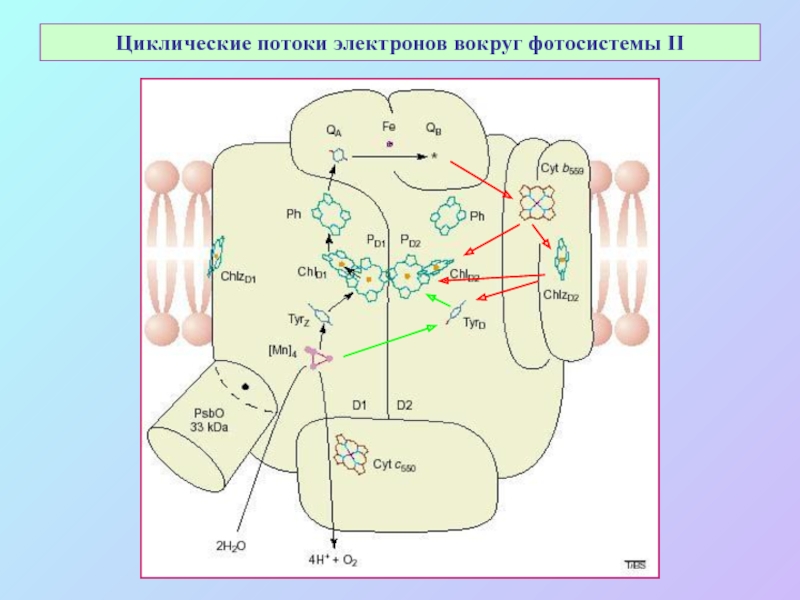
Слайд 66Циклическиe потоки электронов вокруг фотосистемы II
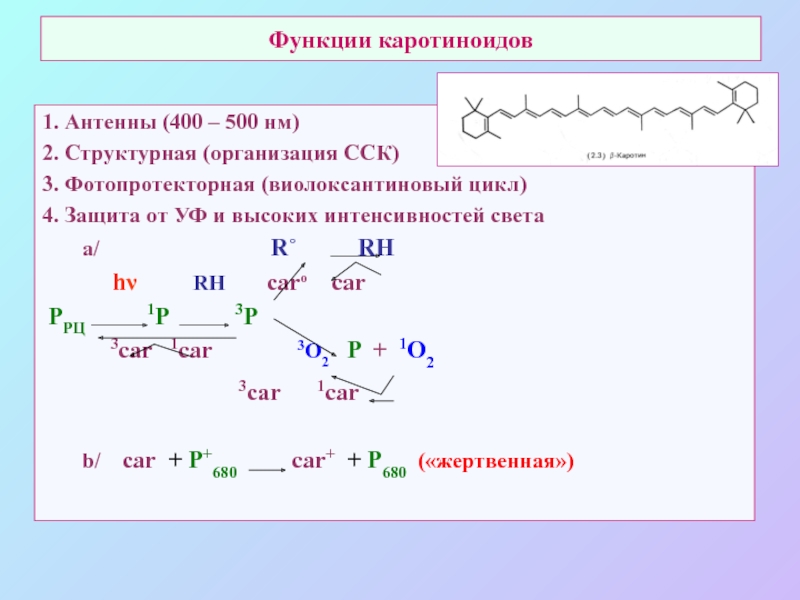
Слайд 67Функции каротиноидов
1. Антенны (400 – 500 нм)
2. Структурная (организация ССК)
3. Фотопротекторная
(виолоксантиновый цикл)
4. Защита от УФ и высоких интенсивностей света
a/ R˚ RН
hν RH carо car
PРЦ 1Р 3Р
3car 1car 3O2 P + 1O2
3car 1car
b/ car + P+680 car+ + P680 («жертвенная»)
Слайд 68Каротиноиды в хлоропластах
1. Разные состояния: мономерная или агрегированная форма, связь с
белками.
2. Изомеры: транс – в антеннах, цис – в РЦ. При этом в РЦ – β-каротины, в ССК – ксантофиллы.
Ядро ФС I высших растений содержит 14 молекул β-каротина,
2 из них в РЦ, 12 – во внутренней антенне.
Ядро ФС II: на D1 и D2 белках расположены симметрично 2 молекулы β-каротина. На D1 – все-транс форма, на D2 – 15-цис форма. Внутренняя антенна (СР43 и СР47) – 2-3 молекулы β-каротина и несколько молекул лютеина. ССК (СР24, СР26, СР29) – в каждом 1 -2 молекулы лютеина, а также молекулы неоксантина, зеаксантина, антероксантина и виолоксантина.
Антенная функция – все-транс форма.
Защитные функции - все-транс форма β-каротина на D1 белке – альтернативный донор е- для Р680 при низких tо и нарушении работы OEC.
15-цис форма на D2 – тушение триплета Р680 за счет изомеризации во все-транс-форму.
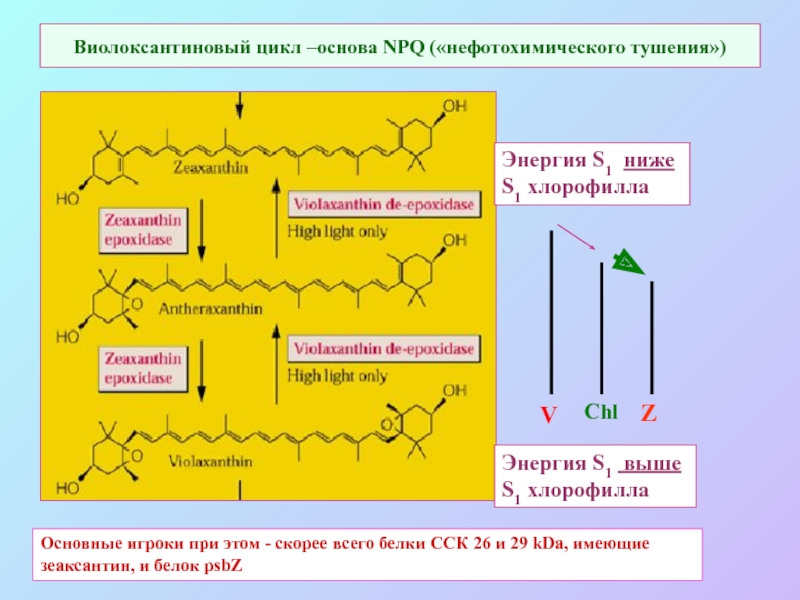
Слайд 69Виолоксантиновый цикл –основа NPQ («нефотохимического тушения»)
Энергия S1 ниже
S1 хлорофилла
Энергия
S1 выше
S1 хлорофилла
V
Chl
Z
Основные игроки при этом - скорее всего белки ССК 26 и 29 kDa, имеющие зеаксантин, и белок psbZ
Слайд 70Фотозащита. «Переключение» виолоксантиновой системы.
Виолоксантин-деэпоксидаза, 43 kDa, тример, рН 7 – неактивна,
рН 5 – активна. Т.к. она находится со стороны люмена, то может «обслуживать» только одно кольцо виолаксантина. Для изменения двух сторон каротиноидов нужен их поворот – флип-флоп, что редко. Этому способствует MGDG – моногалактозил-диглицериды. При повышении их доли в мембране с 5% до 30% реакция эпоксидации увеличивается с 0 о 100%. Они формируют гексагональные кластеры в мембране.
V - виолоксантин
Z - зеаксантин
Слайд 71D1 белок – «камикадзе» растительной клетки
Разборка ФС II: уходят белки OEC,
снимаются атомы Mn, отсоединяются CP43, CP47
Удаление «испорченного» белка: «отгрызаются» выступающие из мембраны участки D1 белка (работает специальная протеаза degP2), специальный белок «выталкивает» его останки из мембраны
Синтез нового D1 белка: синтез идет в ламеллах, процессинг (удаляется N-концевой метионин, оставшийся треонин ацетилируется, этот треонин может обратимо фосфориллироваться).
Миграция D1 белка в граны: белок пальмитинируется и в таком виде мигрирует в граны.
Обратная сборка ФС II
Время «полужизни» D1 белка – 30 минут
Интенсивность синтеза D1 белка - 50% от всех синтезируемых
в хлоропласте белков, тогда как его доля – 0,1% от белков хлоропласта
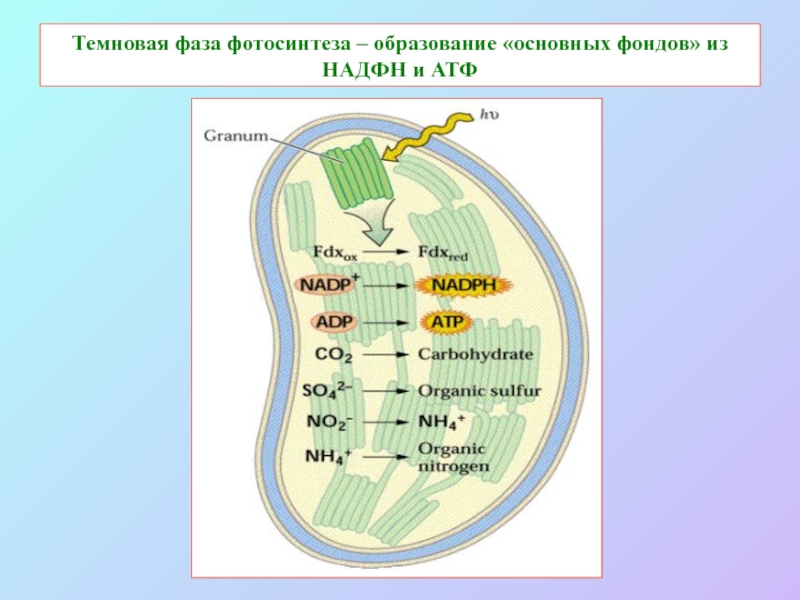
Слайд 72Темновая фаза фотосинтеза – образование «основных фондов» из НАДФН и АТФ
Слайд 73Восстановительный пентозо-фосфатный цикл (ВПЦ)