- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Эпигеномная регуляция процессов эбрионального развития млекопитающих презентация
Содержание
- 1. Эпигеномная регуляция процессов эбрионального развития млекопитающих
- 2. Случайная инактивация Х-хромосомы – “черепаховая” окраска у
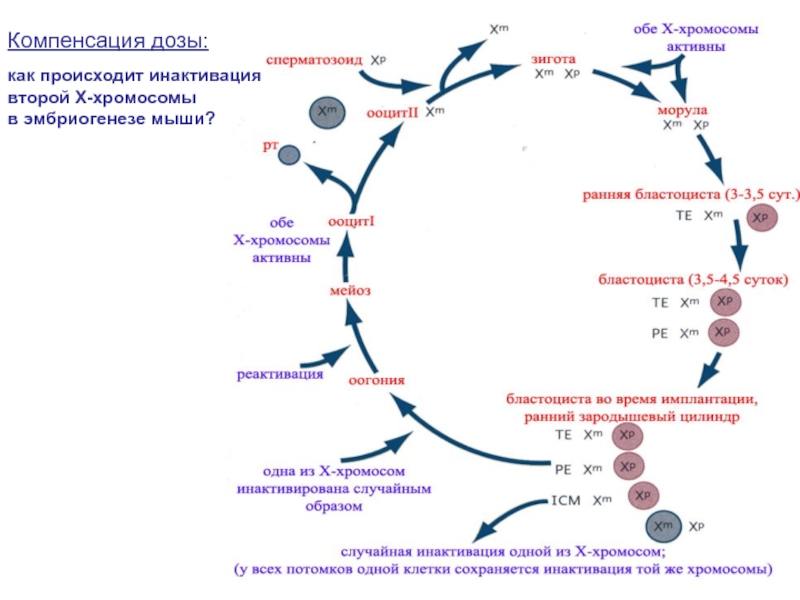
- 3. Компенсация дозы: как происходит инактивация второй Х-хромосомы в эмбриогенезе мыши?
- 4. Механизм инактивации второй Х-хромосомы Тельце Барра: инактивация
- 5. В 1963 году С. Растан с соавторами
- 6. Возможные механизмы инактивации второй Х-хромосомы “Импринтированная” “Случайная?”
- 7. (A) In the preimplantation embryo, the segregation
- 10. “Регуляторы громкости” для генов: 1)
- 11. 1. Это обычный фрагмент молекулы ДНК, за
- 12. Во время оплодотворения: в отцовском геноме
- 13. Эпигенетическое наследование – геномный импритинг Геномный импринтинг
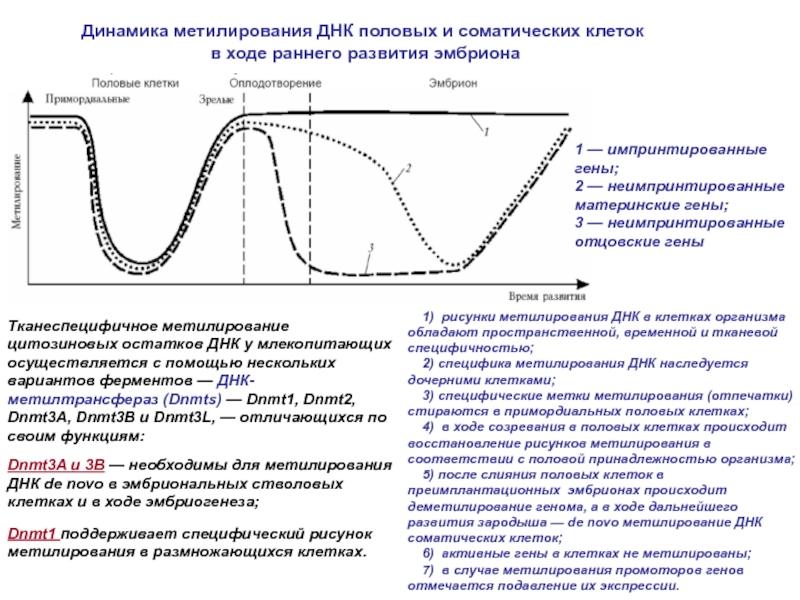
- 14. 2 1 3 4
- 16. Механизмы развития синдромов Прадера - Вилли и
- 17. Геномный импритинг и однородительские дисомии Заболевания
- 18. Ошибки расхождения хромосом в мейозе: численные хромосомные нарушения http://atlasgeneticsoncology.org/Educ/PolyMecaEng.html
- 19. T. Frumkin et al. / Molecular and Cellular Endocrinology 282 (2008) 112–119
- 20. материнский аллель не метилирован Противоположно импринтированные гены
- 21. http://ls-space.blogspot.com/2008/07/047-evolutionary-origin-of-mammalian.html Время возникновения импринтирования локуса IGF2-H19
- 23. Соотношение экспрессии разных аллелей генов H19, IGF2
- 24. Placental methylation levels in regions upstream
- 25. Upstream effectors of the H19
- 26. Modulation of gene expression linked to invasion
- 27. Фермент Dicer разрезает двуцепочечную РНК. При этом
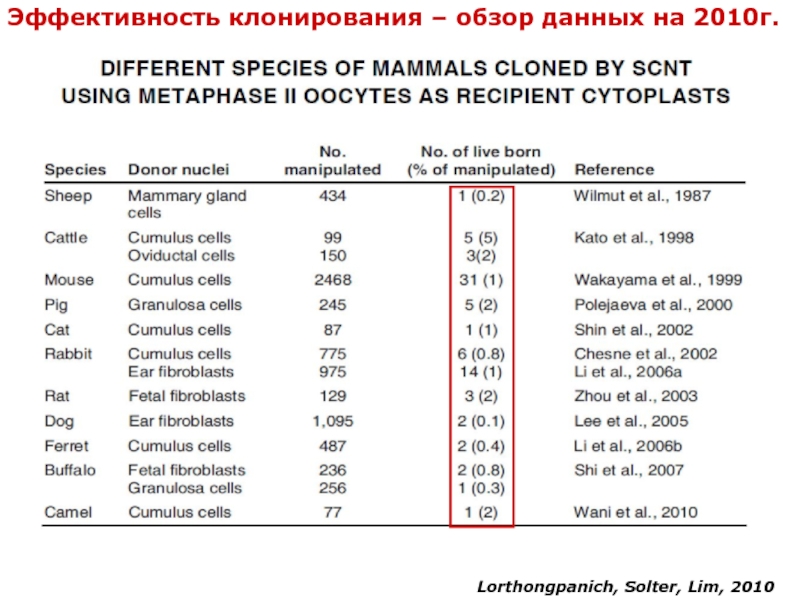
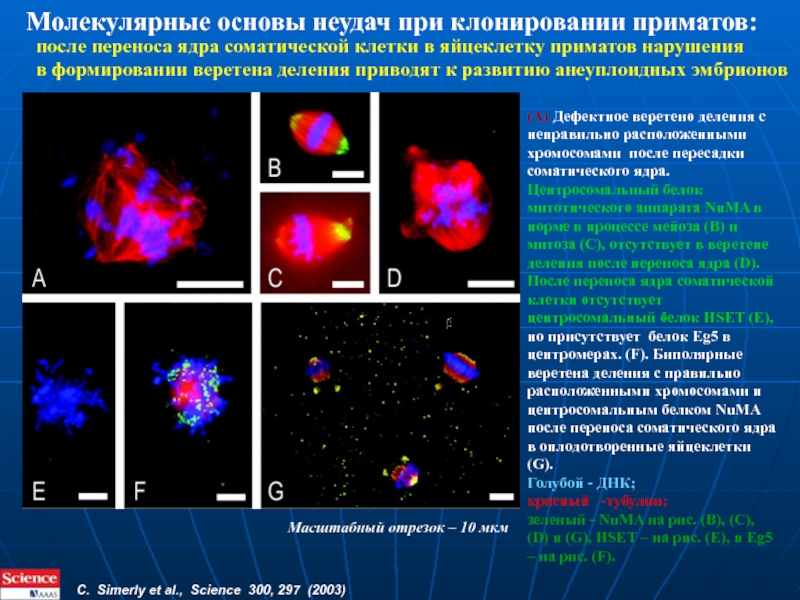
- 32. Lorthongpanich, Solter, Lim, 2010 Эффективность клонирования – обзор данных на 2010г.
- 33. Dr. Ryuzo Yanagimachi, University of Hawaii Genetically
- 34. Клонирование клонов Телята полученные из клеток клонированных
- 35. Three approaches to nuclear reprogramming are described:
- 36. Клонирование: репрограммирование ядер терминально-дифференцированных клеток путем создания линии ЭСК
- 37. Как повысить эффективность клонирования? Прямое клонирование пересадка
- 38. Как повысить эффективность клонирования? Наибольшая эффективность –
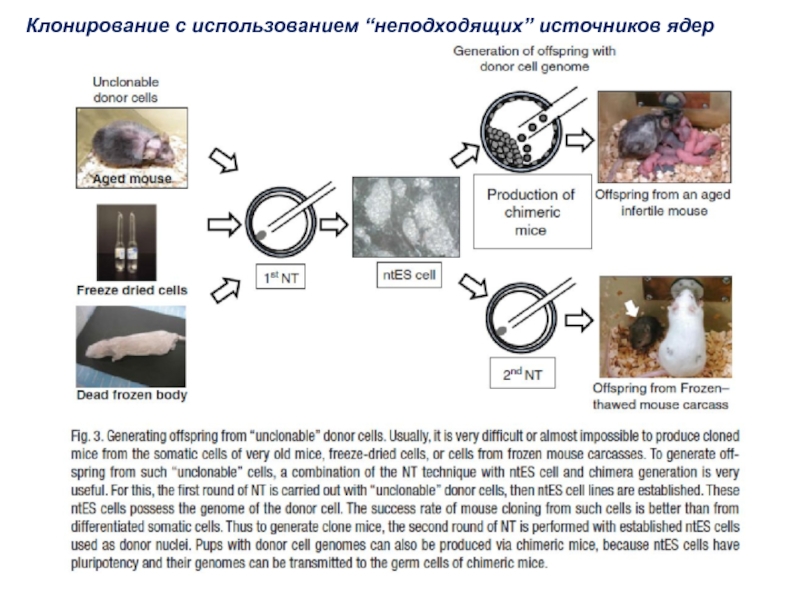
- 39. Клонирование с использованием “неподходящих” источников ядер
- 40. Трансгенные клонированные свиньи, продуцирующие интегрины (белки
- 41. Nature 465, 704–712 (10 June 2010) doi:10.1038/nature09229 Три подхода к возвращению дифференцированным клеткам плюри/тотипотентности
- 43. Южнокорейский ученый Ву Сук Хванг в 2004
- 44. Imprinted genes and their role in human
- 45. Установление различий в паттерне метилирования в мужских
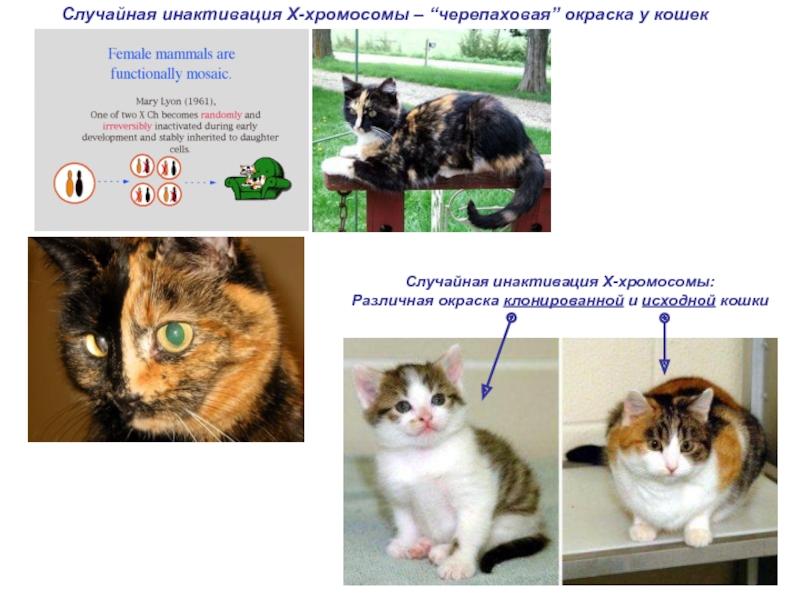
Слайд 2Случайная инактивация Х-хромосомы – “черепаховая” окраска у кошек
Случайная инактивация Х-хромосомы:
Различная окраска
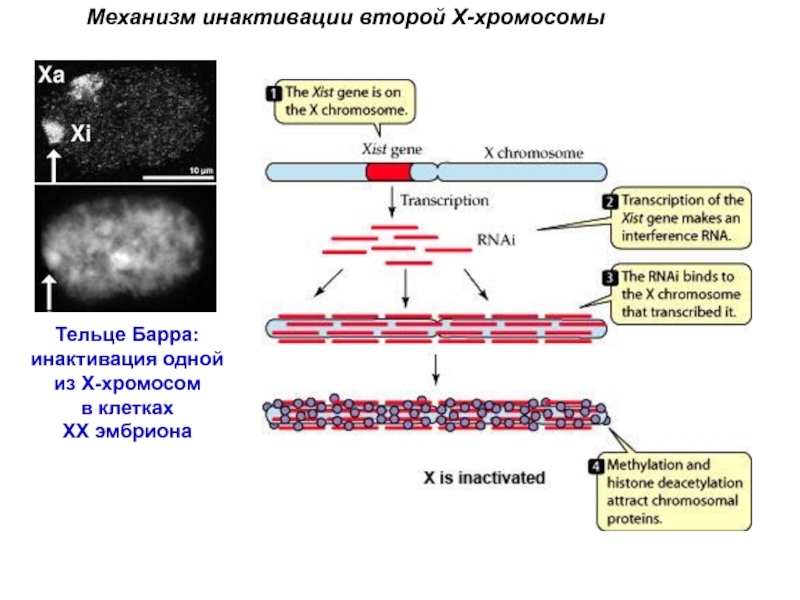
Слайд 4Механизм инактивации второй Х-хромосомы
Тельце Барра:
инактивация одной
из Х-хромосом
в клетках
ХХ эмбриона
Слайд 5В 1963 году С. Растан с соавторами предсказали существование на Х-хромосоме
Таким образом, центр инактивации Xic является «визитной карточкой» Х-хромосомы для систем клетки. Центр инактивации Xic содержит элементы, отвечающие за подсчитывание всех Х-хромосом (центров Xic), а так же за выбор будущей единственной активной Х-хромосомы. Делеция элементов, ответственных за выбор, приводит к преимущественной инактивации Х-хромосом с интактным центром Xic, а повреждение счетных элементов центра Xic вызывает инактивацию единственной Х-хромосомы в клетках с кариотипом Х0 и ХY.
http://www.bionet.nsc.ru/labs/epigenetics/?page_id=304
В центре инактивации Xic расположен ген Xist (X-inactive specific transcript), продуктом которого является функциональная РНК, которая на ранних этапах инактивации необходима и достаточна для «выключения» генов Х-хромосомы.
Активность гена Xist негативно регулируется геном Tsix. Эти гены частично перекрываются между собой (каждая цепь участка двуцепочечной ДНК несет свою информацию) что отражено в названии последнего - Tsix, это Xist наоборот. Помимо этих двух генов в центре инактивации обнаружено еще 9 генов, для которых роль в процессе Х-инактивации пока не до конца ясна
Центр инактивации Х-хромосомы (Xic)
Слайд 6Возможные механизмы инактивации второй Х-хромосомы
“Импринтированная”
“Случайная?”
В ХХ эмбрионах
Но почему в ХУ эмбрионах не выключается единственная Х-хромосома?
В Х-хромосоме, полученной от матери, есть импринт, блокирующий экспрессию Xist, (но не за счет метилирования). Этот импринт, вероятно, связан с модификациями гистонов и устанавливается во время созревания ооцитов.
В Х-хромосоме, полученной от отца, в области промотора Xist есть низкометилированные СрG-участки, деметилирование в них происходит во время сперматогенеза.
В ХХ эмбрионах инактивируются все Х-хромосомы, кроме одной (у тетраплоидных мышиных эмбрионов выключаются 3 из 4-х Х-хромосом). Почему?
В ХУ эмбрионах не выключается единственная Х-хромосома
Теория “блокирующего фактора”
Есть некий фактор (неизвестной природы), который связывается с Х-хромосомой в зоне Хic и блокирует экспрессию гена Xist. Разные аллели Xic имеют разное сродство к этому фактору. Если аллель одна, то фактор связывается с ней (нет конкуренции) и Хist инактивируется.
“Или неслучайная?”
Влияние Tsix: делеции в промоторе Tsix приводят к предпочтительной инактивации этой хромосомы. Вероятно, образование Xist-Tsix (по принципу сенс-антисенс) двуцепочечных РНК
В реконструированный ХХ эмбрионах (2 отцовских или 2 материнских пронуклеуса – так называемые андрогенетические и гиногенетические эмбрионы) нарушаются паттерны инактивации Х-хромосом
У мышей на Х-хромосоме есть локус Xce (Х-controlling element). Его аллели влияют на вероятность того, инактивируется эта хромосома или нет.
У сумчатых – Х-инактивация только по принципу импритига (всегда выключена отцовская X-хромосома)
У мыши – в ТЭ и ПЭ – импритинг, остальные ткани – случайный механизм
У человека?
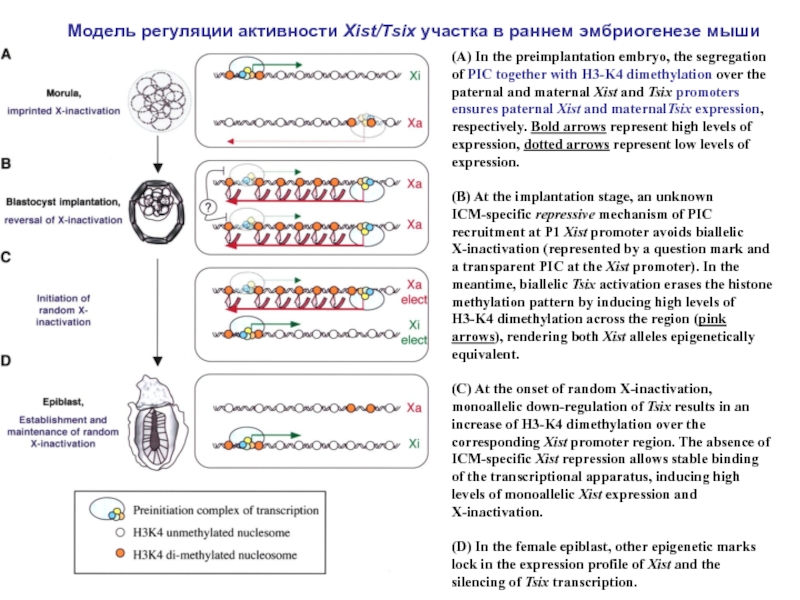
Слайд 7(A) In the preimplantation embryo, the segregation of PIC together with
(B) At the implantation stage, an unknown ICM-specific repressive mechanism of PIC recruitment at P1 Xist promoter avoids biallelic X-inactivation (represented by a question mark and a transparent PIC at the Xist promoter). In the meantime, biallelic Tsix activation erases the histone methylation pattern by inducing high levels of H3-K4 dimethylation across the region (pink arrows), rendering both Xist alleles epigenetically equivalent.
(C) At the onset of random X-inactivation, monoallelic down-regulation of Tsix results in an increase of H3-K4 dimethylation over the corresponding Xist promoter region. The absence of ICM-specific Xist repression allows stable binding of the transcriptional apparatus, inducing high levels of monoallelic Xist expression and X-inactivation.
(D) In the female epiblast, other epigenetic marks lock in the expression profile of Xist and the silencing of Tsix transcription.
Модель регуляции активности Xist/Tsix участка в раннем эмбриогенезе мыши
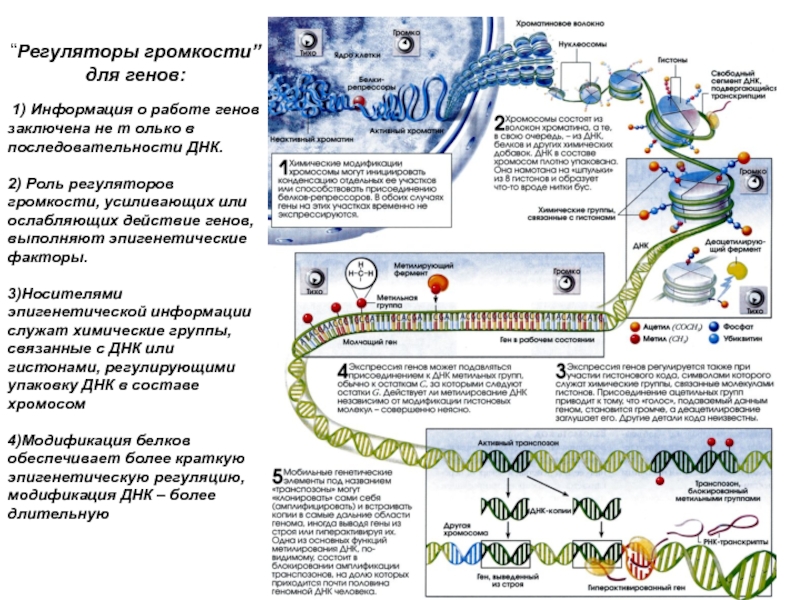
Слайд 10“Регуляторы громкости” для генов:
1) Информация о работе генов заключена не
2) Роль регуляторов громкости, усиливающих или ослабляющих действие генов, выполняют эпигенетические факторы.
3)Носителями эпигенетической информации служат химические группы, связанные с ДНК или гистонами, регулирующими упаковку ДНК в составе хромосом
4)Модификация белков обеспечивает более краткую эпигенетическую регуляцию, модификация ДНК – более длительную
Слайд 111. Это обычный фрагмент молекулы ДНК, за тем исключением,
что цитозин
5'-ACGTAT5-MeCGT-3'
3'-TGCATAG5-MeCA-5'
2. Репликация ДНК: метилированность сама по себе не реплицируется, временная пассивная деметилизация ДНК
5'-ACGTAT5-MeCGT-3'
3'-TGCATAGCA-5'
5'-ACGTATCGT-3'
3'-TGCATAG5-MeCA-5‘
3. Метилирование цитозина поддерживающей метилазой в паре 3'-GC-5' (метилирование цитозина производится только в том случае, если напротив 3'-GC-5' в комплементарной цепи ДНК есть 5'-CG-3' с прометилированным C).
5'-ACGTAT5-MeCGT-3'
3'-TGCATAG5-MeCA-5'
5'-ACGTAT5-MeCGT-3'
3'-TGCATAG5-MeCA-5'
Таким образом, модифицированный цитозин может наследоваться подобно обычному, передавая свою метилированность в дочернюю цепь ДНК.
Метилирование ДНК осуществляется ДНК-метилтрансферазами
Наследование уровня метилирования в ряду поколений клеток
Слайд 12Во время оплодотворения:
в отцовском геноме происходит деметилирование и замена протаминов
материнский пронуклеус – сильнее метилирован и содержит ацетилированные гистоны
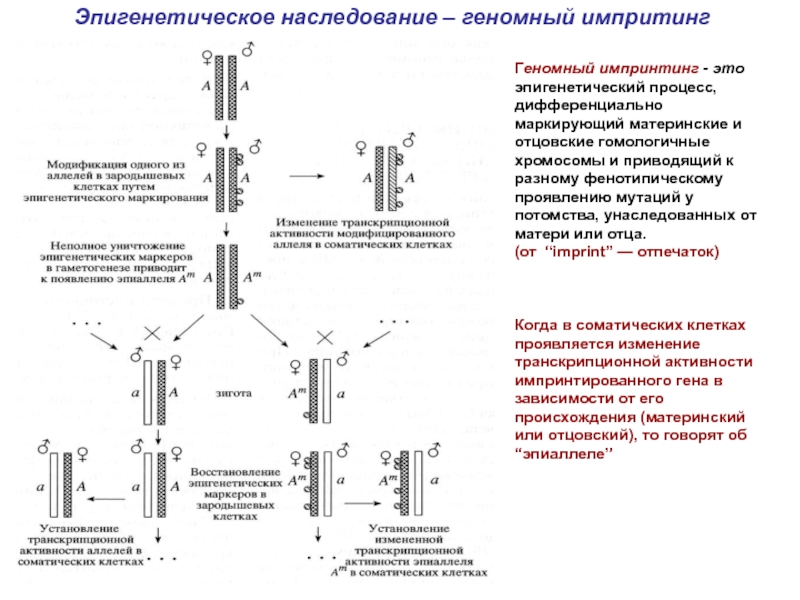
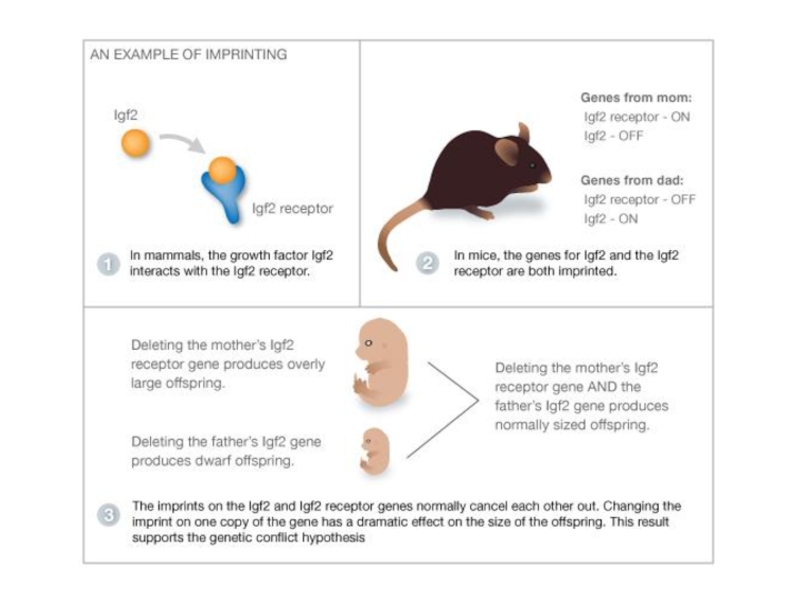
Слайд 13Эпигенетическое наследование – геномный импритинг
Геномный импринтинг - это эпигенетический процесс, дифференциально
(от “imprint” — отпечаток)
Когда в соматических клетках проявляется изменение транскрипционной активности импринтированного гена в зависимости от его происхождения (материнский или отцовский), то говорят об
“эпиаллеле”
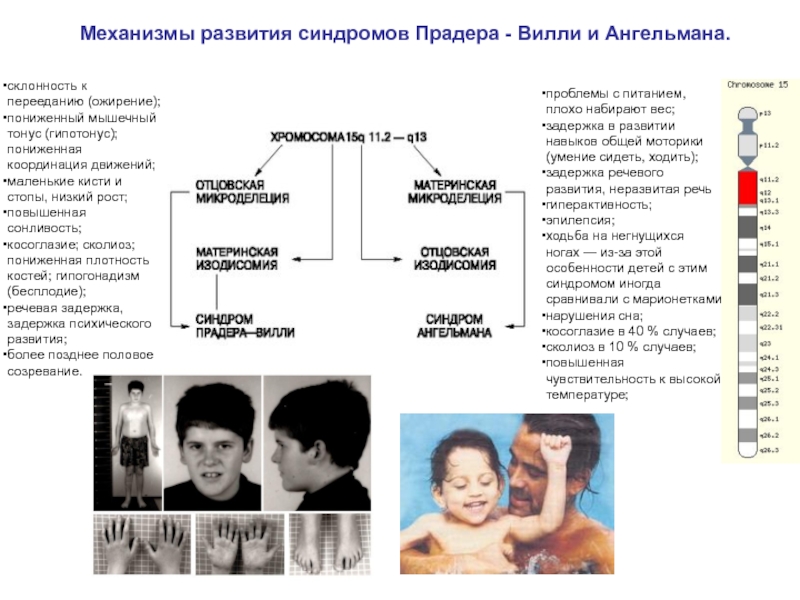
Слайд 16Механизмы развития синдромов Прадера - Вилли и Ангельмана.
склонность к перееданию
пониженный мышечный тонус (гипотонус); пониженная координация движений;
маленькие кисти и стопы, низкий рост;
повышенная сонливость;
косоглазие; сколиоз; пониженная плотность костей; гипогонадизм (бесплодие);
речевая задержка, задержка психического развития;
более позднее половое созревание.
проблемы с питанием, плохо набирают вес;
задержка в развитии навыков общей моторики (умение сидеть, ходить);
задержка речевого развития, неразвитая речь
гиперактивность;
эпилепсия;
ходьба на негнущихся ногах — из-за этой особенности детей с этим синдромом иногда сравнивали с марионетками
нарушения сна;
косоглазие в 40 % случаев;
сколиоз в 10 % случаев;
повышенная чувствительность к высокой температуре;
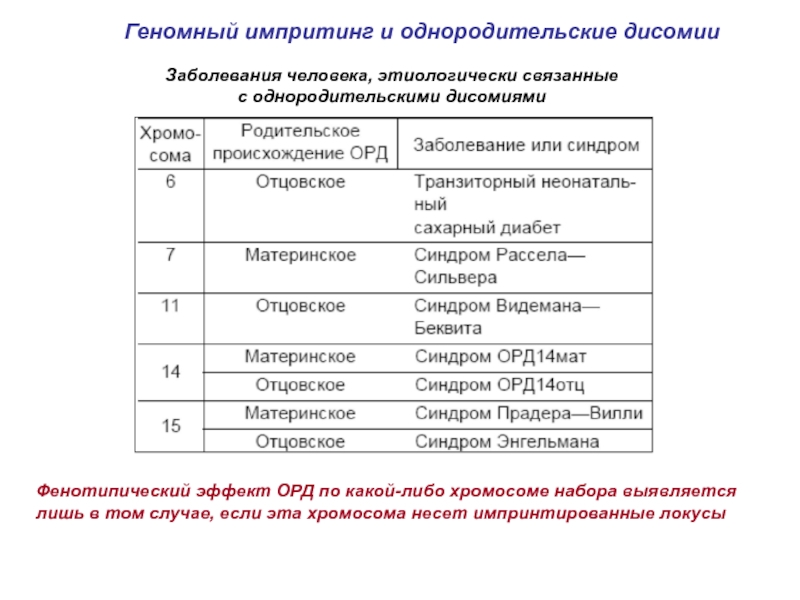
Слайд 17Геномный импритинг и однородительские дисомии
Заболевания человека, этиологически связанные
с однородительскими
Фенотипический эффект ОРД по какой-либо хромосоме набора выявляется лишь в том случае, если эта хромосома несет импринтированные локусы
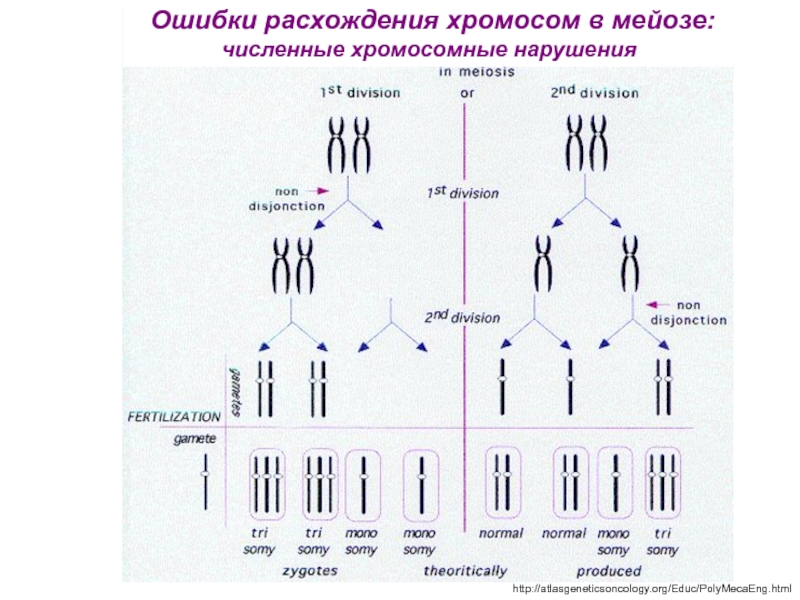
Слайд 18 Ошибки расхождения хромосом в мейозе:
численные хромосомные нарушения
http://atlasgeneticsoncology.org/Educ/PolyMecaEng.html
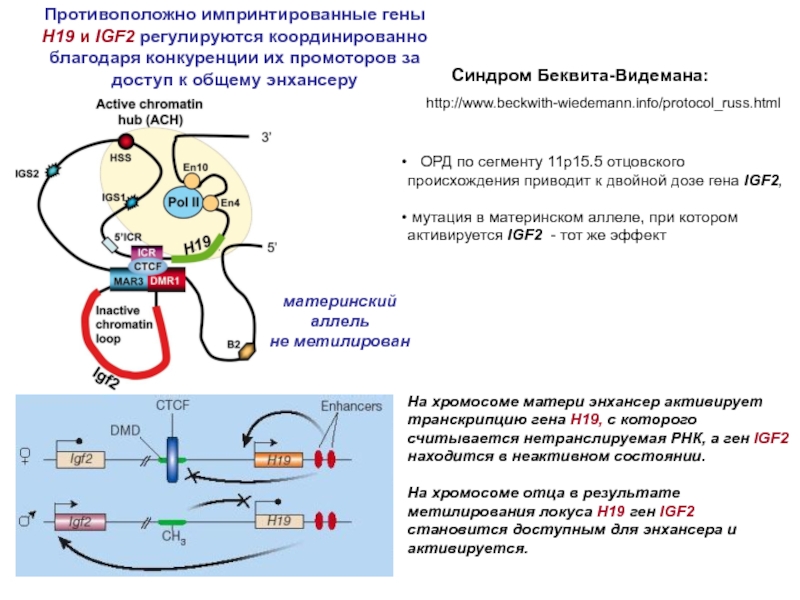
Слайд 20материнский
аллель
не метилирован
Противоположно импринтированные гены
H19 и IGF2 регулируются координированно благодаря конкуренции
На хромосоме матери энхансер активирует транскрипцию гена H19, с которого считывается нетранслируемая РНК, а ген IGF2 находится в неактивном состоянии.
На хромосоме отца в результате метилирования локуса H19 ген IGF2 становится доступным для энхансера и активируется.
ОРД по сегменту 11р15.5 отцовского происхождения приводит к двойной дозе гена IGF2,
мутация в материнском аллеле, при котором активируется IGF2 - тот же эффект
Синдром Беквита-Видемана:
http://www.beckwith-wiedemann.info/protocol_russ.html
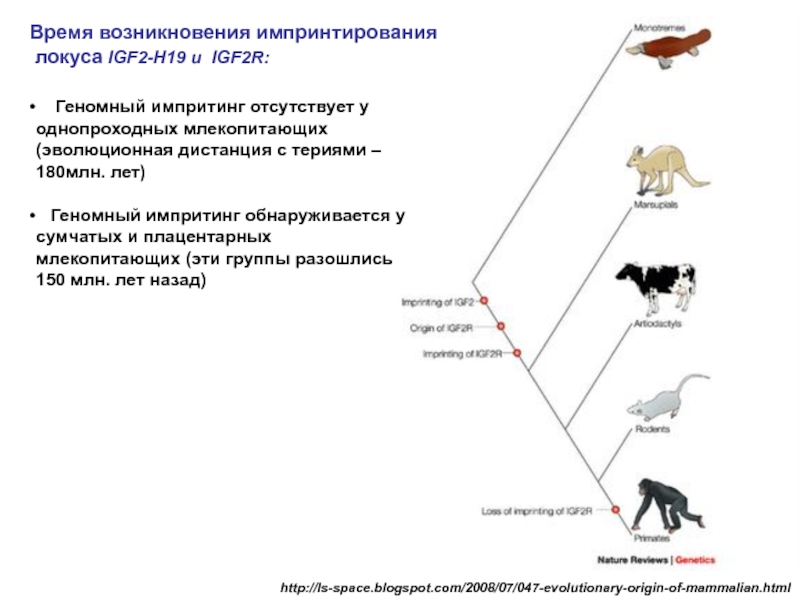
Слайд 21http://ls-space.blogspot.com/2008/07/047-evolutionary-origin-of-mammalian.html
Время возникновения импринтирования
локуса IGF2-H19 и IGF2R:
Геномный импритинг отсутствует
Геномный импритинг обнаруживается у сумчатых и плацентарных млекопитающих (эти группы разошлись 150 млн. лет назад)
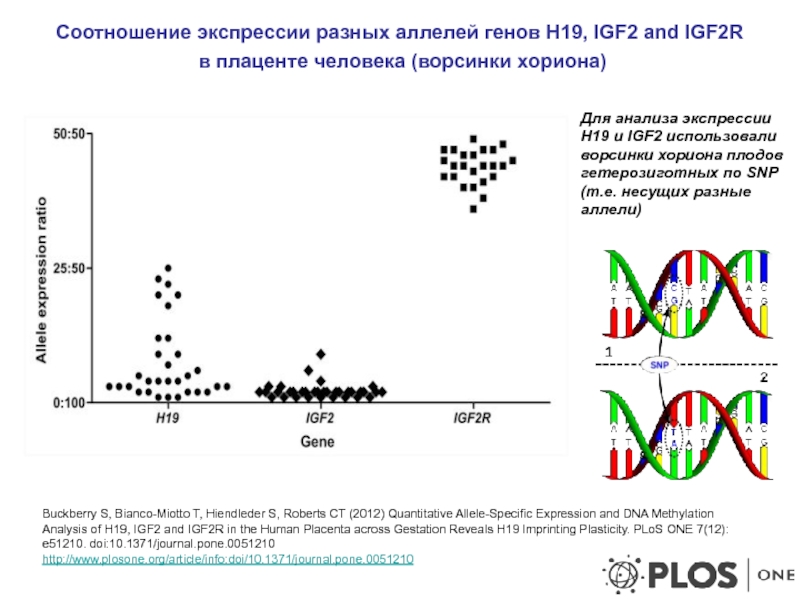
Слайд 23Соотношение экспрессии разных аллелей генов H19, IGF2 and IGF2R
в плаценте
Buckberry S, Bianco-Miotto T, Hiendleder S, Roberts CT (2012) Quantitative Allele-Specific Expression and DNA Methylation Analysis of H19, IGF2 and IGF2R in the Human Placenta across Gestation Reveals H19 Imprinting Plasticity. PLoS ONE 7(12): e51210. doi:10.1371/journal.pone.0051210
http://www.plosone.org/article/info:doi/10.1371/journal.pone.0051210
Для анализа экспрессии Н19 и IGF2 использовали ворсинки хориона плодов гетерозиготных по SNP (т.е. несущих разные аллели)
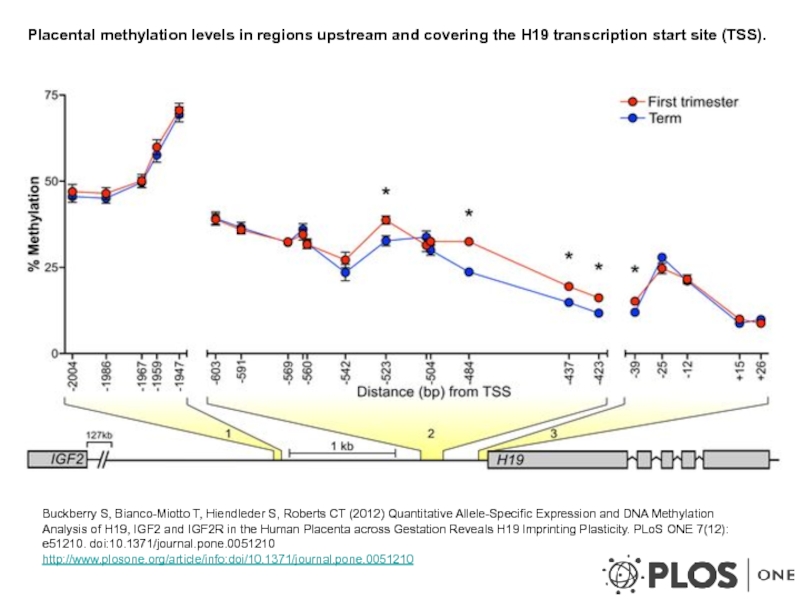
Слайд 24 Placental methylation levels in regions upstream and covering the H19
Buckberry S, Bianco-Miotto T, Hiendleder S, Roberts CT (2012) Quantitative Allele-Specific Expression and DNA Methylation Analysis of H19, IGF2 and IGF2R in the Human Placenta across Gestation Reveals H19 Imprinting Plasticity. PLoS ONE 7(12): e51210. doi:10.1371/journal.pone.0051210
http://www.plosone.org/article/info:doi/10.1371/journal.pone.0051210
Слайд 25
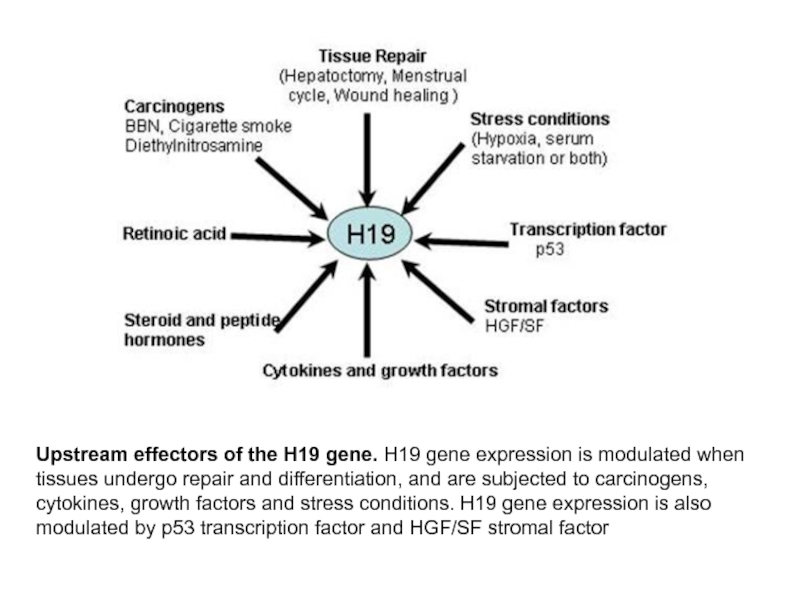
Upstream effectors of the H19 gene. H19 gene expression is modulated
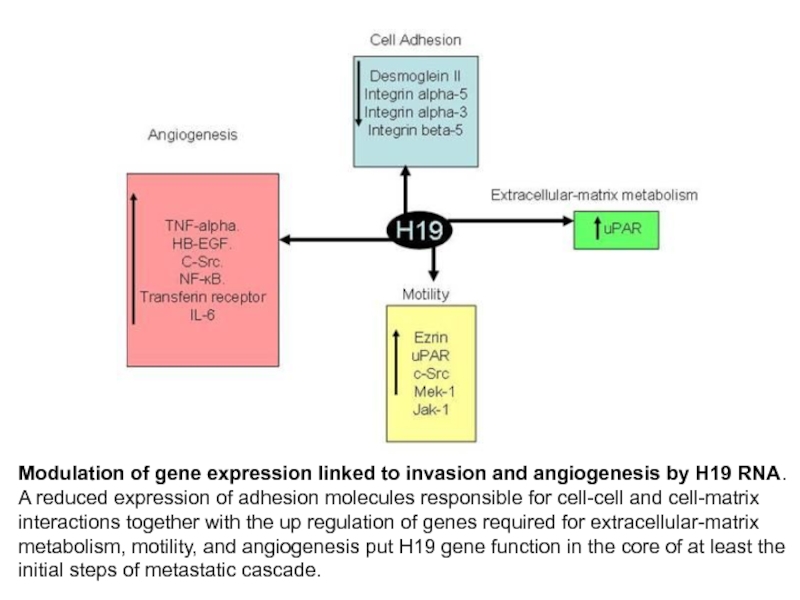
Слайд 26Modulation of gene expression linked to invasion and angiogenesis by H19
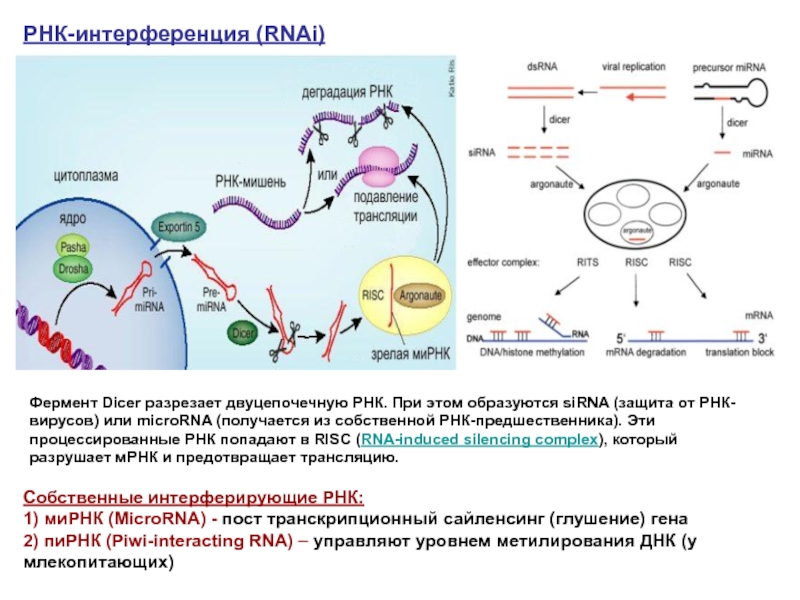
Слайд 27Фермент Dicer разрезает двуцепочечную РНК. При этом образуются siRNA (защита от
РНК-интерференция (RNAi)
Собственные интерферирующие РНК:
1) миРНК (MicroRNA) - пост транскрипционный сайленсинг (глушение) гена
2) пиРНК (Piwi-interacting RNA) – управляют уровнем метилирования ДНК (у млекопитающих)
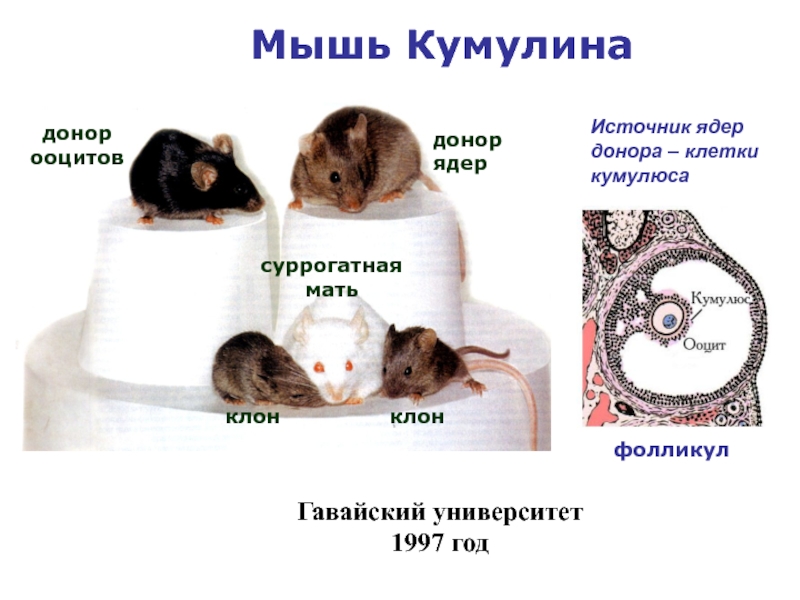
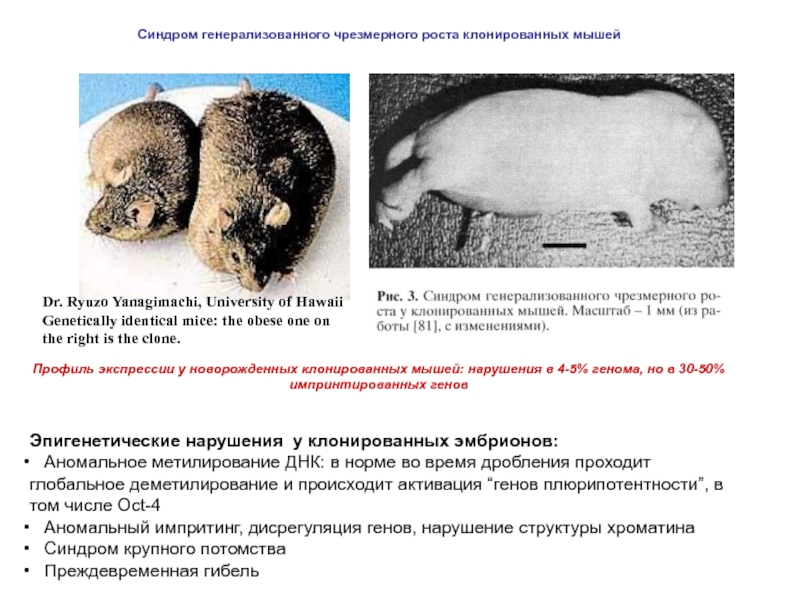
Слайд 33Dr. Ryuzo Yanagimachi, University of Hawaii Genetically identical mice: the obese one
Синдром генерализованного чрезмерного роста клонированных мышей
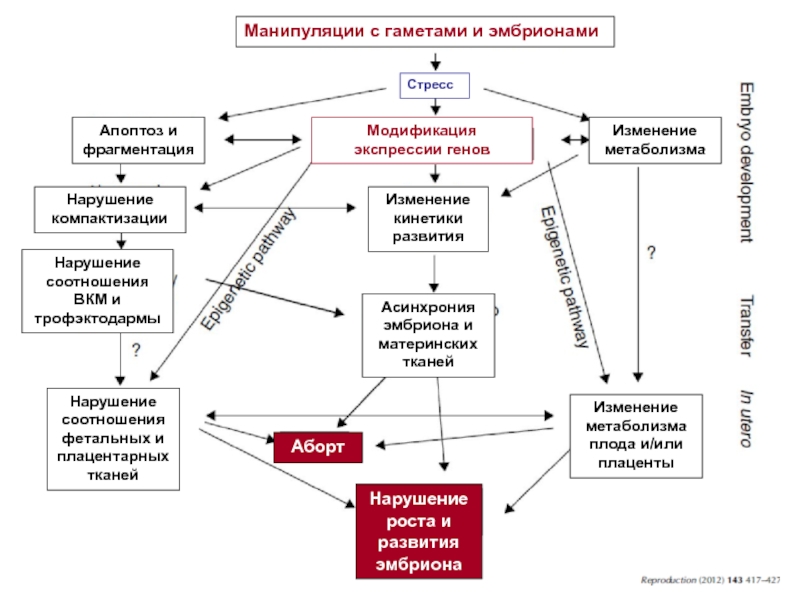
Эпигенетические нарушения у клонированных эмбрионов:
Аномальное метилирование ДНК: в норме во время дробления проходит глобальное деметилирование и происходит активация “генов плюрипотентности”, в том числе Осt-4
Аномальный импритинг, дисрегуляция генов, нарушение структуры хроматина
Синдром крупного потомства
Преждевременная гибель
Профиль экспрессии у новорожденных клонированных мышей: нарушения в 4-5% генома, но в 30-50% импринтированных генов
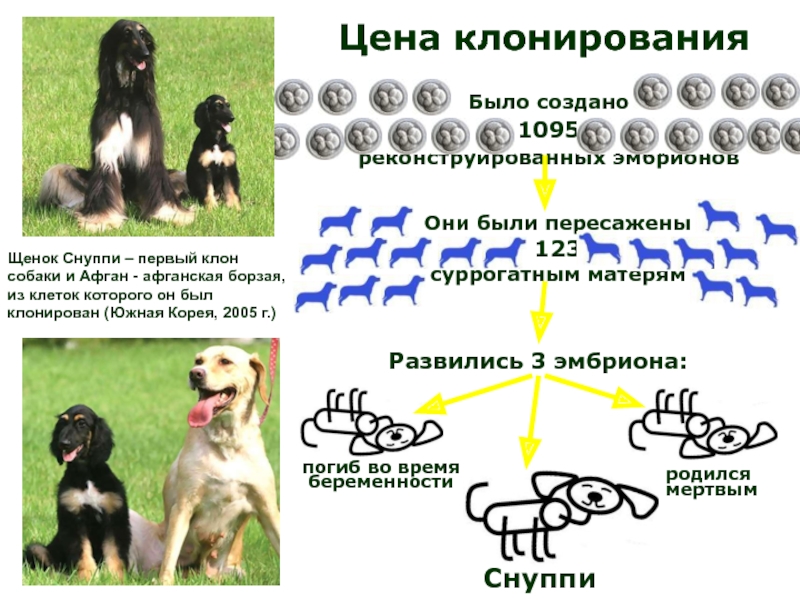
Слайд 34Клонирование клонов
Телята полученные из клеток клонированных коров
в Японии (2000г.) и
Клонированные животные живут меньше, чем обычные.
По некоторым данным, в клетках клонов укороченные теломерные участки.
Чтобы проверить, сократиться ли срок жизни клонов при повторном клонировании в яйцеклетки пересадили ядра из клеток клонов. При таком последовательном клонировании происходила коррекция длины теломер
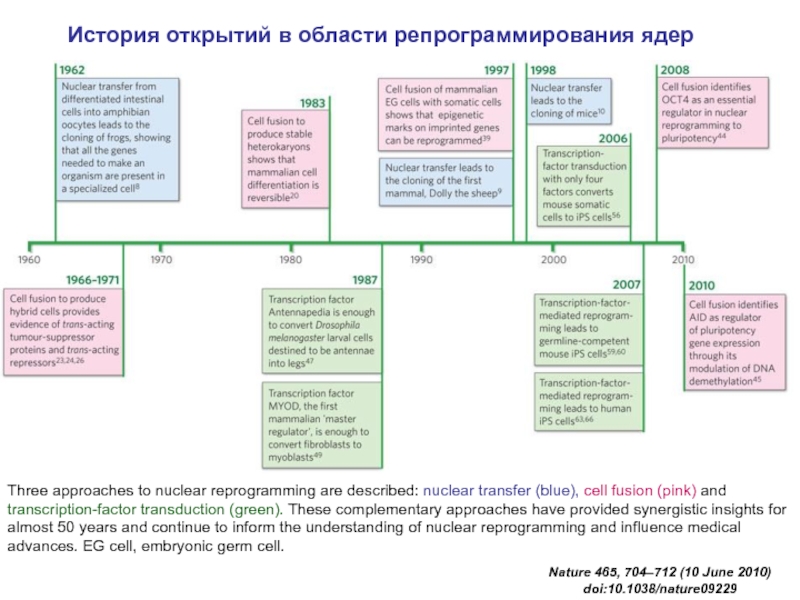
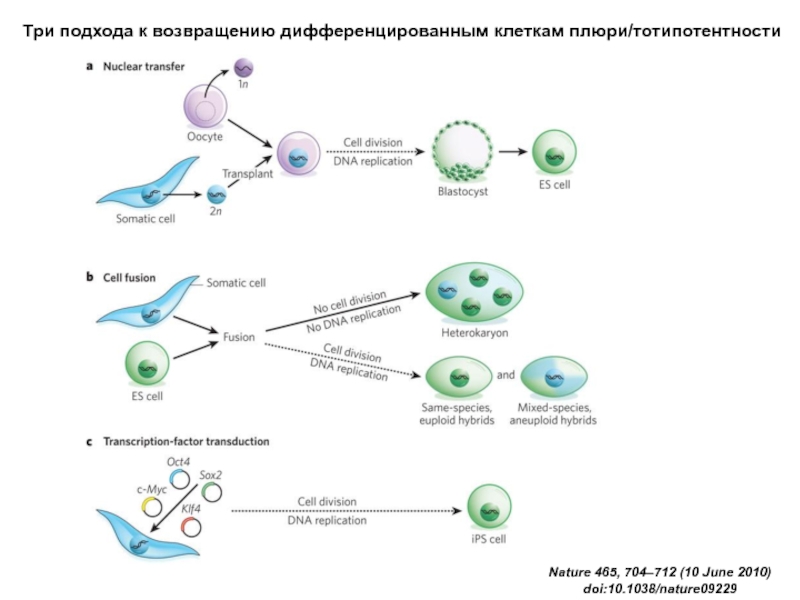
Слайд 35Three approaches to nuclear reprogramming are described: nuclear transfer (blue), cell
История открытий в области репрограммирования ядер
Nature 465, 704–712 (10 June 2010) doi:10.1038/nature09229
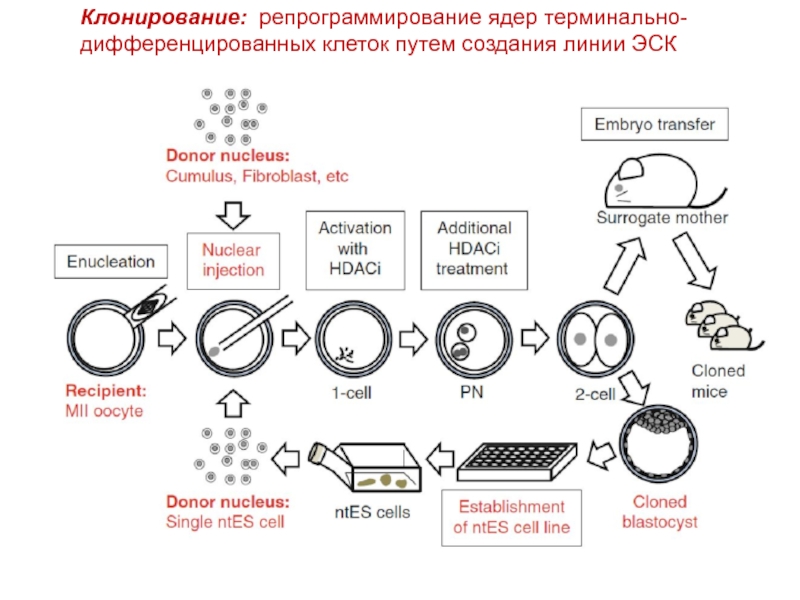
Слайд 36Клонирование: репрограммирование ядер терминально-дифференцированных клеток путем создания линии ЭСК
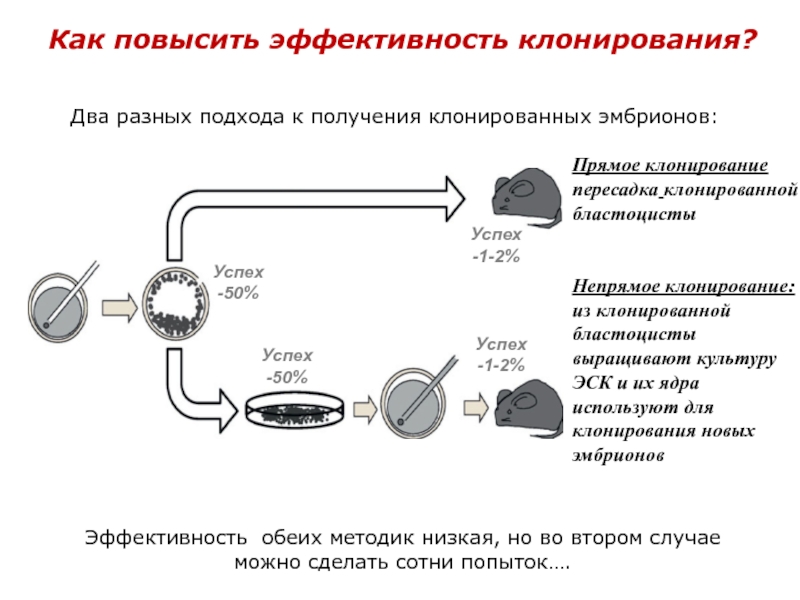
Слайд 37Как повысить эффективность клонирования?
Прямое клонирование пересадка клонированной бластоцисты
Непрямое клонирование: из клонированной
Два разных подхода к получения клонированных эмбрионов:
Эффективность обеих методик низкая, но во втором случае можно сделать сотни попыток….
Успех -50%
Успех -50%
Успех -1-2%
Успех -1-2%
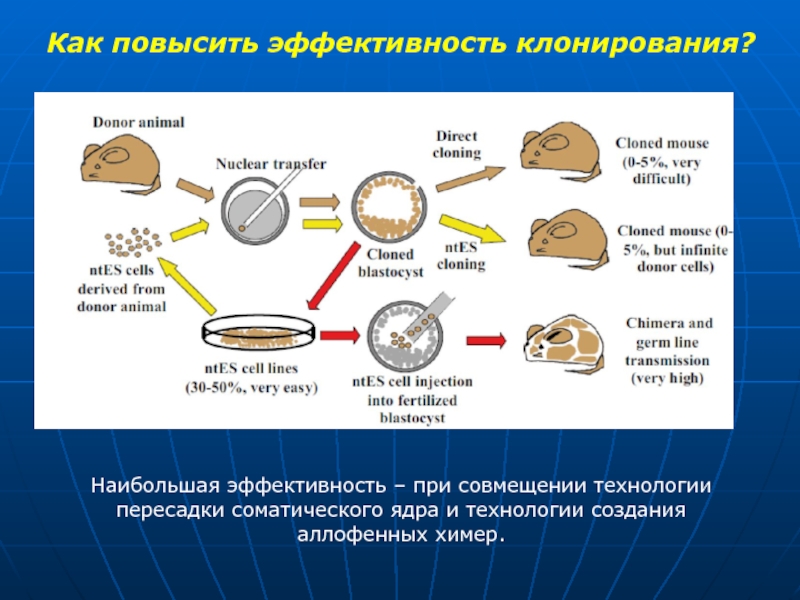
Слайд 38Как повысить эффективность клонирования?
Наибольшая эффективность – при совмещении технологии пересадки соматического
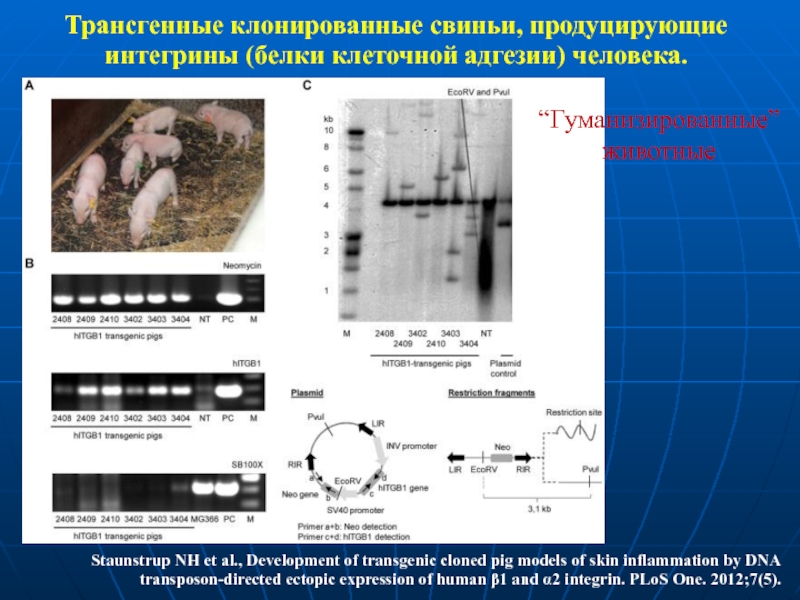
Слайд 40Трансгенные клонированные свиньи, продуцирующие
интегрины (белки клеточной адгезии) человека.
Staunstrup NH
“Гуманизированные”
животные
Слайд 41Nature 465, 704–712 (10 June 2010) doi:10.1038/nature09229
Три подхода к возвращению дифференцированным
Слайд 43Южнокорейский ученый Ву Сук Хванг в 2004 году сообщил о получении
но его работа оказалась подделкой.
Hwang WS, Roh SI Roh SI, Lee BC Roh SI, Lee BC, Kang SK Roh SI, Lee BC, Kang SK, Kwon DK Roh SI, Lee BC, Kang SK, Kwon DK, Kim S Roh SI, Lee BC, Kang SK, Kwon DK, Kim S, Kim SJ Roh SI, Lee BC, Kang SK, Kwon DK, Kim S, Kim SJ, Park SW Roh SI, Lee BC, Kang SK, Kwon DK, Kim S, Kim SJ, Park SW, Kwon HS Roh SI, Lee BC, Kang SK, Kwon DK, Kim S, Kim SJ, Park SW, Kwon HS, Lee CK Roh SI, Lee BC, Kang SK, Kwon DK, Kim S, Kim SJ, Park SW, Kwon HS, Lee CK, Lee JB Roh SI, Lee BC, Kang SK, Kwon DK, Kim S, Kim SJ, Park SW, Kwon HS, Lee CK, Lee JB, Kim JM Roh SI, Lee BC, Kang SK, Kwon DK, Kim S, Kim SJ, Park SW, Kwon HS, Lee CK, Lee JB, Kim JM, Ahn C Roh SI, Lee BC, Kang SK, Kwon DK, Kim S, Kim SJ, Park SW, Kwon HS, Lee CK, Lee JB, Kim JM, Ahn C, Paek SH Roh SI, Lee BC, Kang SK, Kwon DK, Kim S, Kim SJ, Park SW, Kwon HS, Lee CK, Lee JB, Kim JM, Ahn C, Paek SH, Chang SS Roh SI, Lee BC, Kang SK, Kwon DK, Kim S, Kim SJ, Park SW, Kwon HS, Lee CK, Lee JB, Kim JM, Ahn C, Paek SH, Chang SS, Koo JJ Roh SI, Lee BC, Kang SK, Kwon DK, Kim S, Kim SJ, Park SW, Kwon HS, Lee CK, Lee JB, Kim JM, Ahn C, Paek SH, Chang SS, Koo JJ, Yoon HS Roh SI, Lee BC, Kang SK, Kwon DK, Kim S, Kim SJ, Park SW, Kwon HS, Lee CK, Lee JB, Kim JM, Ahn C, Paek SH, Chang SS, Koo JJ, Yoon HS, Hwang JH Roh SI, Lee BC, Kang SK, Kwon DK, Kim S, Kim SJ, Park SW, Kwon HS, Lee CK, Lee JB, Kim JM, Ahn C, Paek SH, Chang SS, Koo JJ, Yoon HS, Hwang JH, Hwang YY Roh SI, Lee BC, Kang SK, Kwon DK, Kim S, Kim SJ, Park SW, Kwon HS, Lee CK, Lee JB, Kim JM, Ahn C, Paek SH, Chang SS, Koo JJ, Yoon HS, Hwang JH, Hwang YY, Park YS Roh SI, Lee BC, Kang SK, Kwon DK, Kim S, Kim SJ, Park SW, Kwon HS, Lee CK, Lee JB, Kim JM, Ahn C, Paek SH, Chang SS, Koo JJ, Yoon HS, Hwang JH, Hwang YY, Park YS, Oh SK Roh SI, Lee BC, Kang SK, Kwon DK, Kim S, Kim SJ, Park SW, Kwon HS, Lee CK, Lee JB, Kim JM, Ahn C, Paek SH, Chang SS, Koo JJ, Yoon HS, Hwang JH, Hwang YY, Park YS, Oh SK, Kim HS Roh SI, Lee BC, Kang SK, Kwon DK, Kim S, Kim SJ, Park SW, Kwon HS, Lee CK, Lee JB, Kim JM, Ahn C, Paek SH, Chang SS, Koo JJ, Yoon HS, Hwang JH, Hwang YY, Park YS, Oh SK, Kim HS, Park JH Roh SI, Lee BC, Kang SK, Kwon DK, Kim S, Kim SJ, Park SW, Kwon HS, Lee CK, Lee JB, Kim JM, Ahn C, Paek SH, Chang SS, Koo JJ, Yoon HS, Hwang JH, Hwang YY, Park YS, Oh SK, Kim HS, Park JH, Moon SY Roh SI, Lee BC, Kang SK, Kwon DK, Kim S, Kim SJ, Park SW, Kwon HS, Lee CK, Lee JB, Kim JM, Ahn C, Paek SH, Chang SS, Koo JJ, Yoon HS, Hwang JH, Hwang YY, Park YS, Oh SK, Kim HS, Park JH, Moon SY, Schatten G. Patient-specific embryonic stem cells derived from human SCNT blastocysts. Science. 2005 Jun 17;308:1777-83.
Hwang WS, Ryu YJ, Ryu YJ, Park JH, Ryu YJ, Park JH, Park ES, Ryu YJ, Park JH, Park ES, Lee EG, Ryu YJ, Park JH, Park ES, Lee EG, Koo JM, Ryu YJ, Park JH, Park ES, Lee EG, Koo JM, Jeon HY, Ryu YJ, Park JH, Park ES, Lee EG, Koo JM, Jeon HY, Lee BC, Ryu YJ, Park JH, Park ES, Lee EG, Koo JM, Jeon HY, Lee BC, Kang SK, Ryu YJ, Park JH, Park ES, Lee EG, Koo JM, Jeon HY, Lee BC, Kang SK, Kim SJ, Ryu YJ, Park JH, Park ES, Lee EG, Koo JM, Jeon HY, Lee BC, Kang SK, Kim SJ, Ahn C, Ryu YJ, Park JH, Park ES, Lee EG, Koo JM, Jeon HY, Lee BC, Kang SK, Kim SJ, Ahn C, Hwang JH, Ryu YJ, Park JH, Park ES, Lee EG, Koo JM, Jeon HY, Lee BC, Kang SK, Kim SJ, Ahn C, Hwang JH, Park KY, Ryu YJ, Park JH, Park ES, Lee EG, Koo JM, Jeon HY, Lee BC, Kang SK, Kim SJ, Ahn C, Hwang JH, Park KY, Cibelli JB, Ryu YJ, Park JH, Park ES, Lee EG, Koo JM, Jeon HY, Lee BC, Kang SK, Kim SJ, Ahn C, Hwang JH, Park KY, Cibelli JB, Moon SY. Evidence of a pluripotent human embryonic stem cell line derived from a cloned blastocyst. Science. 2004 Mar;303:1669-74
Слайд 44Imprinted genes and their role in human fetal growth Abu-Amero S. · Monk D.
Abstract
Growth is defined as the progressive increase in size and is listed as one of the eight main characteristics of life. In human gestation the most rapid growth phase is from 16 to 32 weeks when first there is both cell number and size increase and then from 32 weeks onwards there is continued size increase (Pollack and Divon, 1992). The mechanism of growth in utero is of fundamental interest to clinicians and scientists because of its implications for neonatal health. Growth is multifactorial in origin with both genetics and environment contributing equally large parts. Despite this complexity analysis of the candidate genes involved is possible using simple tissue biopsies at the relevant stages of development. Of particular interest in understanding fetal growth is the analysis of a group of genes that show a parent-of-origin effect known as genomic imprinting. Imprinted genes are not only found in eutherian (placental) and metatherian (marsupial) mammals but surprisingly also in plants. Nevertheless, their evolution in mammals appears to be linked primarily to placentation. It is thought to result from a potential conflict between the parents in terms of the drive to successfully propagate their own separate genes and the mother’s added drive for her survival through the pregnancy to reproduce again. This means that the mother wants to restrict fetal growth and the father to enhance it.
Слайд 45Установление различий в паттерне метилирования в мужских и женских половых клетках:
Самцы
1)
2)
3)
Самки
1)
2)
3)
Cytogenet Genome Res. 2006;113(1-4):36-40.
Origins of extreme sexual dimorphism in genomic imprinting.
Bourc'his DBourc'his D, Bestor TH.
Roughly equal numbers of imprinted genes are subject to repression from alleles of maternal and of paternal origin. This masks the strong sexual dimorphism that underlies major aspects of imprinted gene regulation. First, imprints are established very early in the male germ line and persist for the reproductive life of the organism, while maternal genomic imprints are established shortly prior to ovulation and are erased soon thereafter in the primordial germ cells of the next generation. Second, many CpG island-associated promoters are subject to maternal methylation but no known promoters are subject to paternal-specific germline methylation. The few known paternal methylation marks are kilobases distant from the affected genes and have a low CpG density. Third, Dnmt3L is required for imprint establishment but not transposon methylation in female germ cells, while Dnmt3L is required for transposon methylation and has only a minor role in de novo methylation at imprinted loci in male germ cells. Fourth, maternally expressed genes are commonly repressed on the paternal allele by paternally expressed imprinted genes produced in cis and encoding nontranslated RNAs. It is here suggested that rapid loss of highly mutable methylated CpG sites has led to the depletion of methylation target sites in paternally repressed imprinted genes, and that an imprinting mechanism based on RNAs or local inhibitory influences of ongoing transcription of regulatory loci has evolved to counter the erosion of paternally methylated regulatory regions. This mutability model is based on the fact that paternally methylated sequences are maintained in the methylated state for a much longer time than are maternally methylated sequences, and are therefore lost at a correspondingly faster rate. The difference in timing of imprint establishment is likely to underlie the increasing sexual dimorphism of other aspects of imprinted gene expression.