- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Буферные системы. Классификация буферных растворов презентация
Содержание
- 1. Буферные системы. Классификация буферных растворов
- 2. 03/15/2020
- 3. 03/15/2020 Буферный раствор –
- 4. 03/15/2020 Классификация буферных растворов: 1. слабая
- 5. 03/15/2020 3. кислая и средняя соли
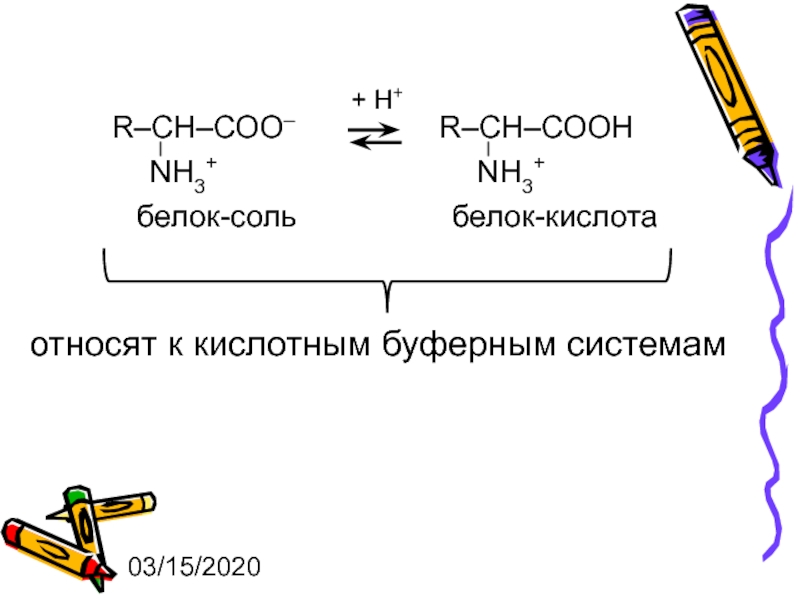
- 6. 03/15/2020 + Н+ белок-соль белок-кислота относят к кислотным буферным системам
- 7. 03/15/2020 + ОН– белок-соль белок-основание относят к основным буферным системам
- 8. 03/15/2020 Расчет рН буферных растворов производят по уравнению Гендерсона-Гассельбаха
- 9. 03/15/2020 для кислотных буферных растворов:
- 10. 03/15/2020 где
- 11. 03/15/2020 для основных буферных растворов:
- 12. 03/15/2020 где
- 13. 03/15/2020 Буферные растворы, состоящие
- 14. 03/15/2020 При
- 15. 03/15/2020
- 16. 03/15/2020 Расчет рН при добавлении кислоты HAn:
- 17. 03/15/2020 Расчет рН при добавлении щелочи: в
- 18. 03/15/2020 При добавлении небольшого
- 19. 03/15/2020 при добавлении небольшого
- 20. 03/15/2020 концентрация ацетата натрия
- 21. 03/15/2020 Число моль-эквивалентов сильной
- 22. 03/15/2020
- 23. 03/15/2020 CН(кислоты) и CН(щелочи) – эквивалентные
- 24. 03/15/2020 Буферная емкость зависит
- 25. 03/15/2020 Кислотно-основный гомеостаз в
- 26. 03/15/2020 устанавливается равновесие:
- 27. 03/15/2020 Уравнение Гендерсона-Гассельбаха
- 28. 03/15/2020 - основная буферная
- 29. 03/15/2020 Гидрофосфатная буферная система
- 30. 03/15/2020 Буферная емкость по
- 31. 03/15/2020 Гемоглобиновая буферная система содержится в
- 32. 03/15/2020 Механизм действия этой системы
- 33. 03/15/2020 играет значительную роль в процессах
- 34. 03/15/2020 Белковая (протеиновая) буферная система состоит
- 35. 03/15/2020 Все буферные системы в организме
- 36. 03/15/2020 Важным показателем для
- 37. 03/15/2020 Ацидоз
- 38. 03/15/2020 Алкалоз
- 39. 03/15/2020 Ацидоз или алкалоз
- 40. 03/15/2020 при недостатке О2
- 41. 03/15/2020 при избыточной вентиляции легких
Слайд 303/15/2020
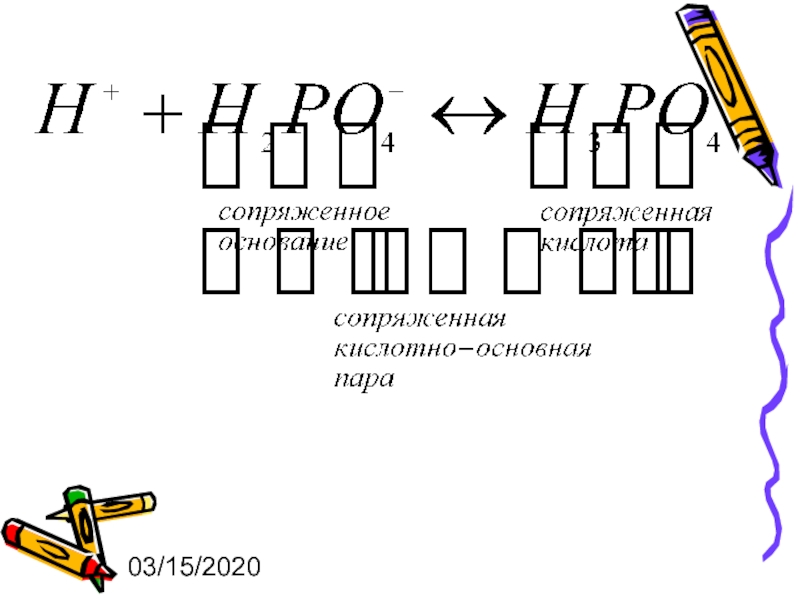
Буферный раствор – это раствор, содержащий сопряженную кислотно-основную пару
Слайд 403/15/2020
Классификация буферных растворов:
1. слабая кислота и ее соль - кислотная буферная
2. слабое основание и его соль - основная буферная система (NH4OH+NH4Cl)
Слайд 503/15/2020
3. кислая и средняя соли или две кислых соли - относят
4. растворы амфолитов (аминокислот, белков) проявляют буферное действие, при добавлении некоторого количества кислоты или щелочи.
Слайд 1003/15/2020
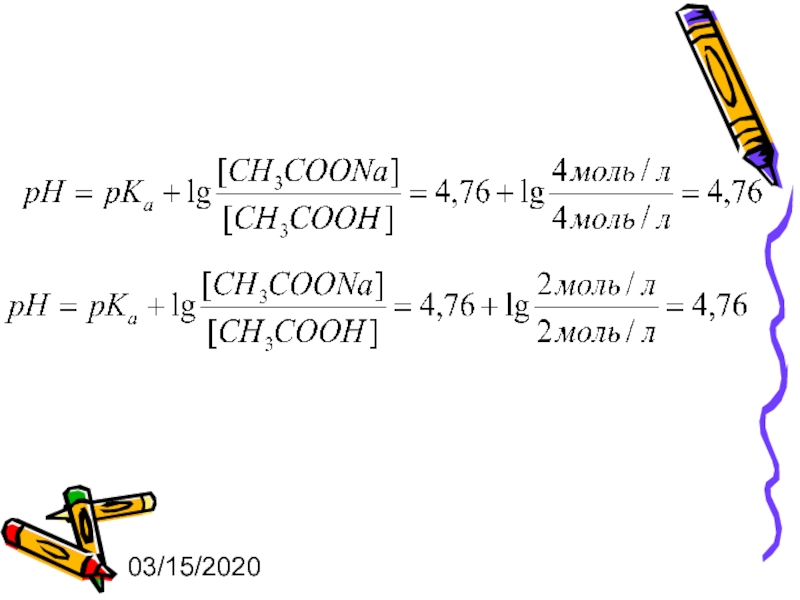
где – показатель константы диссоциации кислоты
[соли] и [кислоты] – молярные равновесные концентрации соли и кислоты соответственно,
Ссоли, Скислоты, Vсоли, Vкислоты – концентрации и объемы соли и кислоты, взятых для приготовления БР
Слайд 1203/15/2020
где – показатель константы диссоциации кислоты
[соли] и [осн] – молярные равновесные концентрации соли и основания соответственно,
Ссоли, Сосн, Vсоли, Vосн – концентрации и объемы соли и основания, взятых для приготовления БР
Слайд 1303/15/2020
Буферные растворы, состоящие из двух солей, одна из которых
Слайд 1403/15/2020
При разбавлении буферных растворов концентрации всех компонентов
их соотношение остается прежним, поэтому согласно формулам Гендерсона-Гассельбаха рН растворов не меняется.
Слайд 1603/15/2020
Расчет рН при добавлении кислоты HAn:
в кислотной буферной системе:
в основной буферной
Слайд 1703/15/2020
Расчет рН при добавлении щелочи:
в кислотной буферной системе:
в основной буферной системе:
Слайд 1803/15/2020
При добавлении небольшого количества кислоты, выделившиеся ионы водорода связываются
Слайд 1903/15/2020
при добавлении небольшого
количества соляной кислоты к
СH3COONa = CH3COO– + Na+
CH3COO– + H+ = CH3COOH
Слайд 2003/15/2020
концентрация ацетата натрия уменьшается, а концентрация уксусной кислоты увеличивается,
изменяется, но для того чтобы
рН раствора изменился на единицу, соотношение компонентов должно изменится в 10 раз.
Слайд 2103/15/2020
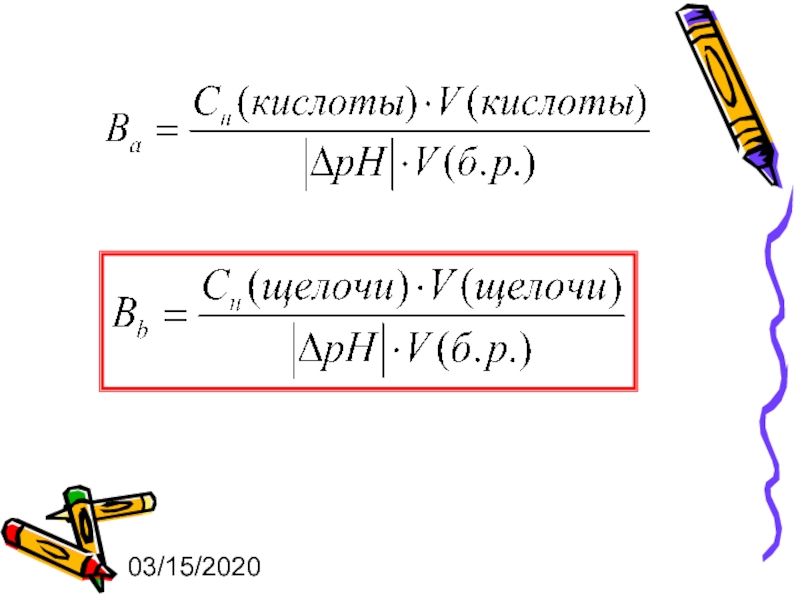
Число моль-эквивалентов сильной кислоты или щелочи, которое нужно добавить
Различают буферную емкость по кислоте и буферную емкость по щелочи :
Слайд 2303/15/2020
CН(кислоты) и CН(щелочи) – эквивалентные концентрации кислоты и щелочи соответственно;
V(кислоты)
V(б.р.) – объем буферного раствора;
|ΔрН| - изменение значения рН, вызванное добавлением кислоты или щелочи.
Слайд 2403/15/2020
Буферная емкость зависит от:
концентраций компонентов
Максимального значения буферная емкость достигает при равенстве концентраций компонентов буферной системы.
Слайд 2503/15/2020
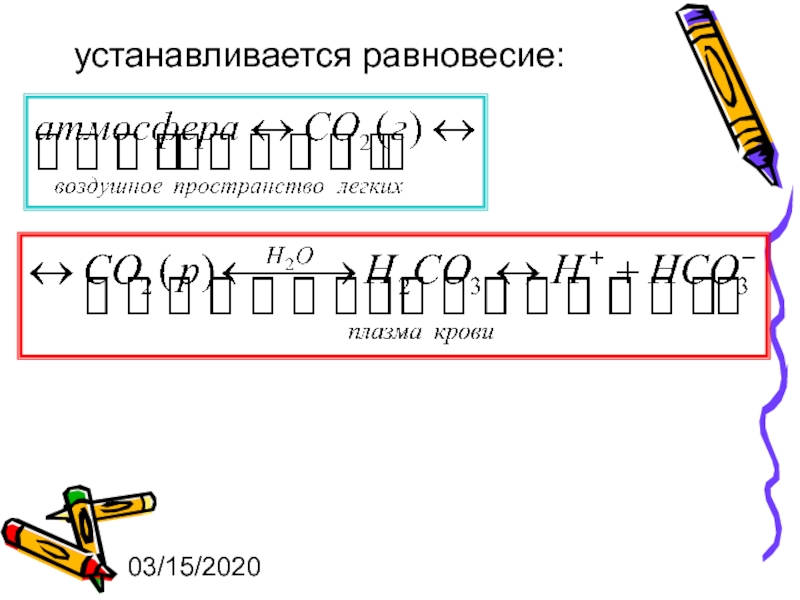
Кислотно-основный гомеостаз в организме обеспечивается несколькими буферными системами.
1. Гидрокарбонатная
Слайд 2703/15/2020
Уравнение Гендерсона-Гассельбаха
или рН=6,36+lg[НСО3–] – lg р(СО2),
где р(СО2) – парциальное
6,36 – рКа угольной кислоты с поправкой на константу Генри.
Слайд 2803/15/2020
- основная буферная система плазмы крови, обеспечивает ≈ 55
Слайд 2903/15/2020
Гидрофосфатная буферная система
в клетках представлена К2HPO4 и
Слайд 3003/15/2020
Буферная емкость по кислоте больше, чем по основанию. Избыточные
Слайд 3103/15/2020
Гемоглобиновая буферная система содержится в эритроцитах, представляет собой две сопряженные кислотно-основные
Слайд 3203/15/2020
Механизм действия этой системы основан на реакциях:
HHb ↔ H+ +
H+ + HbO2– ↔ HHbO2 ↔ HHb + O2
Слайд 3303/15/2020
играет значительную роль в процессах дыхания, транспорта кислорода в ткани
играет значительную роль в процессах дыхания, транспорта кислорода в ткани и поддержании постоянства рН внутри эритроцитов, а также в крови. Эффективно взаимодействует только в сочетании с другими буферными системами организма.
Слайд 3403/15/2020
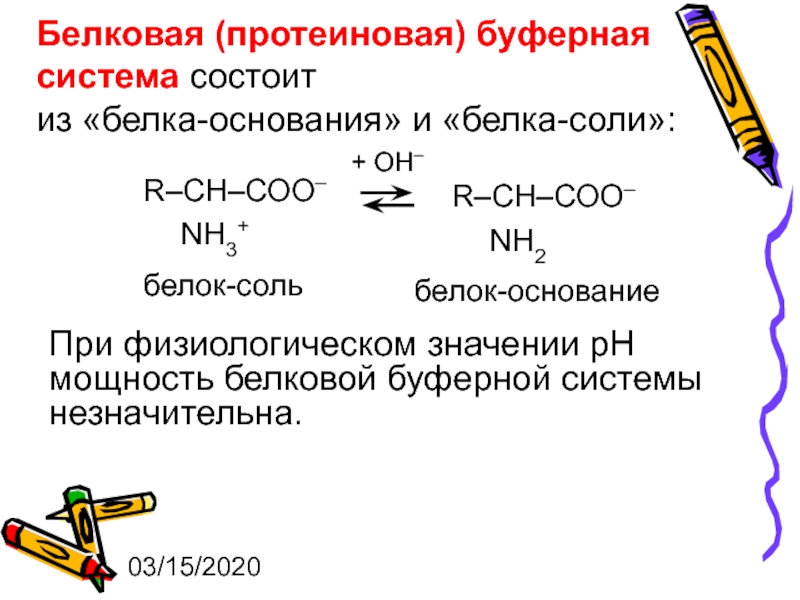
Белковая (протеиновая) буферная система состоит
из «белка-основания» и «белка-соли»:
+ ОН–
белок-соль
белок-основание
При физиологическом
Слайд 3503/15/2020
Все буферные системы в организме взаимосвязаны и для всех них буферная
Слайд 3603/15/2020
Важным показателем для физиологических сред является
кислотная
Слайд 3703/15/2020
Ацидоз
– это уменьшение кислотной буферной ёмкости
Слайд 3803/15/2020
Алкалоз
– это увеличение кислотной буферной ёмкости
Слайд 3903/15/2020
Ацидоз или алкалоз могут быть вызваны нарушением процессов дыхания
Слайд 4003/15/2020
при недостатке О2 или избытке СО2
сдвигается вправо, появляется избыток Н+ в крови, развивается ацидоз
Слайд 4103/15/2020
при избыточной вентиляции легких
равновесие сдвигается влево, содержание







![03/15/2020где – показатель константы диссоциации кислоты ,[соли]](/img/tmb/5/467103/4e45d5f82f7c61bb9c64755f81fe14ea-800x.jpg)

![03/15/2020где – показатель константы диссоциации кислоты ,[соли]](/img/tmb/5/467103/3638a899367ce12048b97dd808b7ee96-800x.jpg)











![03/15/2020Уравнение Гендерсона-Гассельбаха или рН=6,36+lg[НСО3–] – lg р(СО2),где р(СО2) – парциальное давление СО2 в альвеолах легких,6,36](/img/tmb/5/467103/b67d29f4d9ee01b8de250dfec876ecef-800x.jpg)