- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Биологиялық үрдістер термодинамикасы презентация
Содержание
- 1. Биологиялық үрдістер термодинамикасы
- 2. Биологиялық үрдістер термодинамикасы
- 3. Қарастырылатын сұрақтар Биологиялық жүйелерді оқып үйренудегі термодинамикалық
- 4. Термодинамика – материя қозғалысының жылулық формасының заңдылықтарын
- 5. Термодинамиканың негізгі түсініктері Термодинамикалық жүйе Жүйенің күйі Термодинамикалық үрдіс (процесс) Ішкі энергия Жұмыс.Жылу мөлшері
- 6. Термодинамикалық жүйе деп белгілі бір құбылыстағы қасиеттері
- 7. Тұйық термодинамикалық жүйе – сыртқы ортамен энергия және зат алмасуы орындалмайтын жүйе.
- 8. Термодинамикалық жүйе: оқшауланған, жабық және ашық болып
- 9. Жүйенің күйі Жүйенің күйі -өлшенетін физикалық
- 10. Термодинамикалық үрдіс (процесс) Жүйенің бір күйден
- 11. Термодинамикалық үрдістер циклді түрде жүреді. Циклдік
- 12. Термодинамикалық тепе-теңдік – уақытқа қатысты термодинамикалық жүйенің күйі өзгермейтін жағдай.
- 13. Ішкі энергия Макроденелерде механикалық энергиямен қатар, өздерiнiң
- 14. Механикалық жұмыс жасамай-ақ денелердi қыздырғанда, олардың iшкi
- 15. Жүйенің барлық бөлшектерінің кинетикалық және потенциалдық энергияларының
- 16. Жабық жүйе үшін: U = const (ΔU=0)
- 17. Егер дене бір күйден екіші бір күйге
- 18. Жұмыс. Жылу мөлшері Термодинамикалық жүйенің күйін
- 19. Жұмыс классикалық механикадағы сияқты анықталады, бiрақ ол
- 20. Мысалы, газдардың сығылуы кезiнде поршень өзiнiң механикалық
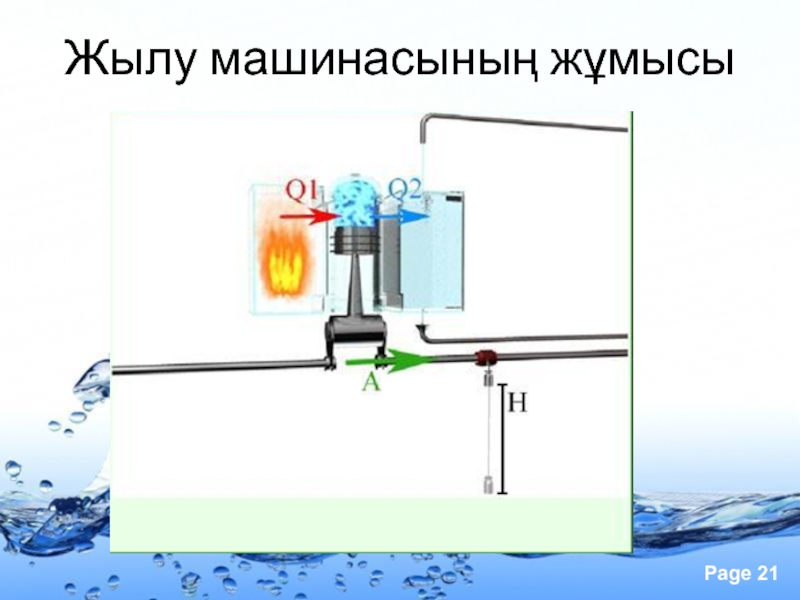
- 21. Жылу машинасының жұмысы
- 22. Керiсiнше, егер газ ұлғайса, онда алыстаған поршеньмен
- 24. Қозғалмалы ортаның көлемi өзгергендегi iстелген жұмыс мынаған
- 26. Ағзада зат алмасуы энергиялардың алмасу үрдістермен жүріп
- 27. Тірі ағза азық-түлік заттардың химиялық энергиясын жұмсап,
- 28. Жұмыс жасалынбай-ақ, бiр денеден екiншi денеге энергияның
- 29. Термодинамика негізгі заңдары: I және II
- 30. Энергия пайда болмайды және жоғалмайды, ол тек
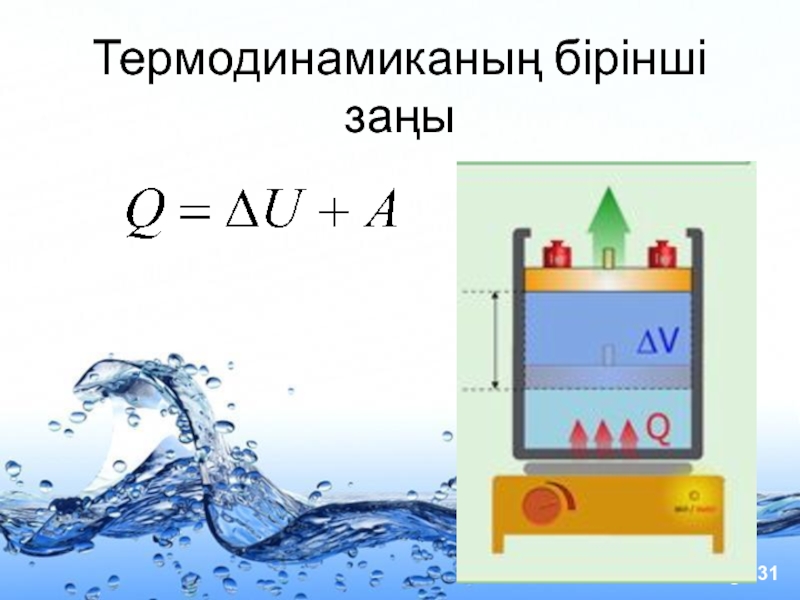
- 31. Термодинамиканың бірінші заңы
- 33. Жылу мөлшері мен жұмысты қандай да бір
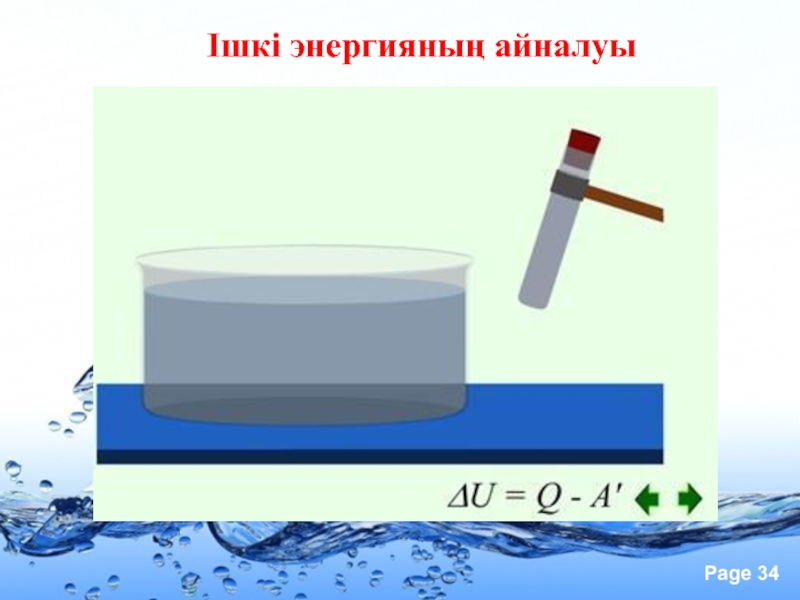
- 34. Ішкі энергияның айналуы
- 35. Жұмыс жасай отырып ішкі энергияны өзгерту Сұйықтықтарды араластыру
- 36. Егер ағза энергия көзі болып саналмаса, екіншіден
- 37. Ақыр соңында ағзаға келіп түскен тамақтан пайда
- 39. Термодинамиканың екінші бастамасы бойынша энергияның әр
- 41. Тепе - теңдік күйі жүйенің максималды тұрақтылығымен
- 42. Бұл занды сипаттайтын бірнеше анықтама бар, олар
- 43. Оствальд анықтамасы: Мәңгі двигательдің екінші түрін
- 44. Термодинамиканың екінші бастамасының биологияда қолданылуы Термодинамиканың
- 45. Жабық жүйеде өзінен-өзі жүретін үрдістер энтропияның өсуіне
- 46. Термодинамикалық тепе-теңдіктің жоқ болуына қарамастан жүйенің ұзақ
- 47. Стационарлық күй ашық жүйеге тән болады.
- 48. Тірі ағза ашық стационар күйдегі термодинамикалық
- 49. Бұл сипатты ағзаның стационар күйі – гомеостаз
- 50. Егер сыртқы ортаның өзгеруіне (айталық қысымның, температураның)
- 51. Термодинамикалық үрдістердің бағыты, шегі, мүмкін болған ағымын
- 52. Сонда энтропияның толық өзгерісі мына формуламен анықталады:
- 53. Ағза мен сыртқы орта арасындағы энтропия алмасуын сипаттайтын Пригожин формуласы:
- 54. Ал термодинамиканың бірінші және екінші бастамаларын біріктірсек, онда мынаны аламыз:
- 55. Больцман физикалық және химиялық үрдістерде жүйе күйінің
- 56. Ағзада градиентті (мысалы, заттың пассивті тасымалы), градиентке
- 57. Ағзада пайда болған әртүрлі градиенттерге (химиялық, электрлік,
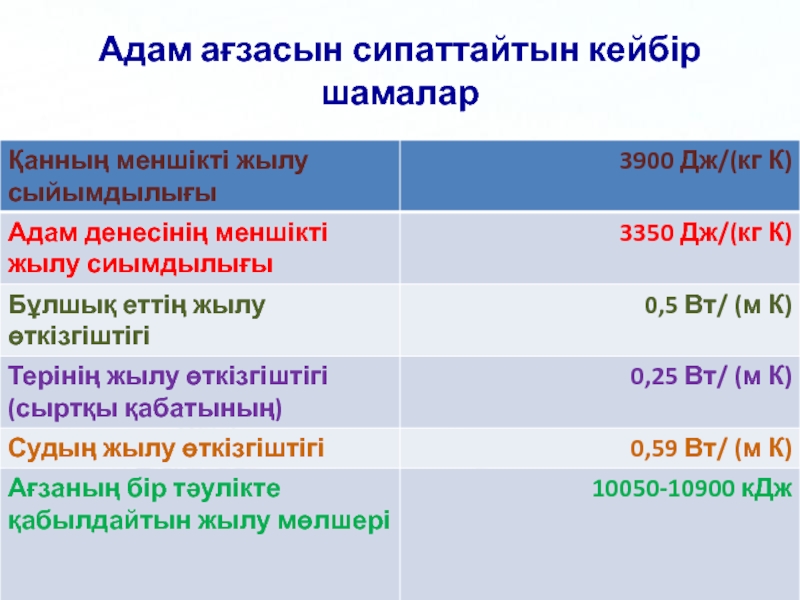
- 58. Адам ағзасын сипаттайтын кейбір шамалар
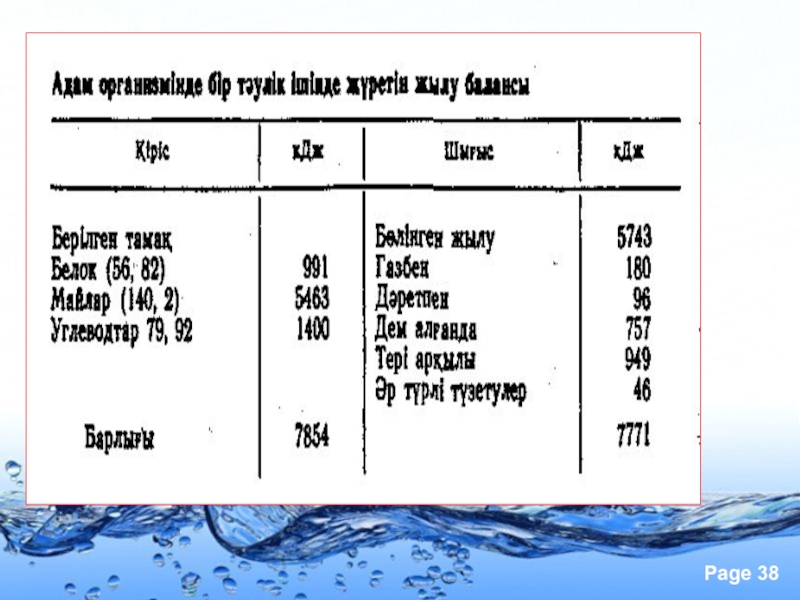
- 59. Сыртқы ортаға бөлінетін жылу мөлшері
- 60. Адам ағзасының бір тәулікте жұмсайтын орташа энергиясы
- 61. Бақылау сұрақтары Термодинамика нені зерттейді? Биологиялық жүйелерді
Слайд 1
Дәріскер
Медициналық биофизикамен
информатика кафедрасының
аға оқытушысы
Умирбекова
Замзагуль Климқызы
Слайд 3Қарастырылатын сұрақтар
Биологиялық жүйелерді оқып үйренудегі термодинамикалық әдістің маңызы мен ерекшеліктері.
Биологиядағы
Биологиялық жүйелердің энтропиясы.
Слайд 4Термодинамика – материя қозғалысының жылулық формасының заңдылықтарын және онымен байланысты болатын
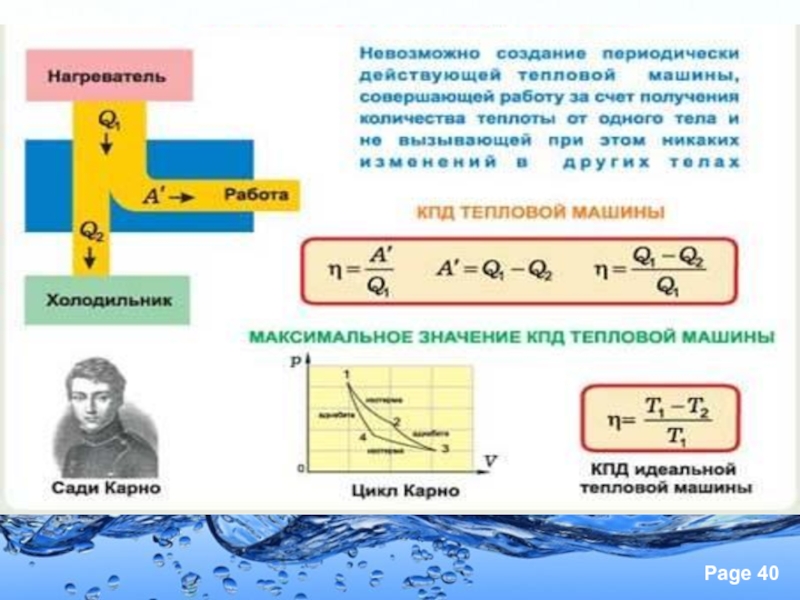
Термодинамиканың негізін қалаушы –
Никола Леонара Сади Карно.
Слайд 5Термодинамиканың негізгі түсініктері
Термодинамикалық жүйе
Жүйенің күйі
Термодинамикалық үрдіс (процесс)
Ішкі энергия
Жұмыс.Жылу мөлшері
Слайд 6Термодинамикалық жүйе деп белгілі бір құбылыстағы қасиеттері қарастырылатын кез-келген дене
Слайд 8Термодинамикалық жүйе: оқшауланған, жабық және ашық болып келеді.
Жабық жүйе сыртқы ортамен
Ашық жүйе сыртқы ортамен зат алмасу да, энергия алмасу да бола алады.
Слайд 9Жүйенің күйі
Жүйенің күйі -өлшенетін физикалық шамалар болып табылатын жүйе параметрлерінің жиынтығымен
Сыртқы ортамен немесе басқа денемен әсерлескенде жүйенің күйін сипаттайтын параметрлері өзгереді.
Жүйенің параметрлерінің өзара байланысын сипаттайтын теңдеуді жүйе күйінің теңдеуі деп атайды: f(p, T, V) = 0
Слайд 10Термодинамикалық үрдіс (процесс)
Жүйенің бір күйден екінші күйге өтуін (бір күйден екінші
Слайд 11Термодинамикалық үрдістер циклді түрде жүреді.
Циклдік немесе дөңгелектік үрдіс термодинамикадағы бірнеше
Слайд 12Термодинамикалық тепе-теңдік – уақытқа қатысты термодинамикалық жүйенің күйі өзгермейтін жағдай.
Слайд 13Ішкі энергия
Макроденелерде механикалық энергиямен қатар, өздерiнiң iштерiне тұйықталған энергияға ие. Ол
Слайд 14Механикалық жұмыс жасамай-ақ денелердi қыздырғанда, олардың iшкi энергиясы ұлғаяды.
Iшкi энергияның механикалық
болатыны сөзсiз.
Слайд 15Жүйенің барлық бөлшектерінің кинетикалық және потенциалдық энергияларының қосындысын жүйенің ішкі энергиясы
Слайд 16Жабық жүйе үшін: U = const (ΔU=0)
Ішкі энергия тек қана жүйенің
Слайд 17Егер дене бір күйден екіші бір күйге өтсе, онда ішкі энергияның
ΔU = U2 – U1
бұл өзгерістің өту жолына байланысты болмайды.
Слайд 18Жұмыс. Жылу мөлшері
Термодинамикалық жүйенің күйін өзгертудің екі жолы бар:
жылу алмасу
Слайд 19Жұмыс классикалық механикадағы сияқты анықталады, бiрақ ол дененiң кинетикалық энергисының өзгеруiне
Слайд 20Мысалы, газдардың сығылуы кезiнде поршень өзiнiң механикалық энергиясының бiр бөлiгiн газдарға
Слайд 22Керiсiнше, егер газ ұлғайса, онда алыстаған поршеньмен соқтығысқаннан кейiн молекулалардың жылдамдығы
Газ ұлғайғандағы жұмыс
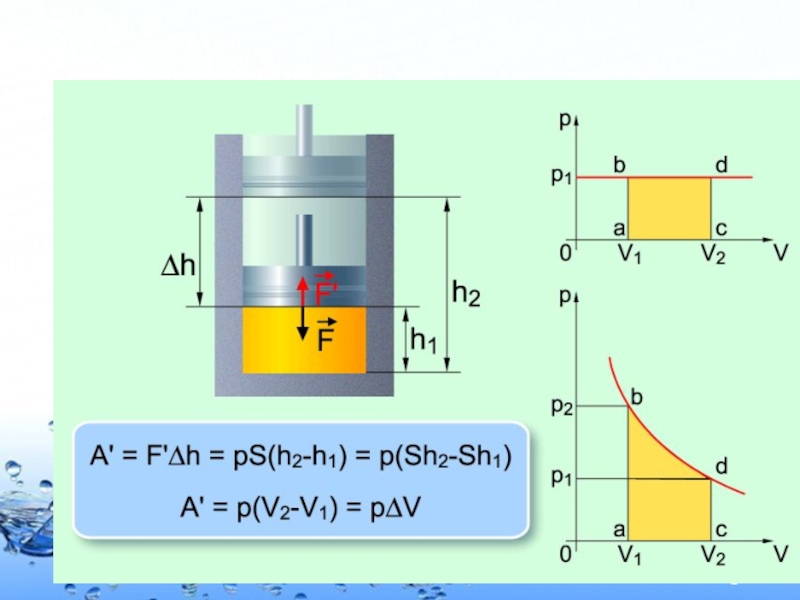
Слайд 24Қозғалмалы ортаның көлемi өзгергендегi iстелген жұмыс мынаған тең болады
А′ =
Ұлғаю кезiнде (V2 > V1) газ оң жұмыс жасайды: А′>0. Газ ұлғайғандағы жұмыс
Сығылу кезiнде V2
Слайд 26Ағзада зат алмасуы энергиялардың алмасу үрдістермен жүріп отырады: өмір сүру негізінде
Слайд 27Тірі ағза азық-түлік заттардың химиялық энергиясын жұмсап, осы энергияны ағзада орындалатын
Слайд 28Жұмыс жасалынбай-ақ, бiр денеден екiншi денеге энергияның берiлу үдерісі жылу алмасу
Жылу алмасу кезiндегi iшкi энергияның өзгеруiнiң мөлшерлiк шамасын жылу мөлшерi деп атайды.
Сәуле шығару энергиясының берілуі
Слайд 29Термодинамика негізгі заңдары:
I және II бастамалары
Термодинамиканың негізі болып энергияның сақталу
Оқшауланған жүйенің толық энергиясы осы жүйеде өтетін кез келген үрдісте өзгеріссіз қалады.
Слайд 30Энергия пайда болмайды және жоғалмайды, ол тек бір түрден екінші түрге
Слайд 33Жылу мөлшері мен жұмысты қандай да бір параметрдің бастапқы және соңғы
Слайд 36Егер ағза энергия көзі болып саналмаса, екіншіден ағзаға келіп түскен тамақтың
Бұл мәселені дәлелдеу үшін сонау XVIII ғасырдан бастап көптеген тәжірибелер жүргізілді.
Слайд 37Ақыр соңында ағзаға келіп түскен тамақтан пайда болатын энергияның мөлшері жұмыс
Слайд 39Термодинамиканың екінші бастамасы бойынша
энергияның әр түрі жылуға айналады да, ал
Слайд 41Тепе - теңдік күйі жүйенің максималды тұрақтылығымен сипатталады:
жүйеде болған кез келген
Ашық жүйелердегі өтетін үрдістер қайтымсыз сипатта болады.
Слайд 42Бұл занды сипаттайтын бірнеше анықтама бар, олар біріне-бірі эквивалентті. Соларға тоқталайық.
Клаузиус
Томсон-Планк анықтамасы: Қыздырғышты суыту арқасында онан алынган жылу мөлшерін түгелімен жүмысқа айналдыру мүмкін емес.
Слайд 43Оствальд анықтамасы:
Мәңгі двигательдің екінші түрін жасау мүмкін емес.
Төрт тактылы іштен
Слайд 44Термодинамиканың екінші бастамасының биологияда қолданылуы
Термодинамиканың бірінші бастамасы өлі табиғатқа да,
Оның себебі тірі ағза жабық жүйе емес ашық жүйеге жатады.
Слайд 45Жабық жүйеде өзінен-өзі жүретін үрдістер энтропияның өсуіне
ΔS >0, бос энергияның
Слайд 46Термодинамикалық тепе-теңдіктің жоқ болуына қарамастан жүйенің ұзақ уақыт бойына өзінің кейбір
физикалық және химиялық қасиеттерін сақтап тұру қасиеті стационар күй деп аталады.
Слайд 47Стационарлық күй
ашық жүйеге тән болады.
Жүйе стационарлык күйге ие болу
Слайд 48
Тірі ағза ашық стационар күйдегі термодинамикалық жүйе болғандықтан, оның күйінің параметрлерінің
Слайд 49Бұл сипатты ағзаның стационар күйі – гомеостаз деп атайды. Сонымен қатар
Слайд 50Егер сыртқы ортаның өзгеруіне (айталық қысымның, температураның) байланысты ағза стационарлық күйде
Ал қоршаған ортаның өзгеруіне байланысты ағза стационарлық күйден ауытқып кететін болса, онда ағза өмір сүруін тоқтатады.
Слайд 51Термодинамикалық үрдістердің бағыты, шегі, мүмкін болған ағымын жүйенің күйін сипаттайтын шама
Егер dQ=0 болса, онда dS=0 және болғандықтан S=const.
Слайд 52Сонда энтропияның толық өзгерісі мына формуламен анықталады:
мұндағы S- энтропия,
Бұл формуладан энтропия жүйе күйінің функциясы екендігін байқауға болады.
Слайд 55Больцман физикалық және химиялық үрдістерде жүйе күйінің ықтималдылығын энтропиямен байланыстырып термодинамиканың
мұндағы k - Больцман тұрақтысы, w- термодинамикалық ықтималдылық.
Слайд 56Ағзада градиентті (мысалы, заттың пассивті тасымалы), градиентке қарсы (заттың активті тасымалы)
Классикалық термодинамика көзқарасы бойынша
өмір – “керемет” күй.
Слайд 57Ағзада пайда болған әртүрлі градиенттерге (химиялық, электрлік, диффузиялық, жылулық және т.б.)
Слайд 60Адам ағзасының бір тәулікте жұмсайтын орташа энергиясы 3000 ккал. Берілген тағамдардан
Слайд 61Бақылау сұрақтары
Термодинамика нені зерттейді?
Биологиялық жүйелерді оқып үйренудегі термодинамикалық әдістің маңызы мен
Биологиядағы термодинамиканың бірінші және екінші заңдарының қолданылуы қандай?
Биологиялық жүйелердің энтропиясының ерекшеліктері.