- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Биологический катализ. Ферменты презентация
Содержание
- 1. Биологический катализ. Ферменты
- 2. Отличия ферментов от небиологических катализаторов Удивительная эффективность ферментов Число оборотов некоторых ферментов
- 3. Отличия ферментов от небиологических катализаторов Ферменты
- 4. Отличия ферментов от небиологических катализаторов Составные
- 5. Коферменты и витамины Витаминами можно назвать
- 6. Коферменты и витамины Если несколько соединений
- 7. Коферменты и витамины Собственно витамины —
- 8. Коферменты и витамины Следует выделить отдельно
- 9. Коферменты и витамины
- 10. Коферменты и витамины
- 11. Классификация энзимов – Е.С. (Enzyme Classification)
- 12. Классификация энзимов – Е.С. (Enzyme Classification)
- 13. Оксиредуктазы Дегидрогеназы (редуктазы) Оксидазы Пероксидазы Гидроксилазы Оксигеназы Гидрогеназы
- 14. Оксиредуктазы Е.С.1.1. – действует на СН-ОН функцию
- 15. Оксиредуктазы Е.С.1.1.1. – NAD+ или NADP+ Е.С.1.1.2.
- 16. Оксиредуктазы Е.С.1.1.1.1. – алкоголь дегидрогеназа NAD+
- 17. Оксиредуктазы Е.С.1.1.1.1
- 18. Трансферазы S-Аденозил-метионин
- 19. Трансферазы Где SAM – S-аденозил-L-метионин
- 20. Трансферазы Е.С.2.1.
- 21. Трансферазы Е.С.2.1.
- 22. Гидролазы Протеазы – гидролизуют
- 23. Гидролазы Е.С.3.1. – действуют
- 24. Гидролазы Е.С.3.1 гидролазы действующие
- 25. Лиазы Е.С.4.1. – углерод-углеродные
- 26. Лиазы Е.С.4.1.1. – карбокси
- 27. Лиазы
- 28. Изомеразы Е.С.5.1. – рацемазы
- 29. Изомеразы Е.С.5.1. рацемазы и
- 30. Лигазы (синтетазы) Е.С.6.1.
- 31. Кинетика ферментативных реакций
- 32. Кинетика ферментативных реакций Влияние
- 33. Кинетика ферментативных реакций Виктор Генри
- 34. Кинетика ферментативных реакций Модель Михаэлиса-Ментон
- 35. Кинетика ферментативных реакций
- 36. Кинетика ферментативных реакций Модель
- 37. Кинетика ферментативных реакций Модель Михаэлиса-Ментон
- 38. Кинетика ферментативных реакций Зависимость скорости
- 39. Кинетика ферментативных реакций Зависимость скорости
- 40. Кинетика ферментативных реакций Количество фермента можно определить
- 41. Специфичность ферментов по отношению к субстратам
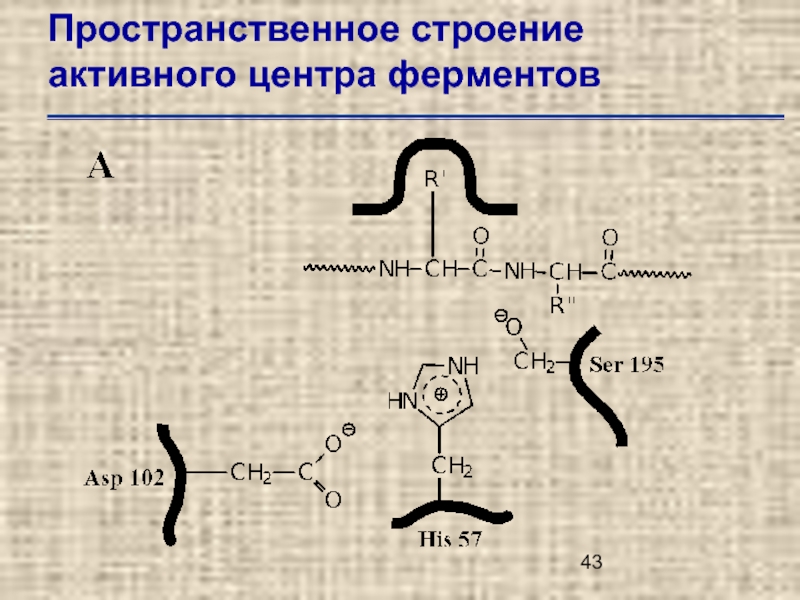
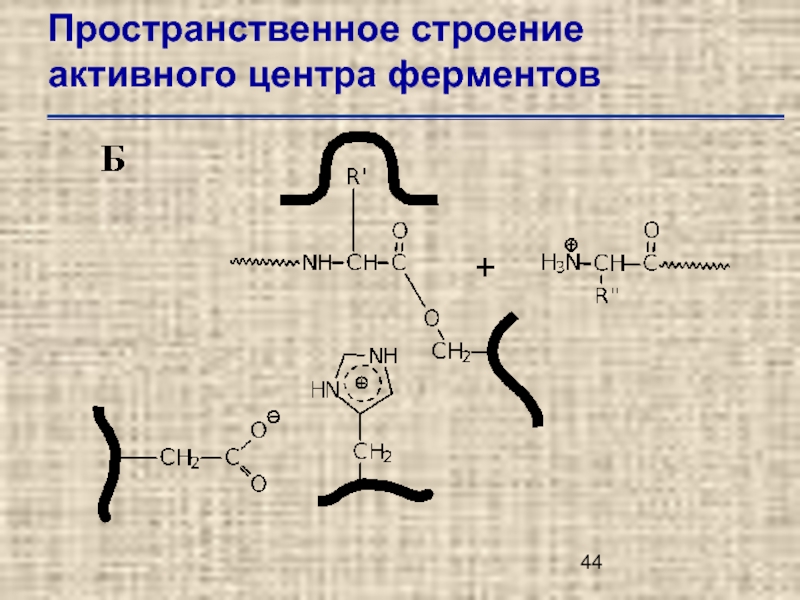
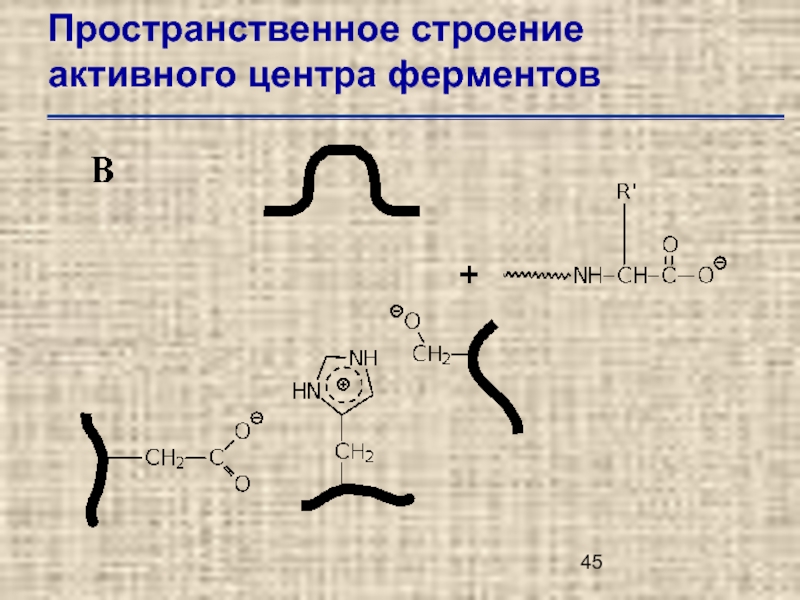
- 42. Пространственное строение активного центра ферментов
- 43. Пространственное строение активного центра ферментов
- 44. Пространственное строение активного центра ферментов
- 45. Пространственное строение активного центра ферментов
- 46. Пространственное строение активного центра ферментов
- 47. Пространственное строение активного центра ферментов
- 48. Пространственное строение активного центра ферментов
- 49. Пространственное строение активного центра ферментов
- 50. Пространственное строение активного центра ферментов
- 51. Факторы, определяющие каталитическую эффективность ферментов
Слайд 1Биологический катализ. Ферменты
«Алиса в стране чудес», иллюстрация John Tenniel, The
Слайд 2Отличия ферментов от небиологических катализаторов
Удивительная эффективность ферментов
Число оборотов некоторых
Слайд 3Отличия ферментов от небиологических катализаторов
Ферменты обладают высокой субстратной специфичностью
Ферменты обладают
Ферменты обладают высокой региоспецифичностью
Ферменты обладают высокой стереоспецифичностью
Слайд 4Отличия ферментов от небиологических катализаторов
Составные ферменты: белковая часть обеспечивает связывание
Слайд 5Коферменты и витамины
Витаминами можно назвать некую группу низкомолекулярных органических соединений
Природные соединения, не являющиеся витаминами, но легко превращающиеся в них в организме человека, называются провитаминами.
Слайд 6Коферменты и витамины
Если несколько соединений близкой химической природы выполняют одну
Коферменты — это органические природные низкомолекулярные соединения различной химической природы, необходимые для осуществления каталитического действия ферментов, катализирующих химические процессы in vivo.
Слайд 7Коферменты и витамины
Собственно витамины — это соединения, выполняющие свою витаминную
Витамины-коферменты — соединения, выполняющие определенную биохимическую функцию в виде производных, т.е. в виде коферментов.
Слайд 8Коферменты и витамины
Следует выделить отдельно группу коферментов, т.е. тех соединений,
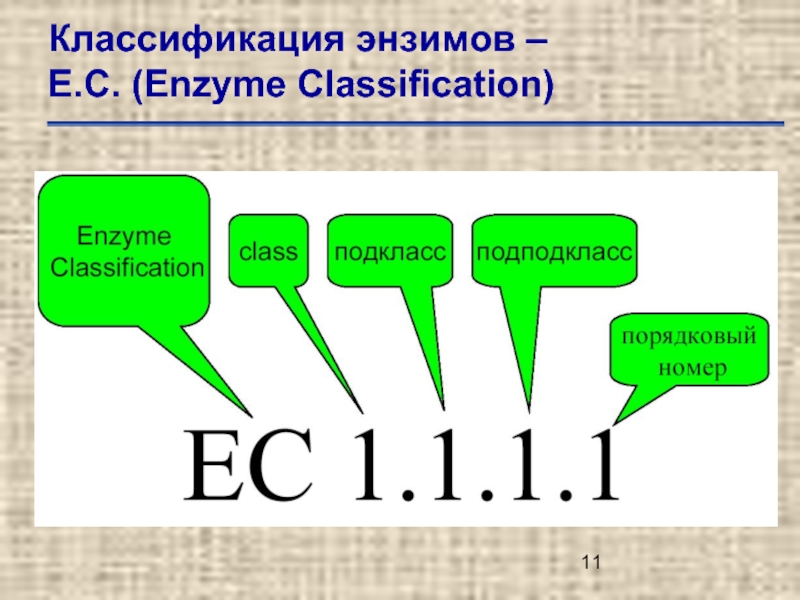
Слайд 12Классификация энзимов –
Е.С. (Enzyme Classification)
Е.С.1. – оксидоредуктазы (oxidoreductases).
Е.С.2. –
Е.С.3. – гидролазы (hydrolases).
Е.С.4. – лиазы (lyases).
Е.С.5. – изомеразы (isomerases)
Е.С.6. – лигазы (ligases).
Слайд 13Оксиредуктазы
Дегидрогеназы (редуктазы)
Оксидазы
Пероксидазы
Гидроксилазы
Оксигеназы
Гидрогеназы
Слайд 14Оксиредуктазы
Е.С.1.1. – действует на СН-ОН функцию
Е.С.1.2. – действует на альдегидную группу
Е.С.1.3.
…………………………………………………
Е.С.1.10. – действует на дифенолы и родственные группы
…………………………………………………
Е.С.1.13. – действует на простую связь с внедрением молекулярного кислорода
………………………………………………………….
Е.С.1.17. – действует на СН2 фрагмент
Слайд 15Оксиредуктазы
Е.С.1.1.1. – NAD+ или NADP+
Е.С.1.1.2. – цитохромом
Е.С.1.1.3. – кислородом
Е.С.1.1.4. –
Е.С.1.1.5. – хиноном
Слайд 16Оксиредуктазы
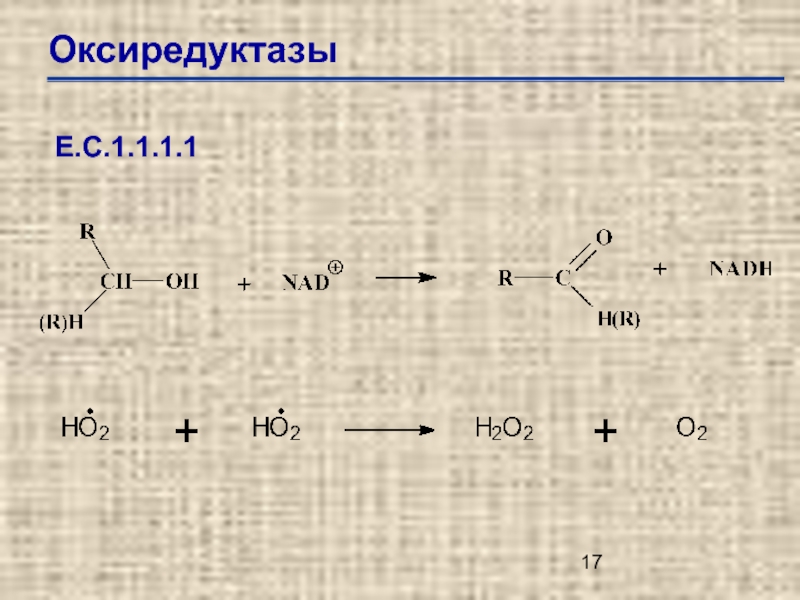
Е.С.1.1.1.1. – алкоголь дегидрогеназа NAD+
Е.С.1.1.1.2. – алкоголь дегидрогеназа NADP+
………………………………………………….
Е.С.1.1.1.27 –
………………………………………………….
Е.С.1.1.1.32 – мевальдат редуктаза
…………………………………………………
Е.С.1.1.1.62 – эстрадиол 17-β-дегидрогеназа
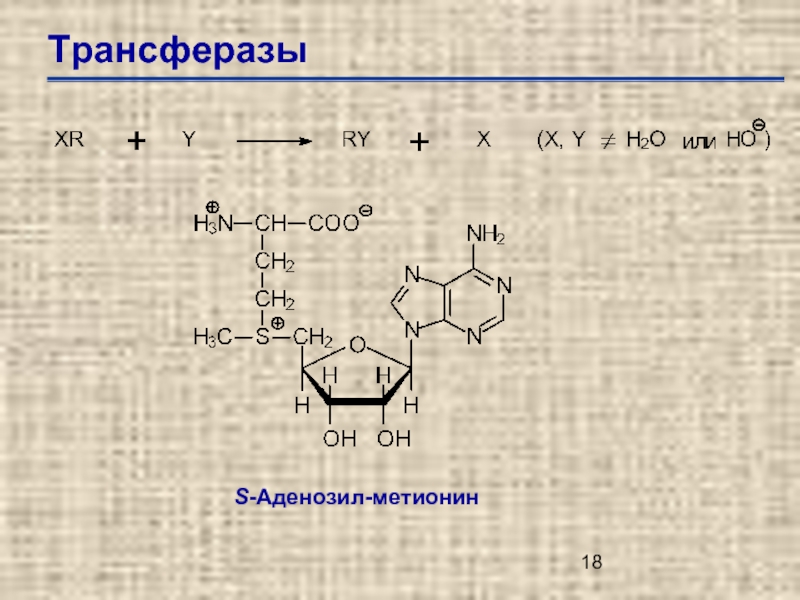
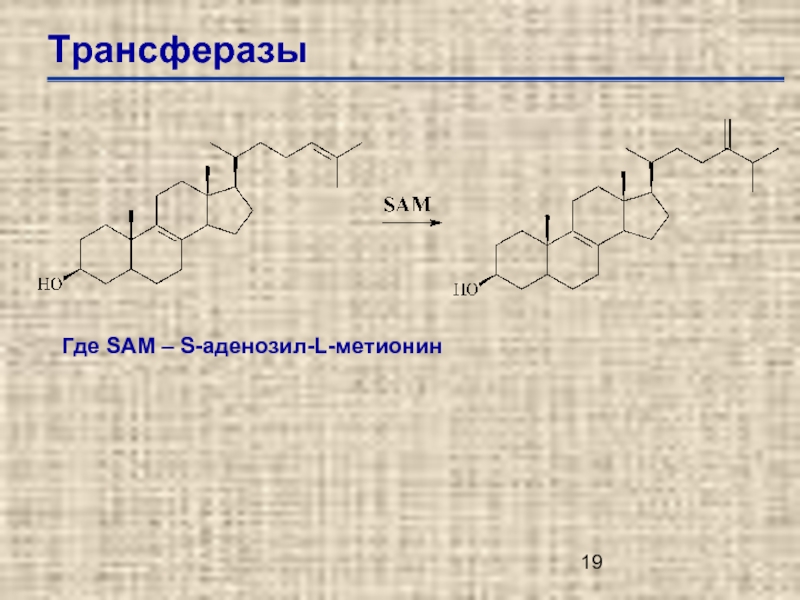
Слайд 20Трансферазы
Е.С.2.1. – переносчики одно-углеродной группы
Е.С.2.2. – переносчики карбонильных функций
Е.С.2.3.
Е.С.2.4. – гликозилтрансферазы
Е.С.2.5. – переносчики алкильных (кроме метильных) и арильных групп
Е.С.2.6. – переносчики азотистых функций
Е.С.2.7. – переносчики фосфор-содержащих групп
Е.С.2.8. – переносчики серу-содержащих функций
Е.С.2.9. – переносчики селен-содержащих групп
Слайд 21Трансферазы
Е.С.2.1. – трансферазы одноуглеродной группы
Е.С.2.1.1. – метилтрансфепразы
Е.С.2.1.1.41.
Слайд 22Гидролазы
Протеазы – гидролизуют белки
Нуклеазы – гидролизуют нуклеиновые кислоты
Специфические эндонуклеазы (так
Слайд 23Гидролазы
Е.С.3.1. – действуют на сложноэфирные связи, эстеразы
Е.С.3.2. – гликозилазы
Е.С.3.3.
Е.С.3.4. – действуют на пептидные связи (пептид гидролазы)
Е.С.3.5. – действуют на C – N связи, кроме пептидных
Е.С.3.6. – действуют на ангидриды кислот
Е.С.3.7. – действуют на углерод-углеродные связи
Е.С.3.8. – действуют на связи с галогеном
Е.С.3.9. – действуют на связи P – N
Е.С.3.10.– действуют на S – N связи
Е.С.3.11.– действуют на C – P связи
Е.С.3.12.– действуют на S – S связи
Е.С.3.13.– действуют на C – S связи.
Слайд 24Гидролазы
Е.С.3.1 гидролазы действующие на сложноэфирную связь
Е.С.3.1.1. гидролазы эфиров карбоновых кислот
Е.С.3.1.1.1
RCOOR1 + H2O = RCOOH + R1OH
Слайд 25Лиазы
Е.С.4.1. – углерод-углеродные лиазы
Е.С.4.2. – углерод-кислородные лиазы
Е.С.4.3. – углерод-азотные
Е.С.4.4. – углерод-серы лиазы
Е.С.4.5. – углерод-галоген лиазы
Е.С.4.6. – фосфор-кислородные лиазы
Е.С.4.99.– другие лиазы.
Слайд 26Лиазы
Е.С.4.1.1. – карбокси лиазы
Е.С.4.1.2. – альдегид лиазы
Е.С.4.1.3. –
Е.С.4.1.99. – другие углерод-углеродные лиазы
Е.С.4.1.1.1. – пируват декарбоксилаза
…………………………………………..
Е.С.4.1.1.23. – оротидин-5-фосфат декабоксилаза
………………………………………………
Е.С.4.1.1.31. – фосфоенолпируват карбоксилаза
………………………………………………….
Е.С.4.1.1.39. – рибулозодифосфат карбоксилаза
………………………………………………….
Е.С.4.1.1.50. – аденозилметионин декарбоксилаза
Слайд 28Изомеразы
Е.С.5.1. – рацемазы и эпимеразы
Е.С.5.2. – цис-трас-изомеразы
Е.С.5.3. – внутримолекулярные
Е.С.5.4. – внутримолекулярные трансферазы (мутазы)
Е.С.5.5. – внутримолекулярные лиазы
Е.С.5.99. – другие изомеразы.
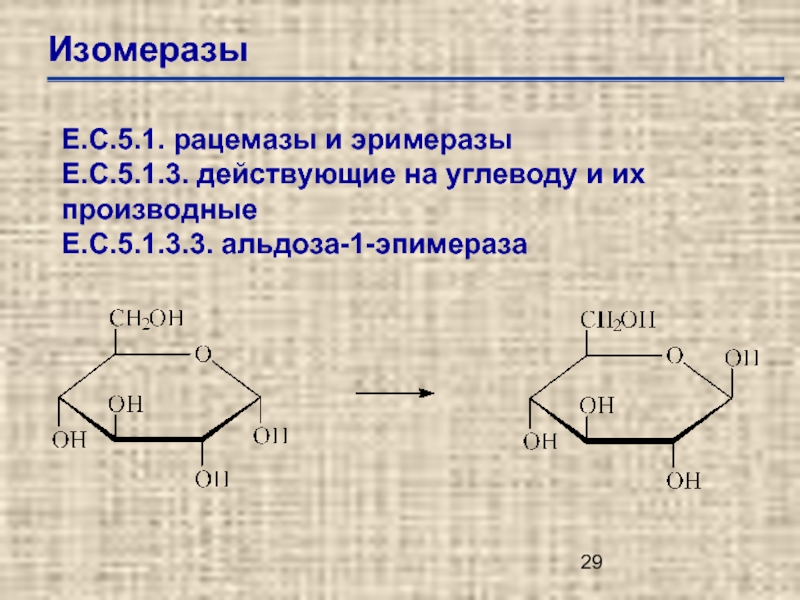
Слайд 29Изомеразы
Е.С.5.1. рацемазы и эримеразы
Е.С.5.1.3. действующие на углеводу и их производные
Е.С.5.1.3.3. альдоза-1-эпимераза
Слайд 30Лигазы (синтетазы)
Е.С.6.1. – образуют углерод-кислородные связи
Е.С.6.2. – образуют углерод-сера связи
Е.С.6.3.
Е.С.6.4. – образуют углерод-углеродные связи
Е.С.6.5. – образуют фосфат эфирные связи.
Е.С.6.3. образующие углерод-азотные связи
Е.С.6.3.1. кислота-аммиак (или амид) лигазы (амид синтазы)
Е.С.6.3.1.1. аспарат-аммиак лигаза.
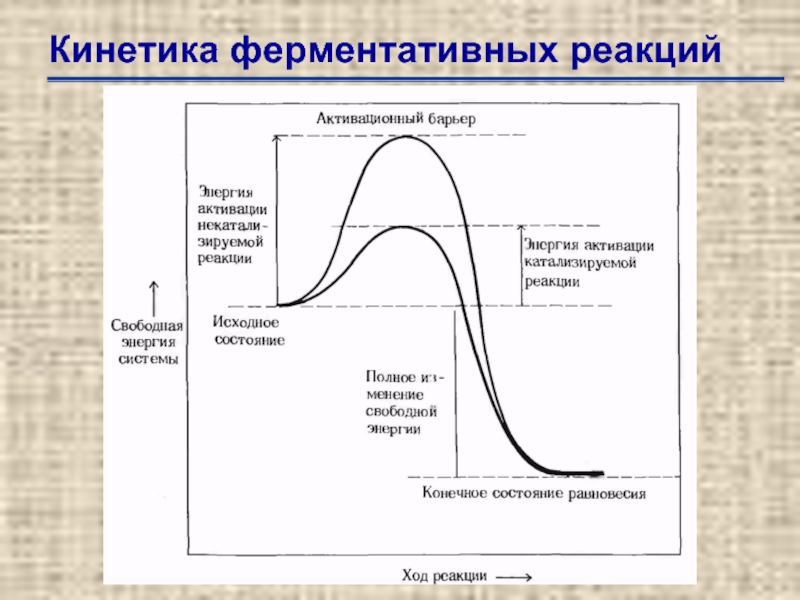
Слайд 32Кинетика ферментативных реакций
Влияние концентрации субстрата на начальную скорость катализируемой ферментом реакции.
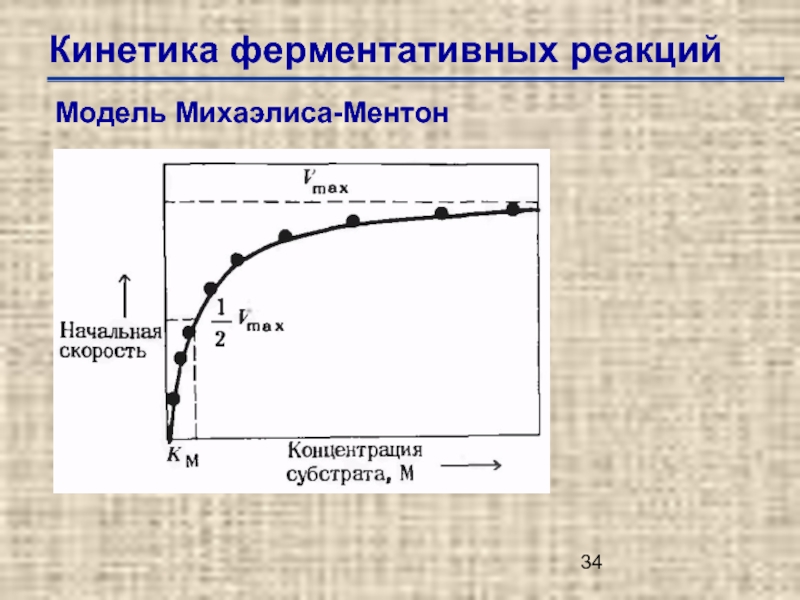
Слайд 35Кинетика ферментативных реакций
Модель Михаэлиса-Ментон
Км (константа Михаэлиса-Ментен) –концентрация специфического субстрата, при
Слайд 36Кинетика ферментативных реакций
Модель Михаэлиса-Ментон
Уравнение Михаэлиса-Ментен
где v0 начальная скорость при
Слайд 38Кинетика ферментативных реакций
Зависимость скорости ферментативных реакций от рН
Зависимость активности ферментов (для
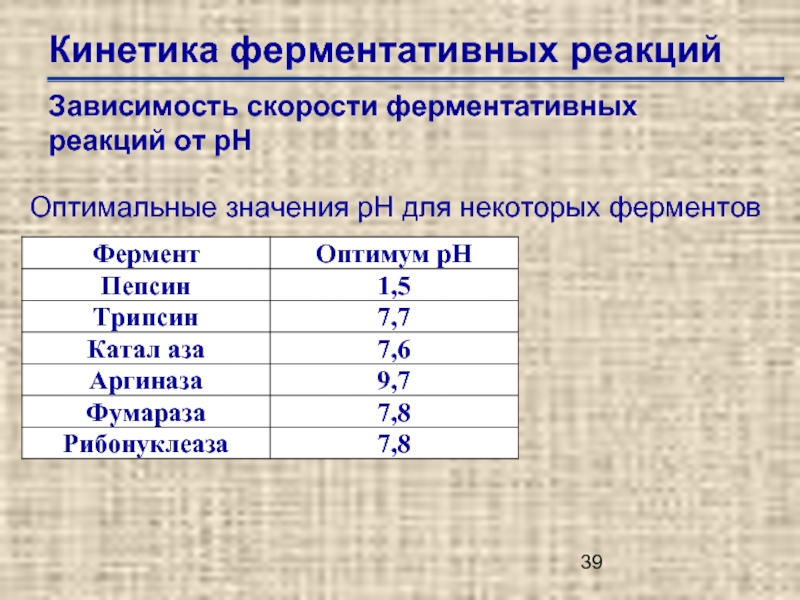
Слайд 39Кинетика ферментативных реакций
Зависимость скорости ферментативных реакций от рН
Оптимальные значения рН для
Слайд 40Кинетика ферментативных реакций
Количество фермента можно определить по его активности
За единицу активности
Удельной активностью называется число единиц ферментативной активности в расчете на 1 мг белка.
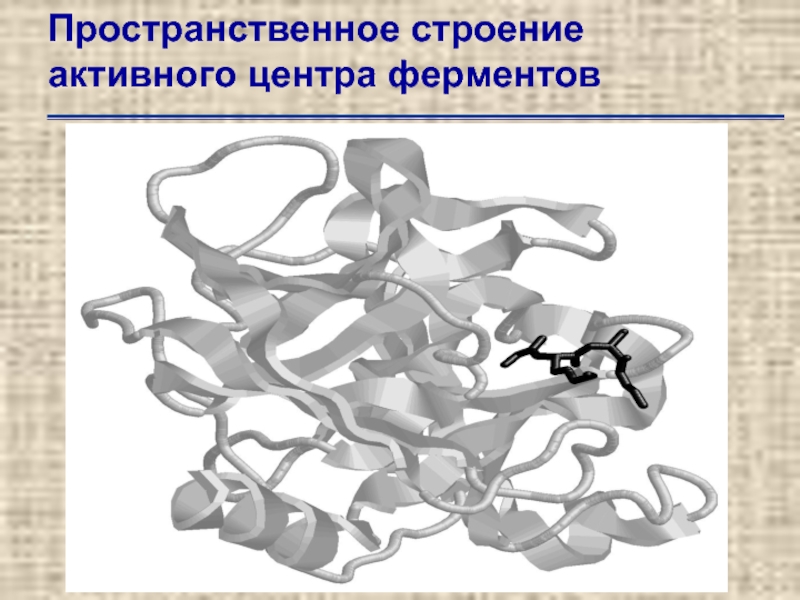
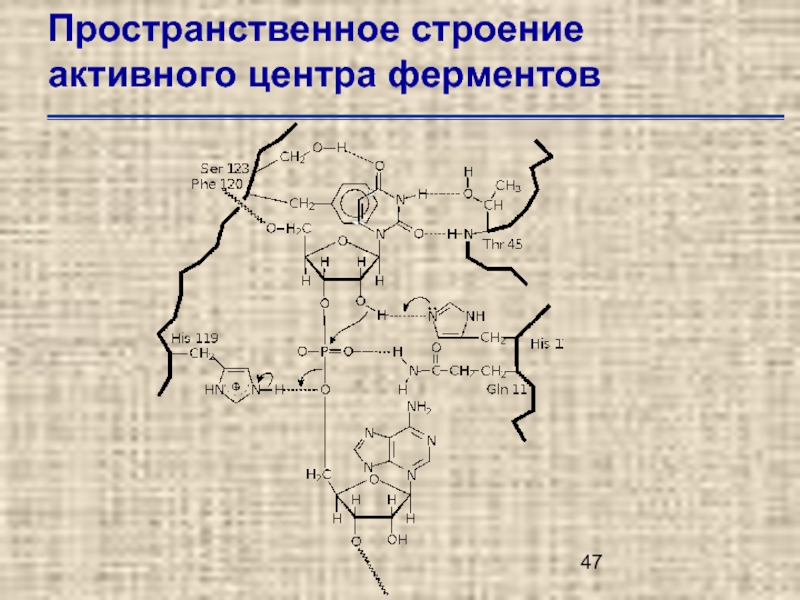
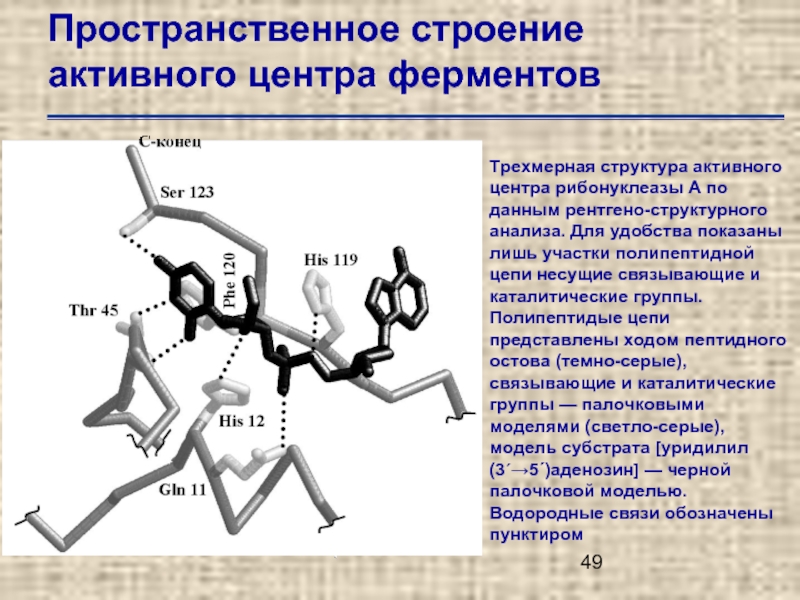
Слайд 49Пространственное строение активного центра ферментов
Трехмерная структура активного центра рибонуклеазы А по
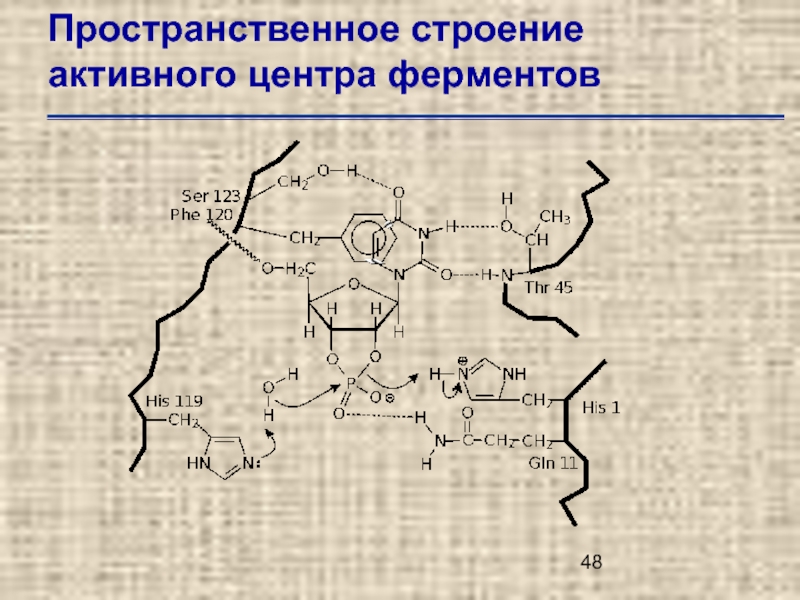
Слайд 50Пространственное строение активного центра ферментов
Укладка субстрата [аденилил(3´→5´)уридилил
(3´→ 5´)аденилил(3´→5´) аденозина] в третичной
Слайд 51Факторы, определяющие каталитическую эффективность ферментов
Сближение и ориентация
Напряжение и деформация; индуцированное соответствие
Общий
Ковалентный катализ




























![Кинетика ферментативных реакцийМодель Михаэлиса-Ментон Уравнение Михаэлиса-Ментен где v0 начальная скорость при концентрации субстрата [S], Vmax](/img/tmb/1/5642/162d956644e8b97d9a772b9f812de7c3-800x.jpg)





![Пространственное строение активного центра ферментов Укладка субстрата [аденилил(3´→5´)уридилил (3´→ 5´)аденилил(3´→5´) аденозина] в третичной структуре фермента](/img/tmb/1/5642/b594d7e5d9476b5bebc8eec8ac5723a8-800x.jpg)






