- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Биохимия соединительной ткани презентация
Содержание
- 3. Особенностью строения соединительной ткани является наличие хорошо
- 4. Внеклеточный матрикс (ВКМ) соединительной ткани: 1. Имеет
- 5. Белки внеклеточного матрикса Среди белков внеклеточного
- 6. Полисахариды внеклеточного матрикса Полисахариды представлены гликозаминогликанами
- 7. Полисахариды – гликозамингликаны и протеогликаны, а также
- 8. Коллаген – основной структурный белок соединительной ткани
- 9. Строение молекул коллагенов Молекулы
- 10. Особенности аминокислотного состава коллагена Полипептидная цепь коллагена
- 11. Схематически цепь коллагена может быть
- 12. Синтез коллагена Коллаген синтезируется внутри
- 13. Созревание коллагена (процессинг) После синтеза цепи коллагена
- 14. Внутриклеточный этап созревание коллагена включает в себя
- 15. 2) Гидроксилирование пролина и лизина проколлагена, катализируют
- 16. Ферментам гидроксилазам для осуществления реакции гидроксилирования необходим
- 17. 3) Гликозилирование гидроксилизина под действием гликозилтрансфераз (присоединение
- 18. 4) Формирование тройной спирали проколлагена Каждая α
- 19. Внеклеточный этап созревания включает в себя ряд
- 20. 2) Формирование фибрилл коллагена
- 21. 3) Стабилизация и укрепление фибрилл коллагена Модифицированные
- 22. Образование аллизина Для создания укрепляющих связей
- 23. Возникшие альдегидные группы участвуют в образовании ковалентных
- 25. На рисунке схематически представлены трехспиральные молекулы тропоколлагена
- 27. Коллагеновые фибриллы формируют коллагеновые волокны
- 28. Общая схема внеклеточного этапа созревания
- 29. Уникальные свойства коллагенов Коллагеновые волокна обладают огромной
- 30. Катаболизм коллагена Распад коллагена происходит медленно под
- 31. Основной маркер распада коллагена Важнейший метаболитом характеризующим
- 32. Типы коллагена В настоящее время известно около
- 33. Наиболее распространенные типы коллагенов.
- 34. Эластин – это основной компонент эластических волокон
- 35. Особенности аминокислотного состава эластина Эластин – гликопротеин
- 36. Структура эластина Нативные волокна эластина построены из
- 37. Неколлагеновые белки межклеточного матрикса К этой
- 38. Фибронектин состоят из 2-х идентичных цепей, содержащих
- 39. Адгезивные белки часто содержат последовательность Арг-Гли-Асп (RGD),
- 40. Ламинины – гликопротеины базальных мембран (3), отделяющую
- 41. Ламинин – гликопротеин, состоит из трех полипептидных
- 42. К неколлагеновым белкам относятся Gla-белки. (это белки,
- 43. К неколлагеновым белкам межклеточного матрикса относятся
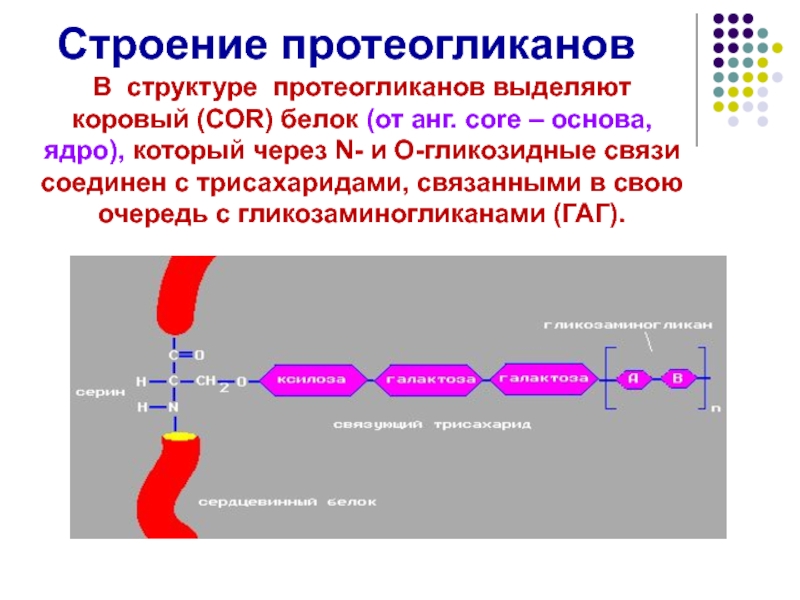
- 44. Строение протеогликанов В структуре протеогликанов выделяют
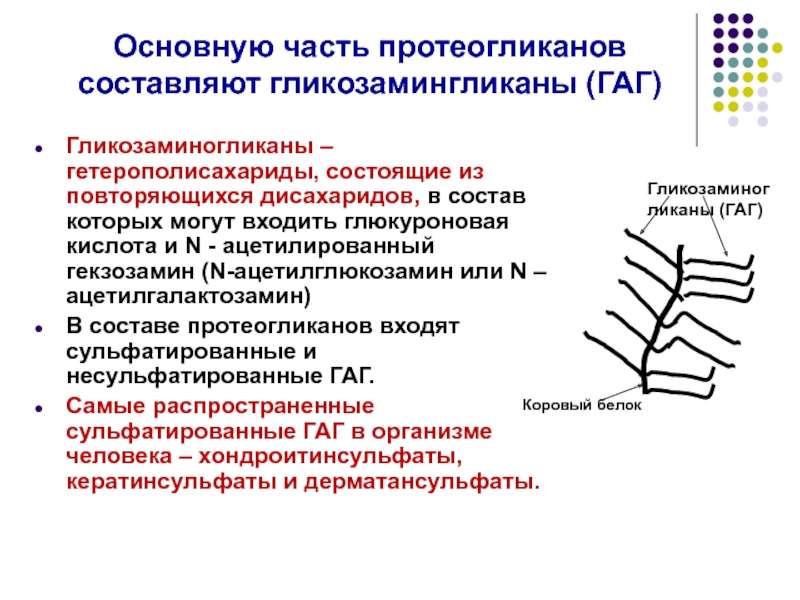
- 45. Основную часть протеогликанов составляют гликозамингликаны (ГАГ) Гликозаминогликаны
- 46. Хондроитинсульфат построен из глюкуроновой кислоты и сульфатированного N–ацетилгалактозамина.
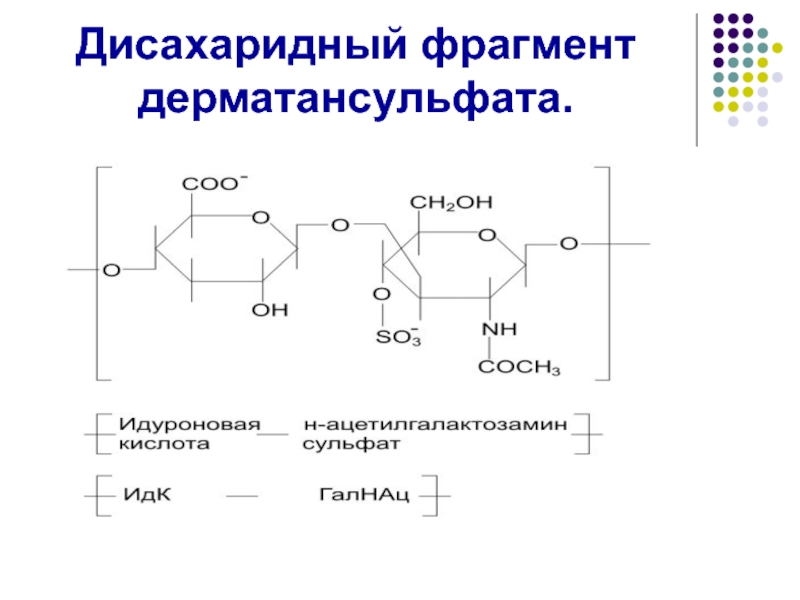
- 47. Дисахаридный фрагмент дерматансульфата.
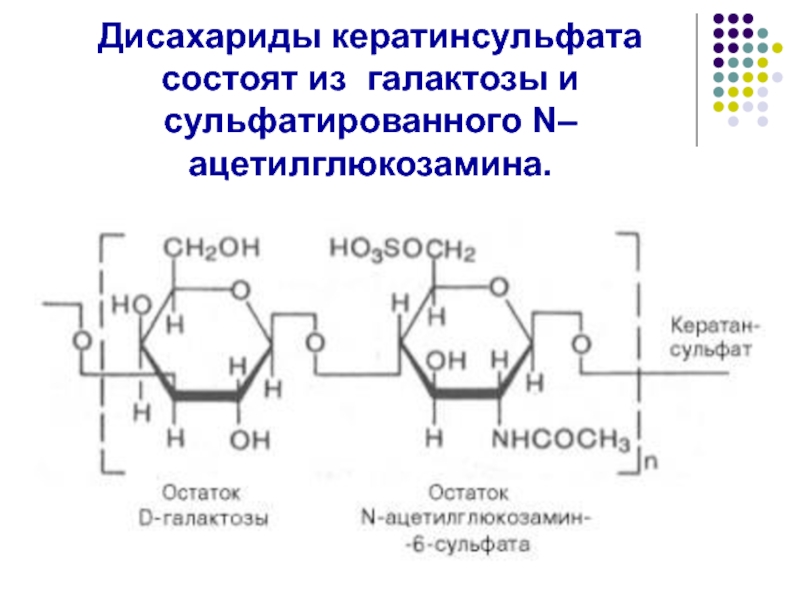
- 48. Дисахариды кератинсульфата состоят из галактозы и сульфатированного N–ацетилглюкозамина.
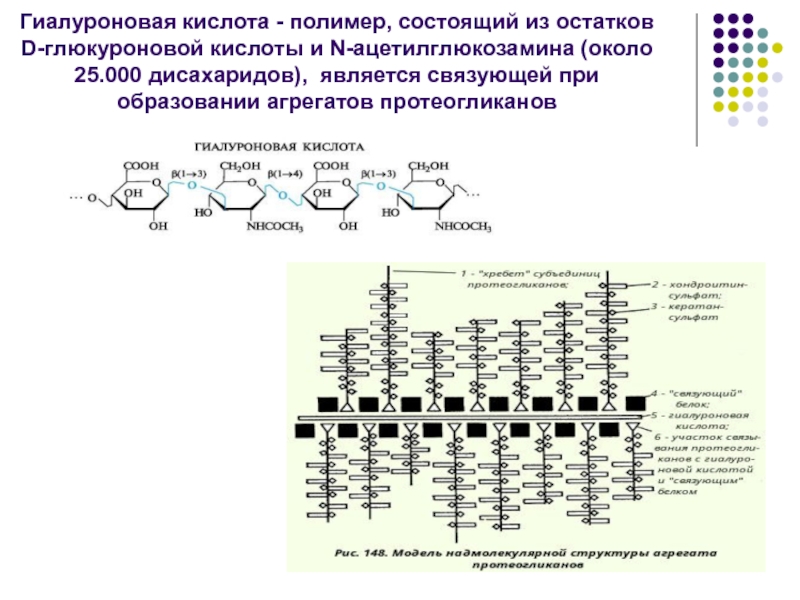
- 49. Гиалуроновая кислота - полимер, состоящий из остатков
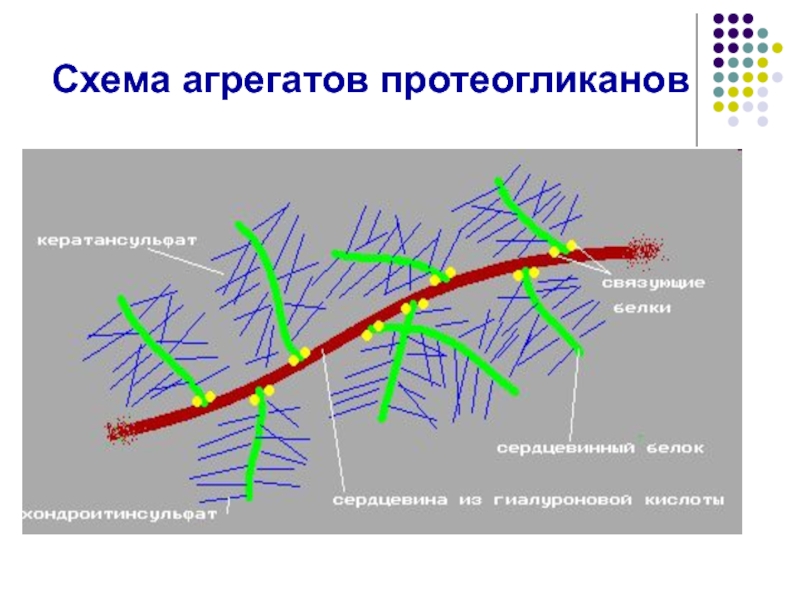
- 50. Схема агрегатов протеогликанов
- 51. Функции гликозаминогликанов - участвуют в организации межклеточного
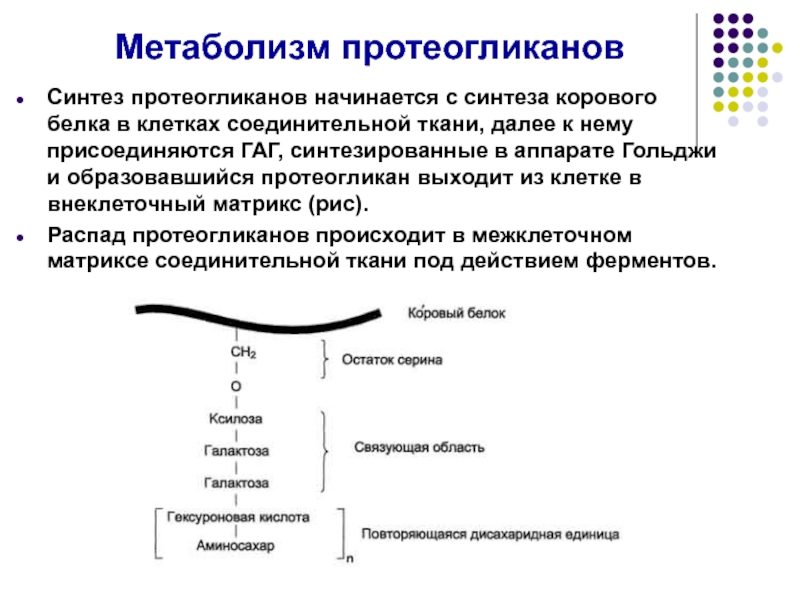
- 52. Метаболизм протеогликанов Синтез протеогликанов начинается с синтеза
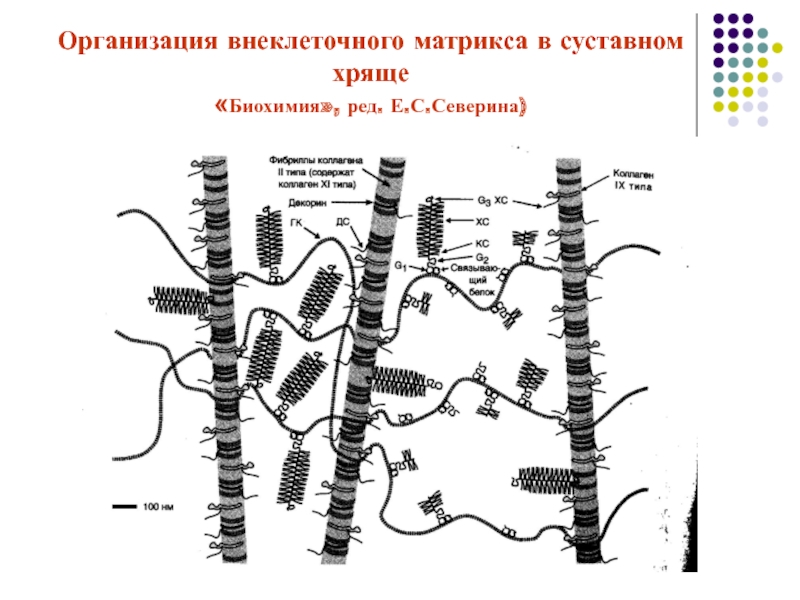
- 53. Организация внеклеточного матрикса в суставном хряще «Биохимия», ред. Е.С.Северина)
- 54. Спасибо за внимание
Слайд 2
К соединительной ткани относят ткани костей, зубов, хрящей, сухожилий, подкожную клетчатку.
Соединительная
Может принимать форму каната, придавая сухожилиям большую прочность на разрыв;
Может формировать прозрачное вещество роговицы глаза.
Слайд 3Особенностью строения соединительной ткани является наличие хорошо развитого внеклеточного матрикса. Межклеточный
Слайд 4Внеклеточный матрикс (ВКМ) соединительной ткани:
1. Имеет сложный химический состав, содержит разнообразные
2. Специфическое взаимодействие этих молекул обеспечивает образование высокоупорядоченной
трехмерной структуры
межклеточного матрикса.
Слайд 5Белки внеклеточного матрикса
Среди белков внеклеточного матрикса выделяют белки двух функциональных
Фибриллярные белки - коллагены и эластин, выполняют преимущественно структурную функцию.
Белки, обладающие адгезивными свойствами (от лат. adhaesio-притяжение, сцепление, прилипание) обеспечивают связывание различных компонентов внеклеточного матрикса. К адгезивным белкам относятся фибронектин, ламинин, нидоген и др.
Слайд 6Полисахариды
внеклеточного матрикса
Полисахариды представлены гликозаминогликанами (ГАГ), которые различаются составом дисахаридов и
Могут быть в свободном или связанном виде.
Связываясь с белками, гликозаминогликаны образуют протеогликаны – высокомолекулярные соединения, включающие белковый (5%) и углеводный (95%) компоненты.
Слайд 7Полисахариды – гликозамингликаны и протеогликаны, а также и адгезивные белки
Соотношение коллагеновых и неколлагеновых белков межклеточного матрикса составляет 75% и 25% соответственно.
Слайд 8Коллаген – основной структурный белок соединительной ткани
Коллагены составляют приблизительно 30 %
В настоящее время идентифицировано более 20 разновидностей коллагенов, которые кодируются отдельными генами.
Слайд 9
Строение молекул коллагенов
Молекулы коллагенов имеют трехспиральную структуру, полученную при
Слайд 10Особенности аминокислотного состава коллагена
Полипептидная цепь коллагена состоит из повторяющихся триплетов:
где Гли – глицин, Х и Y могут быть любыми аминокислотами, но чаще всего:
Х –пролин или аланин
Y - гидроксипролин или гидроксилизин.
Коллаген содержит 33% глицина.
На рисунке аминокислотные остатки
глицина окрашены в черный цвет,
а других аминокислот – в белый.
Слайд 11
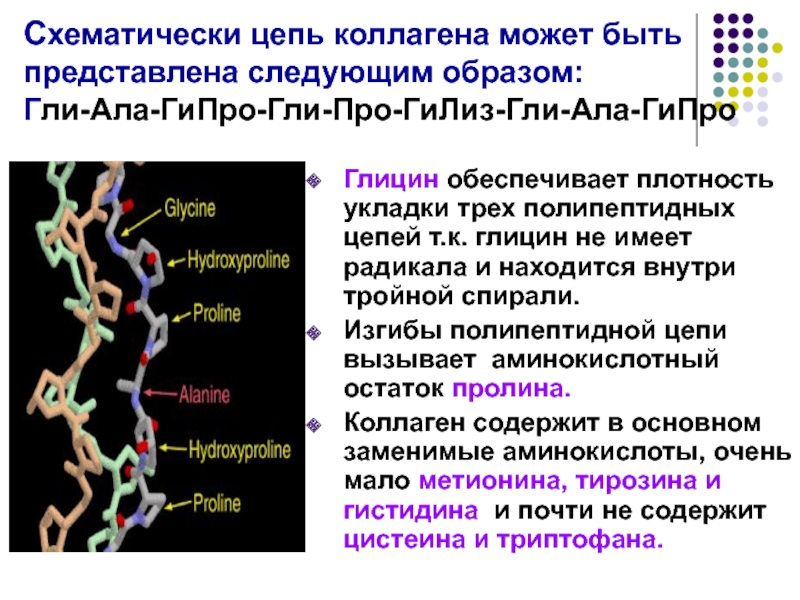
Схематически цепь коллагена может быть представлена следующим образом:
Гли-Ала-ГиПро-Гли-Про-ГиЛиз-Гли-Ала-ГиПро
Глицин обеспечивает плотность
Изгибы полипептидной цепи вызывает аминокислотный остаток пролина.
Коллаген содержит в основном заменимые аминокислоты, очень мало метионина, тирозина и гистидина и почти не содержит цистеина и триптофана.
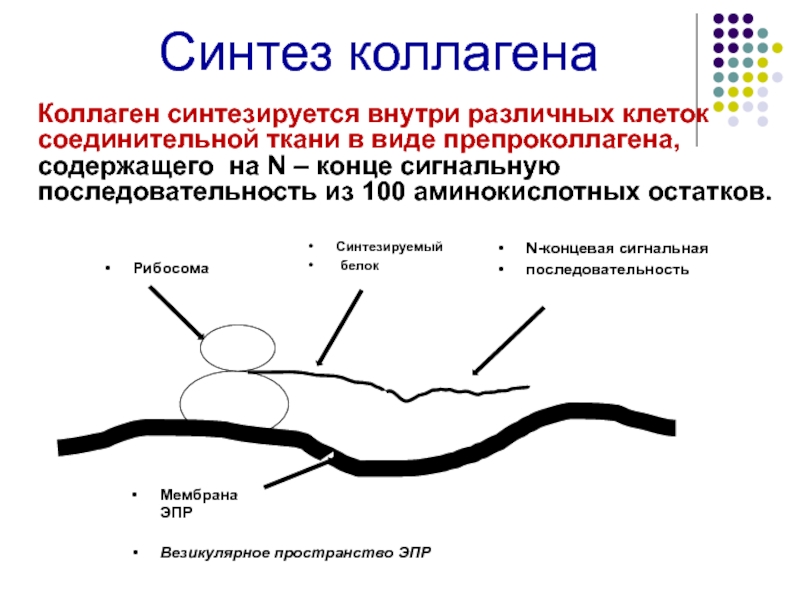
Слайд 12Синтез коллагена
Коллаген синтезируется внутри различных клеток соединительной ткани в
Слайд 13Созревание коллагена (процессинг)
После синтеза цепи коллагена следует сложный многоступенчатый процесс -
Включает 2 этапа:
- внутриклеточный
- внеклеточный
На первом этапе происходит пострансляционная модификация полипептидных цепей препроколлагена.
Во втором этапе – образуются зрелые коллагеновые волокна.
Слайд 14Внутриклеточный этап созревание коллагена включает в себя ряд последовательных изменений цепи
1) Отщепление сигнальной пептидной последовательности от N-конца препроколлагена и образование проколлагена (на мембране ЭПР)
Слайд 152) Гидроксилирование пролина и лизина проколлагена, катализируют ферментативные реакции - гидроксилазы
Синтезированный
Гидроксилизин (ГиЛиз) является участником последующего гликозилирования проколлагена и может превращаться в гидроксиаллизин, который участвует в образовании сшивок между молекулами коллагена.
Слайд 16Ферментам гидроксилазам для осуществления реакции гидроксилирования необходим атом двухвалентного железа и
Слайд 173) Гликозилирование гидроксилизина под действием гликозилтрансфераз (присоединение углеводного компонента)
гидроксилином О - гликозидными связями.
Чаще всего углеводными компонентами являются глюкоза или дисахарид галактозилглюкоза.
Слайд 184) Формирование тройной спирали проколлагена
Каждая α – цепь проколлагена соединяется водородными
Образуются дисульфидные связи внутри- и
между полипептидных цепей.
Внутрицепочечные дисульфидные связи возникают между аминокислотными остатками цистеина на С- и N- концах проколлагена.
Проколлаген
секретируется из клетки в
межклеточный матрикс.
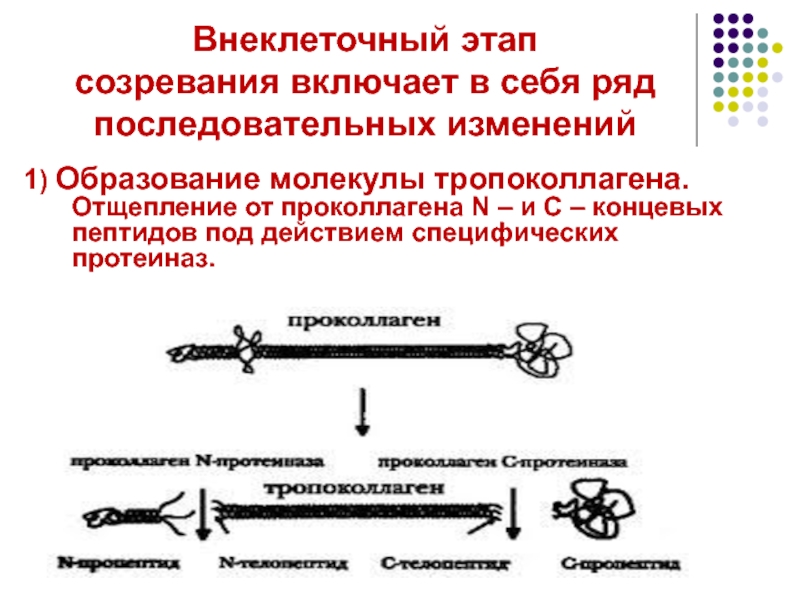
Слайд 19Внеклеточный этап
созревания включает в себя ряд последовательных изменений
1) Образование молекулы тропоколлагена.
Слайд 202) Формирование фибрилл коллагена
Из сформировавшихся молекул тропоколлагена происходит
Такое расположение
повышает прочность
фибрилл на растяжение.
Слайд 213) Стабилизация и укрепление фибрилл коллагена
Модифицированные аминокислоты - гидроксипролин и гидроксилизин
ОН – группы гидроксипролина соседних цепей тропоколлагена образуют водородные связи, укрепляющую структуру фибрилл.
Радикалы лизина, гидроксилизина и аллизина обеспечивают поперечные сшивки между молекулами тропоколлагена.
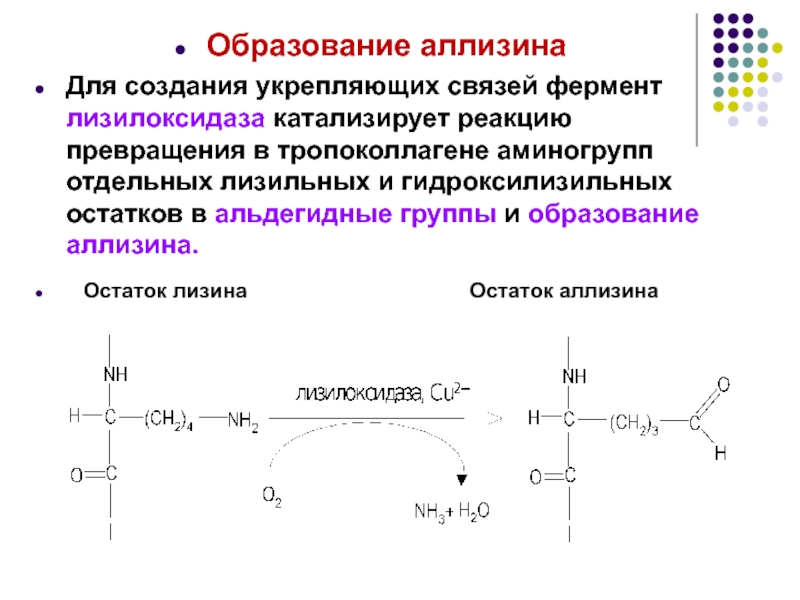
Слайд 22Образование аллизина
Для создания укрепляющих связей фермент лизилоксидаза катализирует реакцию превращения
Остаток лизина Остаток аллизина
Слайд 23Возникшие альдегидные группы участвуют в образовании ковалентных связей, которые стабилизируют фибриллы
Альдольная сшивка –
аллизин + аллизин
Альдиминная сшивка –
лизин + аллизин
Образуются сшивки между молекулами тропоколлагена, стабилизирующие фибриллы коллагена.
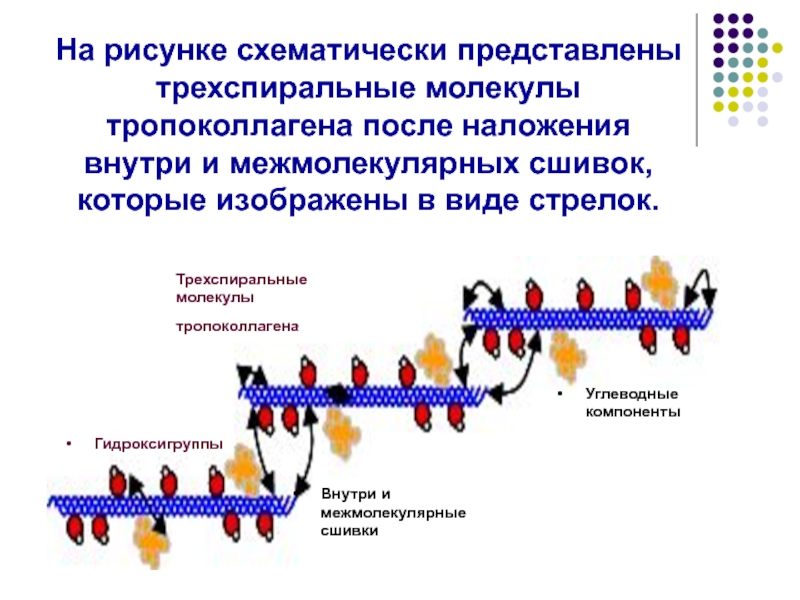
Слайд 25На рисунке схематически представлены трехспиральные молекулы тропоколлагена после наложения внутри и
Трехспиральные молекулы тропоколлагена
Гидроксигруппы
Углеводные компоненты
Внутри и межмолекулярные сшивки
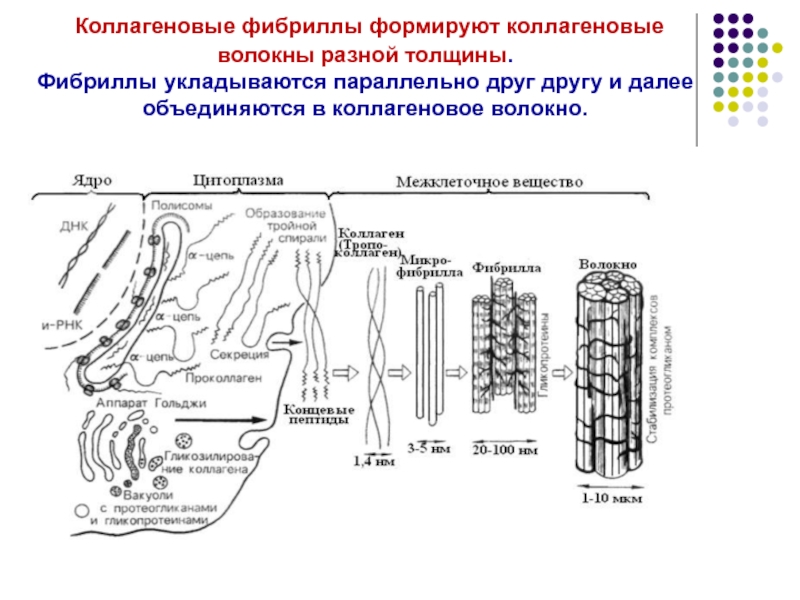
Слайд 27 Коллагеновые фибриллы формируют коллагеновые волокны разной толщины. Фибриллы укладываются параллельно
Слайд 29Уникальные свойства коллагенов
Коллагеновые волокна обладают огромной прочностью и практически нерастяжимы. Они
Именно поэтому большое количество коллагеновых волокон, состоящих из коллагеновых фибрилл, входит в состав кожи, сухожилий, хрящей и костей.
Слайд 30Катаболизм коллагена
Распад коллагена происходит медленно под действием коллагеназ.
Основной фермент -
Образующиеся фрагменты спонтанно денатурируют и становятся доступными для действия других протеолитических ферментов.
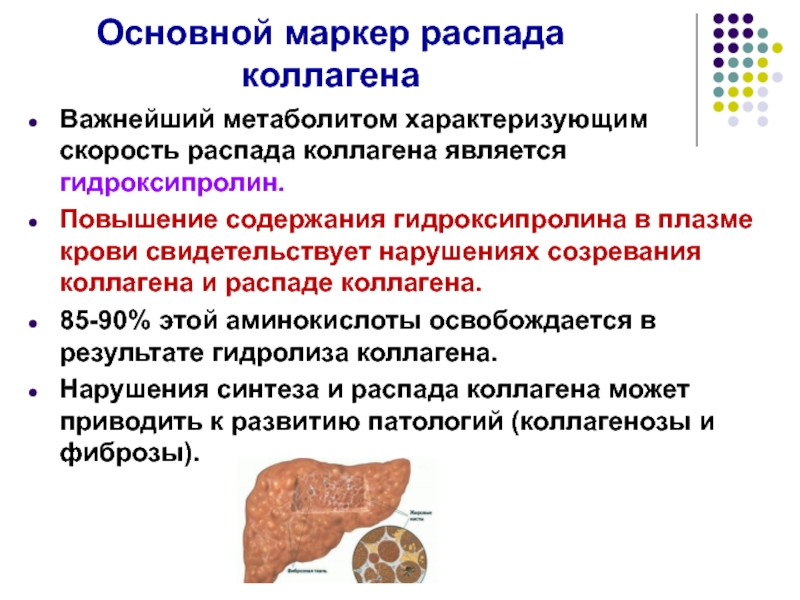
Слайд 31Основной маркер распада коллагена
Важнейший метаболитом характеризующим скорость распада коллагена является гидроксипролин.
Повышение содержания гидроксипролина в плазме крови свидетельствует нарушениях созревания коллагена и распаде коллагена.
85-90% этой аминокислоты освобождается в результате гидролиза коллагена.
Нарушения синтеза и распада коллагена может приводить к развитию патологий (коллагенозы и фиброзы).
Слайд 32Типы коллагена
В настоящее время известно около 20 различных типов коллагена, различающихся
Различают два основных типа цепей коллагена:
α1 и α2,
а также четыре разновидности цепи α1:
α1(I), α1(II), α1(III), α1(IV).
Для обозначения каждого вида коллагена пользуются формулой,
Например: коллаген I типа - [α1(I)]2 α2
Слайд 34Эластин – это основной компонент эластических волокон
Содержатся в тканях,
связки в большом количестве.
Свойства эластичности
проявляются высокой
растяжимостью волокон и быстрым восстановлением
исходной формы и размера
после снятия нагрузки.
Слайд 35Особенности аминокислотного состава эластина
Эластин – гликопротеин с молекулярной массой 70кДа, содержит
Наличие гидрофобных радикалов препятствует созданию вторичной и третичной структуры, в результате молекулы эластина принимают различные конформации в межклеточном матриксе.
В эластине мало гидроксилизина и практически нет цистеина, триптофана.
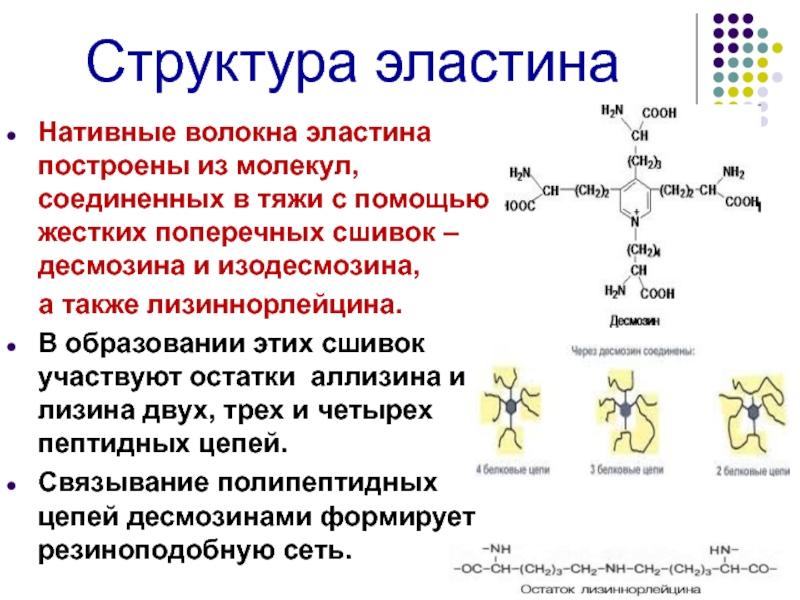
Слайд 36Структура эластина
Нативные волокна эластина построены из молекул, соединенных в тяжи с
а также лизиннорлейцина.
В образовании этих сшивок участвуют остатки аллизина и лизина двух, трех и четырех пептидных цепей.
Связывание полипептидных цепей десмозинами формирует резиноподобную сеть.
Слайд 37Неколлагеновые белки
межклеточного матрикса
К этой группе белков относятся относятся адгезивные белки,
Фибронектин – адгезивный белок, выполняющий интегрирующую роль в организации ВКМ и
регуляторную роль в дифференцировки и делении фибробластов.
Фибронектин называют «молекулярным клеем».
Синтезируется, в основном, фибробластами, но также и др. клетками.
Содержит последовательность Арг-Гли-Асп (RGD) c помощью которой он может присоединятся к интегринам - клеточным рецепторам и передавать информацию как внутрь, так и наружу клеток.
Слайд 38Фибронектин состоят из 2-х идентичных цепей, содержащих по 7-8 доменов со
1) коллагена
2) протеогликанов
3) гиалуроновой кислоты
4) углеводов плазматических мембран
5) гепарина
6) трансглутаминазы
7) клеточных рецепторов-интегринов через RGD (арг-гли-асп)-последовательность
Слайд 39 Адгезивные белки часто содержат последовательность Арг-Гли-Асп (RGD), участвующую в присоединении к
коллагеном IV.
Слайд 40Ламинины – гликопротеины базальных мембран (3), отделяющую соединительную
ткань от эпителия
Содержит
N- концевые группы ламинина могут присоединять кальций и образовывать сетевидные структуры с помощью кальций-зависимого взаимодействия.
Ламинины выступают в роли факторов адгезии, роста и дифференцировки.
Слайд 41Ламинин – гликопротеин, состоит из трех полипептидных цепей (a и 2-х
Слайд 42К неколлагеновым белкам относятся Gla-белки. (это белки, содержащие аминокислотные остатки 7-карбокси
Матриксный gla-белок содержит 5 остатков
7-карбоксиглутаминовой кислоты, способен связываться с гидроксиапатитом (минеральная основа костей).
Остеокальцин - gla-белок содержит 3 остатка 7-карбокси глу, его синтез регулирует 1,25-дигидроксихолекальциферол.
Может связывается с гидроксиапатитом и Са.
Предотвращает кости от избыточной минерализации и запускает процессы ремоделирования костной ткани.
Gla-остатки связываются с
ионами кальция (желтые шарике) на
кристалле гидроксиапатита
(серая пластина).
Слайд 43К неколлагеновым белкам
межклеточного матрикса относятся протеогликаны
Молекулы протеогликанов участвуют в сборке
Протеогликаны могут образовывать комплексы с коллагеном, адгезивными и другими белками, защищая их углеводными компонентами от действия ферментов.
Протеогликаны участвуют в регуляции активности сигнальных молекул.
Слайд 44Строение протеогликанов
В структуре протеогликанов выделяют коровый (COR) белок (от анг.
Слайд 45Основную часть протеогликанов составляют гликозамингликаны (ГАГ)
Гликозаминогликаны – гетерополисахариды, состоящие из повторяющихся
В составе протеогликанов входят сульфатированные и несульфатированные ГАГ.
Самые распространенные сульфатированные ГАГ в организме человека – хондроитинсульфаты, кератинсульфаты и дерматансульфаты.
Слайд 46Хондроитинсульфат построен из глюкуроновой кислоты и сульфатированного N–ацетилгалактозамина.
Слайд 49Гиалуроновая кислота - полимер, состоящий из остатков D-глюкуроновой кислоты и N-ацетилглюкозамина
Слайд 51Функции гликозаминогликанов
- участвуют в организации межклеточного матрикса, являются основным скрепляющим веществом.
- взаимодействуют с клеточными мембранами, обеспечивая межклеточные коммуникации.
ГАГ и протеогликаны образуют гелеподобную среду, в которой погружены фибриллярные и адгезивные белки.
Гликозамингликаны могут связывать большое количество воды, сильно набухают, тем самым придают межклеточному матриксу высокую вязкость (желеобразные свойства).
Слайд 52Метаболизм протеогликанов
Синтез протеогликанов начинается с синтеза корового белка в клетках соединительной
Распад протеогликанов происходит в межклеточном матриксе соединительной ткани под действием ферментов.









![Особенности аминокислотного состава коллагенаПолипептидная цепь коллагена состоит из повторяющихся триплетов: [Гли-Х-Y], где Гли –](/img/tmb/4/374717/4ea4fc07a6c73f0c68b3bf90e2188273-800x.jpg)