- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Биохимия, предмет и задачи. Структурно-функциональная организация белковых молекул презентация
Содержание
- 1. Биохимия, предмет и задачи. Структурно-функциональная организация белковых молекул
- 2. План лекции: Биохимия, её предмет и задачи
- 3. Биохимия – наука о структуре химических веществ,
- 4. Разделы общей биохимии: Статическая биохимия Динамическая биохимия
- 5. Задачи биохимии: Изучение строения и обмена
- 6. Значение биохимии для медицины: Выяснить сущность,
- 7. Белки – это высокомолекулярные,
- 8. Структурные признаки белков: 1 – содержат
- 9. Основные функции белков: Структурная Каталитическая
- 10. Уровни структурной организации белковых молекул Первичная структура Вторичная структура Третичная структура четвертичная структура
- 11. Первичная структура – это последовательность
- 12. Вторичная структура – это конфигурация полипептидной цепи
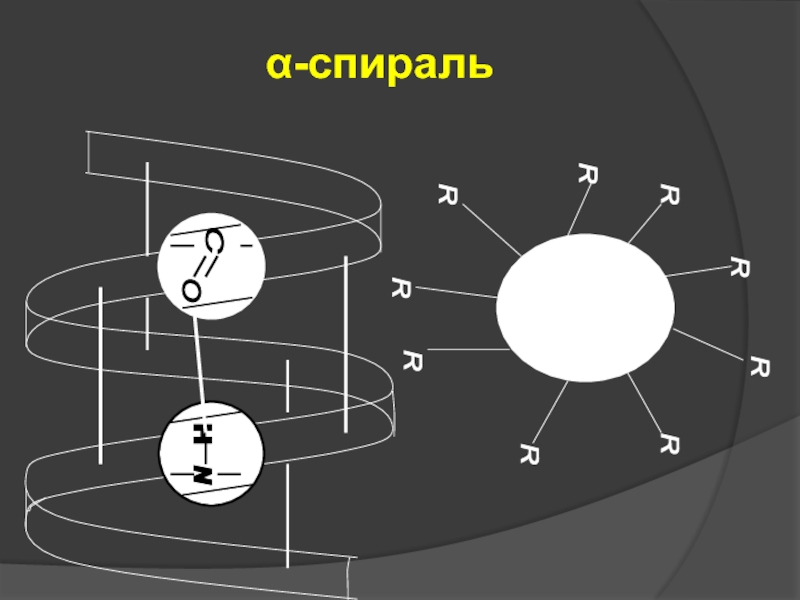
- 13. α-спираль
- 14. β – структура формируется между линейными участками
- 15. Определенные сочетания альфа-спиралей и бета-структур в некоторых
- 16. Третичная структура - это способ укладки полипептидной
- 17. Четвертичная структура - это высший уровень структурной
- 18. Формирование трёхмерной структуры белков от пространственной структуры
- 19. Формирование трёхмерной структуры белков Белки - продукты
- 20. Шапероны при сборке белков возникают промежуточные нестабильные
- 21. Классификация шаперонов По молекулярной массе высокомолекулярные, с
- 22. Роль шаперонов в фолдинге белков При синтезе
- 23. Роль шаперонов в фолдинге белков Фолдинг многих
- 25. Физико-химические свойства белков Строение – аминокислотный состав,
- 26. б) Буферные свойства
- 27. 2. Коллоидные свойства белков а)
- 28. б) малая скорость диффузии гель-фильтрация
- 29. в) неспособность проникать через полупроницаемые мембраны
- 30. Гидратация белков Гидрофобные группы Н2О связывается
- 31. Растворимость белков Много полярных групп – лучше
- 32. Лабильность пространственной конформации.
- 33. СПАСИБО ЗА ВНИМАНИЕ
Слайд 1БИОХИМИЯ, ПРЕДМЕТ И ЗАДАЧИ.
СТРУКТУРНО-ФУНКЦИОНАЛЬНАЯ ОРГАНИЗАЦИЯ БЕЛКОВЫХ МОЛЕКУЛ
Профессор кафедры биохимии Омской
доктор мед. наук
Конвай Владимир Дмитриевич
Слайд 2План лекции:
Биохимия, её предмет и задачи
Значение биохимии для медицины
Признаки и функции
Уровни структурной организации белковых молекул
Слайд 3Биохимия – наука о структуре химических веществ, входящих в состав живого
Слайд 4Разделы общей биохимии:
Статическая биохимия
Динамическая биохимия
Функциональная биохимия
Объекты изучения:
Биохимия растений
Биохимия животных
Биохимия микроорганизмов
Биохимия человека
Технологическая биохимия
Слайд 5Задачи биохимии:
Изучение строения и обмена белков
Изучение строения и обмена нуклеиновых кислот
Изучение
Изучение биокатализа
Изучение превращения углеводов
Изучение обмена липидов
Изучение роли биорегуляторов
Изучение значения витаминов
Слайд 6Значение биохимии для медицины:
Выяснить сущность, механизм развития заболевания
Улучшить эффективность диагностики заболеваний
Обеспечение
Обосновать основы профилактики
Слайд 7
Белки – это высокомолекулярные, азотсодержащие, органические вещества, состоящие из
Слайд 8Структурные признаки белков:
1 – содержат азот
2 – α-аминокислоты L-ряда
3 – формируют
4 – высокая молекулярная масса (от 6 тыс. до нескольких млн. дальтон)
5 – сложная структурная организация
Слайд 9Основные функции белков:
Структурная
Каталитическая
Регуляторная
Рецепторная
Транспортная
Опорная
Энергетическая
Сократительная
Защитная
Антитоксическая
Гемостатическая
Слайд 10Уровни структурной организации белковых молекул
Первичная структура
Вторичная структура
Третичная структура
четвертичная структура
Слайд 11 Первичная структура – это последовательность аминокислот в полипептидной цепи,
Последовательность аминокислот в полипептидной цепи:
определяет последующие уровни структурной организации белка,
физико-химические, биологические свойства
является уникальной в каждом отдельном случае
Слайд 12Вторичная структура – это конфигурация полипептидной цепи в пространстве, образующаяся в
Виды вторичной структуры:
α-спираль
β - структура
нерегулярные вторичные структуры (кольца, изгибы, петли).
Слайд 14β – структура формируется между линейными участками одной полипептидной цепи, образуя
Полипептидые цепи или их части могут формировать параллельные и антипаралельные β-структуры
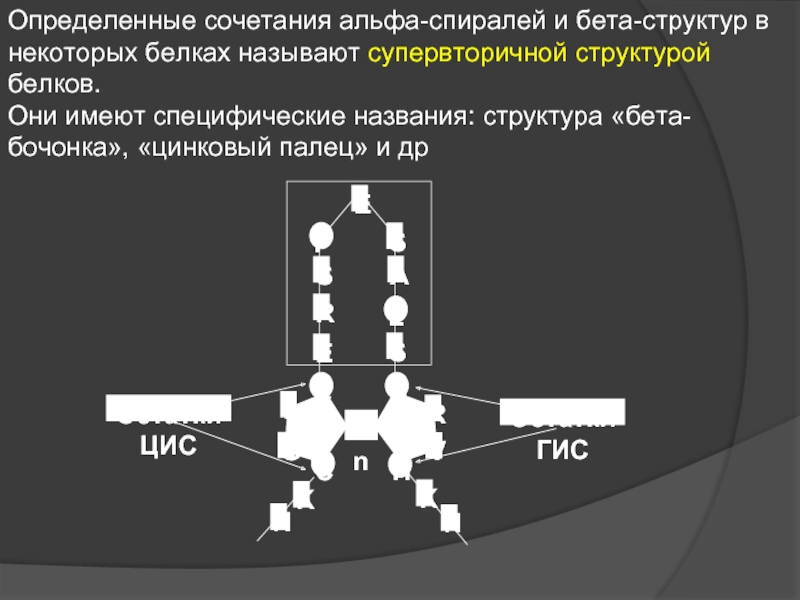
Слайд 15Определенные сочетания альфа-спиралей и бета-структур в некоторых белках называют супервторичной структурой
Они имеют специфические названия: структура «бета-бочонка», «цинковый палец» и др
Слайд 16Третичная структура - это способ укладки полипептидной цепи в пространстве в
В поддержании третичной структуры участвуют:
водородные связи
ионные связи
гидрофобные взаимодействия
дисульфидные связи.
Слайд 17Четвертичная структура - это высший уровень структурной организации, возможный не у
это способ укладки в пространстве третичных структур (глобул) и формирование единого в структурном и функциональном отношениях макромолекулярного образования.
Каждая отдельно взятая глобула, получившая название протомера или субъединицы, чаще всего не обладает биологической активностью.
Слайд 18Формирование трёхмерной структуры белков
от пространственной структуры белков зависит их биологическая функция.
Процесс
Слайд 19Формирование трёхмерной структуры белков
Белки - продукты одного гена:
имеют одинаковую аминокислотную последовательность
приобретают в одинаковых условиях клетки одинаковую конформацию и функцию.
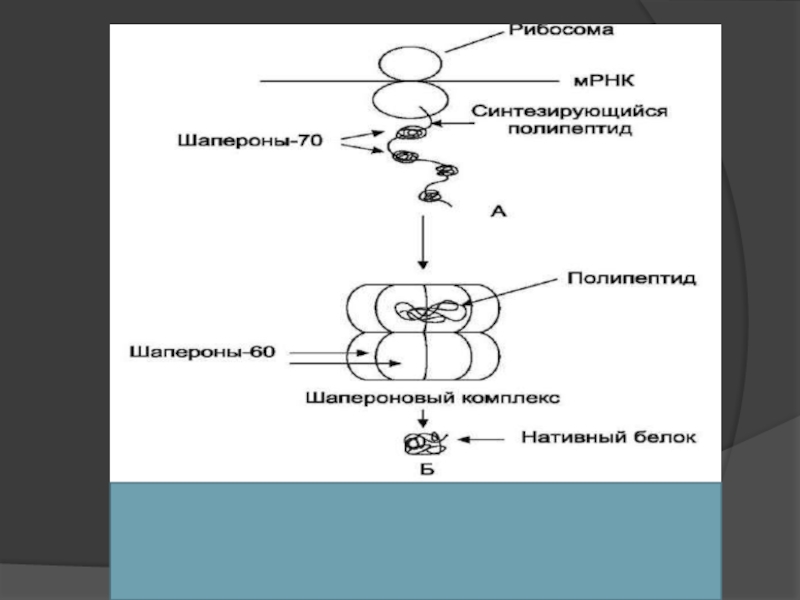
фолдинг протекает при участии специальной группы белков - ШАПЕРОНЫ (от франц. shaperon - няня).
Слайд 20Шапероны
при сборке белков возникают промежуточные нестабильные конформации
Шапероны:
связываются с белками, находящимися в
стабилизируют их конформацию,
Слайд 21Классификация шаперонов
По молекулярной массе
высокомолекулярные, с Mr от 100 до 110 кД;
Шапероны
Шапероны -70 - с Mr от 60 до 80 кД;
Шапероны – с Mr 60;
Шапероны - с Mr 40;
низкомолекулярные шапероны с молекулярной массой от 15 до 30 кД.
Слайд 22Роль шаперонов в фолдинге белков
При синтезе белков N-концевая область полипептида синтезируется
Для формирования конформации белка нужна его полная аминокислотная последовательность.
в период синтеза белка на рибосоме защиту реакционно-способных радикалов (особенно гидрофобных) осуществляют Шапероны -70.
Ш-70 - высококонсервативный класс белков, который присутствует во всех отделах клетки
В области карбоксильного конца единственной полипептидной цепи шаперонов есть участок, образованный радикалами аминокислот в форме бороздки.
Он способен взаимодействовать с участками белковых молекул и развёрнутых полипептидных цепей длиной в 7-9 аминокислот, обогащённых гидрофобными радикалами.
В синтезирующейся полипептидной цепи такие участки встречают примерно через каждые 16 аминокислот.
Слайд 23Роль шаперонов в фолдинге белков
Фолдинг многих высокомолекулярных белков, осуществляется в специальном
Ш-60 функционируют в виде олигомернoго комплекса, состоящего из 14 субъединиц
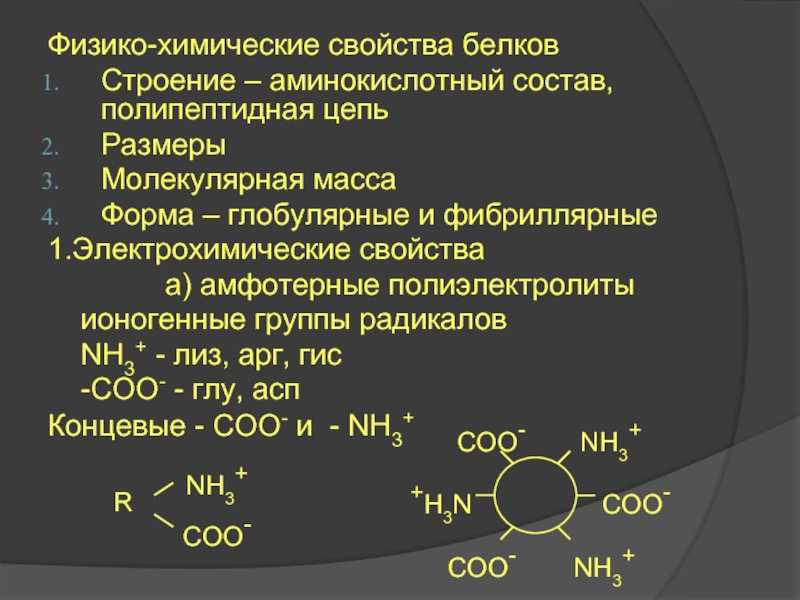
Слайд 25Физико-химические свойства белков
Строение – аминокислотный состав, полипептидная цепь
Размеры
Молекулярная масса
Форма – глобулярные
1.Электрохимические свойства
а) амфотерные полиэлектролиты
ионогенные группы радикалов
NН3+ - лиз, арг, гис
-СОО- - глу, асп
Концевые - СОО- и - NН3+
R
+H3N
Слайд 26б) Буферные свойства Нb – гистидин
в) Общий
Соотношение ионогенных групп радикалов
рН среды – степень ионизации
кислая среда +
основная среда -
Изоэлектрическое состояние
Изоэлектрическая точка (ИЭТ) – рJ
Белки цитоплазмы рJ~5,5, белки ядер – рJ>7,0
Электрофорез – подвижность в электрическом поле
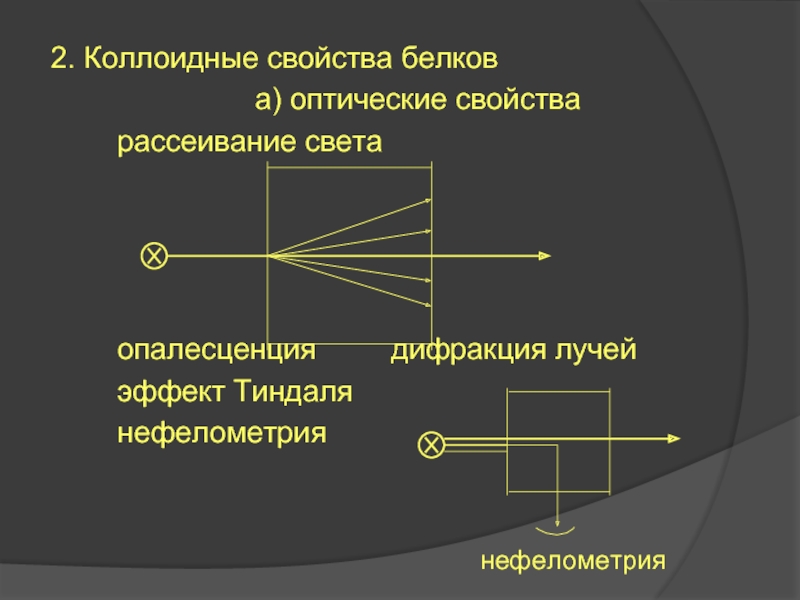
Слайд 272. Коллоидные свойства белков
а) оптические свойства
опалесценция дифракция лучей
эффект Тиндаля
нефелометрия
нефелометрия
Слайд 28б) малая скорость диффузии
гель-фильтрация или молекулярное просеивание через зерна
диффузия крупных молекул медленнее в зерна и они быстрее выходят, а чем меньше молекулярная масса, тем медленнее выходят
Слайд 29в) неспособность проникать через полупроницаемые мембраны
Высокая вязкость растворов
Способность к образованию гелей
Фибриллярные белки (актомиозин)
Слайд 30Гидратация белков
Гидрофобные группы
Н2О связывается 1 - полярными группами
100 г белка связывает 30-35 г Н2О
Гидратная оболочка
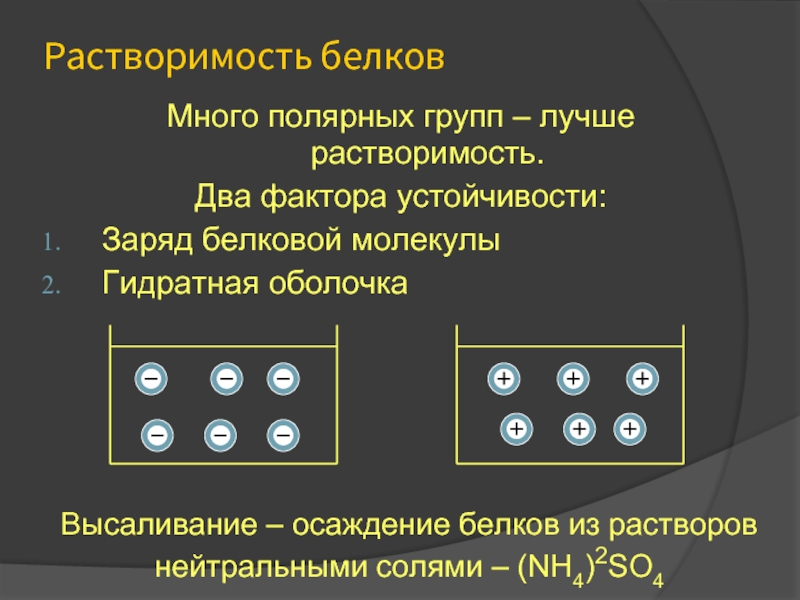
Слайд 31Растворимость белков
Много полярных групп – лучше растворимость.
Два фактора устойчивости:
Заряд белковой молекулы
Гидратная
Высаливание – осаждение белков из растворов нейтральными солями – (NH4)2SO4
Слайд 32Лабильность пространственной конформации.
Денатурация – утрата нативных (природных)
Нарушаются вторичная, третичная и четвертичная структуры.
Физические факторы: кислоты, щелочи, органические растворители (фенол, ацетон, спирт и т.д.)
Ренатурация.