- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Биохимия крови презентация
Содержание
- 1. Биохимия крови
- 2. Основные вопросы лекции: 1.Изменения основных биохимических
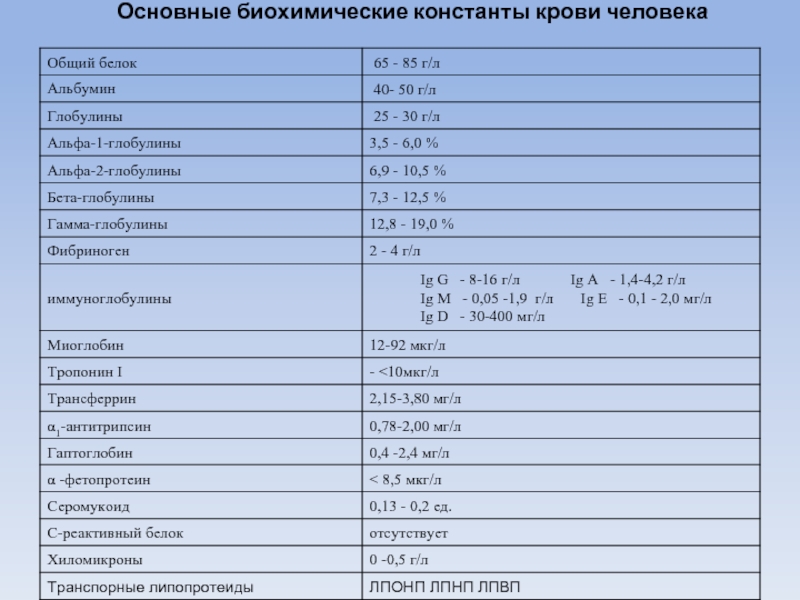
- 3. Основные биохимические константы крови человека
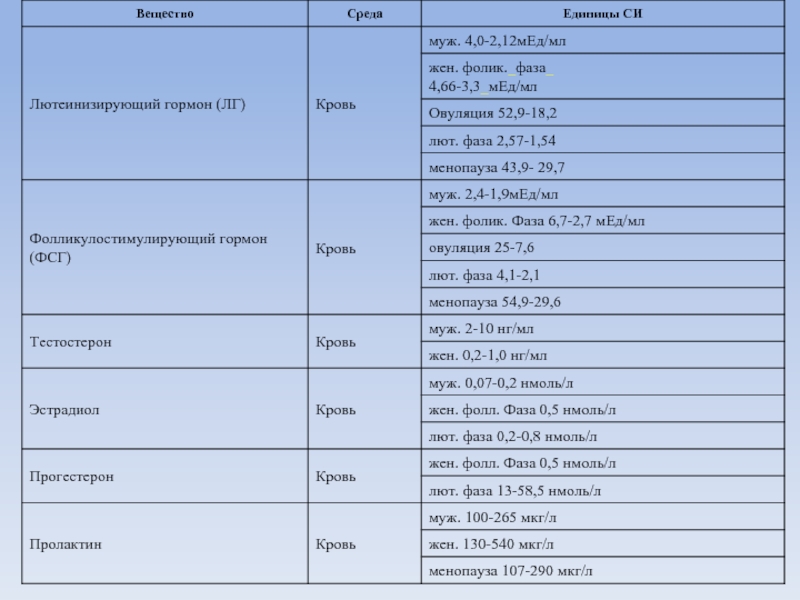
- 4. Содержание гормонов и их метаболитов в организме человека
- 5. Содержание гормонов и их метаболитов в организме человека
- 7. Биохимия крови Кровь представляет собой жидкую ткань,
- 8. Плазма крови человека характеризуется следующими физико-химическими константами:
- 9. Все химические вещества плазмы крови можно
- 10. Клетки крови в основном представлены
- 11. Эритроциты Эритроцит представляет собой безъядерный дериват эритробласта.
- 12. Функции эритроцитов обеспечиваются белками и ферментами,
- 13. Главная биологическая функция эритроцитов
- 14. Основным химическим компонентом эритроцитов является белок гемоглобин.
- 15. Кроме гемоглобина в эритроцитах содержатся белки -
- 16. Особенности обмена веществ в эритроцитах В
- 18. 10% глюкозы в эритроцитах разрушается гексозомонофосфатным механизмом.
- 19. Как показали наблюдения, гексозомонофосфатный путь (пентозный цикл)
- 20. В связи с низким уровнем синтеза АТФ,
- 21. В эритроцитах аденозин подвергается гидролитическому дезаминированию с
- 22. Известно, что 5-фосфорибозил-1-пирофосфат является исходным субстратом
- 25. В эритроцитах человека могут присутствовать несколько типов
- 26. Важным аллостерическим эффектором для гемоглобина является 2,3-дифосфоглицерат.
- 27. Низкий уровень 2,3-дифосфоглицерата в легочных капиллярах приводит
- 28. Более высокое сродство фетального гемоглобина к
- 29. Карбоксигемоглобин (HbCO) относится патологическим производным гемоглобина.
- 30. Кислород может не только быть использован для
- 31. Образование метгемоглобина происходит постоянно: ежедневно около 0,5%
- 32. Супероксидный анион может действовать в организме как
- 33. Гидроксильный радикал при взаимодействии с супероксидным анионом
- 34. Супероксид (О2-), гидроксильный радикал (ОН*), перекись водорода
- 35. Пероксидное окисление липидов уменьшает гидрофобность липидов,
- 36. Во всех клетках, в том числе и
- 37. Особо важное значение для сохранения целостности мембран
- 38. Окисленный глутатион восстанавливается под воздействием фермента
- 39. Антиоксидантное действие оказывает альфа-токоферол (витамин Е), который
- 40. Гемолитическая готовность эритроцитов связана с уменьшением не
- 41. Особенности обмена веществ и функций нейтрофилов.
- 42. В нейтрофилах содержится железосвязывающий белок лактоферрин, который
- 43. В нейтрофилах синтезируется активатор плазминогена. Активная форма
- 44. В нейтрофилах имеется особый фермент - миелопероксидаза,
- 45. Нейтрофилы и пероксинитрит Нейтрофилы, курсирующие в этой
- 46. Благодаря наличию у нейтрофилов факторов хемотаксиса (белки
- 47. Инозитолтрифосфат повышает уровень Са++ в клетке
- 48. НАДФН-оксидазная система плазматических мембран лейкоцитов включает в
- 49. Все эти активные свободно-радикальные формы кислорода, образующиеся
- 50. Активируется фосфолипаза А2, которая высвобождает из фосфолипидов
- 51. Оксид азота (NO) вызывает расслабление гладкой
- 52. Оксид азота в клетках эндотелия гладких мышц
- 53. Сигнал оксида азота может имитироваться органическими нитратами
- 54. Эффекты оксида азота Оксид азота играет двойственную
- 55. Оксид азота соединяется с супероксидом, образует пероксинитрит
- 56. Биохимический анализ крови обычно включает определение следующих
- 57. Показатели углеводного обмена:
- 58. Показатели липидного обмена: 1. Общий холестерин.
- 59. Показатели белкового обмена: 1.
- 60. Показатели пигментного обмена 1. Билирубин
- 61. Показатели водно-солевого обмена:
- 62. Читая лабораторный анализ, врач должен ответить на
- 63. КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ БИОХИМИЧЕСКОГО АНАЛИЗА КРОВИ
- 64. Альбумины - самые легкие белки крови, относительная
- 65. Повышение уровня альбуминов в крови имеет место
- 66. Глобулины крови представлены α1-, α2-, β-, γ
- 67. β -глобулиновая фракция белков сыворотки крови включает
- 68. γ-глобулиновая фракция содержит антитела (иммуноглобулины). Повышение
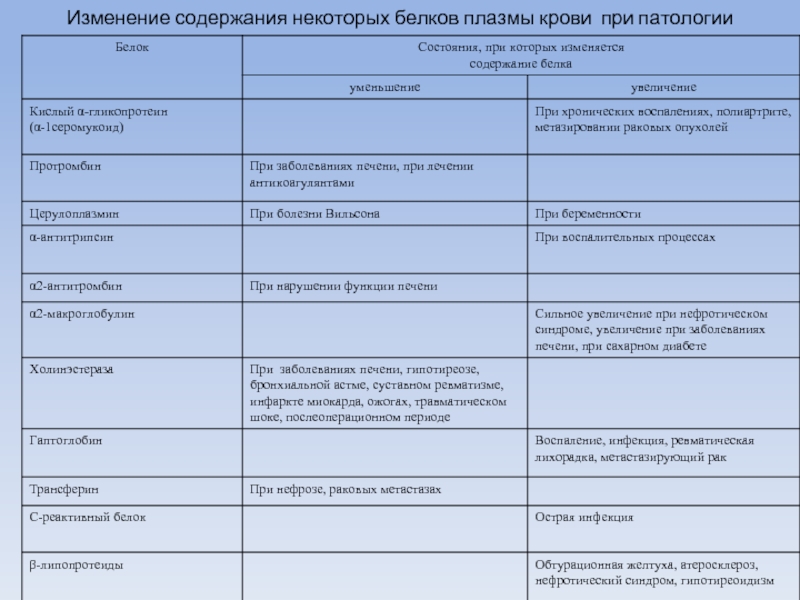
- 69. Белки острой фазы Гаптоглобин - типичный
- 70. С-реактивный белок в сыворотке крови здорового человека
- 71. Белки острой фазы α1-гликопротеин имеет высокое сродство
- 72. Церулоплазмин - это гликопротеид, медь содержащий белок,
- 73. Тропонин J - кардиоспецифический белок тропонинового комплекса
- 74. Миоглобин - гемопротеид мышц. Уровень в
- 75. Изменение содержания некоторых белков плазмы крови при патологии
- 76. Диспротеинемические пробы
- 77. Диспротеинемии при острых воспалительных процессах
- 78. типы гиперлипопротеинемий 1 тип -
- 79. типы гиперлипопротеинемий 3 тип - флотирующая гиперлипопротеинемия.
- 80. типы гиперлипопротеинемий 1 тип -
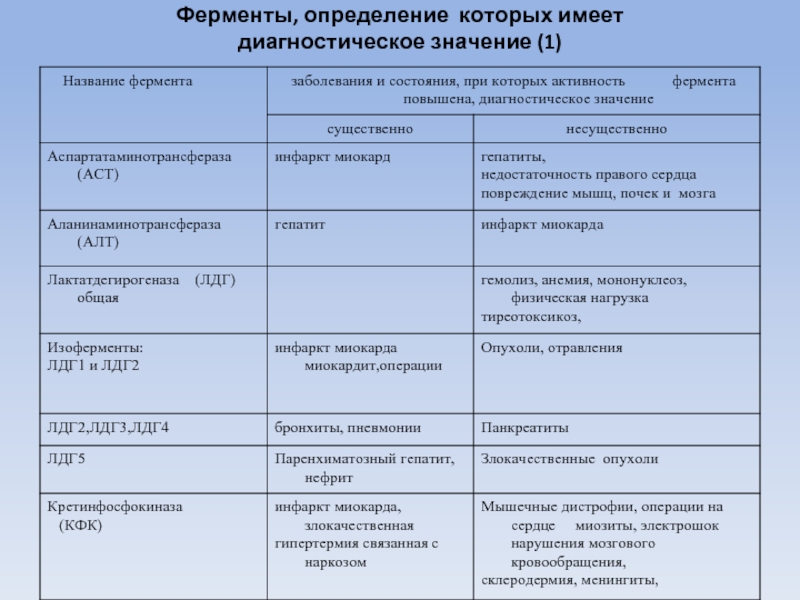
- 81. Ферменты, определение которых имеет диагностическое значение (1)
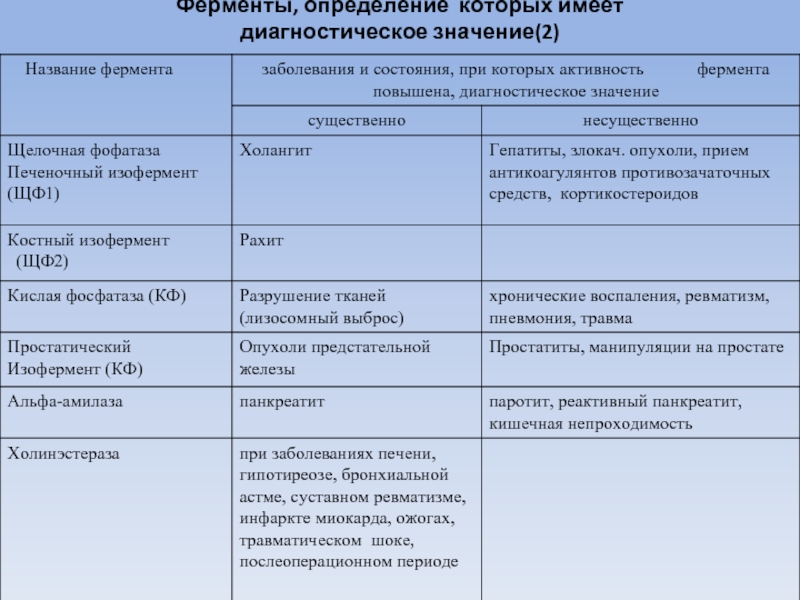
- 82. Ферменты, определение которых имеет диагностическое значение(2)
- 83. Альдолаза (КФ 4.1.2.13)- фермент катализирующий разрушение фруктозо
- 84. α-амилаза ( КФ 3.2.1.1) - фермент (диастаза,
- 85. Трансаминазы ферменты катализирующие реакции переаминирования - перенос
- 86. γ- глутаминилтранспептидаза (ГГТП) (КФ 2.3.2.2) фермент
- 87. Сорбитолдегидрогеназа (СДГ) (КФ 1.1.1.14)- фермент катализирует обратимое
- 88. Креатинфосфокиназа (КФ 2.7.3.3) Креатинфосфокиназа (КФК) катализирует реакцию
- 89. Лактатдегидрогеназа (ЛДГ) (КФ 1.1.1.27) .
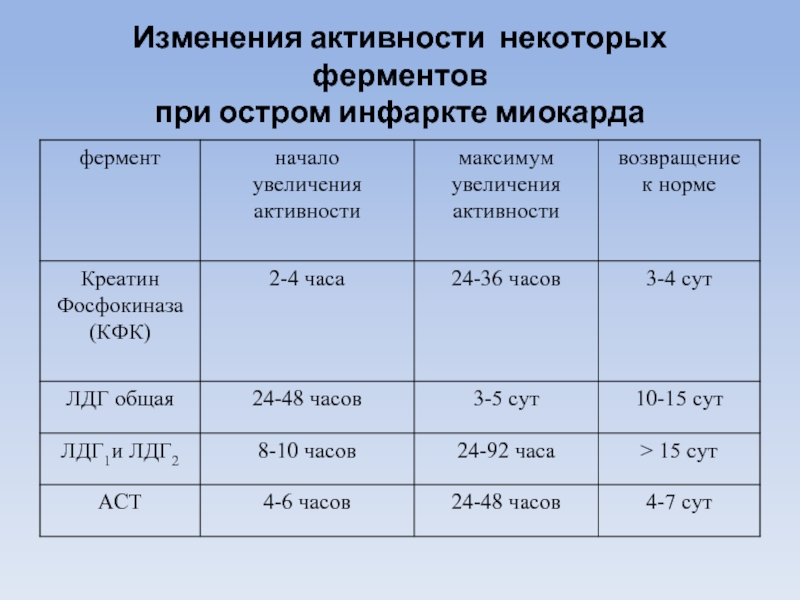
- 90. Изменения активности некоторых ферментов при остром инфаркте миокарда
- 91. ЛДГ при заболевания желчевыводящей системы. Болезнь Боткина
- 92. Липаза (КФ3.1.1.3) катализируюет гидролиз триацилглицеридов. Повышение
- 93. 5`-нуклеотидаза (КФ 3.1.3.5)- катализирует гидролиз нуклеотидов, в
- 94. Фосфатазы - ферменты, катализирующие отщепление фосфорной кислоты
- 95. Фосфатаза кислая Фосфомоноэстераза II или кислая фосфатаза
- 96. Холинэстераза (КФ 3.1.1.8). Холинэстераза (ХЭ) обладает относительной
- 97. Кинины Кинины иногда называют местными гормонами. Они
- 98. Кинины - калликреины Образование кининов из кининогенов
- 100. Кинины Физиологическая роль кининов:
- 101. Участие кининов в формировании патологического процесса:
- 102. Фармакологическое действие кининов: -расширяют просвет кровеносных
- 103. Thanks for attention
Слайд 1БИОХИМИЯ КРОВИ
Биохимические критерии оценки
влияния факторов окружающей и
производственной среды.
Слайд 2Основные вопросы лекции:
1.Изменения основных биохимических констант крови и химического состава плазмы
2.Белки плазмы крови. Альбумин и другие транспортные белки. Глобулины.
3.Ферменты крови.
4.Кининовая система.
5.«Белки острой фазы»: природа, значение, определение с целью диагностики.
6.Небелковые азотистые вещества крови.
7.Безазотистые органические и неорганические вещества крови.
8.Особенности химического состава и метаболизма эритроцитов. Гемоглобин, транспорт кислорода кровью.
9.Токсичные формы кислорода и система антиоксидантной защиты.
10.Гемоглобинопатии.
11.Диагностическое значение определения биохимических показателей крови
Слайд 7Биохимия крови
Кровь представляет собой жидкую ткань, состоящей из клеток (форменные элементы)
Общее количество крови в организме взрослого человека составляет 4,9-5,2 литра у мужчин и 3,8-4,5 литра у женщин. По объему клетки крови составляют 45%, остальное (55%) плазма.
В отличие от плазмы, сыворотка крови не содержит фибриногена.
Благодаря особенностям клеточного и химического состава кровь выполняет транспортную, трофическую, защитную, регуляторную и дыхательную функции.
Слайд 8Плазма крови человека характеризуется следующими физико-химическими константами:
плотность - 1,024-
рН - 7,36- 7,44 ;
депрессия - Δt = 0,56, град. ;
осмотическое давление - около 7,6 атм.;
онкотическое давление - 0,02 атм.
Слайд 9 Все химические вещества плазмы крови можно поделить на следующие группы:
минеральные вещества плазмы крови
органические вещества плазмы крови.
Органические вещества плазмы крови представлены:
1.безазотистыми органическими соединениями.
(безазотистые органические вещества крови - это метаболиты углеводного и липидного обмена)
2.веществами содержащие азот
Азот содержащие органические вещества плазмы крови представлены:
1.белками
2.метаболитами азотистого обмена (остаточный азот крови).
Особое место занимают гормоны и их метаболиты
Слайд 10 Клетки крови в основном представлены
эритроцитами (5млн в мл) и
Существует две основные группы лейкоцитов: гранулоциты и агранулоциты.
Гранулоциты делятся на три разновидности: нейтрофилы, эозинофилы, базофилы.
Агранулоциты (одноядерные лейкоциты) делятся на два типа: моноциты и лимфоциты.
Моноциты (4%) являются предшественниками обширного "семейства" тканевых макрофагов, конкретные характеристики которых варьируют в широких пределах в зависимости от того, на какой органотерритории оседает блуждающий периферический макрофаг-моноцит.
Лимфоциты (24%) образуются в лимфоидной ткани из клеток предшественниц, поступающих из костного мозга. Главная функция - индукция иммунитета, образование антител, отторжение трансплантата, уничтожение опухолевых клеток. Продолжительность жизни лимфоцитов варьирует до десяти и более лет. Различают две популяции лимфоцитов: Т - и В-лимфоциты.
Слайд 11Эритроциты
Эритроцит представляет собой безъядерный дериват эритробласта.
В зрелом эритроците нет ядра,
Эритроциты не имеют митохондрий.
Общее содержание эритроцитов в крови составляет 3,7 - 4,7 млн /мкл.
Гематокритная величина (общий объем эритроцитов в соотношении к объему плазмы крови) у здорового человека составляет
у мужчин - 40 - 48%,
у женщин - 36-42% .
Не являясь в истинном смысле этого слова живой клеткой способной к росту, синтезу органических веществ и самовоспроизведению, эритроцит, тем не менее, способен длительному, до 125 дней, существованию.
Слайд 12
Функции эритроцитов обеспечиваются белками и ферментами, которые синтезируются на стадии ретикулоцита,
Слайд 13 Главная биологическая функция эритроцитов состоит в транспорте газов
Считается, что эритроциты участвуют в транспорте аминокислот, глюкозы и ионов калия и натрия.
Способность эритроцита сохранять наилучшую для переноса газов крови форму двояковогнутого диска в течение всего времени циркуляции по кровеносному руслу объясняется химическим составом, строением и свойствами мембраны эритроцитов
Слайд 14Основным химическим компонентом эритроцитов является белок гемоглобин.
95% массы сухого вещества
У здоровых людей концентрация гемоглобина в крови составляет 132-164 г/л.
Весь гемоглобин организма сосредоточен в эритроцитах. Содержание гемоглобина в плазме крови ничтожно и не превышает уровня 10-40 мг/л.
Слайд 15Кроме гемоглобина в эритроцитах содержатся белки - ферменты обеспечивающие анаэробный гликолиз
В значительных концентрациях в эритроцитах содержится трипептид - глутатион (2-3 ммоль/л), 2,3-дифосфоглицерат (4-5ммоль/л), АТФ+АДФ (3 ммоль/л).
Все эти соединения принимают участие в сохранении структуры и в обеспечении функции эритроцитов.
Слайд 16Особенности обмена веществ в эритроцитах
В эритроцитах катаболизм глюкозы идет анаэробным дихотомическим
В эритроцитах при анаэробном гликолизе имеет место особый фосфоглицератным шунт (Rapoport-Luebering), который сводится к превращению 1,3-дифосфоглицерата в 2,3-дифосфоглицерат, в обход превращению в киназной реакции в 3-фосфоглицетат и АТФ.
По этой причине в эритроцитах теряется возможность синтеза одной молекулы АТФ на каждую молекулу дифосфоглицерата,
но вместо этого появляется возможность накопления
2,3-дифосфоглицерата соединения являющегося аллостерическим регулятором гемоглобина в его свойстве образовывать соединения с кислородом.
Слайд 1810% глюкозы в эритроцитах разрушается гексозомонофосфатным механизмом.
Ключевым ферментом этого пути
Если бы этот путь катаболизма глюкозы шел при участи ферментов митохондрий до конца, то энергетический выход был бы весьма высок.
Но в эритроцитах митохондрий нет.
Слайд 19Как показали наблюдения, гексозомонофосфатный путь (пентозный цикл) для эритроцитов имеет особо
поскольку является источником НАДФН2 необходимого для обеспечения механизмов защиты мембран эритроцитов,
гемоглобина и серусодержащих ферментов от токсического действия активных форм кислорода.
Слайд 20В связи с низким уровнем синтеза АТФ, в эритроцитах имеет место
Сравнительно со многими клетками крови эритроциты более интенсивно поглощают аденозин (аденозин образуется при дефосфорилировании АМФ).
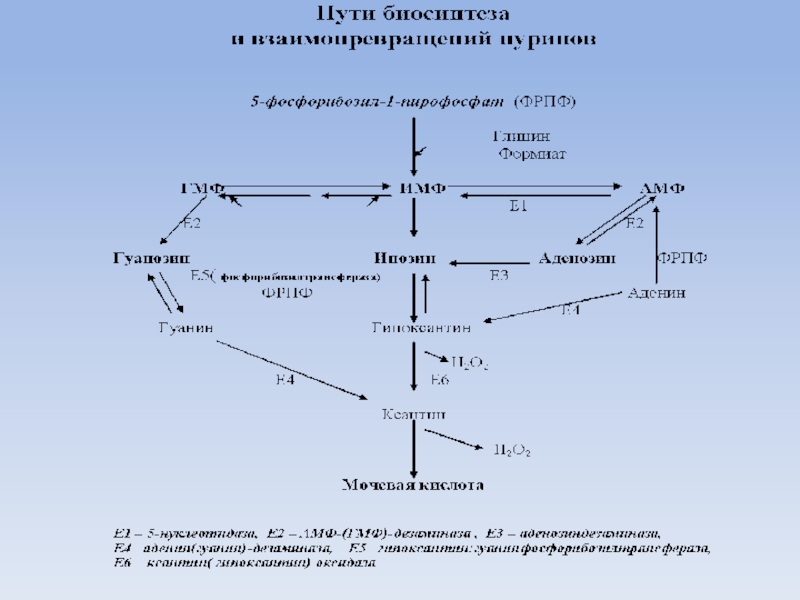
Слайд 21В эритроцитах аденозин подвергается гидролитическому дезаминированию с образованием инозина и аммиака.
Далее инозин подвергается фосфоролизу с образованием гипоксантина и рибозо-1- фосфата, т.е. идет обычный путь распада пуриновых нуклеотидов.
Но, накапливающися рибозо-1-монофосфат под воздействием фосфорибозил-мутазы превращается в рибозо-5-фосфат и через последующие реакции - в
5-фосфорибозил -1-пирофосфат.
Чем больше в эритроциты поступает аденозина, тем больше возможность накопления рибозо-5-фосфата и вероятность его превращения в киназной реакции в 5-фосфорибозил-1-пирофосфат.
Слайд 22
Известно, что 5-фосфорибозил-1-пирофосфат является исходным субстратом для синтеза пуриновых нуклеотидов.
Это соединение
Слайд 25В эритроцитах человека могут присутствовать несколько типов гемоглобинов - от эмбрионального
примитивные гемоглобины (НbP) - Говер 1 и Говерт 2,
фетальный гемоглобин (НbF),
гемоглобин взрослых (HbA, HbA2, HbA3).
Все они отличаются субъединичным составом и сродством к кислороду.
Главная функция гемоглобина транспорт кислорода от легких к тканям.
За сутки гемоглобин доствляет тканям около 600 литров кислорода и способствует выведению около 500 литров углекислого газа.
Каждый грамм гемоглобина может присоединять 1,34 мл кислорода, превращаясь в оксигемоглобин (HbO2).
Поскольку концентрация гемоглобина в цельной крови составляет в среднем 150 г/л, то 1 литр крови связывают около 201 мл кислорода.
Слайд 26Важным аллостерическим эффектором для гемоглобина является 2,3-дифосфоглицерат.
Присутствует 2,3-дифосфоглицерат
По сравнению с окси-формой гемоглобина дезокси-форма имеет примерно вдвое меньше сродство к 2,3-дифосфоглицерату.
Рентгеноструктурный анализ показал, что 2,3-дифосфоглицерат соединясь с двумя β-цепями гемоглобина уменьшает его сродство к кислороду.
Слайд 27Низкий уровень 2,3-дифосфоглицерата в легочных капиллярах приводит к снижению содержания этого
Напротив, в тканях, где концентрация 2,3 -дифосфоглицерата высока и уровень его в эритроцитах нарастает, происходит снижение сродства гемоглобина к кислороду, и оксигемоглобин отдает кислород тканям.
Слайд 28 Более высокое сродство фетального гемоглобина к кислороду, чем HbA, связано
Содержание дифосфоглицерата в эритроцитах варьирует в зависимости от физиологических условий - у людей, живущих в высокогорных районах, его концентрация выше и оксигемоглобин легче отдает кислород тканям.
Слайд 29 Карбоксигемоглобин (HbCO) относится патологическим производным гемоглобина.
При концентрации угарного газа
В сравнении с оксигемоглобином (HbO2) карбоксигемоглобин является более прочным соединением.
Спектр поглощения HbCO очень похож на спектр поглощения оксигемоглобина.
Установить наличие в крови HbCO можно с помощью реактива Стокса (аммиачный раствор виннокаменного железа).
Спектр поглощения HbCO при добавлении реактива Стокса не меняется.
При добавлении реактива Стокса, оксигемоглобин восстанавливается в гемоглобин и спектр меняется.
Это явление используется для судебно-медицинской экспертизы причины смерти, для подтверждения отравления угарным газом.
Слайд 30Кислород может не только быть использован для образования оксигемоглобина, но и
Метгемоглобин (HbOН) относится патологическим производным гемоглобина.
Образование метгемоглобина может происходить при попадании в организм окислителей, таких как бертолетова соль, нитраты, нитриты, анилин, нитробензол и др.
Метгемоглобин не присоединяет кислород, и поэтому не может обеспечить дыхание тканей.
Слайд 31Образование метгемоглобина происходит постоянно: ежедневно около 0,5% всего гемоглобина превращается
Метгемоглобин снова восстанавливается в гемоглобин ферментом метгемоглобинредуктазой использующей НАДН2 или НАДФН2.
Окисление гемоглобина в метгемоглобин кислородом приводит к образованию супероксидного аниона (О2-):
Hb(Fe++) + O2 MetHb(Fe+++) + O2-
Слайд 32Супероксидный анион может действовать в организме как окислитель (акцептор электрона) и
Действуя как окислитель, получая еще один электрон, в водной среде он превращается в пероксид водорода:
O2- + е- + Н+ HО-ОH
Перекись водорода в свою очередь может восстанавливаться супероксидным анионом с образованием свободного гидроксильного радикала (ОН*):
O2- + HO-OH ОН* + ОН- + О2
Слайд 33Гидроксильный радикал при взаимодействии с супероксидным анионом образует синглетный кислород ("О2),
O2- + ОН* "О2 + ОН-
Активные формы кислорода в организме образуются в реакциях самопроизвольного (не ферментативного) окисления ряда веществ, в том числе и лекарств,
а также в реакциях, катализируемых различными оксидазами.
Слайд 34Супероксид (О2-), гидроксильный радикал (ОН*), перекись водорода и синглетный кислород ("О2)
имеют высокую химическую активность и реагируют со многими веществами организма, в том числе с нуклеиновыми кислотами, белками и липидами.
Наибольшее повреждающее действие активные формы кислорода оказывают на липиды, запуская цепную реакцию образования пероксидов ненасыщенных жирных кислот.
Пероксиды не стабильны и распадаются с образованием альдегидов.
Слайд 35Пероксидное окисление липидов уменьшает гидрофобность липидов,
изменяет их конформацию,
приводит
Вследствие этого при окислении мембранных липидов резко повреждаются структуры и функции мембран.
А это в свою очередь приводит к гемолизу эритроцитов.
Слайд 36Во всех клетках, в том числе и в эритроцитах, имеются механизмы
Так супероксидный анион может под воздействием суперокисддисмутазы превращаться в перекись водорода:
O2- + O2- + 2Н+ Н2О2 + О2
супероксиддисмутаза
Перекись водорода разрушается каталазой с образованием воды и кислорода:
2(Н2О2) 2( Н2О ) + О2
каталаза
Слайд 37Особо важное значение для сохранения целостности мембран эритроцитов занимают глутатион и
Фермент глутатионпероксидаза (селен содержащий фермент) восстанавливает перекись водорода за счет восстановленной формы глутатиона (Г-SH), при дегидрировании которого образуется окисленная форма глутатиона (Г-S-S-Г):
Г-S-S-Г
↑
+ 2 ( Г-SH )
Н2О2 2 ( Н2О )
глутатионперексидаза
Этот фермент восстанавливает также органические пероксиды (гидроперекиси липидов):
Г-S-S-Г
R ↑ R
| + 2 ( Г-SH ) |
СН-О-ОН СН-ОН
| глутатионперексидаза |
СН2 СН2
| |
Слайд 38 Окисленный глутатион восстанавливается под воздействием фермента глутатионредуктазы с использованием НАДФН2,
НАДФ
↑
НАДФН2
Г-S-S-Г 2 ( Г-SH )
глутатионредуктаза
Таким образом, антиоксидантное действие глутатиона связано с ферментами глутатионового цикла: глутатионпероксидазы и глутатионредуктазы, сопряженных с функцией глюкозо-6-фосфатдегидрогеназы.
Слайд 39Антиоксидантное действие оказывает альфа-токоферол (витамин Е), который может служить донором электронов
Обнаружено, что при нарушении функции глюкозо-6-фосфатдегидрогеназы (наследственное или приобретенное), в эритроцитах снижается уровень восстановленного глутатиона и такие эритроциты быстро гемолизируются.
Слайд 40Гемолитическая готовность эритроцитов связана с уменьшением не только восстановленного глутатиона,
но
Это приводит к снижению активности SН-содержащего фермента - Nа+,К+ АТФ-азы и как следствие, происходит повышение проницаемости мембраны эритроцитов для ионов Na, K и кислорода.
Все это приводит к набуханию эритроцитов и ускоряет гемолиз.
Слайд 41Особенности обмена веществ и функций нейтрофилов.
Наличие в нейтрофилах большого количества лизосом,
Нейтрофилы содержат большое количество лизоцима, который разрушает полисахаридные участки мембран микроорганизмов.
Нейтрофила содержат особые пептиды, состоящие из 20-33 аминокислот, которые можно назвать естественными антибиотиками, т.к. они способны разрушать бактериальные мембраны.
Слайд 42В нейтрофилах содержится железосвязывающий белок лактоферрин, который может ингибировать рост ряда
вовлекаться в регуляцию пролиферации миелоидных клеток.
Нейтрофилы содержать в мембранах особые гликопротеиные молекулы - селектины и интегрины,
которые осуществляют процесс хемотаксиса и адгезии (прилипание) нейтрофилов к эндотелию сосудов.
Слайд 43В нейтрофилах синтезируется активатор плазминогена. Активная форма плазминогена - плазмин осуществляет
В нейтрофилах интенсивно идет гликолиз и гексозомонофосфатный шунт.
Наличие в нейтрофилах особой электронотранспортной системы (НАФН-оксидаза, цитохром b5) позволяет этим клеткам использовать, образующийся в пентозном цикле НАДФН2 для образования активных форм кислорода.
Слайд 44В нейтрофилах имеется особый фермент - миелопероксидаза, которая разрушает перекись водорода
активной гипохлорной кислоты (HOCl) обладающей бактерицидным действием:
Н2О2 + НCl миелопероксидаза H2O +HOCl
В связи с особенностью состава и обмена веществ, нейтрофилы играют ключевую роль в "остром воспалительном ответе".
Слайд 45Нейтрофилы и пероксинитрит
Нейтрофилы, курсирующие в этой неблагоприятной среде, активируются, прилипают к
NO + O2- ОNОО-
Пероксинитрит (ОNОО-) индуцирует некроз тканей.
Наличие в нейтрофилах большого количества лизосом, содержащие протеиназы типа коллагеназа, эластаза, катепсины, позволяет нейтрофилам разрушать структурные белки бактерий.
Слайд 46Благодаря наличию у нейтрофилов факторов хемотаксиса (белки системы комплемента и селектины)
И за счет рецепторного взаимодействия нейтрофилом с фибронектинами - гликопротеинами межклеточного вещества и плазмы, происходит их адгезия.
После адгезии начинается процесс миграции нейтрофилов в глубь очага воспаления.
В этот момент в нейтрофилах активируется связанная с рецепторным G-белком фосфолипаза С которая приводит к высвобождению из фосфолипидов мембран инозитол 1.4.5 -трифосфата и диацилглицерида (ДАГ).
Слайд 47Инозитолтрифосфат повышает уровень Са++ в клетке за счет его выхода
Ионы кальция активируют актин-миозиновую систему нейтрофилов и сборку микротубул, что усиливает процесс миграции нейтрофилов в очаге воспаления.
Способствует связыванию антигенов и секреции ферментов из лизосом, уничтожающих антигены.
Диацилглицерид стимулирует перемещение протеинкиназы С из цитозоля в плазматическую мембрану, где протеинканаза С путем фосфорилирования активирует ферменты
НАДФН-оксидазной системы.
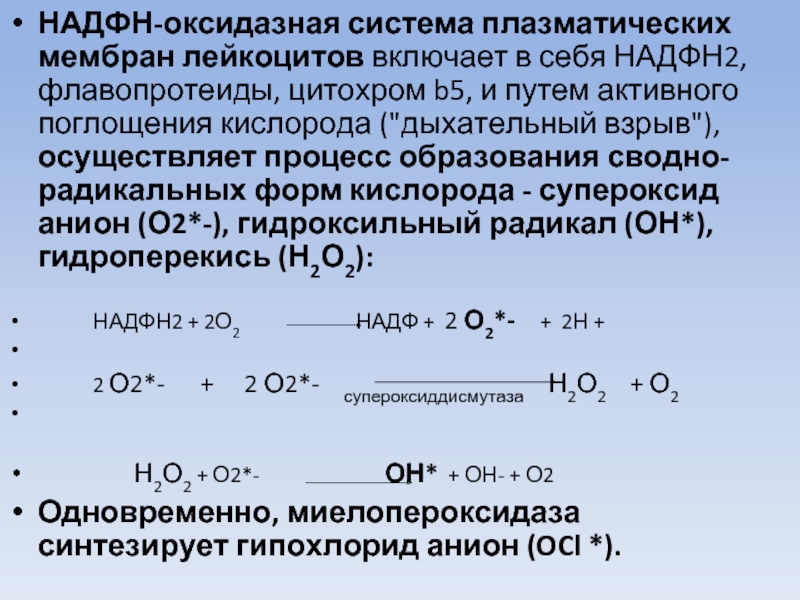
Слайд 48НАДФН-оксидазная система плазматических мембран лейкоцитов включает в себя НАДФН2, флавопротеиды, цитохром
НАДФН2 + 2О2 НАДФ + 2 О2*- + 2Н +
2 О2*- + 2 О2*- супероксиддисмутаза Н2О2 + О2
Н2О2 + О2*- ОН* + ОН- + О2
Одновременно, миелопероксидаза синтезирует гипохлорид анион (OCl *).
Слайд 49Все эти активные свободно-радикальные формы кислорода, образующиеся при "дыхательном взрыве", используются
Увеличение уровня Са внутри нейтрофилов, наблюдаемое при их активации, "разжигает" "респираторный взрыв",
усиливает реакции биологического окисления, гликолиза и пентозного цикла.
Ускоряется перекисное окисление липидов.
Слайд 50Активируется фосфолипаза А2, которая высвобождает из фосфолипидов мембран арахидоновую кислоту, из
"Дыхательный взрыв" в фагоцитирующих клетках индуцирует синтез оксида азота (NO) из аргинина, активируя фермент - синтетаза оксида азота:
аргинин + О2 + НАДФН2 синтетаза NO + цитруллин + Н2О + НАДФ
Слайд 51Оксид азота (NO) вызывает
расслабление гладкой мускулатуры сосудов,
снижает артериальное давление.
В больших количествах оксид азота взаимодействует с супероксид анионом (О2*-) образуя более мощный свободный радикал пероксинитрит (ОNOО*),
который способен вызывает повреждение в молекулах ДНК, вычленяя пуриновые основания, вызывает мутации.
В больших дозах оксид азота блокирует
ферменты антиоксидантной защиты,
гем содержащие ферменты,
вызывает потерю митохондриями цитохрома С.
Все это может существенно повредить клетки не вовлеченные в очаг воспаления.
По этой причине при тяжелых инфекционных процессах нередко развивается коллапс,
нарушаются биоэнергетические процессы.
Слайд 52Оксид азота в клетках эндотелия гладких мышц сосудов,
связывается со специфическими
активирует этот фермент и через 3`,5`-ГМФ в клетке-мишени оказывает физиологическое действие.
Эндотелиальный оксид азота подавляет действие вазоконстрикторов тромбоксана А2 и серотонина, выделяемых из тромбоцитов (снимает
спазм сосудов).
Слайд 53Сигнал оксида азота может имитироваться органическими нитратами (нитроглицерин), которые используются для
Кроме своей центральной роли вазодилататора, оксид азота выполняет функцию нейротрансмиттера и играет важную роль в долговременном потенцировании памяти нейронов, ингибирует адгезию форменных элементов крови к эндотелию.
Одновременно, агрегированные тромбоциты продуцируют оксид азота, который угнетает агрегацию тромбоцитов.
Слайд 54Эффекты оксида азота
Оксид азота играет двойственную роль в патогенезе септического шока.
Он оказывает защитный антибактериальный эффект, но в то же время проявляет неблагоприятное действие,
включая устойчивую вазодилятацию, гипотензию и гипореактивность к сосудосуживающим агентам.
Под влиянием избытка оксида азота усиливается сосудистая проницаемость, формируется отек и последующее развитие воспалительной реакции.
Слайд 55Оксид азота соединяется с супероксидом, образует пероксинитрит анион (ОNОО-), который
Такая оксидантная среда генерирует перекиси липидов, которые увеличивают проницаемость мембран для кальция,
активируют фосфолипазу А2 и
запускают дальнейшую экспрессию индуцибельной синтетазы оксида азота, адгезивных молекул и выделение фактора, активирующего тромбоциты:
лейкотриенов,
тромбоксана А2 и
прочих индукторов воспаления.
Слайд 56Биохимический анализ крови обычно включает определение следующих показателей:
Общий белок
Билирубин;
Креатинин;
КФК (креатинофосфокиназа);
ЛДГ;
Липаза;
мочевая кислота;
мочевина
Холестерин;
триглицериды;
трансаминазы.
Общий белок и его фракции.
Остаточный азот.
индикан
глюкоза
Железо;
Калий;
Кальций;
Натрий;
Магний;
Фосфор;
Слайд 57Показатели углеводного обмена:
1. Глюкоза крови.
2. Серомукоиды.
3. Сиаловые кислоты.
4. Молочная кислота
5. Пируват
Слайд 58Показатели липидного обмена:
1. Общий холестерин.
2. Бета-липопротеиды
3. Общие липиды.
4.
5. Фосфолипиды.
6. Свободные жирные кислоты.
Слайд 59Показатели белкового обмена:
1. Общий белок и его фракции.
2. Остаточный азот.
3. Креатинин.
4. Индикан.
5. Мочевина.
6. Мочевая кислота.
7. Тимоловая проба.
8. Формоловая проба
Слайд 60Показатели пигментного обмена
1. Билирубин и его фракции.
2. Уропорфирины.
3.
Слайд 61Показатели водно-солевого обмена:
1. Определение натрия.
2.
3. Определение кальция.
4. Определение магния.
5. Определение хлоридов
6. Определение железа.
7. Определение фосфора.
8. Определение мышьяка, свинца и ртути.
Слайд 62Читая лабораторный анализ, врач должен ответить на следующие четыре вопроса
2.Какие обменные процессы нарушены?
3.При каких патологических состояниях возможны эти нарушения?
4.Каков механизм их возникновения?
Слайд 64Альбумины
- самые легкие белки крови, относительная молекулярная масса - 70 000.
Благодаря высокой концентрации в крови и низкой молекулярной массе альбумины играют значительную роль в создании онкотического давления крови.
Снижение концентрации альбуминов до 30 г/л приводит к падению онкотического давления и развитию отеков.
Альбумины, являясь резервными белками, транспортируют гормоны, холестерин, желчные пигменты, свободные жирные кислоты, кальций, лекарственные вещества, витамины
Слайд 65Повышение уровня альбуминов в крови имеет место при дегидратации, шоке, внутривенном
Снижение уровня альбуминов в крови (гипоальбуминемия) наблюдается при гломерулонефрите, нефрозе, печеночной недостаточности, опухолях, лейкозах, ревматизме, термических ожогах и др.
Слайд 66Глобулины крови представлены α1-, α2-, β-, γ - фракциями белков
α1-глобулиновая
α2-глобулиновая фракция содержит: α-липопротеиды (ЛПВП), гликопротеиды, гаптоглобин (белок острой фазы), С-реактивный белок, белки, транспортирующие ионы металлов, ингибиторы трипсина, макроглобулин, церулоплазмин
Повышение уровня α1- и α2-фракций глобулинов имеет место при воспалительных состояниях, новообразованиях, некротических процессах, паразитарных заболеваниях.
Слайд 67β -глобулиновая фракция белков сыворотки крови включает в себя β-липопротеиды (ЛПНП),
Повышение уровня β-глобулинов наблюдается при железодефицитной анемии, при беременности, приеме эстрогенов, гиперлипопротеинемии.
Снижение уровня β-глобулинов - при воспалительтных заболеваниях, хронических инфекциях злокачественные новообразования, хронические гепатиты, нефротический синдром.
Слайд 68γ-глобулиновая фракция содержит антитела (иммуноглобулины).
Повышение γ-глобулинов происходит при острых воспалительных
Снижение уровня γ-глобулинов - приобретенные и врожденная гипогаммаглобулинемии, СПИД на терминальной стадии, лучевая болезнь, лечение цитостатиками, лимфогрануломатоз, длительные хронические инфекции, недоедание, некротический синдром, экзема.
Слайд 69Белки острой фазы
Гаптоглобин - типичный представитель белков острой фазы, т.е.
Гаптоглобин выполняет следующие функции: -специфически соединяется с гемоглобином и обусловливает его поглощение клетками ретикулоэндотелиальной системы, -выполняет неспецифическую защитную функцию, комплектуясь с различными белками и небелковыми веществами появляющиеся при распаде клеток, -является естественным ингибитором катепсина В, -принимает участие в транспорте витамина В12.
.
Слайд 70С-реактивный белок в сыворотке крови здорового человека отсутствует, но обнаруживается при
С переходом заболевания в хроническую фазу С-реактивный белок исчезает из крови и снова появляется при обострении процесса.
Резкое повышение С-реактивного белка наблюдается у больных тяжелыми трансмуральными инфарктами миокарда, в острый период после хирургического вмешательства
Слайд 71Белки острой фазы
α1-гликопротеин имеет высокое сродство к полианионам и к гепарину,
α1-нейрамингликопротеин белок, содержащий большое количество сиаловой кислоты, известен в настоящее время как С1 -эстеразный ингибитор, врожденный дефицит которого приводит к ангионевротическому отеку.
Слайд 72Церулоплазмин - это гликопротеид, медь содержащий белок, проявляет свойства оксидазы полифенолов
α2-макроглобулин является ингибитором протеиназ (калликреинов) плазмы крови и клеток.
α1-антитрипсин - белок острой фазы, является ингибитором протеиназ (трипсина, химотрипсиногена, кининогена, плазмина и др.). Повышение уровня α1-антитрипсина наблюдается при воспалении, некрозе ткани, травме, беременности, гепатитах.
Слайд 73Тропонин J - кардиоспецифический белок тропонинового комплекса (тропонин J, тропонин T,
α-фетопротеин (АФП) - является гликопротеином, синтезируется эмбриональными гепатоцитах. Появляется в сыворотке крови беременных женщин на 6-8 неделе беременности, концентрация достигаем максимума на 14-15 неделе беременности. В норме в крови детей и взрослых отсутствует. Появление в крови возможно у детей с различными заболеваниями печени, у взрослых с первичным раком печени.
Слайд 74Миоглобин - гемопротеид мышц.
Уровень в крови повышается при воспалительных поражениях
Трансферрин - белок переносчик железа, относится к β-глобулинам.
Различают 19 различных типов трансферрина, различающихся по величине заряда белковой молекулы, аминокислотному составу и числу сиаловых кислот, связанных с белком.
Повышение наблюдается при хронических железодефицитных анемиях, снижение трансферина - при нефротическом синдроме, хронической почечной недостаточности, злокачественных новообразованиях, выраженных воспалительных процессах, хронических инфекциях, после приема кортизона, тестостерона.
Слайд 77Диспротеинемии
при острых воспалительных процессах
(начальная стадия пневмонии, острый полиартрит,
альбумины - значительно уменьшены
альфа-1 и альфа-2 глобулины - умеренное увеличение
гамма-глобулины - увеличение в поздние стадии заболевания
При хроническом воспалительном процессе
(поздняя стадии пневмонии, хронический туберкулез легких,
эндокардит, холецистит, цистит и пиэлит):
альбумины - умеренное уменьшение
альфа-2 и гамма-глобулины - выраженное увеличение
Слайд 78типы гиперлипопротеинемий
1 тип - гиперхиломикронемия. Увеличено содержание хиломикронов и
2 тип - гипер-β-липопротеинемия имеет два варианта:
а) увеличено содержание ЛПНП, т.е. увеличено содержание холестерина;
в) увеличено содержание ЛПНП и ЛПОНП, т.е. превышает норму содержание холестерина и нейтральных жиров.
Гипер-бэта-липопротеинемия 2а и 2в типа сопровождаются развитием атеросклероза.
Слайд 79типы гиперлипопротеинемий
3 тип - флотирующая гиперлипопротеинемия. Нарушено превращение пре-β-липопротеинов (ЛПОНП) в
4 тип - гипер-пре-β-липопротеинемия. Резко увеличено содержание ЛПОНП, отсутствуют хиломикроны. Встречается при диабете, ишемической болезни сердца, ожирении.
5 тип - гипер-пре-β-липопротеинемия и хиломикронемия. В крови увеличено содержание нейтральных жиров и холестерина. Этот тип липопротеидемии сопровождается развитием ксантоматоза
Слайд 80типы гиперлипопротеинемий
1 тип - гиперхиломикронемия. Увеличено содержание хиломикронов и
2 тип - гипер-β-липопротеинемия имеет два варианта:
а) увеличено содержание ЛПНП, т.е. увеличено содержание холестерина;
в) увеличено содержание ЛПНП и ЛПОНП, т.е. превышает норму содержание холестерина и нейтральных жиров.
Гипер-бэта-липопротеинемия 2а и 2в типа сопровождаются развитием атеросклероза.
Слайд 83Альдолаза (КФ 4.1.2.13)-
фермент катализирующий разрушение фруктозо 1.6 дифосфата на фосфотриозы. Активность
Слайд 84α-амилаза ( КФ 3.2.1.1)
- фермент (диастаза, птиалин) разрушает крахмал (гликоген) до
Активность амилазы в сыворотке крови (в моче) повышается при остром панкреатите, кисте поджелудочной железы, инфекционном паротите, перитоните, кишечной непроходимости, при приеме препаратов опия. При остром панкреатите максимальное повышение наблюдается через 12-24 часа в 10-30 раз, нормализация на 2-6- сутки. При тотальном панкреонекрозе активность амилазы не повышается.
Умеренное повышение отмечается при холецистите, острой алкогольной интоксикации, диабетическом ацидозе, тяжелой дисфункции почечных клубочков. Активность амилазы снижается в сыворотке крови при остром и хроническом гепатите, токсикозе беременности.
Слайд 85Трансаминазы
ферменты катализирующие реакции переаминирования - перенос аминогрупп от альфа-аминокислот на альфа-кетокислот
Наибольшее диагностическое значение имеет определение активности аспартатаминотрансферазы (АСТ) (КФ2.6.1.1.) и аланинаминотрансферазы (АлТ) (КФ 2.6.1.2).
АЛТ - наиболее высокая активность обнаруживается в печени, поджелудочной железе, сердце и скелетной мускулатуре. В печени активность АЛТ в несколько тысяч раз выше, чем в сыворотке крови.
Фермент АСТ имеется во всех тканях организма человека, но наибольшая активность его в сердце, эритроцитах, скелетных мышцах, затем в печени. Активность АСТ в сердечной мышце в 10 000 выше, чем в сыворотке.
.
Слайд 86γ- глутаминилтранспептидаза (ГГТП)
(КФ 2.3.2.2)
фермент катализирует перенос глутамильного радикала с
Фермент высоко активен в печени и в клетках извитых канальцев почек первого рода.
Резкое увеличение в плазме крови наблюдается при механической желтухе, вызванном новообразованием, при холангитах, раке порджелудочной железы.
Умеренное повышение отмечается при инфекционном гепатите, сердечно-сосудистой недостаточности.
У больных инфарктом миокарда автовность ГГТП возрастает постепенно. Наибольшая активность отмечается в конце третье недели заболевания, а к концу 6 недели приходит к норме.
Тест ГГТП используется в качестве маркера рака поджелудочной железы, рака предстательной железы, его уровни отражают ремиссии и рецидивы.
ГГТП-тест применяется для скрининга алкоголизма и при контроле за хроническими алкоголиками в процессе их лечения.
Слайд 87Сорбитолдегидрогеназа (СДГ) (КФ 1.1.1.14)-
фермент катализирует обратимое окисление сорбитола. Фермент специфичен для
Слайд 88Креатинфосфокиназа (КФ 2.7.3.3)
Креатинфосфокиназа (КФК) катализирует реакцию переноса фосфатного остатка с АТФ
Наибольшую активность фермент проявляет в сердечной, скелетной мышцах и в нервной ткани.
КФК имеет три изоформы: КФК-1 (ВВ)-изоформа мозга, КФК-2 (МВ) -изоформа миокарда, КФК-3 (ММ) - изоформа скелетных мышц.
Активность КФК в сыворотке крови резко повышается при прогрессирующей мышечной дистрофии, при остром инфаркте миокарда. При этом активность КФК увеличивается раньше активности других ферментов. Повышение активности отмечается через 3-4 часа после начала заболевания. Максимум активности (в 5-10 раз превышает норму) - через 18-24 часа.
При инфаркте миокарда в течение первых 2-4 часов резко повышается изоформа КФК-2.
При нейротравме, нейрохирургическое вмешательство сопровождается увеличением активности КФК-1.
При всех перечисленных заболеваниях меняется активность аминотрансфераз, ЛДГ и ее изоферментов, альдолазы, однако изменения активности КФК являются более специфичными. Повышение активности КФК наблюдается также при злокачественной гипертермии, связанной с наркозом.
Слайд 89Лактатдегидрогеназа (ЛДГ) (КФ 1.1.1.27) .
ЛДГ в диагностике инфаркта миокарда
Через несколько часов после инфаркта миокарда значительно повышается общая активность ЛДГ. Максимум активности наблюдается через 36-48 часов (в 10-15 раз выше нормы). Активность возвращается к норме на 10-12 день заболевания.
Определение активности ЛДГ особенно большую ценность имеет в неясных случаях инфаркта миокарда: при нетипичной клинической и электрокардиографической картине.
У больных острым инфарктом в сыворотке крови резко повышается активность изоферментов ЛДГ1 и ЛДГ2. Отношение ЛДГ1/ЛДГ2 больше единицы.
Изменения в активности изоферментов сыворотки крови при инфаркте миокарда сохраняются дольше, чем изменения в суммарной активности ЛДГ и обнаруживаются тогда, когда общая ферментативная активность уже оказывается в пределах нормы.
Принято считать, что при неясной клинической картине и нормальной общей активности ЛДГ повышение активности ЛДГ1 указывает на мелкие некротические очаги в миокарде, не определяемые другими способами.
Слайд 91ЛДГ при заболевания желчевыводящей системы.
Болезнь Боткина - общая активность ЛДГ повышена
При механической желтухе, калькулезном холецистите увеличение общей активности ЛДГ в сыворотке крови незначительно и происходит за счет повышения активности ЛДГ5.
Слайд 92Липаза (КФ3.1.1.3)
катализируюет гидролиз триацилглицеридов.
Повышение активности липазы в сыворотке крови наблюдается
Слайд 935`-нуклеотидаза (КФ 3.1.3.5)-
катализирует гидролиз нуклеотидов, в частности АМФ.
Активность этого фермента
Слайд 94Фосфатазы - ферменты, катализирующие отщепление фосфорной кислоты от ее органических эфиров.
Фосфомоноэстераза I или щелочная фосфатаза (КФ 3.1.3.1)- Оптимум рН щелочной фосфатазы лежит в пределах 8,6-10,1.
Щелочная фосфатаза поступает в кровь, в основном, из костной ткани. Активность фермента увеличивается при : при рахите, остеомаляции, остеосаркомах, при метастазах опухолей в кости, болезни Педжета.
Высока активность щелочной фосфатазы в печени и желчных путях, в клетках слизистой оболочки кишечника, плаценте, гранулоцитах.
В физиологических условиях ЩФ секретируется с желчью.
Резкое увеличение активности ЩФ отмечается у больных с механической желтухой, при циррозе печени, вызванном застоем желчи. Механизм повышения активности ЩФ при заболеваниях печени недостаточно ясен.
Снижается активность при кретинизме, гиповитаминозе С, ахондропластии.
Слайд 95Фосфатаза кислая
Фосфомоноэстераза II или кислая фосфатаза (КФ 3.1.3.2). Оптимум рН кислой
Кислая фосфатаза входит в состав лизосом и обычно рассматривается как маркер лизосомальных ферментов.
Содержится главным образом в предстательной железе (изофермент 2), в печени и других паренхиматозных органах (изофермент 3), в эритроцитах (изофермент 4).
Освобождается из тромбоцитов при свертывании крови.
Повышение активности кислой фосфатазы наблюдается: при разрушении тканей (признак выхода лизосомальных ферментов), травме, при опухолях предстательной железы, при простатитах и манипуляциях на предстательной железе,
при хронических воспалительных процессах, пневмонии, ревматизме. Активность повышается при болезни Гоше, болезнях почек, опухолях костей, тромбоэмболиях.
Слайд 96Холинэстераза (КФ 3.1.1.8).
Холинэстераза (ХЭ) обладает относительной специфичностью. Катализирует гидролиз различных эфиров
ХЭ содержится в основном в печени, поджелудочной железе, сыворотке крови.
Сывороточная ХЭ относится к секретируемым ферментам, т.е. синтезируется в печени, а затем поступает в плазму крови.
При патологических состояниях активность холинэстеразы чаще всего снижается.
Снижение активности ХЭ отмечается в начальных стадиях болезни Боткина.
При тяжелой форме активность ХЭ резко снижается на протяжении всего желтушного периода, тогда как при других формах этого заболевания отмечается незначительное или кратковременное падение активности на 1-2 неделе.
Значительно снижается активность ХЭ при циррозах печени. Снижение активности сывороточной ХЭ при заболеваниях печени обусловлено нарушением белоксинтезирующей способности печеночных клеток.
Активность фермента снижается в сыворотке крови при гипотиреозе, бронхиальной астме, ожогах, травматическом шоке, инфаркте миокарда, в послеоперационном периоде.
При инфаркте миокарда низкая активность сохраняется в течение 2 недель. Затем содержание фермента в сыворотке нормализуется. Механизм понижения активности ХЭ в сыворотке крови при инфаркте пока не ясен.
Слайд 97Кинины
Кинины иногда называют местными гормонами. Они вырабатываются не в специфических железах
В плазме крови они связаны с альфа-2-глобулиновой фракцией белков.
По химической природе кинины - полипептиды. В плазме крови содержание кининов ничтожно и присутствуют они в плазме крови в виде кининогенов не менее трех типов.
Важнейшими кининами крови являются
брадикинин,
каллидин
метионил-лизил-брадикинин.
Слайд 98Кинины - калликреины
Образование кининов из кининогенов происходит под воздействием специфических ферментов
Калликреины являются протеиназами типа трипсина.
Калликреины тканей (поджелудочной и слюнной железы, почек, стенки кишечника, ликвора, мочи) имеют более узкую субстратную специфичность, чем калликреины плазмы.
Воздействуя на кининогены, эти ферменты приводят к образованию каллидина, т.е. лизил-брадикинина.
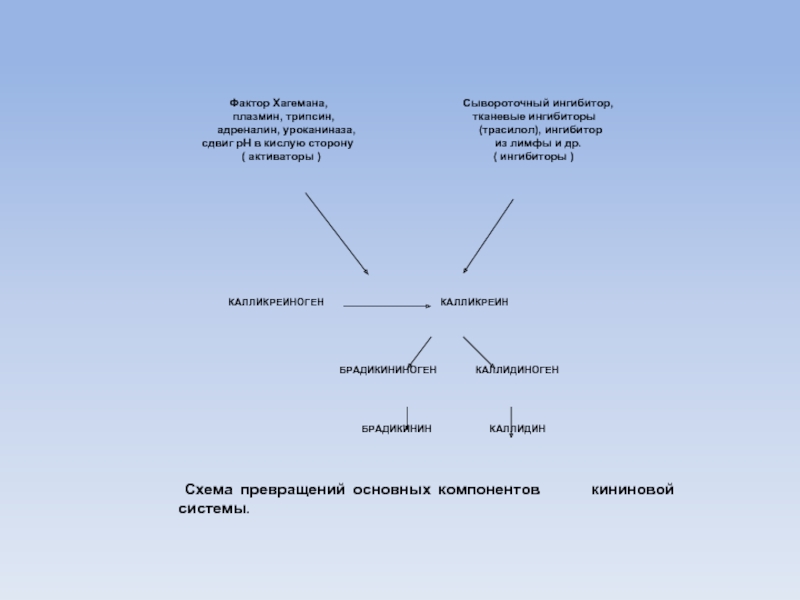
Слайд 99 Фактор
плазмин, трипсин, тканевые ингибиторы
адреналин, уроканиназа, (трасилол), ингибитор
сдвиг рН в кислую сторону из лимфы и др.
( активаторы ) ( ингибиторы )
КАЛЛИКРЕИНОГЕН КАЛЛИКРЕИН
БРАДИКИНИНОГЕН КАЛЛИДИНОГЕН
БРАДИКИНИН КАЛЛИДИН
Схема превращений основных компонентов кининовой системы.
Слайд 100Кинины
Физиологическая роль кининов:
-регулируют местный кровоток
-вызывают гиперемию тканей
-стимулируют сердечно-сосудистую деятельность
-стимулируют моторику кишечника
-оказывают ренотропное действие
-регулируют теплообмен
Слайд 101Участие кининов в формировании патологического процесса:
усиливают воспаление (панкреатиты,артриты, аллергии, ожоги,
способствуют развитию шока (анафилактического, эндотоксинового геморрагического, кардиоваскулярного, родового, хирургического )
способствуют развитию ангионевротического отека Квинке
карциноидному синдрому,
демпинг синдрому,
завороту кишок,
мигрени,
катаракте,
отеку легкого (адреналиновый),
ревматического процесса
способствуют развитию атеросклероза
Слайд 102Фармакологическое действие кининов:
-расширяют просвет кровеносных
сосудов
-снижают
-снижают кровяное давление
-повышают проницаемость капилляров
-вызывают боль
-увеличивают частоту сердечных
сокращений
-стимулируют диапедез лейкоцитов
-сокращают гладкую мускулатуру бронхов