- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Белки (протеины) презентация
Содержание
- 1. Белки (протеины)
- 2. БЕЛКИ – это высокомолекулярные азотосодержащие
- 3. ИСТОРИЧЕСКАЯ СПРАВКА В 1728 г. БЕККАРИ выделил
- 4. БЕЛОК И ЕГО ХАРАКТЕРНЫЕ ПРИЗНАКИ Довольно постоянная
- 5. АМИНОКИСЛОТЫ - ЭТО СТРУКТУРНЫЕ МОНОМЕРЫ БЕЛКОВ АМИНОКИСЛОТЫ
- 6. Следовательно, аминокислоты имеют суммарный нулевой, положительный
- 7. Заменимые и незаменимые аминокислоты
- 8. ПРОТЕНОГЕННЫЕ АМИНОКИСЛОТЫ (желтым цветом выделены радикалы ®, звездочками помечены незаменимые аминокислоты)
- 11. СТРУКТУРНАЯ ОРГАНИЗАЦИЯ БЕЛКОВ Образование молекулы белка происходит
- 12. Каждую аминокислоту, входящую в состав белка,
- 13. ПЕРВИЧНАЯ СТРУКТУРА БЕЛКА Это линейная полипептидная цепь
- 14. К настоящему времени расшифрована первичная структура
- 15. ВТОРИЧНАЯ СТРУКТУРА БЕЛКА Вторичная структура белка –
- 16. ВТОРИЧНАЯ СТРУКТУРА БЕЛКА
- 17. БЕТА-СТРУКТУРА Бета-структура – это разновидность вторичной структуры,
- 18. БЕТА - КОНФОРМАЦИЯ
- 19. ТРЕТИЧНАЯ СТРУКТУРА БЕЛКА Третичная структура белка –
- 20. ТРЕТИЧНАЯ СТРУКТУРА БЕЛКА Характер третичной организации устанавливают
- 21. ОБРАЗОВАНИЕ ПРОСТРАНСТВЕННОЙ СТРУКТУРЫ БЕЛКА Согласно современным представлениям
- 22. СТАДИИ ОБРАЗОВАНИЯ НАТИВНОЙ СТРУКТУРЫ БЕЛКА
- 23. ЧЕТВЕРТИЧНАЯ СТРУКТУРА БЕЛКА Четвертичная структура белка –
- 24. СХЕМА ЧЕТВЕРТИЧНОЙ СТРУКТУРЫ ГЕМОГЛАБИНА
- 25. КЛАССИФИКАЦИЯ БЕЛКОВ Физико-химическая классификация По электрохимическим признакам:
- 27. Функциональная классификация белков Каталически активные белки
- 28. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ
- 29. Коллоидные и осмотические свойства белков Водные растворы
- 30. Факторы, влияющие на растворимость белков Растворимость разных
- 31. Денатурация и ренатурация белков ДЕНАТУРАЦИЯ – это
- 32. Химические свойства белков Разнообразие химических свойств белков
- 33. МЕТОД АКАБОРИ – позволяет определить С-концевую
- 34. БИОЛОГИЧЕСКИЕ СВОЙСТВА БЕЛКОВ 1.Ферментативная или каталическая –ускорение
- 35. БЕЛКИ, УЧАСТВУЮЩИЕ В ОБЕПЕЧЕНИИ МЫШЕЧНОЙ РАБОТЫ Сократительные
- 36. БЕЛКИ СОЕДИНИТЕЛЬНОЙ ТКАНИ Соединительная ткань (сухожилия, связки,
- 38. БЕЛКИ ПЕРЕНОСЧИКИ КИСЛОРОДА ГЕМОГЛОБИН – находится в
- 39. МИОГЛОБИН – это кислородтранспортный белок мышц,
Слайд 2
БЕЛКИ – это высокомолекулярные азотосодержащие вещества, состоящие из аминокислот, связанных между
собой пептидными связями (- NH – CO - ),и имеющие сложную структурную организацию.
БЕЛКИ иначе называют протеинами; этот термин введен в 1838 г. и образован от греческого слова proteos – первостепенный
Белки составляют значительную часть тканей живого организма: до 25% сырой и до 45-50% сухой массы. Они содержат 50-59% углерода, 6,5-7,3% водорода, 15-18% азота, 21-24% кислорода, до 2,5% серы.
Для большинства белков характерна довольно постоянная доля азота (в среднем 16% сухой массы) по сравнению с другими элементами. В составе некоторых белков обнаруживают фосфор, железо, цинк, медь и другие элементы.
БЕЛКИ иначе называют протеинами; этот термин введен в 1838 г. и образован от греческого слова proteos – первостепенный
Белки составляют значительную часть тканей живого организма: до 25% сырой и до 45-50% сухой массы. Они содержат 50-59% углерода, 6,5-7,3% водорода, 15-18% азота, 21-24% кислорода, до 2,5% серы.
Для большинства белков характерна довольно постоянная доля азота (в среднем 16% сухой массы) по сравнению с другими элементами. В составе некоторых белков обнаруживают фосфор, железо, цинк, медь и другие элементы.
Слайд 3ИСТОРИЧЕСКАЯ СПРАВКА
В 1728 г. БЕККАРИ выделил первое белковое вещество из пшеничной
муки, названное «клейковиной». Он же показал его сходство с продуктами животного происхождения, например белком куриного яйца.
1820 г. БРАКОННО открыл в продуктах гидролиза белков аминокислоту глицин. Эта первая аминокислота, найденная непосредственно в белковых веществах.
В 1838 г. После систематического изучения элементарного состава разных белков МУЛЬДЕР предложил теорию протеина.
В 1888 г. А.Я.ДАНИЛЕВСКИЙ выдвинул гипотезу строения белка, получившую название «теории элементарных рядов». Он первым предположил существование в белках связей – NH – CO - .
В 1890 ГОФМЕЙСТЕР впервые получил кристаллический белок – яичный альбумин.
В 1902 г. ФИШЕР и ГОФМЕЙСТЕР предложили пептидную теорию строения белка. В это же время ФИШЕР с сотрудниками синтезировал в лаборатории первые пептиды.
В 1925-1930 гг. Сведберг сконструировал ультрацентрифугу и использовал ее для определения молекулярной массы выделяемых белков.
В 1951 г. ПОЛИНГ и КОРИ разработали модель вторичной структуры белка, названной альфа-спиралью.
В 1952 г. ЛИНДЕРСТРЕМ-ЛАНГ предположил существование трех уровней организации белковой молекулы: первичный, вторичный, третичный.
В 1953 г. СЕНГЕР впервые расшифровал последовательность аминокислот в инсулине.
В 1956 г. МУР и СТЕЙН создали первый автоматический анализатор аминокислот.
В 1958 г. КЕНДРЬЮ и в 1959 г. ПЕРУТЦ расшифровали трехмерные структуры белков – миоглобина и гемоглобина.
В 1963 г. ЦАН синтезировал природный белок инсулин.
1820 г. БРАКОННО открыл в продуктах гидролиза белков аминокислоту глицин. Эта первая аминокислота, найденная непосредственно в белковых веществах.
В 1838 г. После систематического изучения элементарного состава разных белков МУЛЬДЕР предложил теорию протеина.
В 1888 г. А.Я.ДАНИЛЕВСКИЙ выдвинул гипотезу строения белка, получившую название «теории элементарных рядов». Он первым предположил существование в белках связей – NH – CO - .
В 1890 ГОФМЕЙСТЕР впервые получил кристаллический белок – яичный альбумин.
В 1902 г. ФИШЕР и ГОФМЕЙСТЕР предложили пептидную теорию строения белка. В это же время ФИШЕР с сотрудниками синтезировал в лаборатории первые пептиды.
В 1925-1930 гг. Сведберг сконструировал ультрацентрифугу и использовал ее для определения молекулярной массы выделяемых белков.
В 1951 г. ПОЛИНГ и КОРИ разработали модель вторичной структуры белка, названной альфа-спиралью.
В 1952 г. ЛИНДЕРСТРЕМ-ЛАНГ предположил существование трех уровней организации белковой молекулы: первичный, вторичный, третичный.
В 1953 г. СЕНГЕР впервые расшифровал последовательность аминокислот в инсулине.
В 1956 г. МУР и СТЕЙН создали первый автоматический анализатор аминокислот.
В 1958 г. КЕНДРЬЮ и в 1959 г. ПЕРУТЦ расшифровали трехмерные структуры белков – миоглобина и гемоглобина.
В 1963 г. ЦАН синтезировал природный белок инсулин.
Слайд 4БЕЛОК И ЕГО ХАРАКТЕРНЫЕ ПРИЗНАКИ
Довольно постоянная доля азота (в среднем 16%
от сухой массы)
Наличие постоянных структурных звеньев – аминокислот.
Пептидные связи между аминокислотами, с помощью которых они соединяются в полипептидные цепи.
Большая молекулярная масса (от 4-5 тысяч до несколько миллионов дальтонов).
Сложная структурная организация полипептидной цепи, определяющая физико-химические и биологические свойства белков.
Мономерами белков являются альфа-аминокислоты L-ряда. Общая формула а-аминокислот L-ряда имеет вид:
H2N – CH – COOH
|
R
Выделенный фрагмент а-аминокислоты присутствует во всех протеиногенных аминокислотах и называется стандартным аминокислотным блоком. Аминокислоты различаются по структуре радикала R и следовательно по физико-химическим свойствам.
Наличие постоянных структурных звеньев – аминокислот.
Пептидные связи между аминокислотами, с помощью которых они соединяются в полипептидные цепи.
Большая молекулярная масса (от 4-5 тысяч до несколько миллионов дальтонов).
Сложная структурная организация полипептидной цепи, определяющая физико-химические и биологические свойства белков.
Мономерами белков являются альфа-аминокислоты L-ряда. Общая формула а-аминокислот L-ряда имеет вид:
H2N – CH – COOH
|
R
Выделенный фрагмент а-аминокислоты присутствует во всех протеиногенных аминокислотах и называется стандартным аминокислотным блоком. Аминокислоты различаются по структуре радикала R и следовательно по физико-химическим свойствам.
Слайд 5АМИНОКИСЛОТЫ - ЭТО СТРУКТУРНЫЕ МОНОМЕРЫ БЕЛКОВ
АМИНОКИСЛОТЫ – это органические карбоновые кислоты,
у которых как минимум один из атомов водорода углеводородной цепи замещен на аминогруппу. В зависимости от положения – NH2 различают альфа-, бета-, гамма- и др. L-аминокислоты.
Аминокислоты делятся на 2 группы: протеиногенные (входящие в состав белков) и непротеиногенные (не участвующие в образовании белков).
Приняты три классификации аминокислот:
Структурная - по строению белкового радикала.
Электрохимическая – по кислотно-основным свойствам аминокислот.
Биологическая или физиологическая – по степени незаменимости аминокислот для организма.
АМИНОКИСЛОТЫ – относятся к амфотерным электролитам: молекула аминокислоты в нейтральном водном растворе превращается в диполярную форму (цвиттер-ион), которая способная реагировать как с кислотами, так и с основаниями.
По кислотно-основным свойствам делятся на: кислые, основные и нейтральные
К кислым аминокислотам относятся аминокислоты с карбоксильными группами в радикале R (аспаргиновая и глутаминовая кислоты)
К основным аминокислотам относятся лизин, аргинин и гистидин, т.е. аминокислоты, имеющие в радикале R группу атомов с основными свойствами: аминогруппу, гуанидиновую или имидазольную группу.
К нейтральным аминокислотам относятся все остальные аминокислоты, так как их радикал R не обеспечивает ни кислотных, ни основных свойств.
Аминокислоты делятся на 2 группы: протеиногенные (входящие в состав белков) и непротеиногенные (не участвующие в образовании белков).
Приняты три классификации аминокислот:
Структурная - по строению белкового радикала.
Электрохимическая – по кислотно-основным свойствам аминокислот.
Биологическая или физиологическая – по степени незаменимости аминокислот для организма.
АМИНОКИСЛОТЫ – относятся к амфотерным электролитам: молекула аминокислоты в нейтральном водном растворе превращается в диполярную форму (цвиттер-ион), которая способная реагировать как с кислотами, так и с основаниями.
По кислотно-основным свойствам делятся на: кислые, основные и нейтральные
К кислым аминокислотам относятся аминокислоты с карбоксильными группами в радикале R (аспаргиновая и глутаминовая кислоты)
К основным аминокислотам относятся лизин, аргинин и гистидин, т.е. аминокислоты, имеющие в радикале R группу атомов с основными свойствами: аминогруппу, гуанидиновую или имидазольную группу.
К нейтральным аминокислотам относятся все остальные аминокислоты, так как их радикал R не обеспечивает ни кислотных, ни основных свойств.
Слайд 6
Следовательно, аминокислоты имеют суммарный нулевой, положительный или отрицательный заряд в зависимости
от рН среды. Значение рН среды, при котором заряд аминокислоты равен нулю, называют изоэлектрической точкой. Изоэлектрическая точка отражает кислотно-основные свойства разных групп в аминокислотах и является одной из важных констант, характеризующих аминокислоту.
По биологическому значению аминокислоты подразделяются на заменимые, полузаменимые и незаменимые.
Заменимые аминокислоты синтезируются в организме человека в достаточном количестве. К ним относятся глицин, аланин, серин, цистеин, тирозин, аспаргиновая кислота, глутаминовая кислота, аспаргин, глутамин.
Полузаменимые аминокислоты образуются в организме, но в недостаточном количестве, поэтому их недостаток должен восполниться белковой пищей. Для организма человека такими аминокислотами являются аргинин и гистидин.
Незаменимые аминокислоты в организме человека не синтезируются, поэтому они должны поступать извне с пищей. Незаменимых аминокислот восемь: валин, лейцин, изолейцин, треонин, лизин, метионин, фенилаланин, триптофан.
Абсолютная незаменимость 8 аминокислот универсальна для всех видов организмов.
Для крыс и мышей – незаменимых кислот уже 9 (к 8 известным добавляется гистидин).
У курицы – 11 незаменимых аминокислот (к 8 добавляются гистидин, аргинин, тирозин)
Сложившийся для каждого вида организма состав незаменимых аминокислот, называемый АУКСОТРОФНОСТЬЮ организма, отражает стремление его к минимальным энергетическим затратам на синтез аминокислот. Выгоднее получать готовый продукт, чем производить его самому. Поэтому организмы, потребляющие незаменимые аминокислоты, тратят на 20% энергии меньше, чем те которые синтезируют все аминокислоты.
По биологическому значению аминокислоты подразделяются на заменимые, полузаменимые и незаменимые.
Заменимые аминокислоты синтезируются в организме человека в достаточном количестве. К ним относятся глицин, аланин, серин, цистеин, тирозин, аспаргиновая кислота, глутаминовая кислота, аспаргин, глутамин.
Полузаменимые аминокислоты образуются в организме, но в недостаточном количестве, поэтому их недостаток должен восполниться белковой пищей. Для организма человека такими аминокислотами являются аргинин и гистидин.
Незаменимые аминокислоты в организме человека не синтезируются, поэтому они должны поступать извне с пищей. Незаменимых аминокислот восемь: валин, лейцин, изолейцин, треонин, лизин, метионин, фенилаланин, триптофан.
Абсолютная незаменимость 8 аминокислот универсальна для всех видов организмов.
Для крыс и мышей – незаменимых кислот уже 9 (к 8 известным добавляется гистидин).
У курицы – 11 незаменимых аминокислот (к 8 добавляются гистидин, аргинин, тирозин)
Сложившийся для каждого вида организма состав незаменимых аминокислот, называемый АУКСОТРОФНОСТЬЮ организма, отражает стремление его к минимальным энергетическим затратам на синтез аминокислот. Выгоднее получать готовый продукт, чем производить его самому. Поэтому организмы, потребляющие незаменимые аминокислоты, тратят на 20% энергии меньше, чем те которые синтезируют все аминокислоты.
Слайд 7Заменимые и незаменимые аминокислоты
Заменимые, г Незаменимые, г
Аланин 3,0 Валин 1,5
Аргинин 6,0 Гистидин 2,0
Аспаргин 3,0 Лизин 1,5
Аспаргиновая кислота 6,0 Лейцин 2,0
Глицин 3,0 Изолейцин 1,3
Глутамин 6,0 Метионин 2,0
Глутаминовая кислота 6,0 Треонин 0,9
Пролин 3,0 Триптофан 0,5
Серин 3,0 Фенилаланин 2,0
Тирозин 4,0 Аргинин
Цистеин 3,0 (для детей) 6,0
Аланин 3,0 Валин 1,5
Аргинин 6,0 Гистидин 2,0
Аспаргин 3,0 Лизин 1,5
Аспаргиновая кислота 6,0 Лейцин 2,0
Глицин 3,0 Изолейцин 1,3
Глутамин 6,0 Метионин 2,0
Глутаминовая кислота 6,0 Треонин 0,9
Пролин 3,0 Триптофан 0,5
Серин 3,0 Фенилаланин 2,0
Тирозин 4,0 Аргинин
Цистеин 3,0 (для детей) 6,0
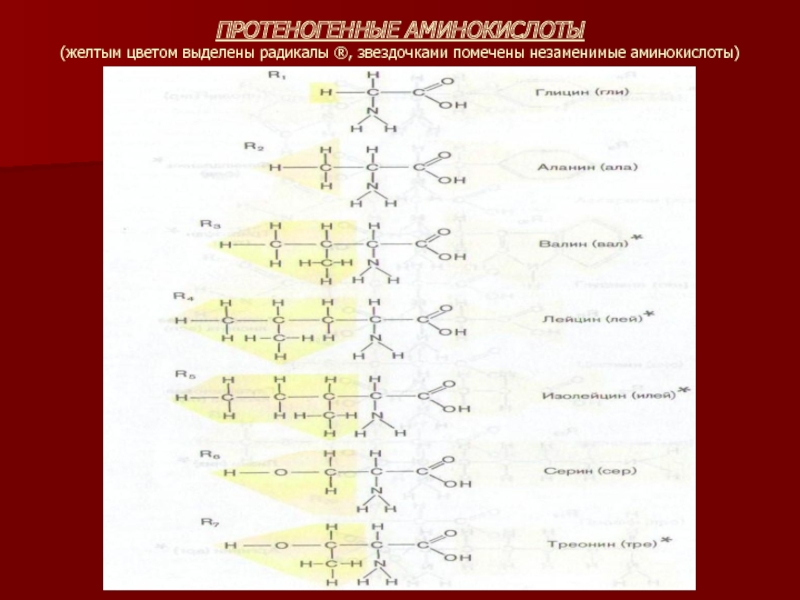
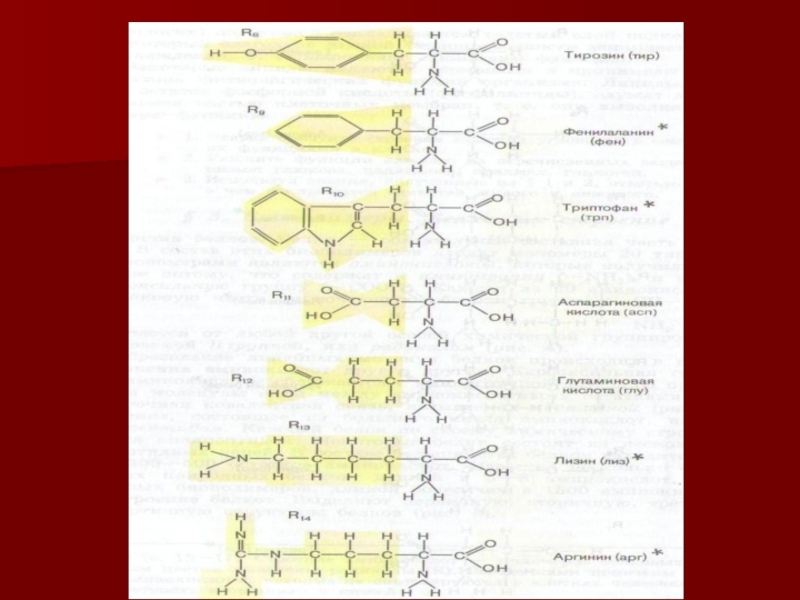
Слайд 8ПРОТЕНОГЕННЫЕ АМИНОКИСЛОТЫ
(желтым цветом выделены радикалы ®, звездочками помечены незаменимые аминокислоты)
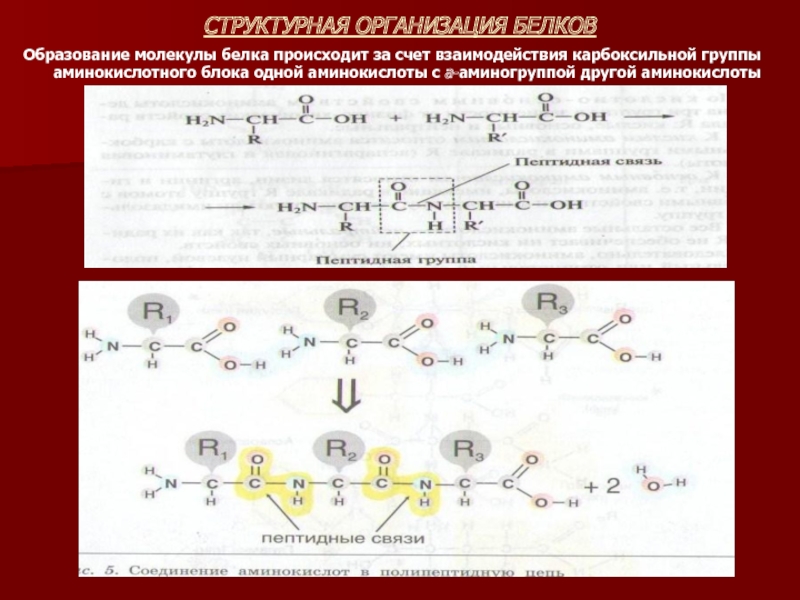
Слайд 11СТРУКТУРНАЯ ОРГАНИЗАЦИЯ БЕЛКОВ
Образование молекулы белка происходит за счет взаимодействия карбоксильной группы
аминокислотного блока одной аминокислоты с а-аминогруппой другой аминокислоты
Слайд 12
Каждую аминокислоту, входящую в состав белка, называют аминокислотным остатком. Аминокислотные остатки
в молекуле белка соединены пептидными связями. Длина пептидной связи = 0,1325 нм – среднее значение между длинами одинарной связи C – N (0,146) и двойной связи C = N (О,127нм), т.е. пептидная связь частично имеет характер двойной связи.
СВОЙСТВА ПЕПТИДНОЙ ГРУППЫ:
1. Пептидная группа имеет жесткую планарную структуру, т.е. все атомы, входящие в нее, располагаются в одной плоскости.
2. Атом кислорода и атом водорода в пептидной группе находится в транс-положении по отношению к пептидной связи C – N.
3. Пептидная группа может существовать в двух резонансных формах (кето- или енольной)
Полипептидная цепь состоит из регулярно повторяющихся участков, образующих остов молекулы, и вариабельных участков – радикалов R аминокислотных остатков.
Полипептидная цепь имеет определенное направление, т.к. каждый из ее строительных блоков имеет разные концы: а-аминогруппу и карбоксильную группу.
Началом полипептидной цепи считают конец, несущий свободную аминогруппу (N-конец), а заканчивается полипептидная цепь свободной карбоксильной группой (С-конец).
СВОЙСТВА ПЕПТИДНОЙ ГРУППЫ:
1. Пептидная группа имеет жесткую планарную структуру, т.е. все атомы, входящие в нее, располагаются в одной плоскости.
2. Атом кислорода и атом водорода в пептидной группе находится в транс-положении по отношению к пептидной связи C – N.
3. Пептидная группа может существовать в двух резонансных формах (кето- или енольной)
Полипептидная цепь состоит из регулярно повторяющихся участков, образующих остов молекулы, и вариабельных участков – радикалов R аминокислотных остатков.
Полипептидная цепь имеет определенное направление, т.к. каждый из ее строительных блоков имеет разные концы: а-аминогруппу и карбоксильную группу.
Началом полипептидной цепи считают конец, несущий свободную аминогруппу (N-конец), а заканчивается полипептидная цепь свободной карбоксильной группой (С-конец).
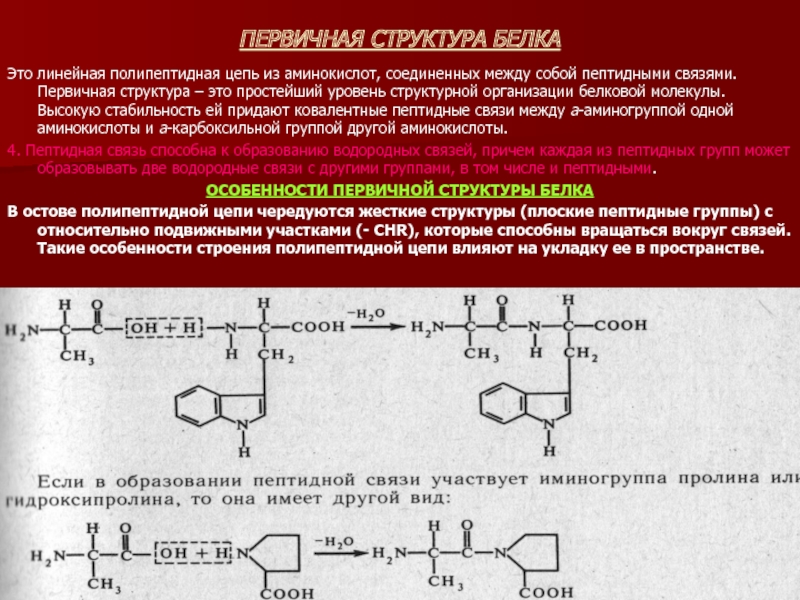
Слайд 13ПЕРВИЧНАЯ СТРУКТУРА БЕЛКА
Это линейная полипептидная цепь из аминокислот, соединенных между собой
пептидными связями. Первичная структура – это простейший уровень структурной организации белковой молекулы. Высокую стабильность ей придают ковалентные пептидные связи между а-аминогруппой одной аминокислоты и а-карбоксильной группой другой аминокислоты.
4. Пептидная связь способна к образованию водородных связей, причем каждая из пептидных групп может образовывать две водородные связи с другими группами, в том числе и пептидными.
ОСОБЕННОСТИ ПЕРВИЧНОЙ СТРУКТУРЫ БЕЛКА
В остове полипептидной цепи чередуются жесткие структуры (плоские пептидные группы) с относительно подвижными участками (- CHR), которые способны вращаться вокруг связей. Такие особенности строения полипептидной цепи влияют на укладку ее в пространстве.
4. Пептидная связь способна к образованию водородных связей, причем каждая из пептидных групп может образовывать две водородные связи с другими группами, в том числе и пептидными.
ОСОБЕННОСТИ ПЕРВИЧНОЙ СТРУКТУРЫ БЕЛКА
В остове полипептидной цепи чередуются жесткие структуры (плоские пептидные группы) с относительно подвижными участками (- CHR), которые способны вращаться вокруг связей. Такие особенности строения полипептидной цепи влияют на укладку ее в пространстве.
Слайд 14
К настоящему времени расшифрована первичная структура более тысячи белков разных организмов,
в том числе и человека. Примеры последовательностей аминокислотных остатков для некоторых белков.
Слайд 15ВТОРИЧНАЯ СТРУКТУРА БЕЛКА
Вторичная структура белка – это способ укладки полипептидной цепи
в упорядоченную структуру благодаря образованию водородных связей между пептидными группами одной цепи или смежными полипептидными цепями.
По конфигурации вторичные структуры делятся на спиральные (а-спираль) и слоисто-складчатые (бета-структура и кросс-бета-форма).
Модель строения а-спирали, учитывающая все совйства пептидной связи, была разработана Л.Полингом и Р.Кори (1949-1951).
ОСНОВНЫЕ СВОЙСТВА АЛЬФА-СПИРАЛИ
Спиральная конфигурация полипептидной цепи, имеет винтовую симметрию.
Водородные связи образуются между пептидными группами каждого первого и четвертого амино-кислотных остатков.
Регулярность витков спирали.
Все амино-кислотные остатки в альфа-спирали равнозначны независимо от строения их боковых радикалов.
Боковые радикалы не участвуют в образовании альфа-спирали.
Высота одного витка или шаг альфа-спирали равен 0,54 нм. В него входит 3,6 аминокислотных остатка. Период регуларности альфа-спирали равен 5 виткам или 18 аминокислотным остаткам. Длина одного периода составляет 2,7 нм.
По конфигурации вторичные структуры делятся на спиральные (а-спираль) и слоисто-складчатые (бета-структура и кросс-бета-форма).
Модель строения а-спирали, учитывающая все совйства пептидной связи, была разработана Л.Полингом и Р.Кори (1949-1951).
ОСНОВНЫЕ СВОЙСТВА АЛЬФА-СПИРАЛИ
Спиральная конфигурация полипептидной цепи, имеет винтовую симметрию.
Водородные связи образуются между пептидными группами каждого первого и четвертого амино-кислотных остатков.
Регулярность витков спирали.
Все амино-кислотные остатки в альфа-спирали равнозначны независимо от строения их боковых радикалов.
Боковые радикалы не участвуют в образовании альфа-спирали.
Высота одного витка или шаг альфа-спирали равен 0,54 нм. В него входит 3,6 аминокислотных остатка. Период регуларности альфа-спирали равен 5 виткам или 18 аминокислотным остаткам. Длина одного периода составляет 2,7 нм.
Слайд 17БЕТА-СТРУКТУРА
Бета-структура – это разновидность вторичной структуры, которая имеет слабо изогнутую конфигурацию
полипептидной цепи и формируется с помощью межпептидных водородных связей в пределах отдельных участков одной полипептидной цепи или смежных полипептидных цепей. В отличие от а-спирали бета-складчатый слой имеет линейную, а не стержневую форму. Участки полипептидной цепи оказываются сближенными на расстояние, равное длине водородной связи (0,272) между группой С=О и HN-группой.
Параллельный бета-слой – это структура, в которой участки полипептидной цепи имеют одинаковое направление.
Антипараллельный бета-слой имеет разное направление.
Вторичная структура белка определяется первичной. Аминокислотные остатки в различной степени способны к образованию водородных связей, что и является движущей силой при образовании а-спирали и бета-слоя. Во многих белках имеются одновременно а-спирали и бета-слои. Доля спиральной конфигурации разных белков различна. Так, мышечный белок парамиозин на 100% спирализован; на 75% спирализован миоглобин и гемоглобин человека. У трипсина и рибонуклеазы значительная часть полипептидной цепи укладывается в слоистые бета-структуры. Белки опорных тканей – кератин (белок волос), коллаген (белок кожи и сухожилий) – имеют бета-конфигурацию полипептидных цепей.
Супервторичная структура - это ансамбли регулярных вторичных белков. Характерны как для фибриллярных, так и для глобулярных белков. К элементам супервторичной структуры относятся домены. Домен – это обособленная область полипептидной цепи, обладающая структурной и функциональной автономией. Такую сложную субдоменную структуру имеет синтетаза высших жирных кислот животных.
Параллельный бета-слой – это структура, в которой участки полипептидной цепи имеют одинаковое направление.
Антипараллельный бета-слой имеет разное направление.
Вторичная структура белка определяется первичной. Аминокислотные остатки в различной степени способны к образованию водородных связей, что и является движущей силой при образовании а-спирали и бета-слоя. Во многих белках имеются одновременно а-спирали и бета-слои. Доля спиральной конфигурации разных белков различна. Так, мышечный белок парамиозин на 100% спирализован; на 75% спирализован миоглобин и гемоглобин человека. У трипсина и рибонуклеазы значительная часть полипептидной цепи укладывается в слоистые бета-структуры. Белки опорных тканей – кератин (белок волос), коллаген (белок кожи и сухожилий) – имеют бета-конфигурацию полипептидных цепей.
Супервторичная структура - это ансамбли регулярных вторичных белков. Характерны как для фибриллярных, так и для глобулярных белков. К элементам супервторичной структуры относятся домены. Домен – это обособленная область полипептидной цепи, обладающая структурной и функциональной автономией. Такую сложную субдоменную структуру имеет синтетаза высших жирных кислот животных.
Слайд 19ТРЕТИЧНАЯ СТРУКТУРА БЕЛКА
Третичная структура белка – это способ укладки полипептидной цепи
в пространстве. По форме третичной структуры белки делятся в основном на глобулярные и фибоиллярные.
Чтобы белок приобрел присущие ему функциональные свойства, полипептидная цепь должна определенным образом свернуться в пространстве, сформировав функционально активную структуру. Такую структуру называют нативной.
СВЯЗИ, СТАБИЛИЗИРУЮЩИЕ ТРЕТИЧНУЮ СТРУКТУРУ БЕЛКА
Сильные (ковалентные)
Слабые (полярные, ван-дер-ваальсовы)
К ковалентным связям относятся дисульфидные мостики (- S – S - ) между боковыми радикалами цистеинов, находящихся в разных участках полипептидной цепи, изопептидные, находящиеся между аминогруппами боковых радикалов лизина, аргинина,глутаминовой и аминнолимонной кислот.
К полярным связям относятся водородные и ионные. Водородные связи возникают между группой – NH2, - ОН, - SH бокового радикала одной аминокислоты и карбоксильной группой другой. Ионные связи образуются при контакте заряженных групп боковых радикалов – NH3+(лизина, аргинина, гистидина) и – СОО-( аспаргиновой и клутаминовой кислот)
Неполярные или ван-дер-ваальсовы связи образуются между углеводородными радикалами аминокислот. Этот тип взаимодействий способствует формированию гидрофобного ядра (жирной капли) внутри белковой глобулы, т.к. углеводородные радикалы стремятся избежать соприкосновения с водой.
Только правильная пространственная укладка белка делает его активным. Различные нарушения третичной структуры приводят к изменению свойств белка и потери им биологической активности.
Чтобы белок приобрел присущие ему функциональные свойства, полипептидная цепь должна определенным образом свернуться в пространстве, сформировав функционально активную структуру. Такую структуру называют нативной.
СВЯЗИ, СТАБИЛИЗИРУЮЩИЕ ТРЕТИЧНУЮ СТРУКТУРУ БЕЛКА
Сильные (ковалентные)
Слабые (полярные, ван-дер-ваальсовы)
К ковалентным связям относятся дисульфидные мостики (- S – S - ) между боковыми радикалами цистеинов, находящихся в разных участках полипептидной цепи, изопептидные, находящиеся между аминогруппами боковых радикалов лизина, аргинина,глутаминовой и аминнолимонной кислот.
К полярным связям относятся водородные и ионные. Водородные связи возникают между группой – NH2, - ОН, - SH бокового радикала одной аминокислоты и карбоксильной группой другой. Ионные связи образуются при контакте заряженных групп боковых радикалов – NH3+(лизина, аргинина, гистидина) и – СОО-( аспаргиновой и клутаминовой кислот)
Неполярные или ван-дер-ваальсовы связи образуются между углеводородными радикалами аминокислот. Этот тип взаимодействий способствует формированию гидрофобного ядра (жирной капли) внутри белковой глобулы, т.к. углеводородные радикалы стремятся избежать соприкосновения с водой.
Только правильная пространственная укладка белка делает его активным. Различные нарушения третичной структуры приводят к изменению свойств белка и потери им биологической активности.
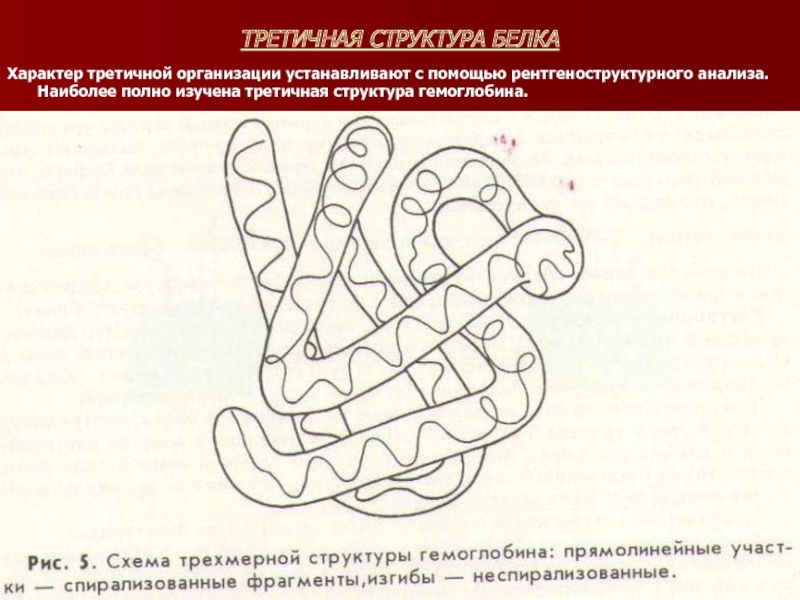
Слайд 20ТРЕТИЧНАЯ СТРУКТУРА БЕЛКА
Характер третичной организации устанавливают с помощью рентгеноструктурного анализа. Наиболее
полно изучена третичная структура гемоглобина.
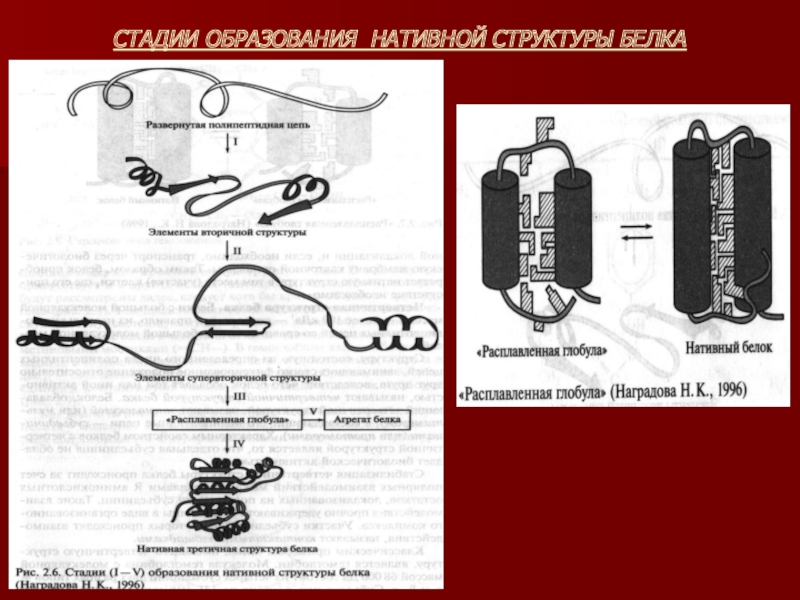
Слайд 21ОБРАЗОВАНИЕ ПРОСТРАНСТВЕННОЙ СТРУКТУРЫ БЕЛКА
Согласно современным представлениям процесс сворачивания полипептидной цепи в
нативную структуру протекает в несколько стадий:
Сначала очень быстро (за миллисек.) формируются элементы вторичной структуры.
Далее происходит ассоциация элементов вторичной структуры с образованием супервторичной структуры.
Этап формирования структуры, близкой к нативной, которую называют «расплавленной глобулой». При ее образовании главенствующую роль играют гидрофобные взаимодействия, обусловленные сближением неполярных групп и вытеснением молекул воды, находящихся между ними.
«Расплавленная глобула» отличается от нативной структуры меньшей степенью упорядочности – неполярные группы, формирующие гидрофобное ядро, «упакованы» недостаточно плотно. Значимым процессом а данном этапе является образование дисульфидных мостиков. Завершающей стадией является образование нативной глобулы.
Образование нативной структуры белка – регулируемый процесс, в котором принимают участие специфические белки. Они связываясь с развернутой полипептидной цепью, не дают ей образовать правильные структуры. Эти белки получили название молекулярные шапероны (от англ. Shaperone – гувернантка). Опекаемая шаперонами полипептидная цепь не может образовать нативную структуру, т.к. не обладает для этого необходимой подвижностью.
Вторая функция шаперонов – транспорт синтезированного белка к месту его постоянной локализации и, если необходимо, транспорт через биологическую мембрану клеточной органеллы. Таким образом, белок приобретает нативную структуру в том месте (участке) клетки, где его присутствие необходимо.
Сначала очень быстро (за миллисек.) формируются элементы вторичной структуры.
Далее происходит ассоциация элементов вторичной структуры с образованием супервторичной структуры.
Этап формирования структуры, близкой к нативной, которую называют «расплавленной глобулой». При ее образовании главенствующую роль играют гидрофобные взаимодействия, обусловленные сближением неполярных групп и вытеснением молекул воды, находящихся между ними.
«Расплавленная глобула» отличается от нативной структуры меньшей степенью упорядочности – неполярные группы, формирующие гидрофобное ядро, «упакованы» недостаточно плотно. Значимым процессом а данном этапе является образование дисульфидных мостиков. Завершающей стадией является образование нативной глобулы.
Образование нативной структуры белка – регулируемый процесс, в котором принимают участие специфические белки. Они связываясь с развернутой полипептидной цепью, не дают ей образовать правильные структуры. Эти белки получили название молекулярные шапероны (от англ. Shaperone – гувернантка). Опекаемая шаперонами полипептидная цепь не может образовать нативную структуру, т.к. не обладает для этого необходимой подвижностью.
Вторая функция шаперонов – транспорт синтезированного белка к месту его постоянной локализации и, если необходимо, транспорт через биологическую мембрану клеточной органеллы. Таким образом, белок приобретает нативную структуру в том месте (участке) клетки, где его присутствие необходимо.
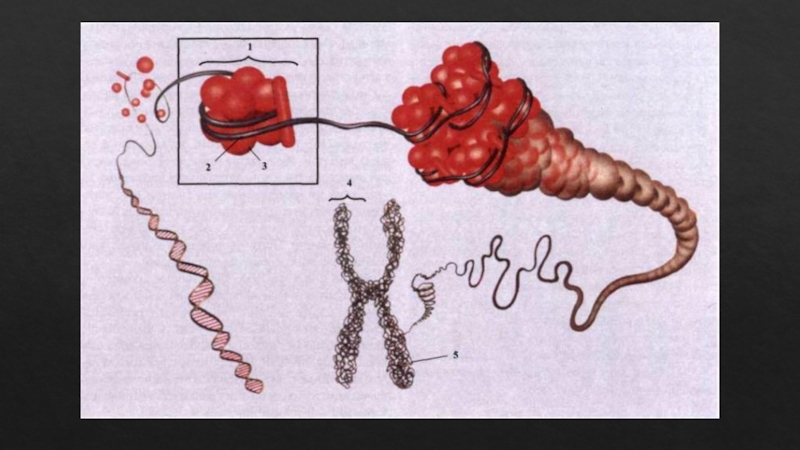
Слайд 23ЧЕТВЕРТИЧНАЯ СТРУКТУРА БЕЛКА
Четвертичная структура белка – это организация нескольких полипептидных цепей
с третичной структурой в единую функциональную молекулу белка. Белки с большой молекулярной массой – более 100 кДа (Дальтон (Да)-единица массы, равная массе атома водорода (1кДа) =103 Да). Белок, обладающий четвертичной структурой, называют эпимолекулой (или мультимером), а составляющие его полипептидные цепи – субъединицами (или протомерами).
Характерное свойство белков с четвертичной структурой – отдельная субъединица не обладает биологической активностью.
Стабилизация четвертичной структуры белка происходит за счет полярных взаимодействий между радикалами R аминокислотных остатков, локализованных на поверхности субъединиц.
Участки субъединиц, на которых происходят взаимодействия, называют контактными площадками.
Классический пример белка, имеющего четвертичную структуру, является гемоглобин. М.М. молекулы гемоглобина 68000 Да, состоит из 4х субъединиц двух разных типов: a и b. Альфа-субъединица состоит из 141 аминокислотного остатка, бета-субъединица – из 146.
Каждая субъединица содержит простетическую группу – гем. Гем представляет сложную плоскую циклическую систему, состоящую из центрального атома, образующего ординационные связи с 4 остатками пиррола, соединенными метиновыми мостиками
( =СН-). В гемоглобине железо обычно находится в состоянии окисления +2. Четыре альфа- субъединицы контактируют только с бета-субъединицами, и наоборот. Одна молекула гемоглобина способна переносить 4 молекулы кислорода. Связывание и освобождение кислорода сопровождается конформационными изменениями структуры альфа- и бета субъединиц гемоглобина и их взаимного расположения в эпимолекуле. Этот факт свидетельствует о том, что четвертичная структура белка не является абсолютно жесткой.
Характерное свойство белков с четвертичной структурой – отдельная субъединица не обладает биологической активностью.
Стабилизация четвертичной структуры белка происходит за счет полярных взаимодействий между радикалами R аминокислотных остатков, локализованных на поверхности субъединиц.
Участки субъединиц, на которых происходят взаимодействия, называют контактными площадками.
Классический пример белка, имеющего четвертичную структуру, является гемоглобин. М.М. молекулы гемоглобина 68000 Да, состоит из 4х субъединиц двух разных типов: a и b. Альфа-субъединица состоит из 141 аминокислотного остатка, бета-субъединица – из 146.
Каждая субъединица содержит простетическую группу – гем. Гем представляет сложную плоскую циклическую систему, состоящую из центрального атома, образующего ординационные связи с 4 остатками пиррола, соединенными метиновыми мостиками
( =СН-). В гемоглобине железо обычно находится в состоянии окисления +2. Четыре альфа- субъединицы контактируют только с бета-субъединицами, и наоборот. Одна молекула гемоглобина способна переносить 4 молекулы кислорода. Связывание и освобождение кислорода сопровождается конформационными изменениями структуры альфа- и бета субъединиц гемоглобина и их взаимного расположения в эпимолекуле. Этот факт свидетельствует о том, что четвертичная структура белка не является абсолютно жесткой.
Слайд 25КЛАССИФИКАЦИЯ БЕЛКОВ
Физико-химическая классификация
По электрохимическим признакам: кислые, основные, нейтральные
По полярным признакам:
Полярные
или гидрофильные (хорошо растворимы, содержат много полярных групп),
Неполярные или гидрофобные (почти нерастворимы, содержат много неполярных остатков),
Амфифильные (обладают двойственными признаками, одна часть молекулы полярна, а другая неполярна – мембранные белки).
Функциональная классификация
По структурным признакам:
Простые белки (протеины: гистоны, протамины, проламины, глютеины, альбумины и глобулины, протеноиды).
Сложные белки (протеиды)
По форме белковой молекулы
Фибриллярные (волокнистые)
Глобулярные (корпускулярные)
Неполярные или гидрофобные (почти нерастворимы, содержат много неполярных остатков),
Амфифильные (обладают двойственными признаками, одна часть молекулы полярна, а другая неполярна – мембранные белки).
Функциональная классификация
По структурным признакам:
Простые белки (протеины: гистоны, протамины, проламины, глютеины, альбумины и глобулины, протеноиды).
Сложные белки (протеиды)
По форме белковой молекулы
Фибриллярные (волокнистые)
Глобулярные (корпускулярные)
Слайд 27Функциональная классификация белков
Каталически активные белки (или ферменты) – осуществляют катализ практически
всех химических превращений в клетке
Белки-гормоны – регулируют обмен веществ внутри клеток и ингибируют обмен в различных клетках организма в целом.
Регуляторные белки – рецепторы избирательно связывают различные регуляторы (гормоны, медиаторы) на поверхности клеточных мембран.
Транспортные белки – осуществляют связывание и транспорт веществ между тканями и через мембраны клетки.
Структурные белки – это прежде всего белки, участвующие в построении различных биологических мембран.
Белки-ингибиторы ферментов – это многочисленная группа эндогенных ингибиторов, осуществляющих регуляцию активности ферментов.
Сократительные белки – группа белков, обеспечивающих механический процесс – сокращение с использованием химической энергии.
Токсичные белки – некоторые белки и пептиды, выделяемые организмами (змеи, пчелы, микроорганизмы), являющиеся ядовитыми для других живых организмов.
Защитные белки – антитела – это вещества белковой природы, вырабатываемые живым организмом в ответ на введение антигена. Антитела, взаимодействуя с антигенами, дезактивируют их и тем самым защищают организм от воздействия чужеродных соединений, вирусов, бактерий.
Белки-гормоны – регулируют обмен веществ внутри клеток и ингибируют обмен в различных клетках организма в целом.
Регуляторные белки – рецепторы избирательно связывают различные регуляторы (гормоны, медиаторы) на поверхности клеточных мембран.
Транспортные белки – осуществляют связывание и транспорт веществ между тканями и через мембраны клетки.
Структурные белки – это прежде всего белки, участвующие в построении различных биологических мембран.
Белки-ингибиторы ферментов – это многочисленная группа эндогенных ингибиторов, осуществляющих регуляцию активности ферментов.
Сократительные белки – группа белков, обеспечивающих механический процесс – сокращение с использованием химической энергии.
Токсичные белки – некоторые белки и пептиды, выделяемые организмами (змеи, пчелы, микроорганизмы), являющиеся ядовитыми для других живых организмов.
Защитные белки – антитела – это вещества белковой природы, вырабатываемые живым организмом в ответ на введение антигена. Антитела, взаимодействуя с антигенами, дезактивируют их и тем самым защищают организм от воздействия чужеродных соединений, вирусов, бактерий.
Слайд 28ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ
ФИЗИЧЕСКИЕ СВОЙСТВА БЕЛКОВ
Белки – кристаллические вещества, как правило, белого цвета (существуют и окрашенные белки, например гемоглобин)
Белки обладают кислотно-основными, буферными, коллоидными, осмотическими свойствами.
Кислотно-основные свойства белков
Белки являются амфотерными полиэлектролитами и сочетают в себе кислотные и основные свойства. Кислотно-основные свойства аминокислот обусловлены наличием а-амино- и а-карбоксильной групп.
Кислотные свойства белку придают кислые аминокислоты (аспаргиновая, глутаминовая, аминолимонная).
Щелочные свойства белку придают основные аминокислоты (лизин, аргинин, гистидин).
Буферные свойства белков
Белки хотя и обладают свойствами буфера, но емкость их при физиологических условиях рН ограничена. Исключение составляют белки , содержащие много гистидина, т.к. боковая группа гистидина обладает буферными свойствами в интервале значений рН, близких к физиологическим. Таких белков мало. Гемоглобин (чуть ли не единственный белок) содержит до 8% гистидина и является мощным внутриклеточным буфером в эритроцитах, поддерживая рН крови на постоянном уровне. Стабильность растворам белков придают заряд белковой молекулы и гидратная оболочка. Водородный показатель (рН) среды влияет на заряд белка и следовательно на его растворимость.
Значения рН среды, при котором белок имеет суммарный нулевой заряд, называется изоэлектрической точкой данного белка. Изоэлектрическая точка белка определяется соотношением кислотных и основных групп в радикалах R аминокислотных остатков. Усредненная изоэлектрическая точка всех белков цитоплазмы соответствует рН 5,5. Следовательно, при рН (7,0-7,4) клеточные белки имеют суммарный отрицательный заряд. Избыток отрицательных зарядов белков клетки уравновешивается неорганическими катионами. Знание изоэлектрической точки очень важно для понимания стабильности белков в растворах, т.к. в изоэлектрическом состоянии белки наименее устойчивы. Незаряженные частицы белка могут слипаться друг с другом и выпадать в осадок.
Белки – кристаллические вещества, как правило, белого цвета (существуют и окрашенные белки, например гемоглобин)
Белки обладают кислотно-основными, буферными, коллоидными, осмотическими свойствами.
Кислотно-основные свойства белков
Белки являются амфотерными полиэлектролитами и сочетают в себе кислотные и основные свойства. Кислотно-основные свойства аминокислот обусловлены наличием а-амино- и а-карбоксильной групп.
Кислотные свойства белку придают кислые аминокислоты (аспаргиновая, глутаминовая, аминолимонная).
Щелочные свойства белку придают основные аминокислоты (лизин, аргинин, гистидин).
Буферные свойства белков
Белки хотя и обладают свойствами буфера, но емкость их при физиологических условиях рН ограничена. Исключение составляют белки , содержащие много гистидина, т.к. боковая группа гистидина обладает буферными свойствами в интервале значений рН, близких к физиологическим. Таких белков мало. Гемоглобин (чуть ли не единственный белок) содержит до 8% гистидина и является мощным внутриклеточным буфером в эритроцитах, поддерживая рН крови на постоянном уровне. Стабильность растворам белков придают заряд белковой молекулы и гидратная оболочка. Водородный показатель (рН) среды влияет на заряд белка и следовательно на его растворимость.
Значения рН среды, при котором белок имеет суммарный нулевой заряд, называется изоэлектрической точкой данного белка. Изоэлектрическая точка белка определяется соотношением кислотных и основных групп в радикалах R аминокислотных остатков. Усредненная изоэлектрическая точка всех белков цитоплазмы соответствует рН 5,5. Следовательно, при рН (7,0-7,4) клеточные белки имеют суммарный отрицательный заряд. Избыток отрицательных зарядов белков клетки уравновешивается неорганическими катионами. Знание изоэлектрической точки очень важно для понимания стабильности белков в растворах, т.к. в изоэлектрическом состоянии белки наименее устойчивы. Незаряженные частицы белка могут слипаться друг с другом и выпадать в осадок.
Слайд 29Коллоидные и осмотические свойства белков
Водные растворы белков являются устойчивыми и равновесными
Водные
растворы белков со временем не выпадают в осадок (не коагулируют) и не требуют присутствия стабилизаторов.
Белковые растворы гомогенны.
Однако высокая молекулярная масса белков придает их растворам многие свойства коллоидных систем:
Характерные оптические свойства (опалесценция растворов и способность и способность их рассеивать лучи видимого света)
Малая скорость диффузии
Неспособность проникать через полупроницаемые мембраны – осмос (т.е. перемещение молекул воды через полупроницаемую мембрану в раствор белка). Давление или сила, которое следует приложить, чтобы остановить осмотический ток воды называется осмотическим давлением. Осмотическое давление обусловленное белком называется онкотическим давлением.
Высокая вязкость растворов.
Способность к образованию гелей.
Белки – гидрофильные вещества. При набухании белка молекулы воды проникают в белок и связываются с его полярными группами. Растворение связано с гидратацией, т.е. связыванием молекул воды с белками – это электростатическое связывание молекул воды с полярными группами боковых радикалов кислых аминокислот, несущих отрицательный заряд, и основных аминокислот, несущих положительный заряд.
Коагуляция – (от лат.coagulatio – свертывание, сгущение) – это укрупнение частиц в коллоидных системах, которое может сопровождаться образованием коагулянта (плотного сгустка).
Белковые растворы гомогенны.
Однако высокая молекулярная масса белков придает их растворам многие свойства коллоидных систем:
Характерные оптические свойства (опалесценция растворов и способность и способность их рассеивать лучи видимого света)
Малая скорость диффузии
Неспособность проникать через полупроницаемые мембраны – осмос (т.е. перемещение молекул воды через полупроницаемую мембрану в раствор белка). Давление или сила, которое следует приложить, чтобы остановить осмотический ток воды называется осмотическим давлением. Осмотическое давление обусловленное белком называется онкотическим давлением.
Высокая вязкость растворов.
Способность к образованию гелей.
Белки – гидрофильные вещества. При набухании белка молекулы воды проникают в белок и связываются с его полярными группами. Растворение связано с гидратацией, т.е. связыванием молекул воды с белками – это электростатическое связывание молекул воды с полярными группами боковых радикалов кислых аминокислот, несущих отрицательный заряд, и основных аминокислот, несущих положительный заряд.
Коагуляция – (от лат.coagulatio – свертывание, сгущение) – это укрупнение частиц в коллоидных системах, которое может сопровождаться образованием коагулянта (плотного сгустка).
Слайд 30Факторы, влияющие на растворимость белков
Растворимость разных белков колеблется в разных пределах
и определяется:
Аминокислотным составом белка (полярные аминокислоты придают большую растворимость, чем неполярные).
Особенностями организации (глобулярные белки лучше растворимы, чем фибриллярные).
Свойствами растворителя.
Стабильность растворам белков придают заряд белковой молекулы и гидратная оболочка.
Нейтральные соли в небольших концентрациях повышают растворимость даже тех белков, которые нерастворимы в чистой воде (ионы солей взаимодействуя с противоположно заряженными группами молекул белков разрушают солевые мостики между молекулами белков).
Растворимость и устойчивость белка будут минимальны при рН, соответствующем изоэлектрической точке белка. Снятие заряда позволяет молекулам белка легко сближаться, склеиваться и выпадать в осадок.
Строгой зависимости между температурой и характером растворимости не имеется.
Если в раствор кислого белка добавить основной белок, то они образуют агрегаты.
Высаливание
Процесс осаждения белков нейтральными солевыми растворами называется высаливанием. Характерной особенностью белков, полученных высаливанием, является сохранение ими нативных биологических свойств после удаления соли. Механизм высаливания состоит в том, что добавляемые анионы и катионы солевого раствора снимают гидратную оболочку белков, являющуюся одним из факторов его устойчивости.
Аминокислотным составом белка (полярные аминокислоты придают большую растворимость, чем неполярные).
Особенностями организации (глобулярные белки лучше растворимы, чем фибриллярные).
Свойствами растворителя.
Стабильность растворам белков придают заряд белковой молекулы и гидратная оболочка.
Нейтральные соли в небольших концентрациях повышают растворимость даже тех белков, которые нерастворимы в чистой воде (ионы солей взаимодействуя с противоположно заряженными группами молекул белков разрушают солевые мостики между молекулами белков).
Растворимость и устойчивость белка будут минимальны при рН, соответствующем изоэлектрической точке белка. Снятие заряда позволяет молекулам белка легко сближаться, склеиваться и выпадать в осадок.
Строгой зависимости между температурой и характером растворимости не имеется.
Если в раствор кислого белка добавить основной белок, то они образуют агрегаты.
Высаливание
Процесс осаждения белков нейтральными солевыми растворами называется высаливанием. Характерной особенностью белков, полученных высаливанием, является сохранение ими нативных биологических свойств после удаления соли. Механизм высаливания состоит в том, что добавляемые анионы и катионы солевого раствора снимают гидратную оболочку белков, являющуюся одним из факторов его устойчивости.
Слайд 31Денатурация и ренатурация белков
ДЕНАТУРАЦИЯ – это явление при действии различных веществ,
нарушающих высшие уровни организации белковой молекулы (вторичную, третичную, четвертичную) с сохранением первичной структуры, при котором белок теряет свои нативные физико-химические и биологические свойства. При этом теряется гидратная оболочка и белок выпадает в осадок.
ДЕНАТУРИРУЮЩИЕ ФАКТОРЫ
ФИЗИЧЕСКИЕ ХИМИЧЕСКИЕ
температура кислоты и щелочи
давление органические растворители (спирт, ацетон)
механическое давление детергены (моющие средства)
ультразвуковое излучение некоторые соли (мочевина, соли)
ионизирующее излучение алкалоиды
тяжелые металлы (соли ртути, меди, бария,
кадмия)
СВОЙСТВА ДЕНАТУРИРОВАННЫХ БЕЛКОВ
Увеличение числа реактивных или функциональных групп (СООН, NH2, SH, ОН).
Уменьшение растворимости и осаждения белка (связано с потерей гидратной оболочки, развертыванием молекулы белка с «обнажением» гидрофобных радикалов и нейтрализацией зарядов полярных групп).
Изменение конфигурации молекулы белка.
Потеря биологической активности, вызванная нарушением нативной структурной организации молекулы.
Более легкое расщепление протеолитическими ферментами по сравнению с нативным белком – переход компактной нативной структуры в развернутую рыхлую форму облегчает доступ ферментов к пептидным связям белка, которые они разрушают.
РЕНАТУРАЦИЯ – это процесс восстановления физико-химических и биологических свойств денатурированного белка.
ДЕНАТУРИРУЮЩИЕ ФАКТОРЫ
ФИЗИЧЕСКИЕ ХИМИЧЕСКИЕ
температура кислоты и щелочи
давление органические растворители (спирт, ацетон)
механическое давление детергены (моющие средства)
ультразвуковое излучение некоторые соли (мочевина, соли)
ионизирующее излучение алкалоиды
тяжелые металлы (соли ртути, меди, бария,
кадмия)
СВОЙСТВА ДЕНАТУРИРОВАННЫХ БЕЛКОВ
Увеличение числа реактивных или функциональных групп (СООН, NH2, SH, ОН).
Уменьшение растворимости и осаждения белка (связано с потерей гидратной оболочки, развертыванием молекулы белка с «обнажением» гидрофобных радикалов и нейтрализацией зарядов полярных групп).
Изменение конфигурации молекулы белка.
Потеря биологической активности, вызванная нарушением нативной структурной организации молекулы.
Более легкое расщепление протеолитическими ферментами по сравнению с нативным белком – переход компактной нативной структуры в развернутую рыхлую форму облегчает доступ ферментов к пептидным связям белка, которые они разрушают.
РЕНАТУРАЦИЯ – это процесс восстановления физико-химических и биологических свойств денатурированного белка.
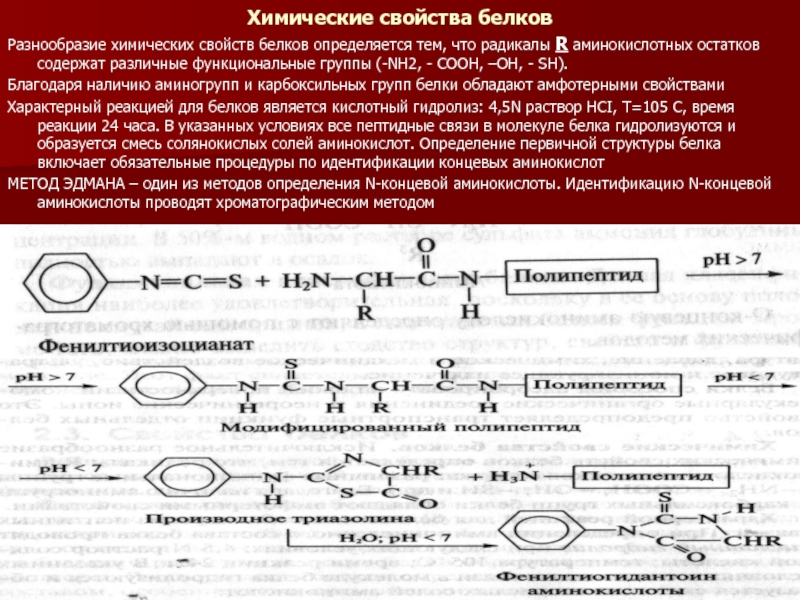
Слайд 32Химические свойства белков
Разнообразие химических свойств белков определяется тем, что радикалы R
аминокислотных остатков содержат различные функциональные группы (-NH2, - COOH, –OH, - SH).
Благодаря наличию аминогрупп и карбоксильных групп белки обладают амфотерными свойствами
Характерный реакцией для белков является кислотный гидролиз: 4,5N раствор HCI, T=105 C, время реакции 24 часа. В указанных условиях все пептидные связи в молекуле белка гидролизуются и образуется смесь солянокислых солей аминокислот. Определение первичной структуры белка включает обязательные процедуры по идентификации концевых аминокислот
МЕТОД ЭДМАНА – один из методов определения N-концевой аминокислоты. Идентификацию N-концевой аминокислоты проводят хроматографическим методом
Благодаря наличию аминогрупп и карбоксильных групп белки обладают амфотерными свойствами
Характерный реакцией для белков является кислотный гидролиз: 4,5N раствор HCI, T=105 C, время реакции 24 часа. В указанных условиях все пептидные связи в молекуле белка гидролизуются и образуется смесь солянокислых солей аминокислот. Определение первичной структуры белка включает обязательные процедуры по идентификации концевых аминокислот
МЕТОД ЭДМАНА – один из методов определения N-концевой аминокислоты. Идентификацию N-концевой аминокислоты проводят хроматографическим методом
Слайд 33
МЕТОД АКАБОРИ – позволяет определить С-концевую аминокислоту. Идентификацию С – концевой
аминокислоты определяют хроматографическим способом
Слайд 34БИОЛОГИЧЕСКИЕ СВОЙСТВА БЕЛКОВ
1.Ферментативная или каталическая –ускорение химических превращений.
2.Гормональная или регуляторная –
регуляция обмена веществ внутри клеток и интеграция обмена в разных клетках целого организма.
3.Рецепторная – избирательное связывание различных регуляторов (гормонов, медиаторов) на поверхности клеточных мембран или внутри клетки.
4.Транспортная – связывание и транспорт веществ между тканями и через мембраны клетки.
5.Структурная – участвуют в построении различных мембран.
6.Опорная или механическая – Обеспечивает прочность опорных тканей, участвуя в построении внеклеточных структур.
7.Резервная или трофическая – использование белков как запасного материала для питания развивающихся клеток.
8.Субстратно-энергетическая – белок используется как субстрат для образовании энергии.
9.Механохимическая или сократительная – сокращение с использованием химической энергии.
10.Элктроосмотическая – участие в образовании разницы электрических зарядов и градиента концентрации ионов на мембране.
11.Энерготрансформирующая – трансформация электрической и осмотической энергии в химическую энергию (АТФ).
12.Когенетическая – вспомогательная генетическая функция белков (ко – совместность действия).
13.Генно-регуляторная – способность некоторых белков участвовать в регуляции матричных функций нуклеиновых кислот и переноса генетической информации.
14.Иммунологическая или антитоксическая – антитела участвуют в обезвреживании чужеродных АГ
15.Обезвреживающая – связывают токсические соединения (тяжелые металлы, алкалоиды), обезвреживая их (альбумины).
16.Гемостатическая – участвуют в образовании тромба и остановке кровотечения (фибриноген).
3.Рецепторная – избирательное связывание различных регуляторов (гормонов, медиаторов) на поверхности клеточных мембран или внутри клетки.
4.Транспортная – связывание и транспорт веществ между тканями и через мембраны клетки.
5.Структурная – участвуют в построении различных мембран.
6.Опорная или механическая – Обеспечивает прочность опорных тканей, участвуя в построении внеклеточных структур.
7.Резервная или трофическая – использование белков как запасного материала для питания развивающихся клеток.
8.Субстратно-энергетическая – белок используется как субстрат для образовании энергии.
9.Механохимическая или сократительная – сокращение с использованием химической энергии.
10.Элктроосмотическая – участие в образовании разницы электрических зарядов и градиента концентрации ионов на мембране.
11.Энерготрансформирующая – трансформация электрической и осмотической энергии в химическую энергию (АТФ).
12.Когенетическая – вспомогательная генетическая функция белков (ко – совместность действия).
13.Генно-регуляторная – способность некоторых белков участвовать в регуляции матричных функций нуклеиновых кислот и переноса генетической информации.
14.Иммунологическая или антитоксическая – антитела участвуют в обезвреживании чужеродных АГ
15.Обезвреживающая – связывают токсические соединения (тяжелые металлы, алкалоиды), обезвреживая их (альбумины).
16.Гемостатическая – участвуют в образовании тромба и остановке кровотечения (фибриноген).
Слайд 35БЕЛКИ, УЧАСТВУЮЩИЕ В ОБЕПЕЧЕНИИ МЫШЕЧНОЙ РАБОТЫ
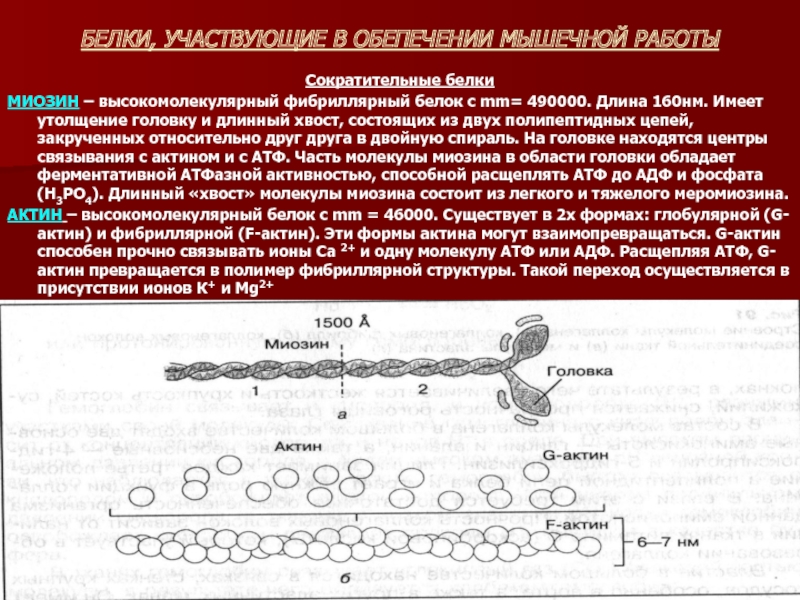
Сократительные белки
МИОЗИН – высокомолекулярный фибриллярный белок
с mm= 490000. Длина 160нм. Имеет утолщение головку и длинный хвост, состоящих из двух полипептидных цепей, закрученных относительно друг друга в двойную спираль. На головке находятся центры связывания с актином и с АТФ. Часть молекулы миозина в области головки обладает ферментативной АТФазной активностью, способной расщеплять АТФ до АДФ и фосфата (Н3РО4). Длинный «хвост» молекулы миозина состоит из легкого и тяжелого меромиозина.
АКТИН – высокомолекулярный белок с mm = 46000. Существует в 2х формах: глобулярной (G-актин) и фибриллярной (F-актин). Эти формы актина могут взаимопревращаться. G-актин способен прочно связывать ионы Са 2+ и одну молекулу АТФ или АДФ. Расщепляя АТФ, G-актин превращается в полимер фибриллярной структуры. Такой переход осуществляется в присутствии ионов К+ и Mg2+
АКТИН – высокомолекулярный белок с mm = 46000. Существует в 2х формах: глобулярной (G-актин) и фибриллярной (F-актин). Эти формы актина могут взаимопревращаться. G-актин способен прочно связывать ионы Са 2+ и одну молекулу АТФ или АДФ. Расщепляя АТФ, G-актин превращается в полимер фибриллярной структуры. Такой переход осуществляется в присутствии ионов К+ и Mg2+
Слайд 36БЕЛКИ СОЕДИНИТЕЛЬНОЙ ТКАНИ
Соединительная ткань (сухожилия, связки, органическая часть костей, хрящи, подкожная
клетчатка, роговица глаза и.т.д.) выполняет строительную и опорную функцию.
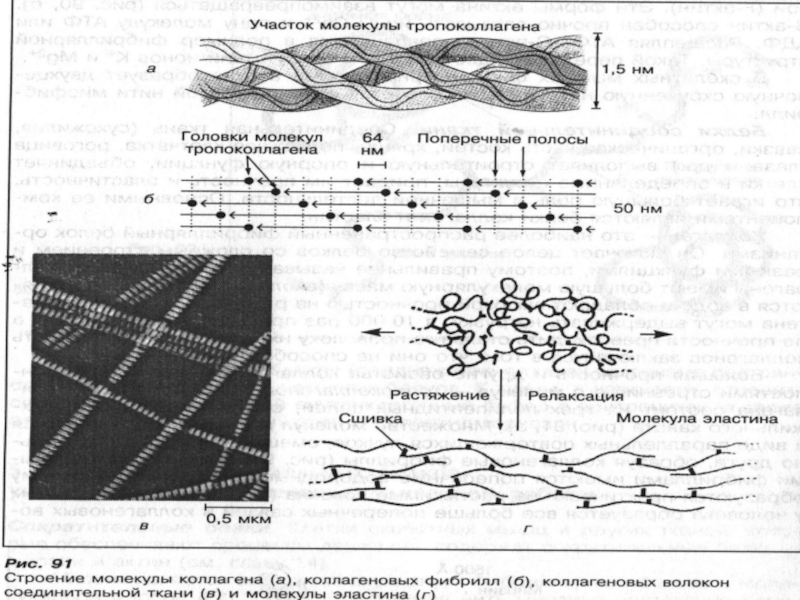
КОЛЛАГЕН – mm = 300000, не растворяется в воде и обладает высокой прочностью на разрыв. Особенность коллагенов – они не способны растягиваться. Каждая молекула коллагена состоит из трех полипептидных цепей, скрученных в виде трехжильного каната. Множество молекул коллагена объединяются в виде параллельных повторяющихся пучков, образуя фибриллы. Между отдельными фибриллами имеются поперечные водородные связи, благодаря чему образуются практически не растяжимые волокна. В состав молекулы коллагена в большом количестве входят две основные аминокислоты – глицин и аланин, а также 2 неосновные – 4-гидроксипролин и 5-гидроксилизин. Прочность коллагеновых волокон зависит от наличия в тканях витамина С, который участвует в образовании коллагена.
ЭЛАСТИН – в большом количестве находится в связках, стенках крупных сосудов, особенно в аорте, а также в других эластичных тканях. Mm – 72000. Фибриллы эластина состоят из субъединиц – тропоэластина, которые соединены между собой и образуют сеть, способную проявлять большую упругость. Участвует аминокислота – десмин. Благодаря такому строению эластиновые волокна могут растягиваться в несколько раз и возвращаться к исходной длине при снятии нагрузки
КОЛЛАГЕН – mm = 300000, не растворяется в воде и обладает высокой прочностью на разрыв. Особенность коллагенов – они не способны растягиваться. Каждая молекула коллагена состоит из трех полипептидных цепей, скрученных в виде трехжильного каната. Множество молекул коллагена объединяются в виде параллельных повторяющихся пучков, образуя фибриллы. Между отдельными фибриллами имеются поперечные водородные связи, благодаря чему образуются практически не растяжимые волокна. В состав молекулы коллагена в большом количестве входят две основные аминокислоты – глицин и аланин, а также 2 неосновные – 4-гидроксипролин и 5-гидроксилизин. Прочность коллагеновых волокон зависит от наличия в тканях витамина С, который участвует в образовании коллагена.
ЭЛАСТИН – в большом количестве находится в связках, стенках крупных сосудов, особенно в аорте, а также в других эластичных тканях. Mm – 72000. Фибриллы эластина состоят из субъединиц – тропоэластина, которые соединены между собой и образуют сеть, способную проявлять большую упругость. Участвует аминокислота – десмин. Благодаря такому строению эластиновые волокна могут растягиваться в несколько раз и возвращаться к исходной длине при снятии нагрузки
Слайд 38БЕЛКИ ПЕРЕНОСЧИКИ КИСЛОРОДА
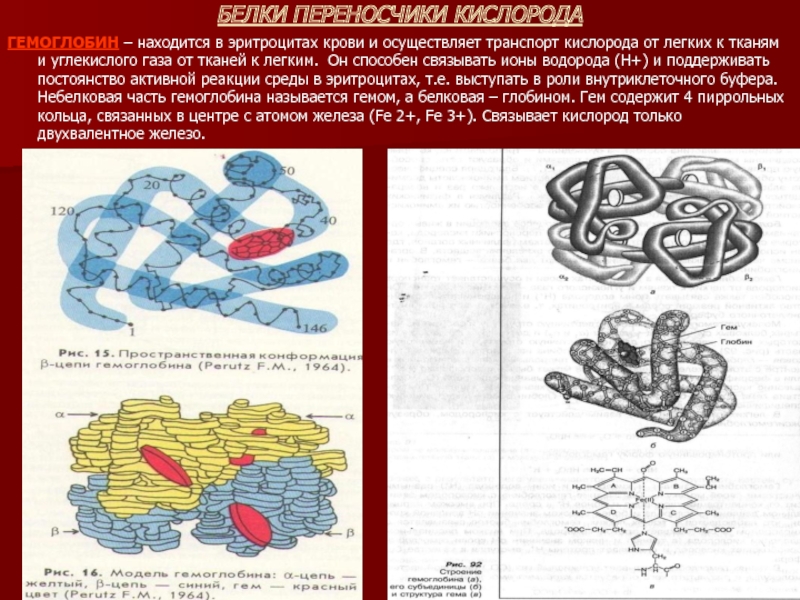
ГЕМОГЛОБИН – находится в эритроцитах крови и осуществляет транспорт
кислорода от легких к тканям и углекислого газа от тканей к легким. Он способен связывать ионы водорода (Н+) и поддерживать постоянство активной реакции среды в эритроцитах, т.е. выступать в роли внутриклеточного буфера. Небелковая часть гемоглобина называется гемом, а белковая – глобином. Гем содержит 4 пиррольных кольца, связанных в центре с атомом железа (Fe 2+, Fe 3+). Связывает кислород только двухвалентное железо.
Слайд 39
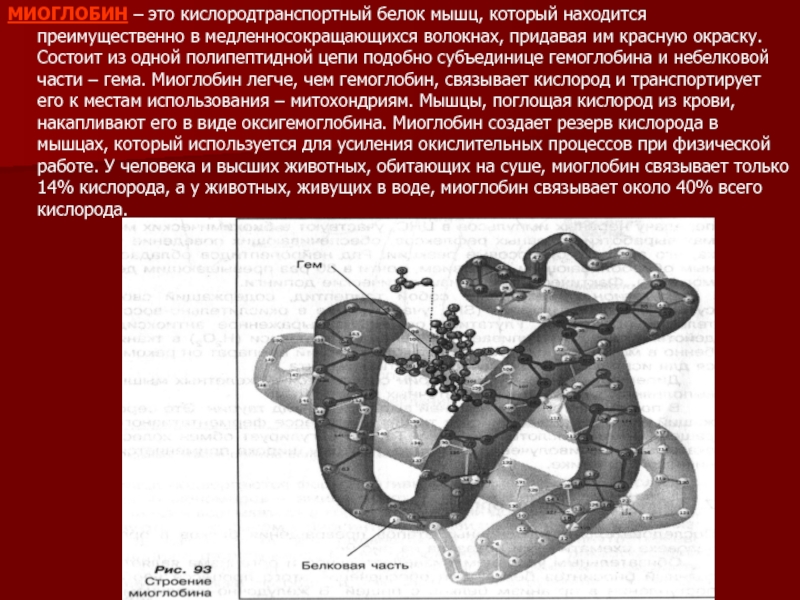
МИОГЛОБИН – это кислородтранспортный белок мышц, который находится преимущественно в медленносокращающихся
волокнах, придавая им красную окраску. Состоит из одной полипептидной цепи подобно субъединице гемоглобина и небелковой части – гема. Миоглобин легче, чем гемоглобин, связывает кислород и транспортирует его к местам использования – митохондриям. Мышцы, поглощая кислород из крови, накапливают его в виде оксигемоглобина. Миоглобин создает резерв кислорода в мышцах, который используется для усиления окислительных процессов при физической работе. У человека и высших животных, обитающих на суше, миоглобин связывает только 14% кислорода, а у животных, живущих в воде, миоглобин связывает около 40% всего кислорода.