- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Белки (или белковые вещества) презентация
Содержание
- 1. Белки (или белковые вещества)
- 2. Белки (или белковые вещества) составляют основу и
- 3. ФУНКЦИИ БЕЛКОВ это разносторонние роли белков в
- 4. ФУНКЦИИ БЕЛКОВ К главным, и в некотором
- 5. ФУНКЦИИ БЕЛКОВ СТРУКТУРНАЯ (ОПОРНАЯ) ФУНКЦИЯ Белки,
- 6. ФУНКЦИИ БЕЛКОВ ФЕРМЕНТАТИВНАЯ (КАТАЛИТИЧЕСКАЯ) ФУНКЦИЯ Все
- 7. ФУНКЦИИ БЕЛКОВ РЕЦЕПТОРНАЯ И ГОРМОНАЛЬНАЯ ФУНКЦИЯ
- 8. ФУНКЦИИ БЕЛКОВ ТРАНСПОРТНАЯ ФУНКЦИЯ Только белки
- 9. ФУНКЦИИ БЕЛКОВ РЕЗЕРВНАЯ (ПИТАТЕЛЬНАЯ) ФУНКЦИЯ Эту
- 10. ФУНКЦИИ БЕЛКОВ СОКРАТИТЕЛЬНАЯ ФУНКЦИЯ Существует ряд
- 11. ФУНКЦИИ БЕЛКОВ ЗАЩИТНАЯ ФУНКЦИЯ Защитную функцию,
- 12. ФУНКЦИИ БЕЛКОВ ФУНКЦИИ БЕЛКОВ КРОВИ Плазма
- 13. ФУНКЦИИ БЕЛКОВ ФУНКЦИИ БЕЛКОВ КРОВИ Белки
- 14. ФУНКЦИИ БЕЛКОВ ФУНКЦИИ БЕЛКОВ КРОВИ определяют
- 15. ФУНКЦИИ БЕЛКОВ НАРИСОВАТЬ СХЕМУ СТРУКТУРНАЯ (ОПОРНАЯ)
- 16. БЕЛКИ Белками, или белковыми веществами, называют высокомолекулярные
- 17. α-аминокислоты участвуют в синтезе белка.
- 23. Помимо наличия в большинстве природных белков двадцати
- 26. БЕЛКИ Структура белков очень сложная. Аминокислотные остатки
- 27. БЕЛКИ Следует отметить, что почти все α-аминокислоты
- 28. БЕЛКИ Отдельные пептидные цепи или их участки
- 29. БЕЛКИ Различают первичную, вторичную, третичную и четвертичную
- 30. БЕЛКИ Вторичная структура - конформация полипептидной цепи,
- 31. ФИЗИЧЕСКИЕ ПОКАЗАТЕЛИ Α-СПИРАЛИ
- 32. ФИЗИЧЕСКИЕ ПОКАЗАТЕЛИ Α-СПИРАЛИ
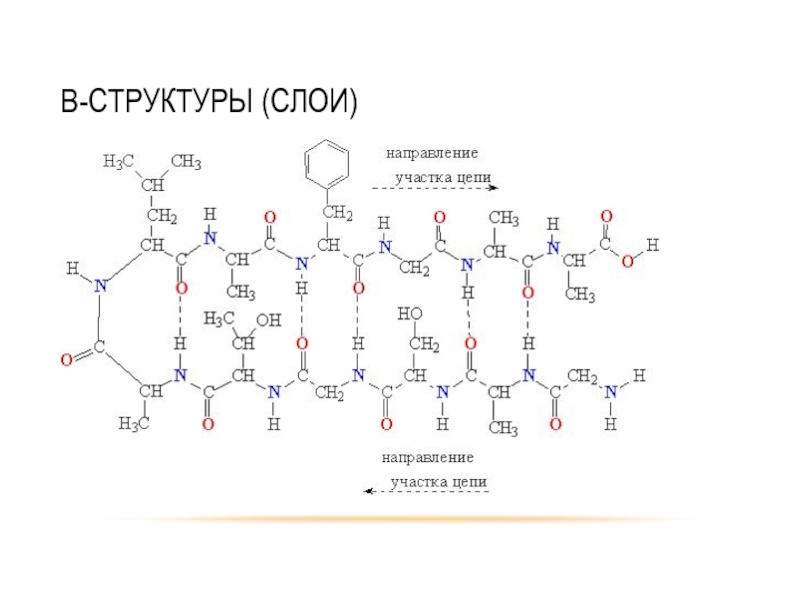
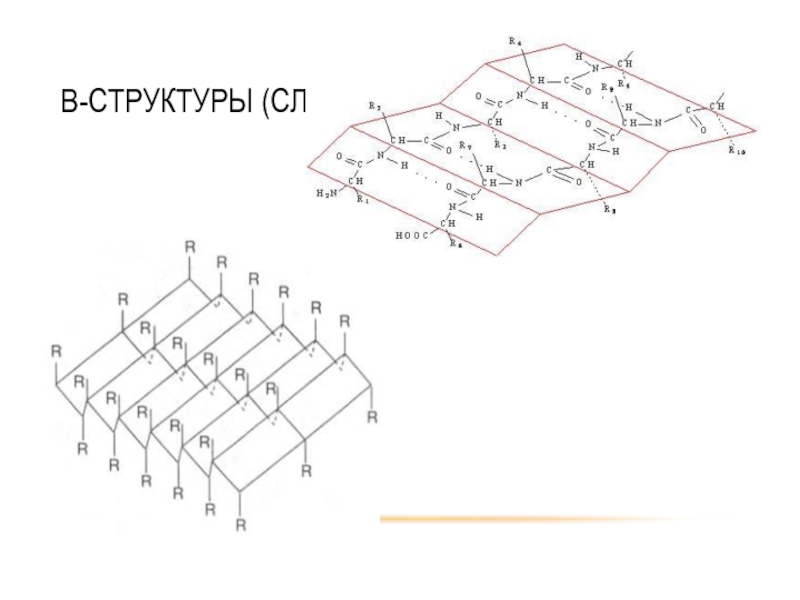
- 33. Β-СТРУКТУРЫ (СЛОИ)
- 34. Β-СТРУКТУРЫ (СЛОИ)
- 35. БЕЛКИ Третичная структура – это пространственное строение,
- 36. БЕЛКИ
- 37. СВЯЗИ, ПОДДЕРЖИВАЮЩИЕ ТРЕТИЧНУЮ СТРУКТУРУ БЕЛКОВОЙ МОЛЕКУЛЫ Ковалентные
- 38. 1 - ИОННЫЕ СВЯЗИ; 2 - ВОДОРОДНЫЕ
- 39. БЕЛКИ Четвертичная структура - агрегаты нескольких белковых макромолекул (белковые комплексы)
- 40. БЕЛКИ Все белки, независимо от того к
- 41. БЕЛКИ Глобулины – не растворимы в чистой
- 42. БЕЛКИ Пртеиды – сложные белки, в состав
- 43. ГОМОЛОГИЧЕСКИЙ РЯД
- 44. СПЕЦИФИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ Отношение к воде. Электролитическая
- 45. СПЕЦИФИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ Отношение к воде. Диаминомонокарбоновые кислоты (рН>7)
- 46. СПЕЦИФИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ Отношение к воде. Моноаминодикарбоновые кислоты (рН
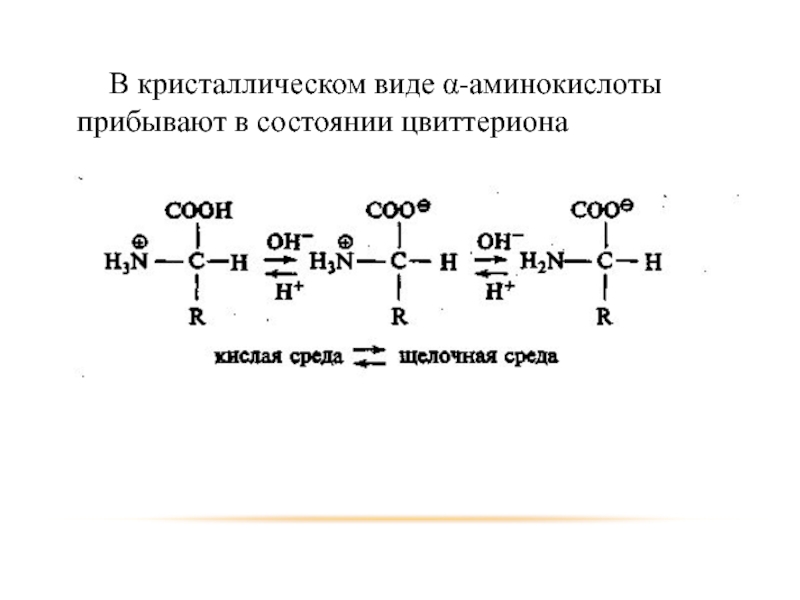
- 47. В кристаллическом виде α-аминокислоты прибывают в состоянии цвиттериона
- 48. Белок можно создать искусственно. Чтобы соединить две
Слайд 2 Белки (или белковые вещества) составляют основу и структуры и функции как
Соматропин – гормон роста, выделяемый гипофизом головного мозга.
Инсулин – гормон поджелудочной железы, ответственный за глюкозный обмен
Слайд 3ФУНКЦИИ БЕЛКОВ
это разносторонние роли белков в живом организме, решающей из которых
Слайд 4ФУНКЦИИ БЕЛКОВ
К главным, и в некотором смысле уникальным биологическим функциям белков,
Структурная (опорная) функция
Ферментативная (каталитическая) функция
Рецепторная и гормональная функция
Транспортная функция
Резервная (питательная) функция
Сократительная функция
Защитная функция
Функции белков крови
Слайд 5ФУНКЦИИ БЕЛКОВ
СТРУКТУРНАЯ (ОПОРНАЯ) ФУНКЦИЯ
Белки, выполняющие структурную функцию, преобладают среди других
Большое значение имеют комплексы белков с углеводородами в формировании ряда секретов: мукоидов, муцина и т.д. В комплексе с липидами (в частности, с фосфолипидами) белки участвуют в образовании биомембран клеток. Непосредственно участвуют в построении мембран и цитоскелета (интегральные, полуинтегральные и поверхностные белки) — спектрин (поверхностный, основной белок цитоскелета эритроцитов), гликофорин A (интегральный, фиксирует спектрин на поверхности). Также к данной функции можно отнести участие белка в создании таких органелл, как рибосомы.
Слайд 6ФУНКЦИИ БЕЛКОВ
ФЕРМЕНТАТИВНАЯ (КАТАЛИТИЧЕСКАЯ) ФУНКЦИЯ
Все ферменты являются белками, которые определяет скорость
Слайд 7ФУНКЦИИ БЕЛКОВ
РЕЦЕПТОРНАЯ И ГОРМОНАЛЬНАЯ ФУНКЦИЯ
Эта функция заключается в избирательном связывании
Слайд 8ФУНКЦИИ БЕЛКОВ
ТРАНСПОРТНАЯ ФУНКЦИЯ
Только белки осуществляют перенос веществ в крови, например, липопротеины (перенос
Транспорт веществ через мембраны осуществляют белки — Na+,К+-АТФаза (антинаправленный трансмембранный перенос ионов натрия и калия), Са2+-АТФаза (выкачивание ионов кальция из клетки), глюкозные транспортеры.
Слайд 9ФУНКЦИИ БЕЛКОВ
РЕЗЕРВНАЯ (ПИТАТЕЛЬНАЯ) ФУНКЦИЯ
Эту функцию выполняют так называемые резервные протеины.
Слайд 10ФУНКЦИИ БЕЛКОВ
СОКРАТИТЕЛЬНАЯ ФУНКЦИЯ
Существует ряд внутриклеточных белков, предназначенных для изменения формы
Слайд 11ФУНКЦИИ БЕЛКОВ
ЗАЩИТНАЯ ФУНКЦИЯ
Защитную функцию, предупреждая инфекционный процесс и сохраняя устойчивость
Слайд 12ФУНКЦИИ БЕЛКОВ
ФУНКЦИИ БЕЛКОВ КРОВИ
Плазма крови человека в норме содержит более 100
В регуляции содержания белков плазмы на определенном уровне большое значение имеет печень, которая полностью синтезирует фибриноген и альбумины крови, большую часть α- и β-глобулинов, клетки ретикулоэндотелиальной системы костного мозга и лимфатических узлов.
Слайд 13ФУНКЦИИ БЕЛКОВ
ФУНКЦИИ БЕЛКОВ КРОВИ
Белки плазмы крови выполняют несколько важных функций:
поддерживают
Белковая буферная система участвует в поддержании кислотно-основного состояния — альбумины, гемоглобин;
удерживают в связанном состоянии и транспортируют ионы кальция, магния, железа, меди и другие ионы, препятствуя их потере с мочой — альбумины и специфические транспортные белки;
связывают и транспортируют органические вещества (углеводы, липиды, гормоны, лекарства, витамины, токсины) — альбумины и другие белки;
Слайд 14ФУНКЦИИ БЕЛКОВ
ФУНКЦИИ БЕЛКОВ КРОВИ
определяют вязкость крови и сохраняют устойчивость эритроцитов
являются резервом аминокислот;
специализированные белки, участвующие в свертывании крови (фибриноген, протромбин, антигемофильный глобулин и др.);
обеспечивают иммунную защиту организма — иммуноглобулины, факторы системы комплемента, трансферрин и пропердин;
обеспечивают неспецифическую защиту организма при повреждении тканей — белки острой фазы.
Слайд 15ФУНКЦИИ БЕЛКОВ НАРИСОВАТЬ СХЕМУ СТРУКТУРНАЯ (ОПОРНАЯ) ФУНКЦИЯ ФЕРМЕНТАТИВНАЯ (КАТАЛИТИЧЕСКАЯ) ФУНКЦИЯ РЕЦЕПТОРНАЯ
Слайд 16БЕЛКИ
Белками, или белковыми веществами, называют высокомолекулярные органические соединения, молекулы которых построены
Белки можно рассматривать как биополимеры. Эти полимеры не регулярны по своему составу.
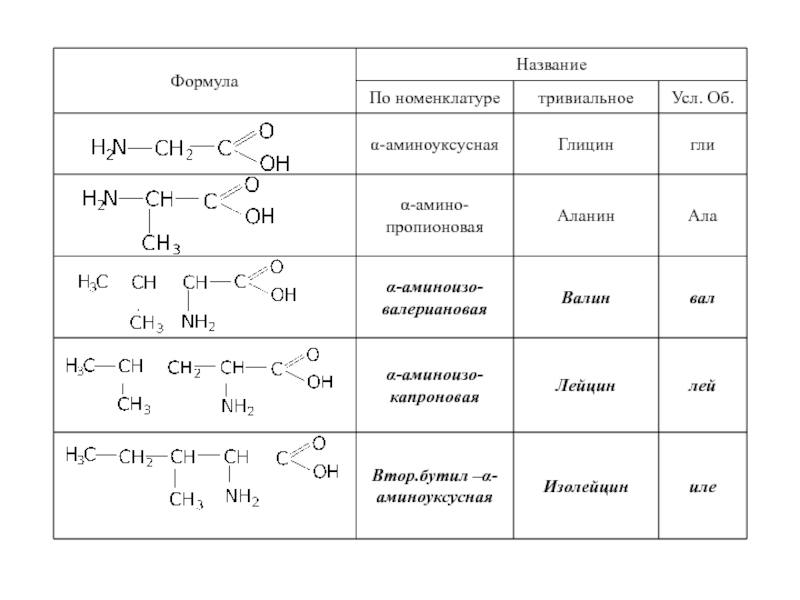
Слайд 17 α-аминокислоты участвуют в синтезе белка.
В состав белковых тел входят
По своей значимости для организма все аминокислоты делятся на:
Заменимые (синтезируются в организме)
Не заменимые (запас пополняется только с пищей)
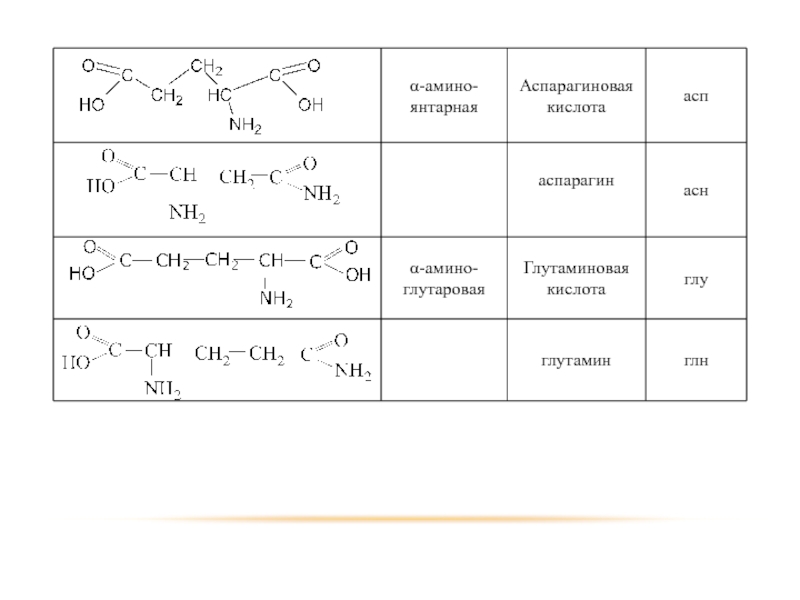
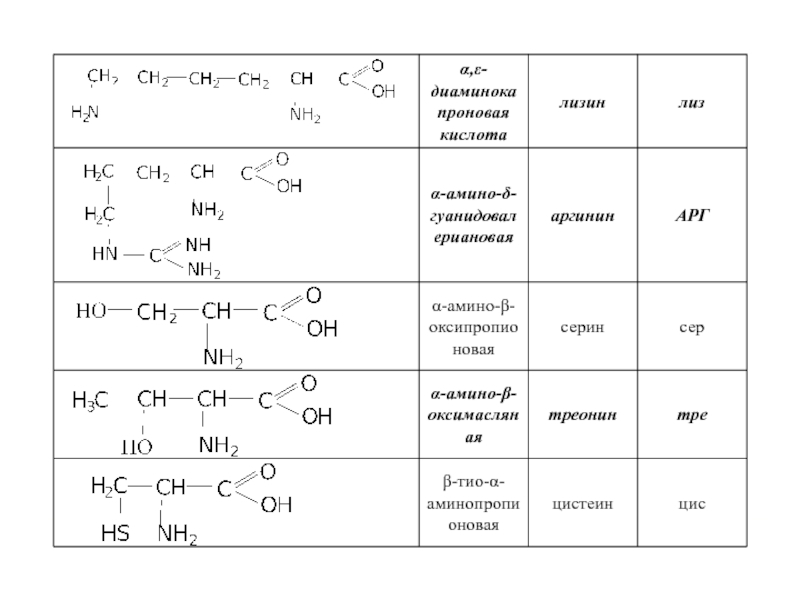
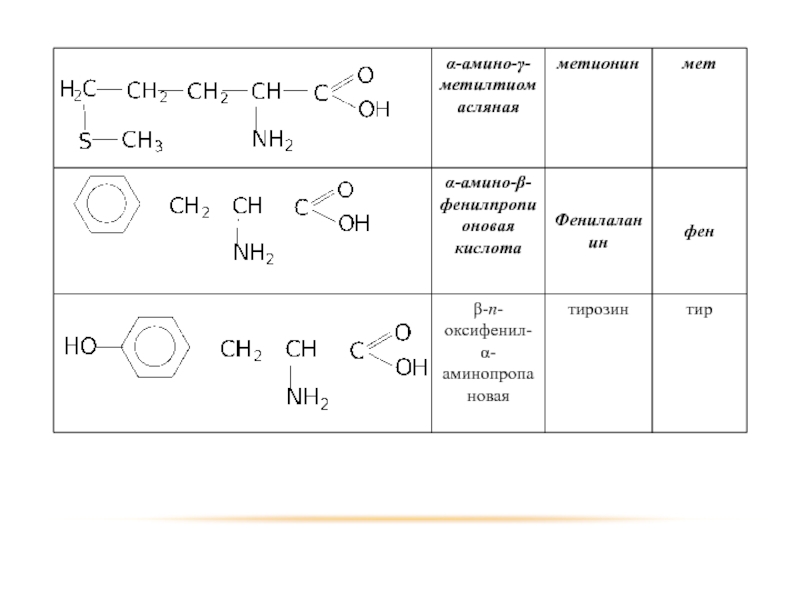
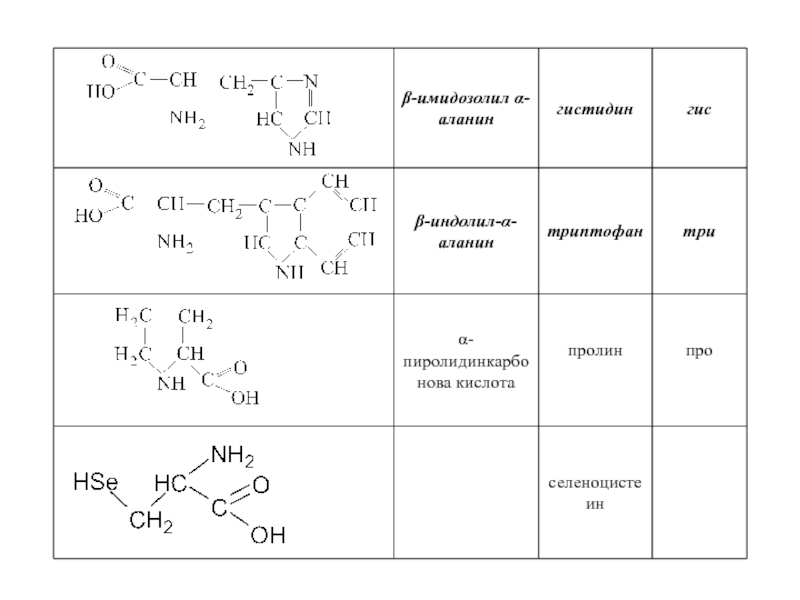
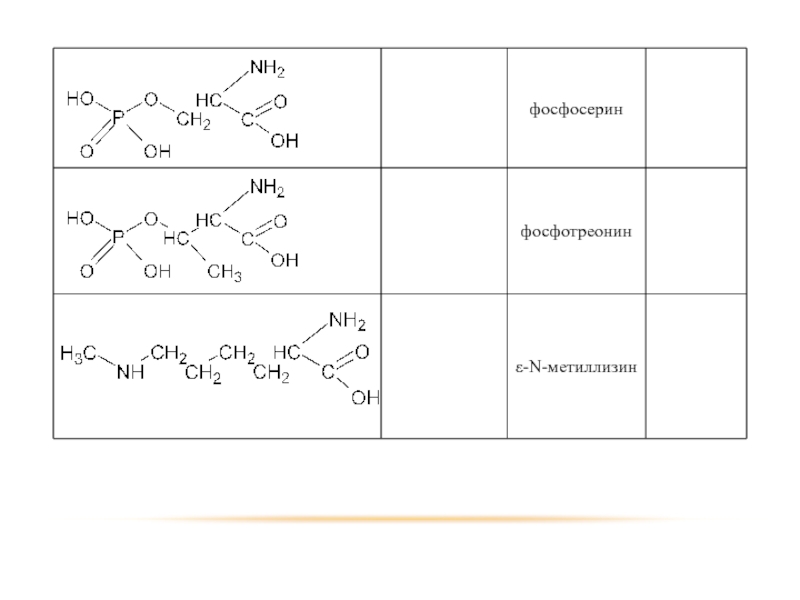
Слайд 23 Помимо наличия в большинстве природных белков двадцати аминокислот, в некоторых белках
- Оксипролин и оксилизин содержатся в белке соединительной ткани коллагене;
Дийодтирозин является основой структуры гормонов щетовидной железы:
Фосфосерин и фосфотреонин входят в состав сложных белков – фосфопротеинов;
ε-N-метиллизин обнаружен в составе мышечного белка – миозина.
Кроме того в состав некоторых белков типа кератина входит цистин.
Слайд 26БЕЛКИ
Структура белков очень сложная. Аминокислотные остатки в молекуле белка связаны пептидными
Слайд 27БЕЛКИ
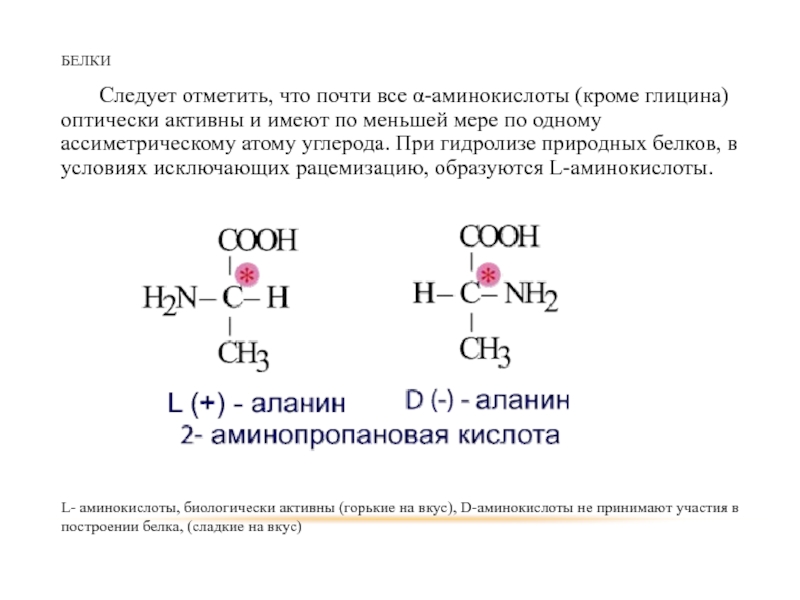
Следует отметить, что почти все α-аминокислоты (кроме глицина) оптически активны и
L- аминокислоты, биологически активны (горькие на вкус), D-аминокислоты не принимают участия в построении белка, (сладкие на вкус)
Слайд 28БЕЛКИ
Отдельные пептидные цепи или их участки могут быть связаны между собой
Солевые связи образуются между свободными аминогруппами (например, концевая аминогруппа, расположенная на одном конце полипептидной цепи или ε-аминогруппа лизина) и свободными карбоксильными группами (концевая карбоксильная группа цепи или свободные карбоксильные группы двухосновных аминокислот);
Водородные связи могут возникать между атомом кислорода карбонильной группы и атомом водорода аминогруппы, а также за счет гидроксогрупп оксиаминокислот и кислорода пептидных групп.
Слайд 29БЕЛКИ
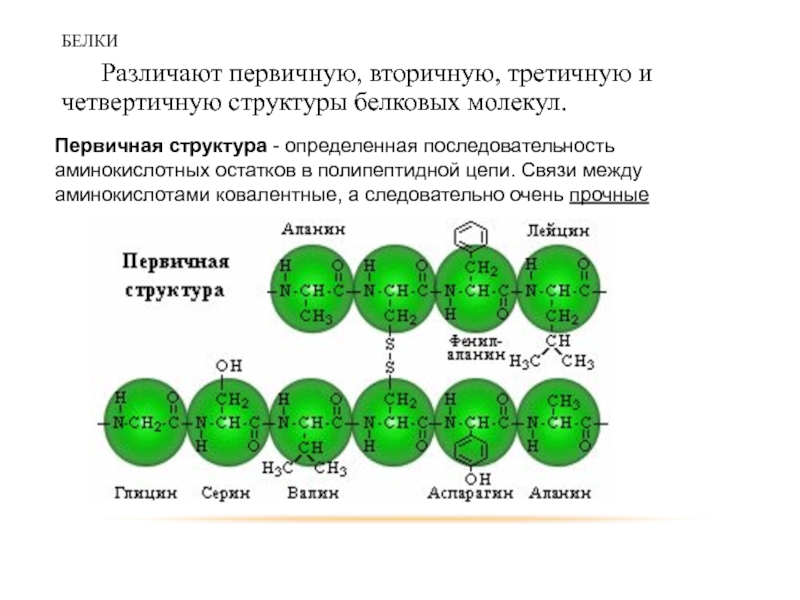
Различают первичную, вторичную, третичную и четвертичную структуры белковых молекул.
Первичная структура -
Слайд 30БЕЛКИ
Вторичная структура - конформация полипептидной цепи, закрепленная множеством водородных связей между
Модели вторичной структуры - a-спираль (левозакрученные и правозакрученные), а также β-листы.
Слайд 35БЕЛКИ
Третичная структура – это пространственное строение, включая конформацию, всей молекулы белка,
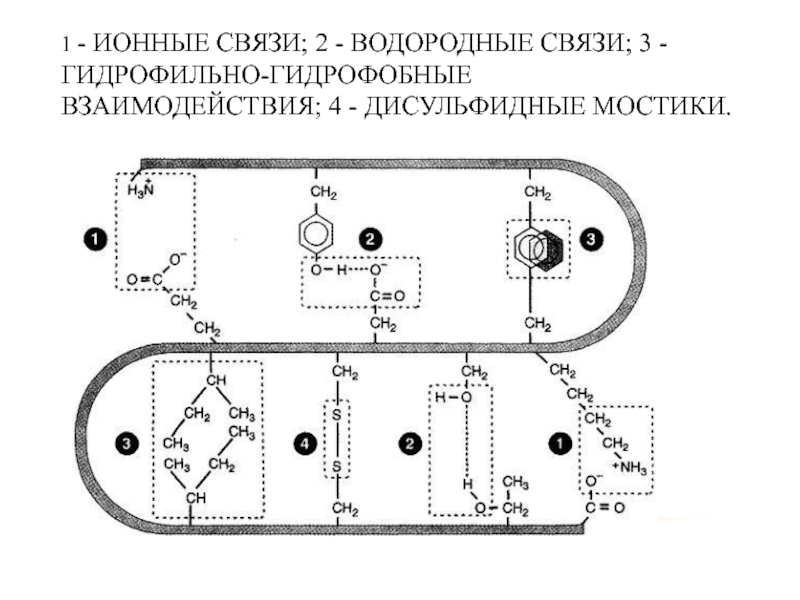
Слайд 37СВЯЗИ, ПОДДЕРЖИВАЮЩИЕ ТРЕТИЧНУЮ СТРУКТУРУ БЕЛКОВОЙ МОЛЕКУЛЫ
Ковалентные связи между двумя остатками цистеина
Ионные связи между противоположно заряженными боковыми группами аминокислотных остатков;
Водородные связи;
Гидрофильно-гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула «стремится» свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированными от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
Слайд 381 - ИОННЫЕ СВЯЗИ; 2 - ВОДОРОДНЫЕ СВЯЗИ; 3 - ГИДРОФИЛЬНО-ГИДРОФОБНЫЕ
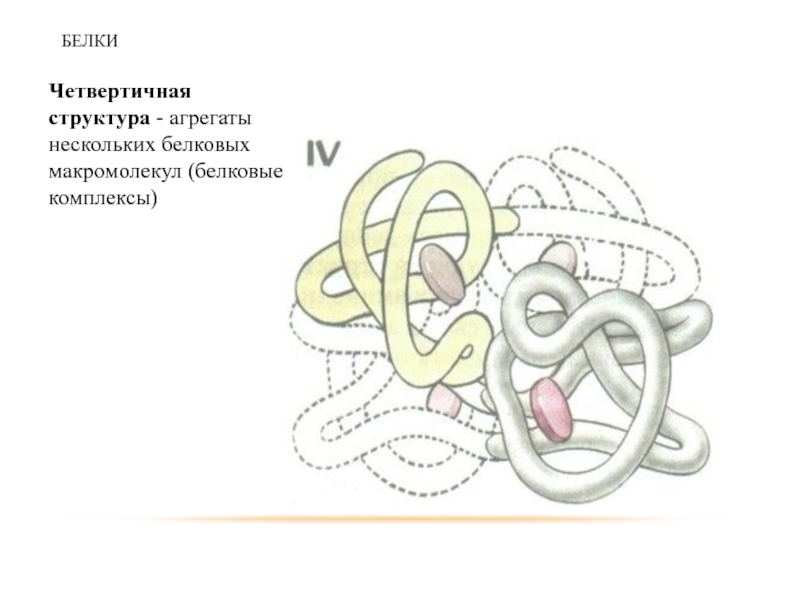
Слайд 39БЕЛКИ
Четвертичная структура - агрегаты нескольких белковых макромолекул (белковые комплексы)
Слайд 40БЕЛКИ
Все белки, независимо от того к какой группе они относятся и
Белки подразделяют на протеины и протеиды.
Протеины – простые белки, состоящие только из остатков аминокислот.
Альбумины – обладают сравнительно небольшой молекулярной массой, хорошо растворимы в воде, при нагревании свертываются.
Слайд 41БЕЛКИ
Глобулины – не растворимы в чистой воде, но растворимы в теплом
Проламины – незначительно растворимы в воде, но растворимы в 60÷80%-ном водном этиловом спирте.
Глютелины – растворимы только в 0,2%-ной щелочи.
Протамины – совершенно не содержат серы.
Пртеиноиды – нерастворимые белки.
Фосфопротеины – содержат фосфорную кислоту (козеин).
Слайд 42БЕЛКИ
Пртеиды – сложные белки, в состав которых наряду с аминокислотами входят
Липопротеиды – гидролизуются на простой белок и липиды. (зерна хлорофила, протоплазма клеток).
Гликопротеиды – гидролизуются на простые белки и высокомолекулярные углеводы. (слизистые выделения животных).
Хромопротеиды – гидролизуются на простые белки и красящие вещества (гемоглобин)
Нуклеопротеиды – гидролизуются на простые белки (обычно протамины) и нуклеиновые кислоты
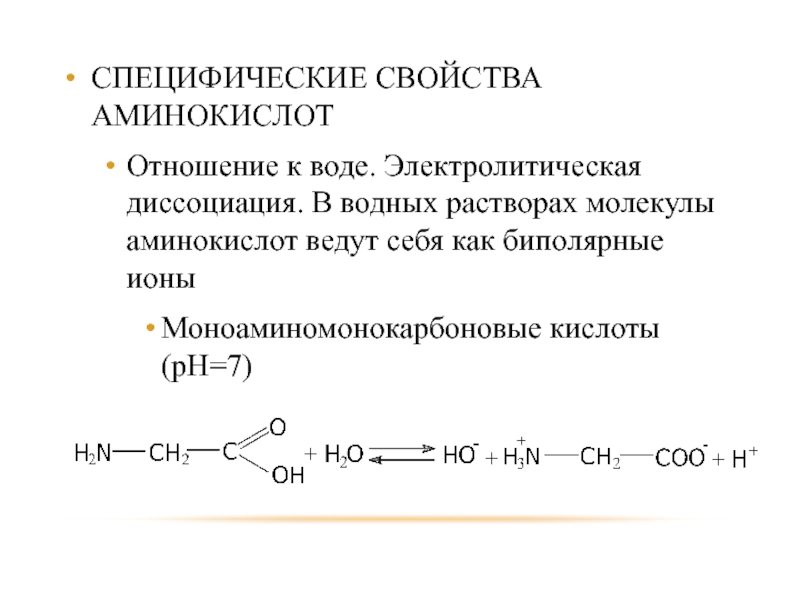
Слайд 44СПЕЦИФИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ
Отношение к воде. Электролитическая диссоциация. В водных растворах молекулы
Моноаминомонокарбоновые кислоты (рН=7)