- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Белки презентация
Содержание
- 1. Белки
- 2. Белками, или белковыми веществами, называют высокомолекулярные
- 3. Антуан Франсуа де Фуркруа Белки были выведены
- 4. Голландский химик Геррит Мульдер
- 5. Термин «протеин» для обозначения подобных
- 6. В XXI веке исследование белков перешло на
- 7. Сравнительный размер белков. Слева направо: антитело (IgG),
- 8. каталитические (ферменты); регуляторные (гормоны);
- 9. Белки – основа биомембран, важнейшей составной части
- 10. Химический состав организма человека ВОДА
- 11. К концу XIX века было исследовано большинство
- 12. Аминокислоты, их строение и свойства
- 13. Аминокислоты, их строение и свойства Благодаря взаимодействию
- 14. Большую роль в создании структуры белков играют
- 15. В начале XX века немецкий химик Эмиль
- 16. Однако центральная роль белков в организмах не
- 17. Лайнус Полинг считается первым учёным, который смог
- 18. Последовательность соединения аминокислотных остатков в полипептидной
- 19. Полипептидные цепочки с определённой вторичной
- 20. В ряде случаев отдельные субъединицы белка с
- 21. В 1949 году Фред
- 22. Характеристика трёх структур белковых молекул Пептидная связь
- 23. Существует несколько классификаций белков. В их основе
- 24. Белки – амфотерные электролиты. При определённом значении
- 25. Процесс гидратации означает связывание белками воды, при
- 26. При денатурации под влиянием внешних факторов (температуры,
- 27. Под процессом пенообразования понимают способность белков образовывать
- 28. Реакцию гидролиза с образованием аминокислот в общем виде можно записать так: Гидролиз белков
- 29. Белки горят с образованием азота, углекислого газа
- 30. Ход работы Добавляют к 5
- 32. Функции белков в организме Каталитическая Структурная Защитная Регуляторная Сигнальная Транспортная Запасная Рецепторная Моторная
- 33. Ноначастицы из белковых оболочек вируса
- 34. Гидрофобы (гидрофобные вещества) Вещества, плохо
- 35. Макроэлементы Элементы, количество которых составляет до
- 36. Буферность Способность поддерживать относительно постоянную концентрацию ионов
- 37. Полисахариды Углеводы, являющиеся полимерами и состоящие из
- 38. Липопротеиды Сложные соединения липидов с белками. Выполняют строительную функцию.
- 39. Проверь себя 1. Главным носителем жизни являются
- 40. 5. Многие белки растворимы в …,
- 41. КРИТЕРИИ ОЦЕНКИ:
- 42. ОТВЕТЫ: 1. Белки. 2. Белки;
- 43. 6.Ткани живых организмов: кожа, сухожилия,
- 44. Денатурация Необратимая денатурация белка куриного
Слайд 2 Белками, или белковыми веществами, называют высокомолекулярные (молекулярная масса варьирует
Слайд 3Антуан Франсуа де Фуркруа
Белки были выведены в отдельный класс биологических молекул
Слайд 4 Голландский химик Геррит Мульдер провёл анализ состава белков
Мульдер также определил продукты разрушения белков — аминокислоты и для одной из них (лейцина) с малой долей погрешности определил молекулярную массу — 131 дальтон. В 1836 Мульдер предложил первую модель химического строения белков. Основываясь на теории радикалов он сформулировал понятие о минимальной структурной единице состава белка, C16H24N4O5, которая была названа «протеин», а теория — «теорией протеина»[5]. По мере накопления новых данных о белках теория стала неоднократно подвергаться критике, но до конца 1850-х несмотря на критику ещё считалась общепризнанной.
Слайд 5 Термин «протеин» для обозначения подобных молекул был предложен в
Слайд 6В XXI веке исследование белков перешло на качественно новый уровень, когда
Кристаллы различных белков, выращенные на космической станции «Мир» и во время полётов шаттлов НАСА. Высокоочищенные белки при низкой температуре образуют кристаллы, которые используют для получения модели данного белка
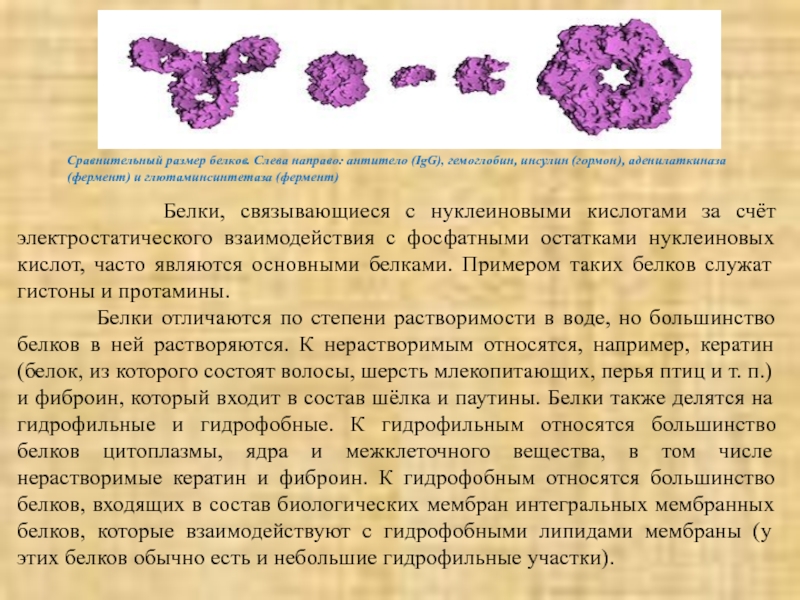
Слайд 7Сравнительный размер белков. Слева направо: антитело (IgG), гемоглобин, инсулин (гормон), аденилаткиназа
Белки, связывающиеся с нуклеиновыми кислотами за счёт электростатического взаимодействия с фосфатными остатками нуклеиновых кислот, часто являются основными белками. Примером таких белков служат гистоны и протамины.
Белки отличаются по степени растворимости в воде, но большинство белков в ней растворяются. К нерастворимым относятся, например, кератин (белок, из которого состоят волосы, шерсть млекопитающих, перья птиц и т. п.) и фиброин, который входит в состав шёлка и паутины. Белки также делятся на гидрофильные и гидрофобные. К гидрофильным относятся большинство белков цитоплазмы, ядра и межклеточного вещества, в том числе нерастворимые кератин и фиброин. К гидрофобным относятся большинство белков, входящих в состав биологических мембран интегральных мембранных белков, которые взаимодействуют с гидрофобными липидами мембраны (у этих белков обычно есть и небольшие гидрофильные участки).
Слайд 8 каталитические (ферменты);
регуляторные (гормоны);
структурные (коллаген, фиброин);
двигательные (миозин);
транспортные
защитные (иммуноглобулины, интерферон);
запасные (казеин, альбумин, глиадин).
Среди белков встречаются антибиотики и вещества, оказывающие токсическое действие.
Биологические функции белков
Слайд 9Белки – основа биомембран, важнейшей составной части клетки и клеточных компонентов.
Исключительное свойство белка – самоорганизация структуры, т.е. его способность самопроизвольно создавать определённую, свойственную только данному белку пространственную структуру. По существу, вся деятельность организма (развитие, движение, выполнение им различных функций и многое другое) связана с белковыми веществами. Без белков невозможно представить себе жизнь.
Белки - важнейшая составная часть пищи человека и животных, поставщик необходимых им аминокислот.
Слайд 10Химический состав организма человека
ВОДА – 65%
ЖИРЫ – 10%
УГЛЕВОДЫ – 5%
Другие неорганические
и органические вещества – 2%
Слайд 11К концу XIX века было исследовано большинство аминокислот, которые входят в
В 1894 году немецкий физиолог Альбрехт Коссель выдвинул теорию, согласно которой именно аминокислоты являются основными структурными элементами белков
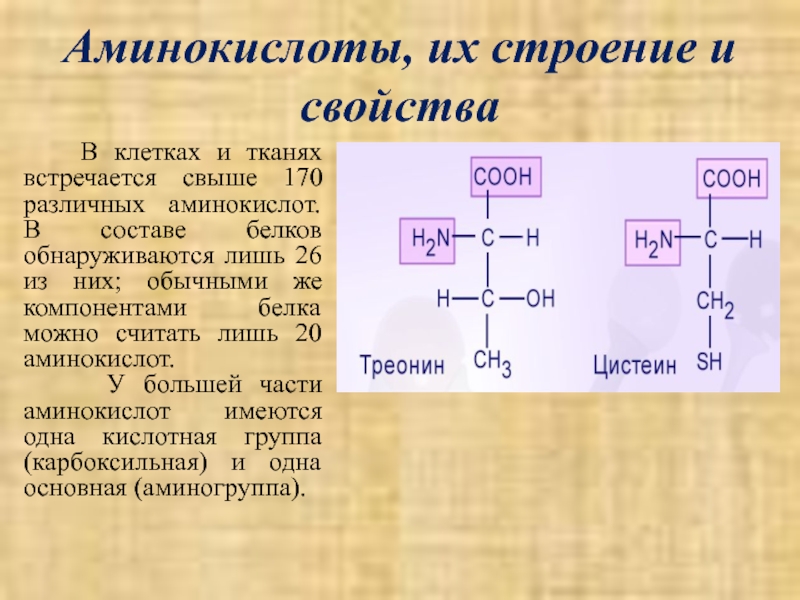
Слайд 12Аминокислоты, их строение и свойства
В клетках и тканях встречается
У большей части аминокислот имеются одна кислотная группа (карбоксильная) и одна основная (аминогруппа).
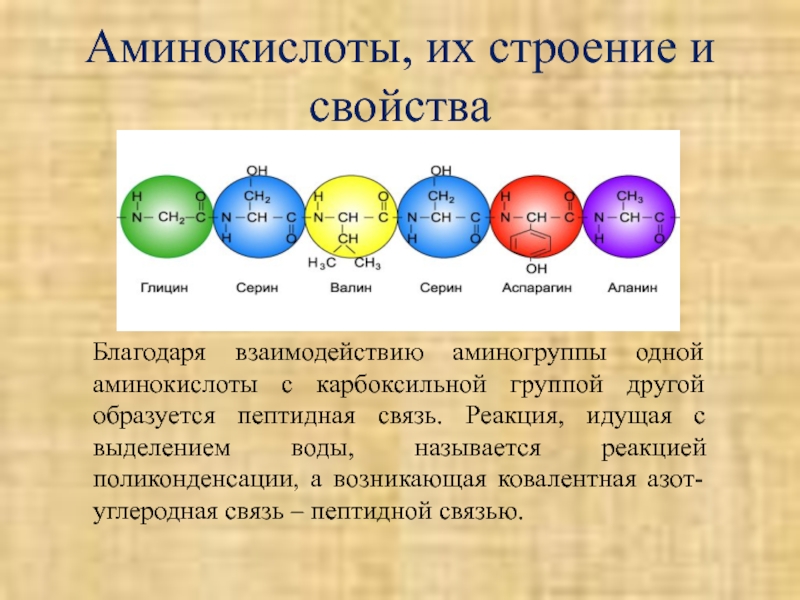
Слайд 13Аминокислоты, их строение и свойства
Благодаря взаимодействию аминогруппы одной аминокислоты с карбоксильной
Слайд 14Большую роль в создании структуры белков играют ионные (солевые) и водородные
Несмотря на различие в строении и функциях белковых веществ, их элементный состав колеблется незначительно (в % на сухую массу):
углерода-51-53; кислорода-21,5-23,5;
азота-16,8-18,4; водорода-6,5-7,3;
серы-0,3-2,5
Некоторые белки содержат в небольших количествах фосфор, селен и другие элементы.
Слайд 15В начале XX века немецкий химик Эмиль Фишер экспериментально доказал, что
Слайд 16Однако центральная роль белков в организмах не была признана до 1926
Сложность выделения чистых белков затрудняла их изучение. Поэтому первые исследования проводились с использованием тех полипептидов, которые могли быть очищены в большом количестве, то есть белков крови, куриных яиц, различных токсинов, а также пищеварительных/метаболических ферментов, выделяемых после забоя скота. В конце 1950-х годов компания Armour Hot Dog Co. смогла очистить килограмм бычьей панкреатической рибонуклеазы А, которая стала экспериментальным объектом для многих учёных.
Слайд 17Лайнус Полинг считается первым учёным, который смог успешно предсказать вторичную структуру
Идея о том, что вторичная структура белков — результат образования водородных связей между аминокислотами, была высказана Уильямом Астбери в 1933 году,
Позднее Уолтер Каузман, опираясь на работы Кая Линдерстрём-Ланга, внёс весомый вклад в понимание законов образования третичной структуры белков и роли в этом процессе гидрофобных взаимодействий.
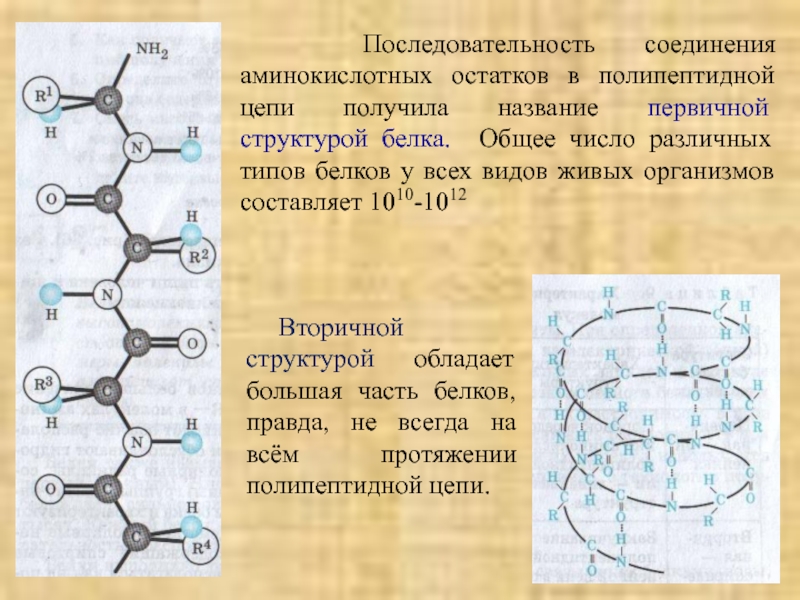
Слайд 18 Последовательность соединения аминокислотных остатков в полипептидной цепи получила название первичной
Вторичной структурой обладает большая часть белков, правда, не всегда на всём протяжении полипептидной цепи.
Слайд 19 Полипептидные цепочки с определённой вторичной структурой могут быть по-разному
Это пространственное расположение получило название третичной структуры.
В формировании третичной структуры, кроме водородных связей, большую роль играет ионное и гидрофобное взаимодействие. По характеры «упаковки» белковой молекулы различают глобулярные, или шаровидные, и фибриллярные, или нитевидные, белки.
Слайд 20В ряде случаев отдельные субъединицы белка с помощью водородных связей, электростатического
Однако следует ещё раз отметить, что в организации более высоких структур белка исключительная роль принадлежит первичной структуре.
С3022Н4816О872N780S8Fe4
Мr = 66552
Белок вируса желтухи
Слайд 21 В 1949 году Фред Сенгер определил аминокислотную последовательность
Слайд 23Существует несколько классификаций белков. В их основе лежат разные признаки:
Степень сложности
Форма молекул (глобулярные и фибриллярные белки);
Растворимость в отдельных растворителях (водорастворимые, растворимые в разбавленных солевых растворах – альбумины, спирторастворимые – проламины, растворимые в разбавленных щелочах и кислотах – глутелины);
Выполняемая функция (например, запасные белки, скелетные и т.п.).
Классификация
Слайд 24Белки – амфотерные электролиты. При определённом значении рН среды (она называется
Свойства
Слайд 25Процесс гидратации означает связывание белками воды, при этом они проявляют гидрофильные
При ограниченном набухании концентрированные белковые растворы образуют сложные системы, называемые студнями. Студни не текучи, упруги, обладают пластичностью, определенной механической прочностью, способны сохранять свою форму. Глобулярные белки могут полностью гидратироваться, растворяясь в воде (например, белки молока), образуя растворы с невысокой концентрацией.
Гидрофильность белков зерна и муки играет большую роль при хранении и переработке зерна, в хлебопечении. Тесто, которое получают в хлебопекарном производстве, представляет собой набухший в воде белок, концентрированный студень, содержащий зёрна крахмала.
Гидратация
Слайд 26При денатурации под влиянием внешних факторов (температуры, механического воздействия, действия химических
Денатурация белков
Необратимая денатурация белка куриного яйца
под воздействием высокой температуры
В пищевой технологии особое практическое значение имеет тепловая денатурация белков, степень которой зависит от температуры, продолжительности нагревания и влажности.
Денатурация белков может вызываться и механическим воздействием (давлением, растиранием, встряхиванием, ультразвуком). Наконец, к денатурации белков приводит действие химических реагентов (кислот, щелочей, спирта, ацетона). Все эти приёмы широко используются в пищевой промышленности и и биотехнологии.
Слайд 27Под процессом пенообразования понимают способность белков образовывать высококонцентрированные системы «жидкость –газ»,
Пенообразование
Для пищевой промышленности можно выделить два очень важных процесса:
1) Гидролиз белков под действием ферментов;
2) Взаимодействие аминогрупп белков или аминокислот с карбонильными группами восстанавливающих сахаров.
Скорость гидролиза белка зависит от его состава, молекулярной структуры, активности фермента и условий.
Слайд 28Реакцию гидролиза с образованием аминокислот в общем виде можно записать так:
Гидролиз белков
Слайд 29Белки горят с образованием азота, углекислого газа и воды, а также
Горение
Цветные реакции
Используют следующие реакции:
ксантопротеиновую, при которой происходит взаимодействие ароматических и гетероатомных циклов в молекуле белка с концентрированной азотной кислотой, сопровождающееся появлением жёлтой окраски;
биуретовую, при которой происходит взаимодействие слабощелочных растворов белков с раствором сульфата меди(II) с образованием комплексных соединений между ионами Cu2+ и полипептидами. Реакция сопровождается появлением фиолетово-синей окраски.
Слайд 30
Ход работы
Добавляют к 5 каплям разбавленного раствора яичного белка 5 капель
Наблюдения
При нагревании до кипения появляется сине-фиолетовое окрашивание.
Вывод: при гидролизе белков образуется А-аминокислота, которая взаимодействует с нингидрином.
1. Биуретовая реакция на пептидную связь
Ход работы
Помещают в пробирку 5 капель разбавленного раствора белка, добавляют 3 капли 10 %-ного раствора NaOH и 1 каплю 1 %-ного раствора CuS04. Все перемешивают.
Наблюдения
Появляется сине-фиолетовое окрашивание.
Уравнения:
ПРИГОТОВЛЕНИЕ РАСТВОРОВ БЕЛКОВ ДЛЯ ПРОВЕДЕНИЯ КАЧЕСТВЕННЫХ РЕАКЦИЙ
1. Приготовление неразбавленного белка куриного яйца
Отделяют белок трех куриных яиц от желтков. Считая, что средняя масса белка в одном яйце равна 33 г (желтка — 19 г), получают примерно 100 мл неразбавленного белка куриного яйца. Он содержит 88 % воды, 1 % углеводородов и 0,5 % минеральных веществ, остальное приходится на белок. Таким образом, получен неразбавленный белок куриного яйца, который представляет собой 10 %-ный раствор белка.
2. Приготовление разбавленного раствора яичного альбумина
Отделяют белок одного куриного яйца от желтка, хорошо его взбивают и затем смешивают в колбе при встряхивании с 10-кратным объемом дистиллированной воды. Раствор фильтруют через двойной слой марли, смоченной водой. Фильтрат содержит раствор яичного альбумина, а яичный глобулин остается в осадке. Получают 0,5 %-ный раствор яичного альбумина.
ЦВЕТНЫЕ РЕАКЦИИ НА БЕЛКИ
Эти реакции применяют для установления белковой природы вещества, идентификации белков и определения их аминокислотного состава в различных биологических жидкостях.
2. Нингидриновая реакция
Вывод: биуретовая реакция — качественная на пептидную связь в белке. В ее основе лежит способность пептидной связи образовывать с CuS04 в щелочной среде окрашенные комплексные соединения.
Слайд 31
3. Ксантопротеиновая реакция
Ход работы Добавляют к 5 каплям разбавленного раствора яичного
Наблюдения
После нагревания окраска раствора становится бледно-желтой, а после охлаждения и добавления раствора NaOH — желто-оранжевой.
Уравнение:
Вывод: ксантопротеиновая реакция позволяет обнаруживать в белке аминокислоты, имеющие в своем составе бензельное кольцо (триптофан, фенил ал анин, тирозин).
4. Реакция Адамкевича
Ход работы Помещают в пробирку 5 капель неразбавленного белка и 2 мл ледяной СН3СООН. Слегка нагревают до растворения образовавшегося осадка. Охлаждают пробирку со смесью. Осторожно по стенке пробирки приливают 1 мл концентрированной H2S04 так, чтобы жидкости не смешались.
Наблюдения
При добавлении в пробирку уксусной кислоты образуется осадок, который при нагревании растворяется.
При добавлении в пробирку концентрированной серной кислоты на границе двух жидкостей появляется красно-фиолетовое кольцо.
Уравнения:
Вывод: реакция Адамкевича — качественная на триптофан, так как последний в кислой среде взаимодействует с
глиоксиловой кислотой, присутствующей в СН3СООН в виде примеси.
5. Реакция
с пикриновой кислотой
Ход работы
Добавляют к 10 каплям разбавленного раствора белка несколько кристаллов Na2C03 и 5 капель насыщенного водного раствора пикриновой кислоты, перемешивают и нагревают в пламени спиртовки до изменения желтой окраски раствора на красную.
Наблюдения
После добавления пикриновой кислоты раствор окрашивается в желтый цвет, а после нагревания окраска изменяется на красную.
Уравнение:
Вывод: реакция с пикриновой кислотой позволяет обнаружить соединения, обладающие восстановительной способностью (основана на восстановлении пикриновой кислоты в пикраминовую за счет дикетопиперазиновых группировок).
6. Реакция Фоля
Ход работы Добавляют к 10 каплям неразбавленного белка 20 капель 30 %-ного раствора NaOH, несколько капель (СН3СОО)2РЬ и кипятят смесь (осторожно: жидкость выбрасывается!). Выделяющийся аммиак обнаруживают влажной лакмусовой бумажкой.
Наблюдения
Неразбавленный белок дает с NaOH оранжевое окрашивание, при добавлении (СН3СОО)2РЬ и нагревании оно переходит в черное. Лакмус синеет.
Слайд 32Функции белков в организме
Каталитическая
Структурная
Защитная
Регуляторная
Сигнальная
Транспортная
Запасная
Рецепторная
Моторная
Слайд 34Гидрофобы
(гидрофобные вещества)
Вещества, плохо или вовсе нерастворимые в воде (от греч.
Слайд 35Макроэлементы
Элементы, количество которых составляет до 0,001% от массы тела (кислород, углерод,
Слайд 36Буферность
Способность поддерживать относительно постоянную концентрацию ионов водорода в растворе.
Определяется ионами (фосфатная
Слайд 37Полисахариды
Углеводы, являющиеся полимерами и состоящие из неопределенно большого (до нескольких сотен
Слайд 39Проверь себя
1. Главным носителем жизни являются …
2. … - это
3. Элементный состав белков: … .
4. Молекулярная масса белков изменяется от … до … .
Слайд 40
5. Многие белки растворимы в …, почти все растворяются в …
6. Нерастворимы белки, из которых построены … .
7. В структуре белка различают … структуры.
8. Функции белков в организме … .
Слайд 41КРИТЕРИИ ОЦЕНКИ:
«5» - все ответы правильные;
«3» - 3 неверных ответа; «2» - 4 и более неверных ответов.
Исправление приравнивается к ошибке.
Слайд 42ОТВЕТЫ:
1. Белки.
2. Белки; остатков α – аминокислот.
3. С, Н,
4. Десятки тысяч, миллионов.
5. Воде, растворах солей, кислот; щелочах.
Слайд 43
6.Ткани живых организмов: кожа, сухожилия, мышцы, ногти, волосы.
7.Первичную, вторичную, третичную, четвертичную.
8.Строительная,
Слайд 44Денатурация
Необратимая денатурация белка куриного яйца под воздействием высокой температуры
Основная статья:
Как правило, белки сохраняют структуру и, следовательно, физико-химические свойства, например, растворимость в условиях, таких как температура и pH, к которым приспособлен данный организм[7]. Резкое изменение этих условий, например, нагревание или обработка белка кислотой или щёлочью приводит к потере четвертичной, третичной и вторичной структур белка, называемой денатурацией. Самый известный случай денатурации белка в быту — это приготовление куриного яйца, когда под воздействием высокой температуры растворимый в воде прозрачный белок овальбумин становится плотным, нерастворимым и непрозрачным. Денатурация в некоторых случаях обратима, как в случае осаждения (преципитации) водорастворимых белков с помощью солей аммония, и используется как способ их очистки[11].
Простые и сложные белки
Основные статьи: Простые белки, Сложные белки
В состав многих белков помимо пептидных цепей входят и неаминокислотные фрагменты, по этому критерию белки делят на две большие группы — простые и сложные белки (протеиды). Простые белки содержат только аминокислотные цепи, сложные белки содержат также неаминокислотные фрагменты. Эти фрагменты небелковой природы в составе сложных белков называются «простетическими группами». В зависимости от химической природы простатических групп среди сложных белков выделяют следующие классы:
Гликопротеиды, содержащие в качестве простатической группы ковалентно связанные углеводные остатки и их подкласс — протеогликаны, с мукополисахаридными простетическими группами. В образованию связи с углеводными остатками обычно участвуют гидроксильные группы серина или треонина. Большая часть внеклеточных белков, в частности, иммуноглобулины — гликопротеиды. В протеогликанах углеводная часть составляет ~95 %, они являются основным компонентом межклеточного матрикса.
Липопротеиды, содержащие в качестве простатической части нековалентно связанные липиды. Липопротеиды, образованные белками-аполипопротеинами связывающимися с ними липидами и выполняют функцию транспорта липидов.
Металлопротеиды, содержащие негемовые координационно связанные ионы металлов. Среди металлопротеидов есть белки, выполняющие депонирующие и транспортные функции (например, железосодержащие ферритин и трансферрин) и ферменты (например, цинксодержащая карбоангидраза и различные супероксиддисмутазы, содержащие в качестве активных центров ионы меди, марганца, железа и других металлов)
Нуклеопротеиды, содержащие нековалентно связанные ДНК или РНК, в частности, хроматин, из которого состоят хромосомы, является нуклеопротеидом.
Фосфопротеиды, содержащие в качестве простетической группы ковалентно связанные остатки фосфорной кислоты. В образованию сложноэфирной связи с фосфатом участвуют гидроксильные группы серина или треонина, фосфопротеинами являются, в частности, казеин молока.
Хромопротеиды — собирательное название сложных белков с окрашенными простетическими группами различной химической природы. К ним относятся множество белков с металлсодержащей порфириновой простетической группой, выполняющие разнообразные функции — гемопротеины (белки содержащие в качестве простетической группы гем — гемоглобин, цитохромы и др.), хлорофиллы; флавопротеиды с флавиновой группой, и др.
Необратимая денатурация белка куриного яйца
под воздействием высокой температуры