- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Анализ степени структурной и функциональной однотипности поливалентного ингибитора протеаз, содержащегося в поджелудочной железе животных, и соевого ингибитора трипсина презентация
Содержание
- 1. Анализ степени структурной и функциональной однотипности поливалентного ингибитора протеаз, содержащегося в поджелудочной железе животных, и соевого ингибитора трипсина
- 2. Протеолиз лежит в основе регуляции важных
- 3. ЦЕЛЬ – анализ степени структурной гомологии
- 4. Итоги проекта по отделу ЭЛЕКТРОННЫЕ БАЗЫ ДАННЫХ
- 5. ОПРЕДЕЛЕНИЕ СТЕПЕНИ ГОМОЛОГИИ ИНГИБИТОРОВ Рис. 1. Результат
- 6. ОПРЕДЕЛЕНИЕ СПЕКТРА БИОЛОГИЧЕСКОЙ АКТИВНОСТИ Программа показала 4
- 7. Рис. 4. Электронные трехмерные третичные структуры апротинина и СИТ.
- 8. ОПРЕДЕЛЕНИЕ ТРИПСИН-ИНГИБИТОРНОЙ АКТИВНОСТИ АПРОТИНИНА И СИТ
- 9. Табл. 1. Влияние апротинина, СИТ и трипсина
- 10. Табл. 2. Влияние апротинина, СИТ и трипсина
- 11. ИССЛЕДОВАНИЕ ГЕМОЛИТИЧЕСКОЙ АКТИВНОСТИ КОМПЛЕМЕНТА Рис. 7.
- 12. ИССЛЕДОВАНИЕ ВЛИЯНИЯ ПРИЕМА ИЗОЛЯТА СОЕВОГО БЕЛКА НА
- 13. ВЫВОДЫ 1) Первичные структуры и спектры биологической
Слайд 1АНАЛИЗ СТЕПЕНИ СТРУКТУРНОЙ И ФУНКЦИОНАЛЬНОЙ ОДНОТИПНОСТИ ПОЛИВАЛЕНТНОГО ИНГИБИТОРА ПРОТЕАЗ, СОДЕРЖАЩЕГОСЯ В
Слайд 2
Протеолиз лежит в основе регуляции важных физиологических процессов организма. Протеолиз осуществляется
Слайд 3 ЦЕЛЬ – анализ степени структурной гомологии и функциональной однотипности апротинина
ЗАДАЧИ:
1) Методами биоинформатики установить степень структурной гомологии, спектр биологической активности и потенциальные молекулы-мишени апротинина и СИТ среди протеаз человека.
2) Определить трипсин-ингибиторную активность апротинина и СИТ в опытах in vitro.
3) Изучить влияние апротинина и СИТ на свертывание крови (протромбиновое время, активированное частичное тромбопластиновое время и тромбиновое время).
4) Определить влияние апротинина и СИТ на фибринолиз (определение времени фибринолиза).
5) Сравнить влияние апротинина и СИТ на агрегацию тромбоцитов (скорость и степень агрегации).
6) Проанализировать влияние апротинина и СИТ на функциональное состояние системы комплемента (гемолитическая активность).
7) Изучить влияние приема изолята соевого белка, содержащего соевый ингибитор трипсина, на общую протеолитическую и трипсин-ингибиторную активности в сыворотке крови людей.
Слайд 4Итоги проекта по отделу
ЭЛЕКТРОННЫЕ БАЗЫ ДАННЫХ БЕЛКОВ
Из 49 просмотренных баз данных
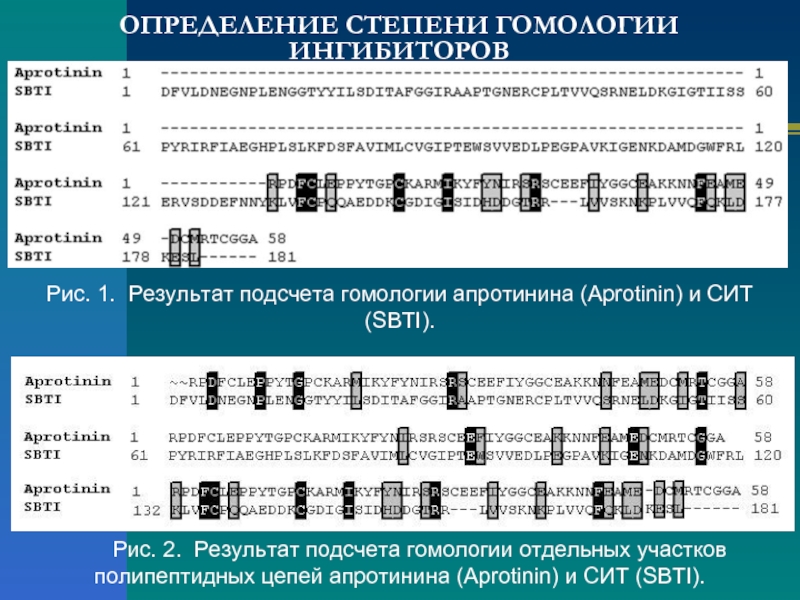
Слайд 5ОПРЕДЕЛЕНИЕ СТЕПЕНИ ГОМОЛОГИИ ИНГИБИТОРОВ
Рис. 1. Результат подсчета гомологии апротинина (Aprotinin) и
Рис. 2. Результат подсчета гомологии отдельных участков полипептидных цепей апротинина (Aprotinin) и СИТ (SBTI).
Слайд 6ОПРЕДЕЛЕНИЕ СПЕКТРА БИОЛОГИЧЕСКОЙ АКТИВНОСТИ
Программа показала 4 вида активности для апротинина и
Произвести поиск молекул-мишеней для исследуемых ингибиторов методами биоинформатики не удалось, по причине отсутствия в свободном доступе необходимых программ.
Рис. 3. Результат определения биологической активности апротинина и СИТ.
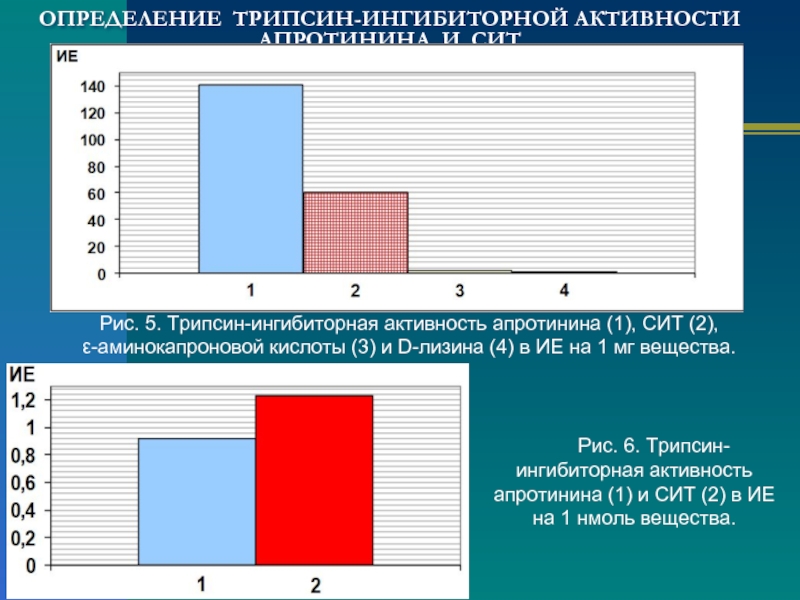
Слайд 8ОПРЕДЕЛЕНИЕ ТРИПСИН-ИНГИБИТОРНОЙ АКТИВНОСТИ АПРОТИНИНА И СИТ
Рис. 5. Трипсин-ингибиторная активность апротинина (1),
Рис. 6. Трипсин-ингибиторная активность апротинина (1) и СИТ (2) в ИЕ на 1 нмоль вещества.
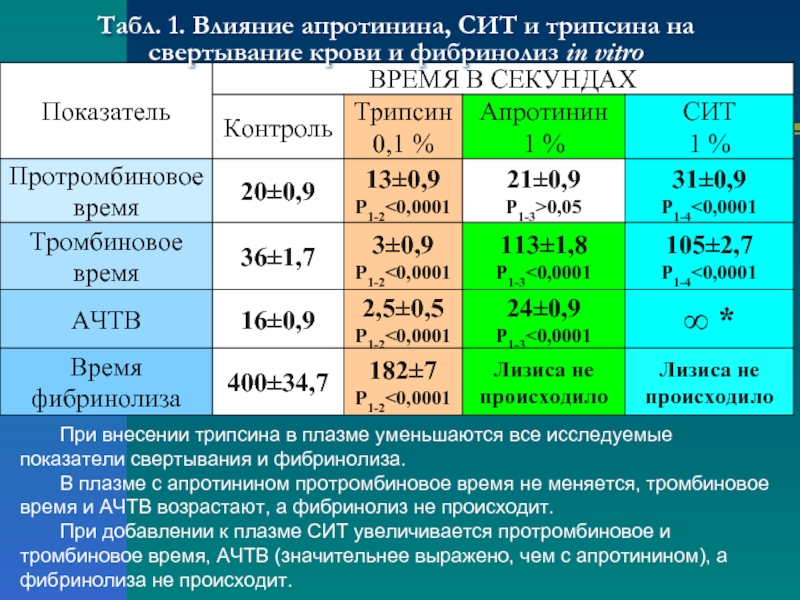
Слайд 9Табл. 1. Влияние апротинина, СИТ и трипсина на свертывание крови и
При внесении трипсина в плазме уменьшаются все исследуемые показатели свертывания и фибринолиза.
В плазме с апротинином протромбиновое время не меняется, тромбиновое время и АЧТВ возрастают, а фибринолиз не происходит.
При добавлении к плазме СИТ увеличивается протромбиновое и тромбиновое время, АЧТВ (значительнее выражено, чем с апротинином), а фибринолиза не происходит.
Слайд 10Табл. 2. Влияние апротинина, СИТ и трипсина на АДФ- и Адреналин-инициируемую
Установлено, что трипсин повышает, а ингибиторы в равной степени снижают агрегабельность тромбоцитов при всех исследуемых типах агрегации.
Примечание. МА – максимальный уровень агрегации (%), ТМА – время достижения МА в секундах, адр – адреналин
Слайд 11ИССЛЕДОВАНИЕ ГЕМОЛИТИЧЕСКОЙ АКТИВНОСТИ КОМПЛЕМЕНТА
Рис. 7. Типичные кривые гемолиза в присутствие трипсина
Система комплемента активируется путем ограниченного протеолиза и мы предполагали, что трипсин может ускорить гемолиз эритроцитов, а ингибиторы наоборот. Однако, внесение трипсина оказало противоположный эффект, возможно за счет разрушения компонентов системы комплемента. Ингибиторы не повлияли на процесс гемолиза вероятно по причине их субстратной специфичности.
Слайд 12ИССЛЕДОВАНИЕ ВЛИЯНИЯ ПРИЕМА ИЗОЛЯТА СОЕВОГО БЕЛКА НА ОБЩУЮ ПРОТЕОЛИТИЧЕСКУЮ И ТРИПСИН-ИНГИБИТОРНУЮ
После термической обработки в процессе приготовления изолята соевого белка сохранилась активность соевого ингибитора трипсина.
Установлено, что прием на протяжении 2 месяцев изолята соевого белка, обладающего антитрипсиновой активностью, сопровождался достоверным снижением общего уровня протеолитической активности на 18% и увеличением уровня трипсин-ингибиторной активности на 22% в сыворотки крови.
Табл. 3. Трипсин-ингибиторная активность СИТ и изолята соевого белка
Табл. 4. Общая протеолитическая и трипсин-ингибиторная активность сыворотки крови людей, длительно принимавших изолят соевого белка
Слайд 13ВЫВОДЫ
1) Первичные структуры и спектры биологической активности апротинина и СИТ гомологичны
2) СИТ и апротинин обладают одинаковой трипсин-ингибиторной активностью in vitro.
3) СИТ и апротинин в равной степени препятствуют свертыванию крови, фибринолизу и агрегации тромбоцитов. СИТ замедляет время свертывания, протекающего по внешнему и внутреннему пути, а апротинин – только по внутреннему пути.
4) Оба ингибитора полностью блокируют фибринолиз.
5) Апротинин и СИТ обладают антиагрегационными свойствами. Они не отличаются по силе торможения обратимой, двухфазной, необратимой АДФ-инициируемой и двухфазной адреналин-инициируемой агрегации тромбоцитов.
6) Растворы СИТ и апротинина в концентрациях 0,01-1,0% не влияют на скорость и степень комплемент-зависимого гемолизиса in vitro.
7) 2-хмесячный прием изолята соевого белка, содержащего активный СИТ, снижает общую протеолитическую активность на 18% и увеличивает трипсин-ингибиторную активность на 21% в сыворотке крови.