- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Активность ферментов: влияние факторов, регуляция презентация
Содержание
- 1. Активность ферментов: влияние факторов, регуляция
- 2. Факторы, влияющие на активность ферментов Концентрация фермента
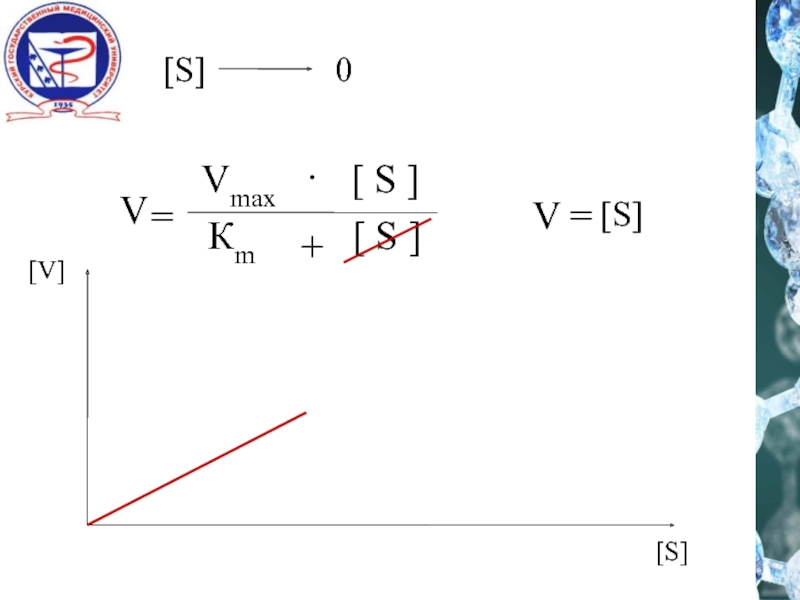
- 3. Влияние [E] [S] - const
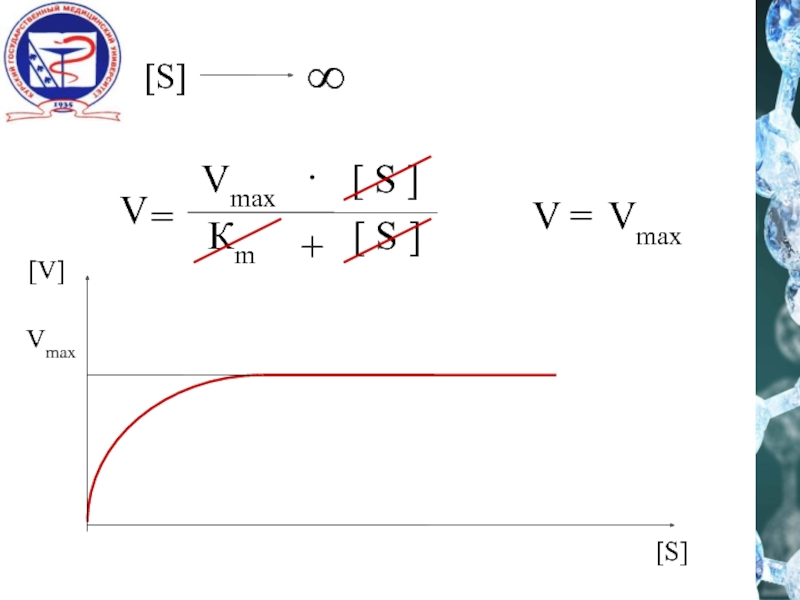
- 4. Влияние [S] Уравнение Михаэлиса - Ментен
- 7. Если v = ½ vmax Km = [ s ]
- 8. [ s ] v 1
- 9. Значение Km 1. Показывает сродство [E] и [S]
- 10. Этанол НАД НАДНН+ НАД НАДНН+
- 11. [S] Vmax V Km Этанол Km Этиленгликоль
- 12. Значение Km 2. Km – важная количественная
- 13. Значение Km 3. Позволяет определить вид ингибирования фермента 4. Показывает сродство апофермента и кофактора
- 14. График Лайнувера – Берка. 1 vmax
- 15. V Мкмоль/мин t, С 0 10
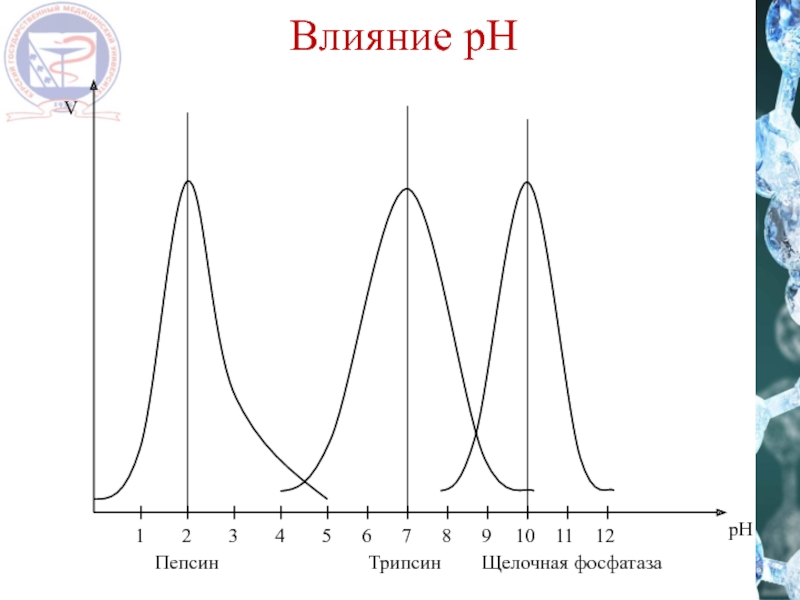
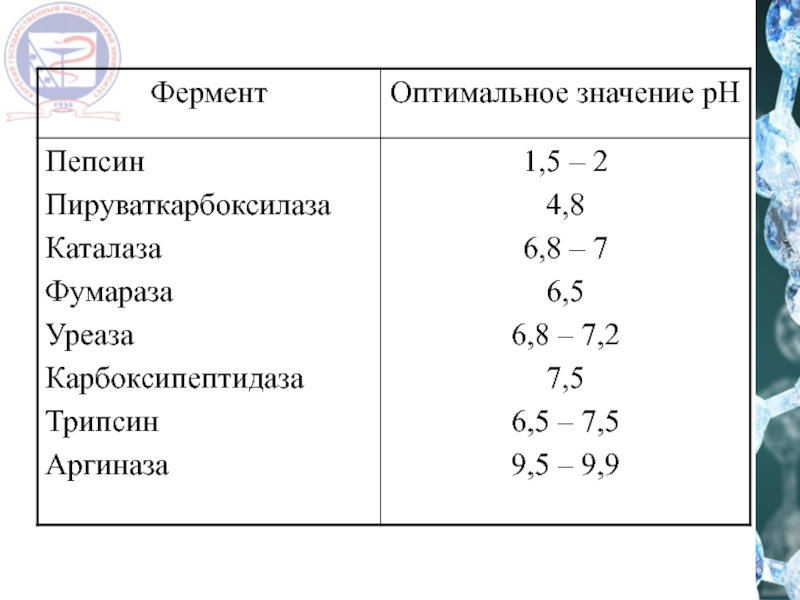
- 16. Влияние рН 1 2
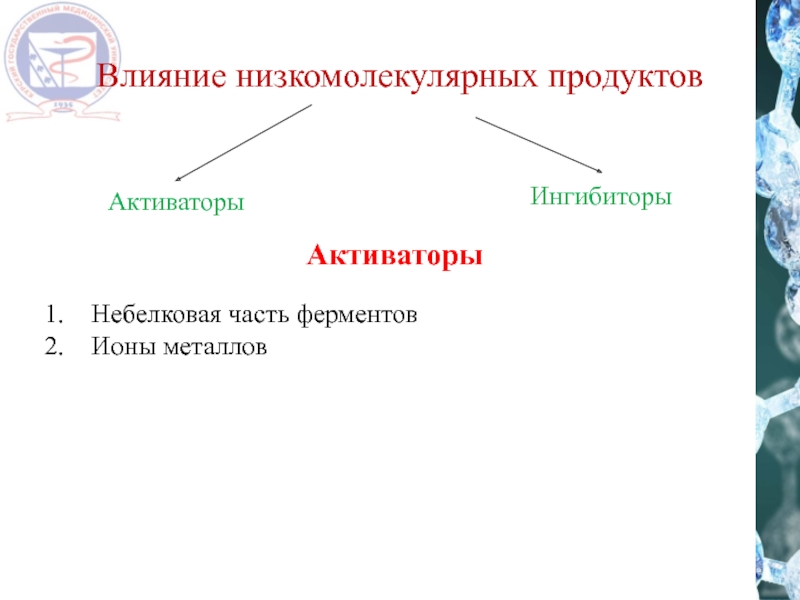
- 18. Влияние низкомолекулярных продуктов Активаторы Ингибиторы Активаторы Небелковая часть ферментов Ионы металлов
- 19. 2.1. Ионы металлов – стабилизаторы молекулы субстрата:
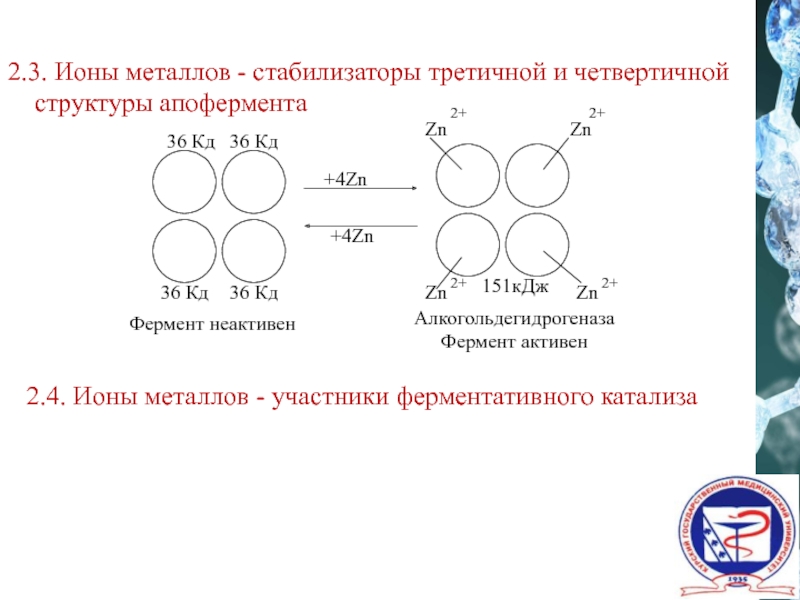
- 20. 2.3. Ионы металлов - стабилизаторы третичной и
- 21. Ингибирование ферментативной активности – снижение каталитической
- 22. Необратимое ингибирование – наблюдается в случае образования
- 23. Конкурентный тип ингибирования E + S ES
- 24. + + Е +
- 25. Торможение активности СДГ малоновой кислотой +
- 26. Влияние конкурентного ингибитора на скорость ферментативной реакции
- 27. - - - - - -
- 28. Лекарственные препараты, как конкурентные ингибиторы Ингибиторы
- 29. Неконкурентное ингибирование – ингибитор взаимодействует с ферментом
- 30. В присутствии смешанного неконкурентного ингибитора
- 31. - - - - - -
- 32. График зависимости V от [S] в
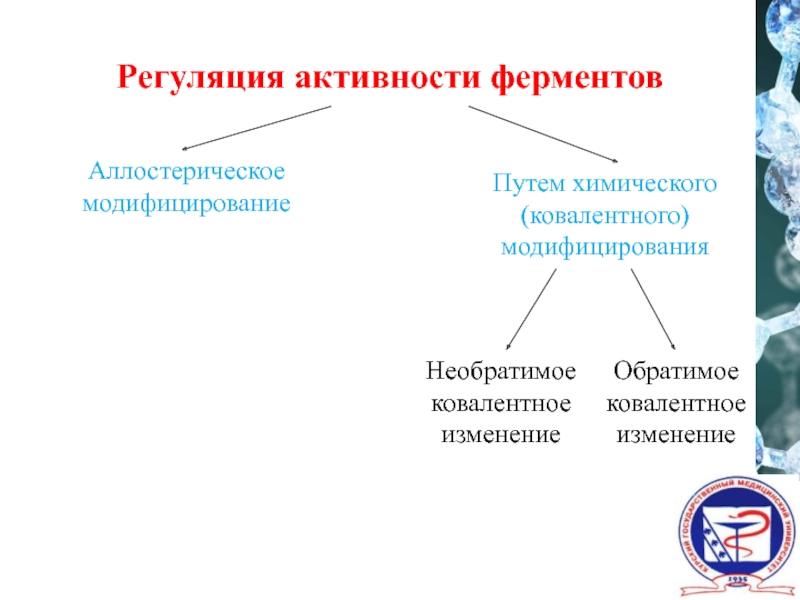
- 33. Регуляция активности ферментов Аллостерическое модифицирование Необратимое ковалентное изменение Путем химического (ковалентного) модифицирования Обратимое ковалентное изменение
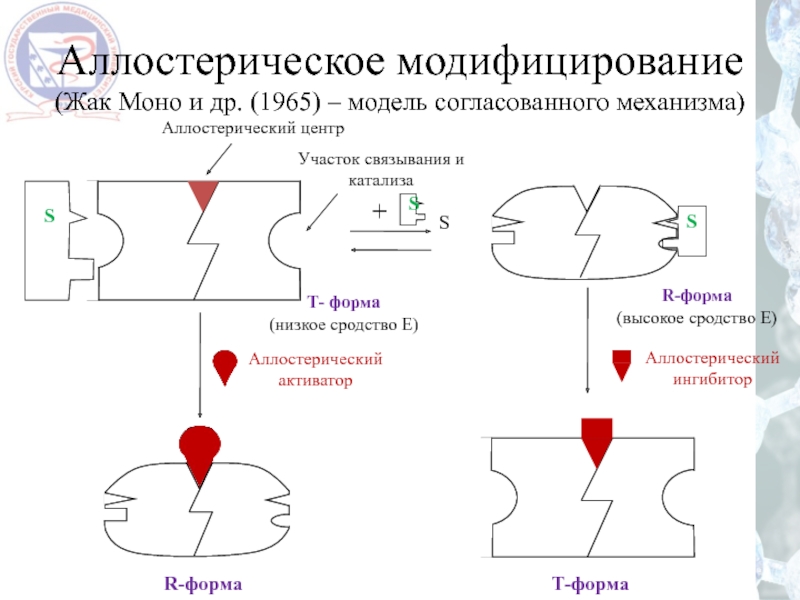
- 34. Аллостерическое модифицирование (Жак Моно и др. (1965)
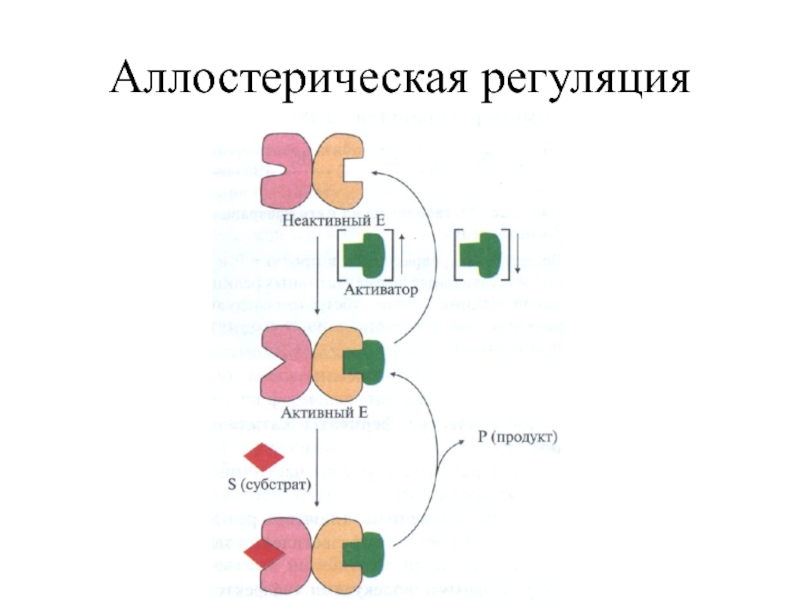
- 35. Аллостерическая регуляция
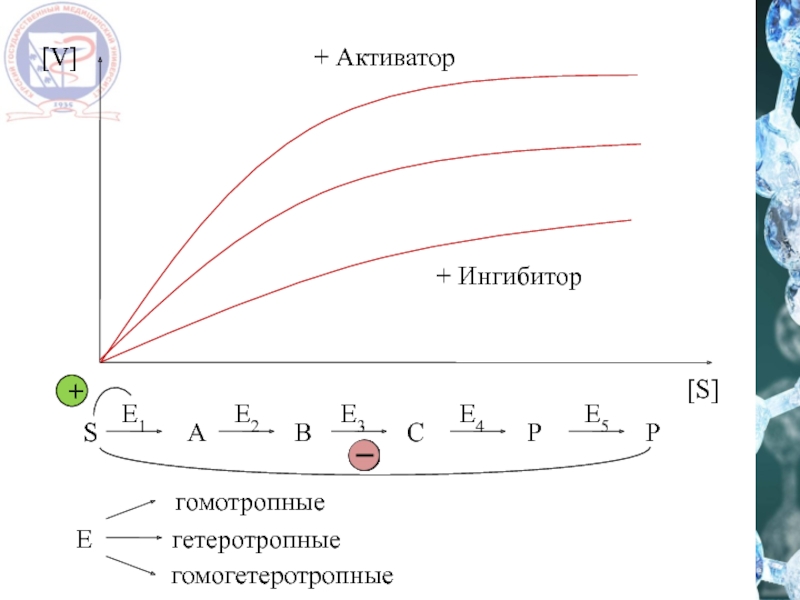
- 36. S A B C P P
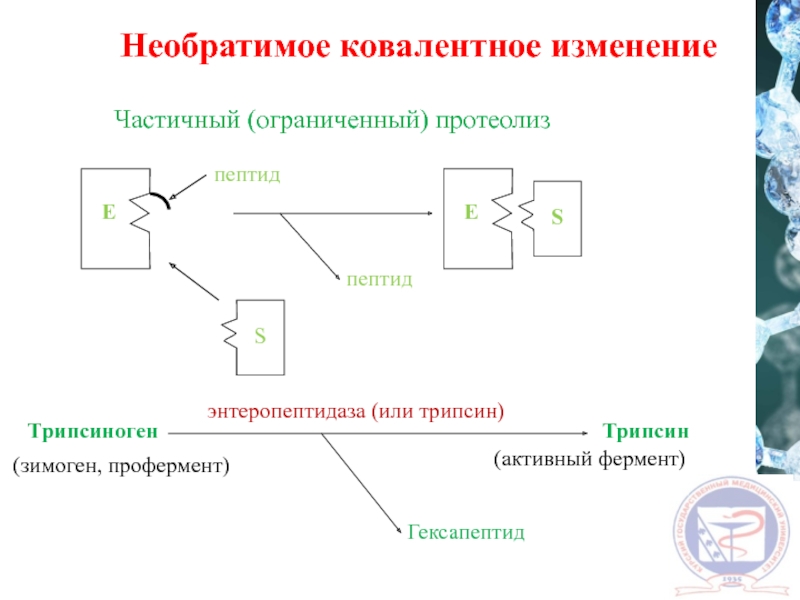
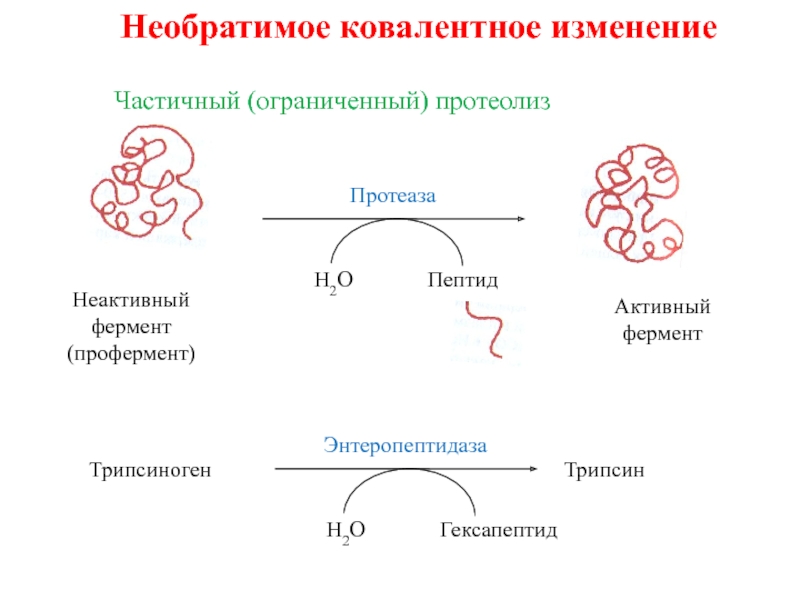
- 37. Частичный (ограниченный) протеолиз пептид Трипсиноген
- 38. Частичный (ограниченный) протеолиз Необратимое ковалентное изменение
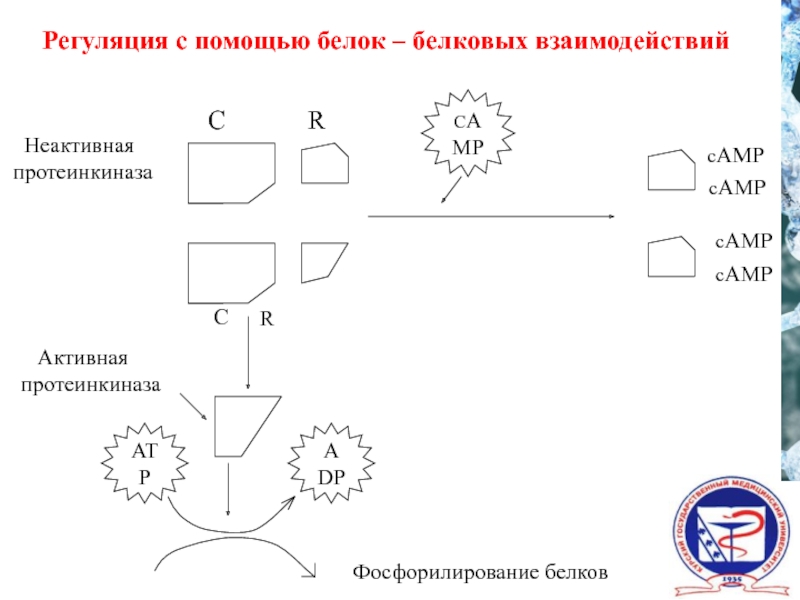
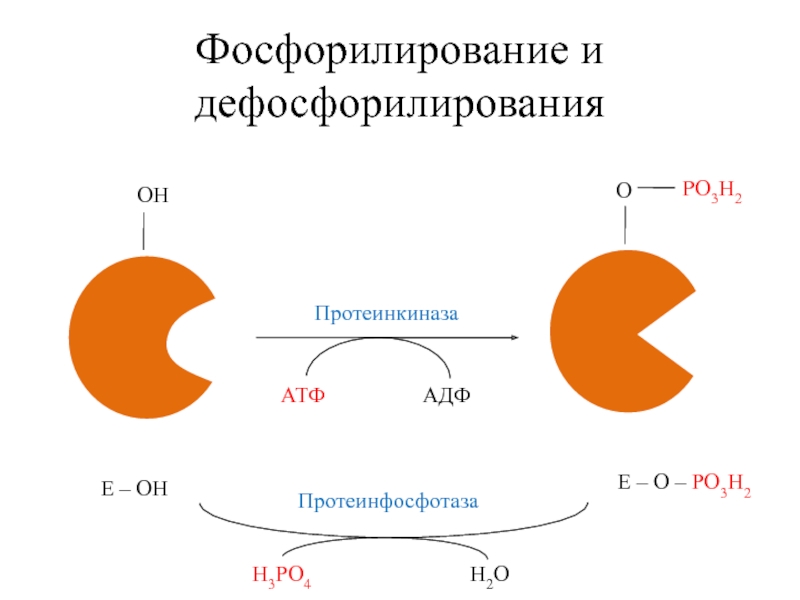
- 39. Фосфорилирование и дефосфорилирование АТР ADP P
- 40. Фосфорилирование и дефосфорилирования ОН Е
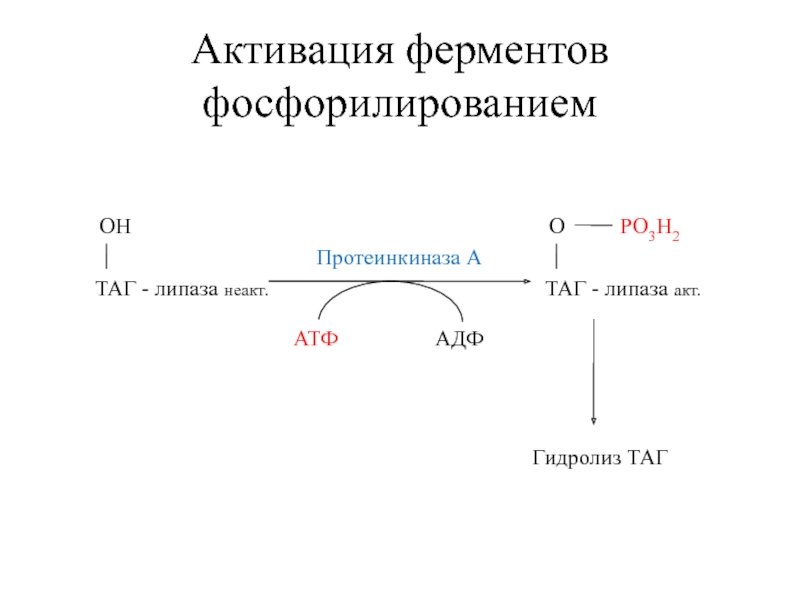
- 41. Активация ферментов фосфорилированием ОН ТАГ - липаза
- 42. Активация ферментов дефосфорилированием РО3Н2 Протеинфосфатаза О Пируваткиназа неакт. Н2О Н3РО4 ОН Пируваткиназа акт.
- 43. Регуляция путем ассоциации-диссоциации протомеров ацетил-КоА-карбоксилазы [цитрат] Неактивные протомеры ацетил-КоА карбоксилазы Активация ацетил-КоА карбоксилаза (Е-ОН)
- 44. Регуляция с помощью белок – белковых взаимодействий
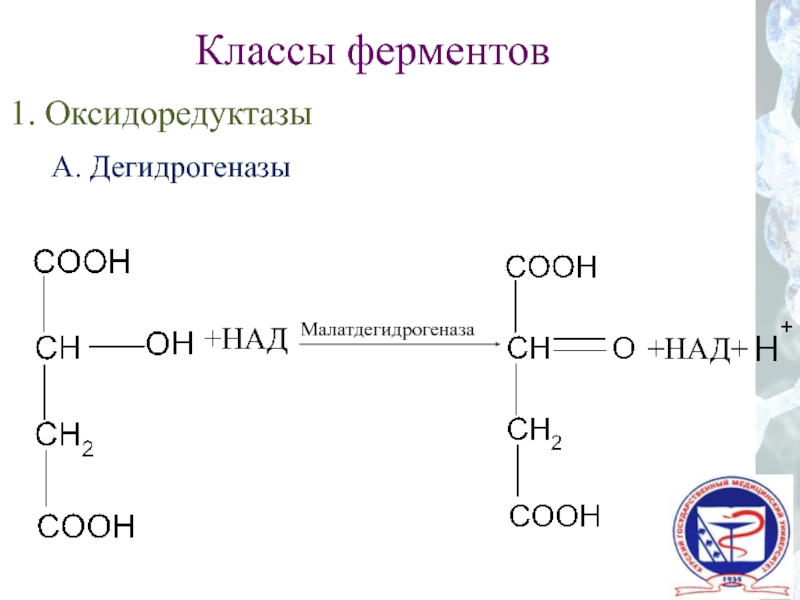
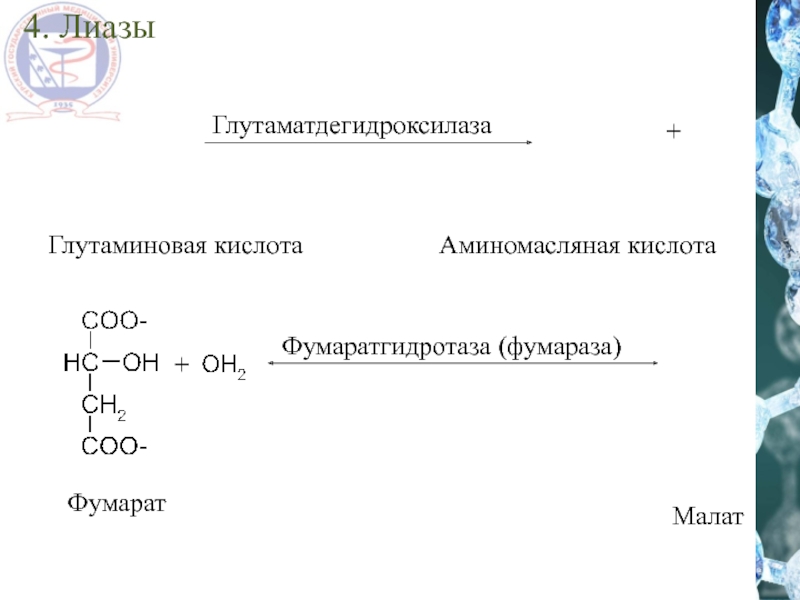
- 45. Классы ферментов 1. Оксидоредуктазы А. Дегидрогеназы +НАД Малатдегидрогеназа +НАД+
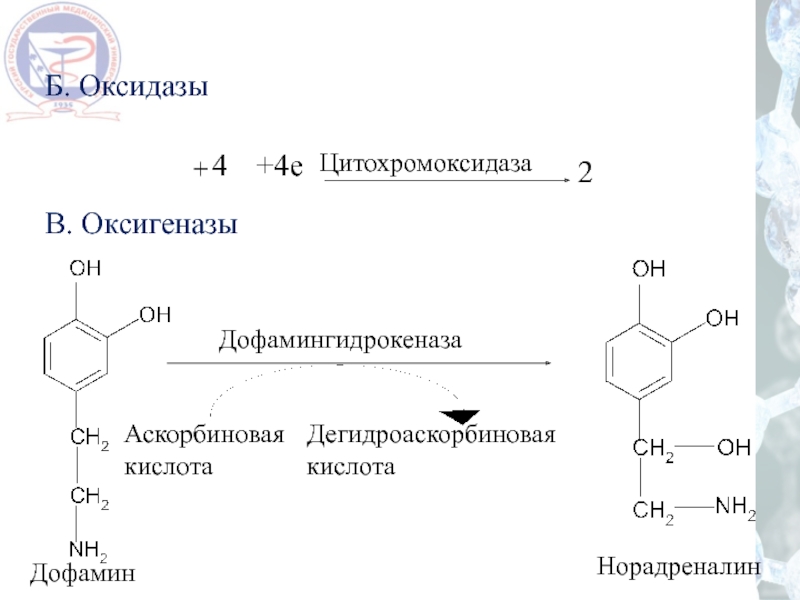
- 46. Б. Оксидазы В. Оксигеназы
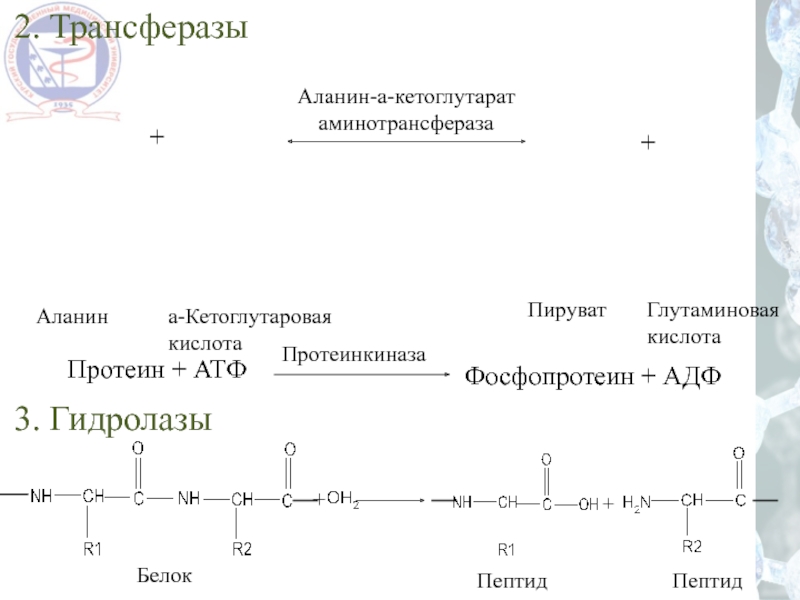
- 47. 2. Трансферазы 3. Гидролазы
- 48. 4. Лиазы
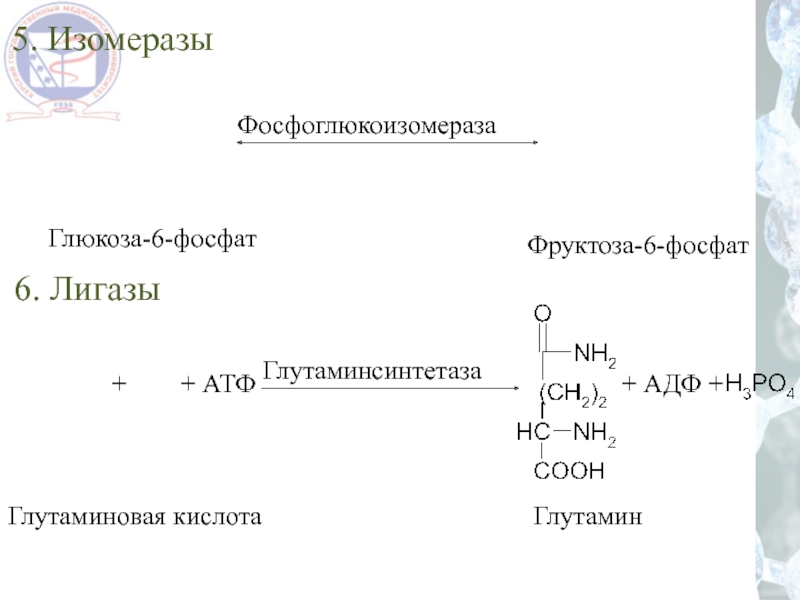
- 49. 5. Изомеразы 6. Лигазы
Слайд 2Факторы, влияющие
на активность ферментов
Концентрация фермента (энзима) [E]
Концентрация субстрата [S]
Температура
Концентрация ионов Н
Низкомолекулярные продукты
Слайд 10Этанол
НАД
НАДНН+
НАД
НАДНН+
Щавелевая кислота
Токсикант
Диглиоксаль
Этиленгликоль
Алкогольдегидрогеназа
Уксусный альдегид
Ацетил-СоА
Использование степени сродства [ES]
Слайд 12Значение Km
2. Km – важная количественная характеристика фермента, определяет с каким
Слайд 13Значение Km
3. Позволяет определить вид ингибирования фермента
4. Показывает сродство апофермента и
Слайд 15
V
Мкмоль/мин
t, С
0
10
20
30
40
50
60
Максимальная каталитическая активность
Влияние температуры
Оптимум t [E]
Слайд 18Влияние низкомолекулярных продуктов
Активаторы
Ингибиторы
Активаторы
Небелковая часть ферментов
Ионы металлов
Слайд 192.1. Ионы металлов – стабилизаторы молекулы субстрата:
E –
2.2. Ионы металлов–стабилизаторы активного центра фермента:
Слайд 202.3. Ионы металлов - стабилизаторы третичной и четвертичной
структуры
2.4. Ионы металлов - участники ферментативного катализа
Слайд 21 Ингибирование ферментативной активности – снижение каталитической активности в присутствии определенных
Ингибирование по степени прочности
связывания фермента и ингибитора
Обратимое
Необратимое
по механизму действия
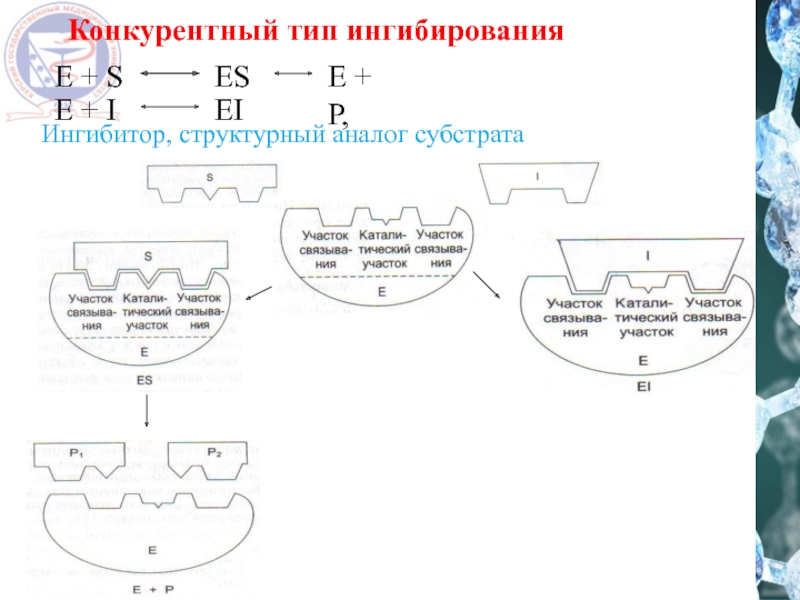
Конкурентное
Неконкурентное
Ингибиторы
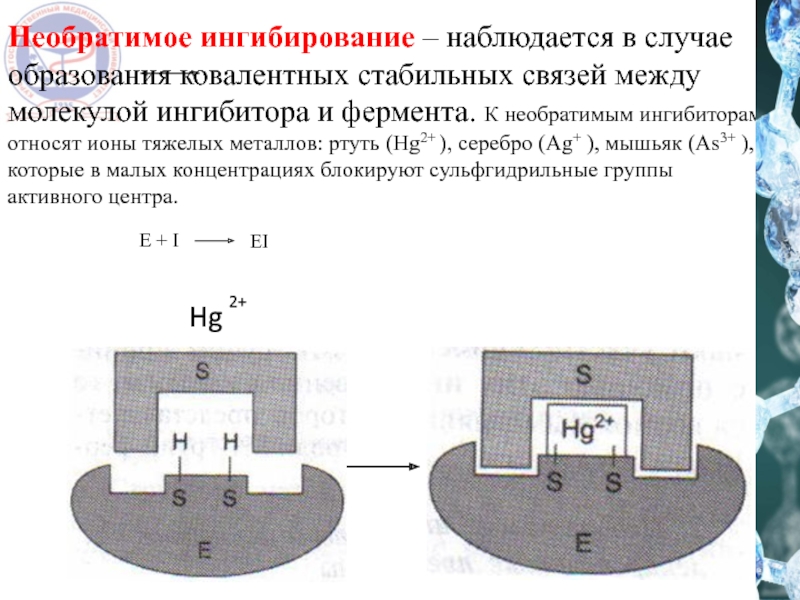
Слайд 22Необратимое ингибирование – наблюдается в случае образования ковалентных стабильных связей между
Hg
2+
E + I
EI
Слайд 24 +
+
Е +
Комлекс Е +
(неактивный)
Е + S
ES
E
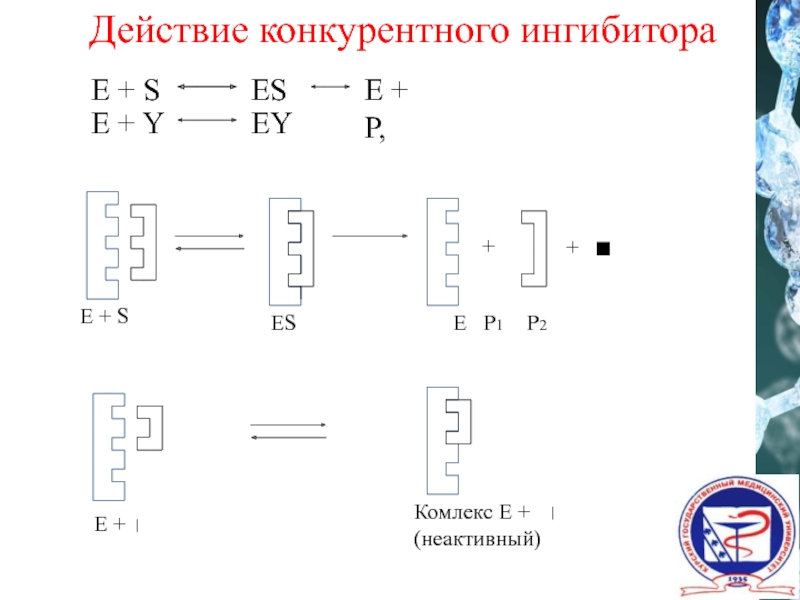
Действие конкурентного ингибитора
E + S
ES
E + P,
E + Y
EY
Слайд 25
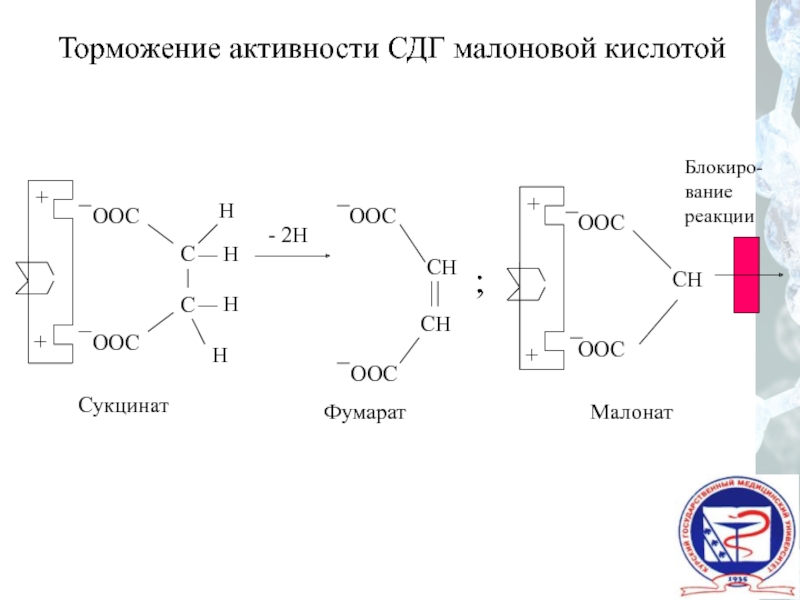
Торможение активности СДГ малоновой кислотой
+
+
ООС
ООС
С
С
Н
Н
Н
Н
- 2Н
ООС
СН
СН
ООС
;
+
+
ООС
ООС
СН
Блокиро-
вание
реакции
Сукцинат
Фумарат
Малонат
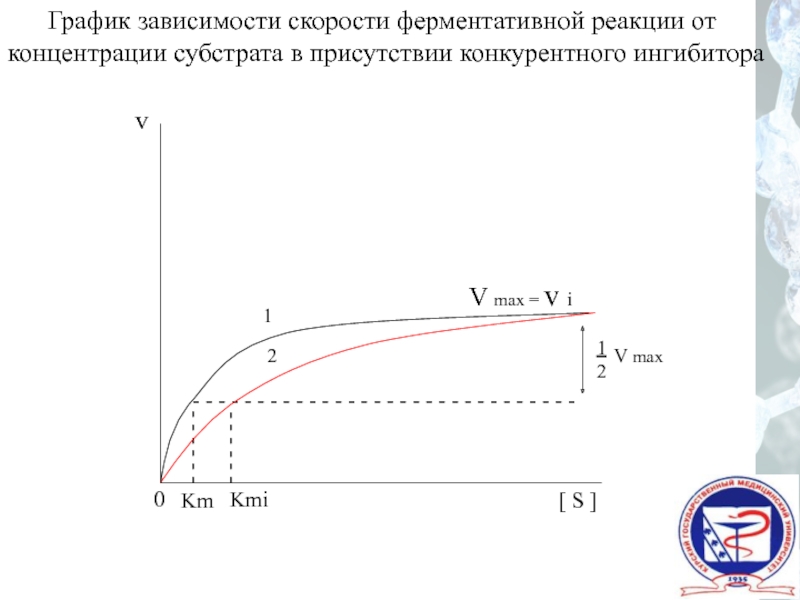
Слайд 26Влияние конкурентного ингибитора на скорость ферментативной реакции в зависимости от концентрации
Km
‘Km >
(c I)
Vmax
2
Vmax
[S]
+ I
Слайд 27
- - - - - -
- - - - -
- - - - - - - - - - - - - - - - - - - - - - - - - - - - - -
1
2
V max
2
1
0
v
V max = v i
Km
Kmi
[ S ]
График зависимости скорости ферментативной реакции от
концентрации субстрата в присутствии конкурентного ингибитора
Слайд 28
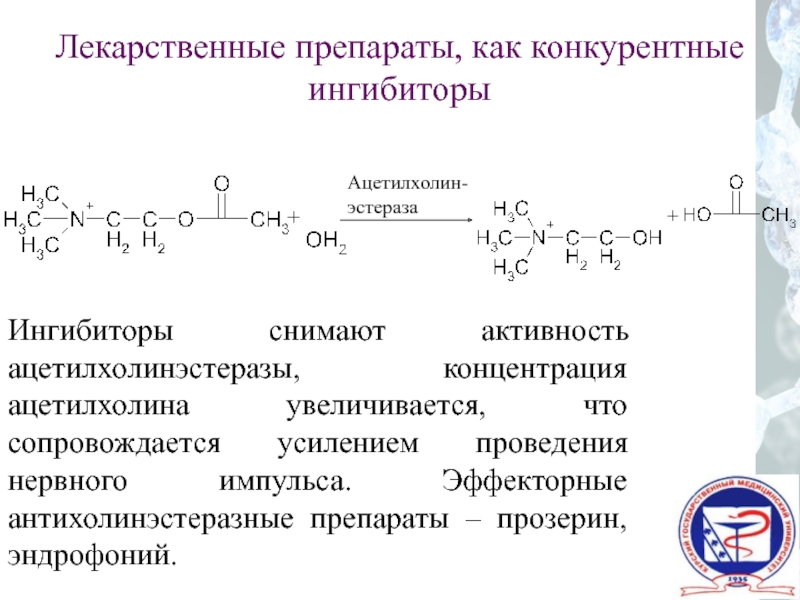
Лекарственные препараты, как конкурентные ингибиторы
Ингибиторы снимают активность ацетилхолинэстеразы, концентрация ацетилхолина увеличивается,
Ацетилхолин-
эстераза
+
+
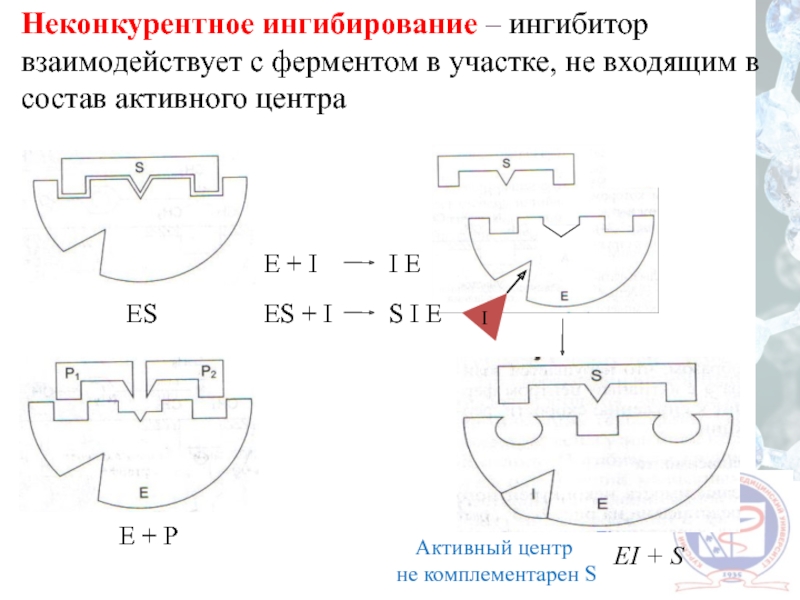
Слайд 29Неконкурентное ингибирование – ингибитор взаимодействует с ферментом в участке, не входящим
Активный центр
не комплементарен S
Слайд 30
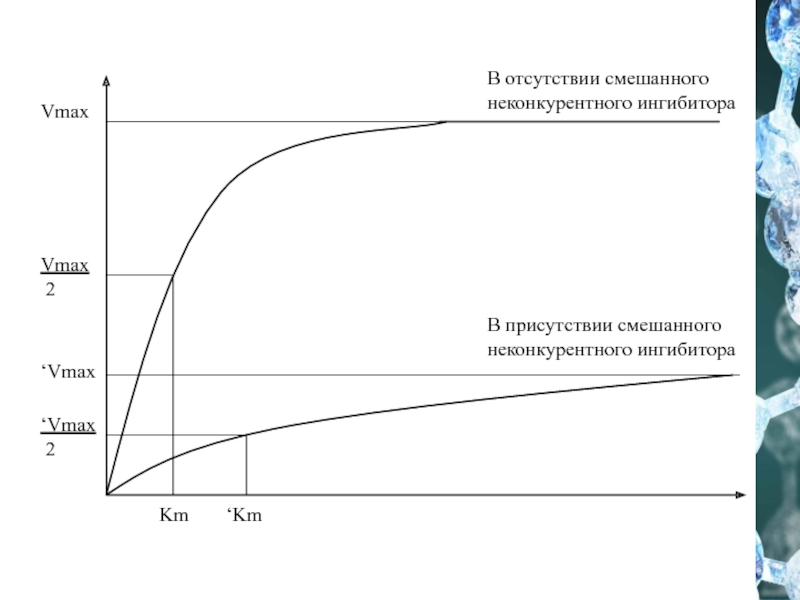
В присутствии смешанного неконкурентного ингибитора
В отсутствии смешанного неконкурентного ингибитора
Km
‘Km
Vmax
Vmax
2
‘Vmax
‘Vmax
2
Слайд 31- - - - - -
- - - -
vmax
=
1
vi
1
Km
1
Kmi
-
1
v
2
1
[ S ]
1
-
График зависимости скорости ферментативной реакции от
концентрации субстрата в присутствии конкурентного ингибитора.
Слайд 32
График зависимости V от [S] в присутствии
неконкурентного ингибитора
Km
V
Vmax (с I)
Vmax
+I
½ Vmax
снижение
½ Vmax
Слайд 33Регуляция активности ферментов
Аллостерическое модифицирование
Необратимое ковалентное изменение
Путем химического (ковалентного) модифицирования
Обратимое ковалентное изменение
Слайд 34Аллостерическое модифицирование
(Жак Моно и др. (1965) – модель согласованного механизма)
Аллостерический центр
Участок
R-форма
(высокое сродство Е)
Т-форма
R-форма
Т- форма
(низкое сродство Е)
Слайд 37Частичный (ограниченный) протеолиз
пептид
Трипсиноген
Трипсин
Гексапептид
(активный фермент)
(зимоген, профермент)
энтеропептидаза (или трипсин)
Необратимое ковалентное изменение
пептид
Слайд 39Фосфорилирование и дефосфорилирование
АТР
ADP
P
H2O
О – Р
Е – ОР
неактивный
Протеинкиназа
ОН
Е – ОН
активный
Протеинфосфатаза
Обратимое ковалентное изменение

![Факторы, влияющие на активность ферментовКонцентрация фермента (энзима) [E]Концентрация субстрата [S]ТемператураКонцентрация ионов Н (рН)Низкомолекулярные продукты](/img/tmb/1/41346/9cc533c2571dcc944d803fb8b3c284a1-800x.jpg)
![Влияние [E][S] - const](/img/tmb/1/41346/7f613fb276cde4376d4fad1f1f963358-800x.jpg)
![Влияние [S]Уравнение Михаэлиса - Ментен VMAX .[ s ]Кm+[ s ]V =](/img/tmb/1/41346/c18d0168404a6ddac4a6f4417d0c4657-800x.jpg)
![Если v = ½ vmax Km = [ s ]](/img/tmb/1/41346/efa6398b2bd02c7ff3cf9d98bac507ec-800x.jpg)
![[ s ]v12 vmaxKmДля многих ферментов Km = 10-1 – 10-6 M](/img/tmb/1/41346/e06658674c24c714ab0bfe58609fa305-800x.jpg)
![Значение Km1. Показывает сродство [E] и [S]](/img/tmb/1/41346/1b3c1265a59948c7e95ab715317a8d41-800x.jpg)
![ЭтанолНАДНАДНН+НАДНАДНН+Щавелевая кислотаТоксикантДиглиоксальЭтиленгликольАлкогольдегидрогеназаУксусный альдегидАцетил-СоАИспользование степени сродства [ES]](/img/tmb/1/41346/91ac6341fff54f130b5d4e4029c39a37-800x.jpg)
![[S] VmaxV Km ЭтанолKm Этиленгликоль](/img/tmb/1/41346/c58755895451daac727c3498ad900104-800x.jpg)
![Значение Km2. Km – важная количественная характеристика фермента, определяет с каким [S] будет наиболее эффективно](/img/tmb/1/41346/4d73d7d40907969c8bff8a5c3aa0270c-800x.jpg)

![График Лайнувера – Берка.1vmax1Km1v1[s] Определение Km](/img/tmb/1/41346/04f753c02b00a67e774162bd2d44d1a5-800x.jpg)
![VМкмоль/минt, С0102030405060Максимальная каталитическая активностьВлияние температурыОптимум t [E]](/img/tmb/1/41346/0b747058d49702c42a4a2bbf6d2d71e0-800x.jpg)


![Влияние конкурентного ингибитора на скорость ферментативной реакции в зависимости от концентрации субстратаKm‘Km >(c I)Vmax 2Vmax[S]+ I](/img/tmb/1/41346/5c544701f7e130c43318c4d94b62d534-800x.jpg)
![- - - - - - - - - - 1vmax= 1vi1Km1Kmi-1v21[ S ]1-](/img/tmb/1/41346/510ac59f23ec5cc78df72791624239f6-800x.jpg)
![График зависимости V от [S] в присутствиинеконкурентного ингибитораKmVVmax (с I)Vmax+I½ Vmax (с I) снижение½ Vmax](/img/tmb/1/41346/b4ed6ee9a2ee23218298fd187f544c06-800x.jpg)


![Регуляция путем ассоциации-диссоциации протомеров ацетил-КоА-карбоксилазы[цитрат]Неактивные протомерыацетил-КоА карбоксилазыАктивация ацетил-КоАкарбоксилаза (Е-ОН)](/img/tmb/1/41346/b9ed1d822ff79a8a0977d4943ead2c91-800x.jpg)