- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Взаимосвязь классов органических соединений Как подготовить учащихся к успешной сдаче ЕГЭ презентация
Содержание
- 1. Взаимосвязь классов органических соединений Как подготовить учащихся к успешной сдаче ЕГЭ
- 2. Элементы
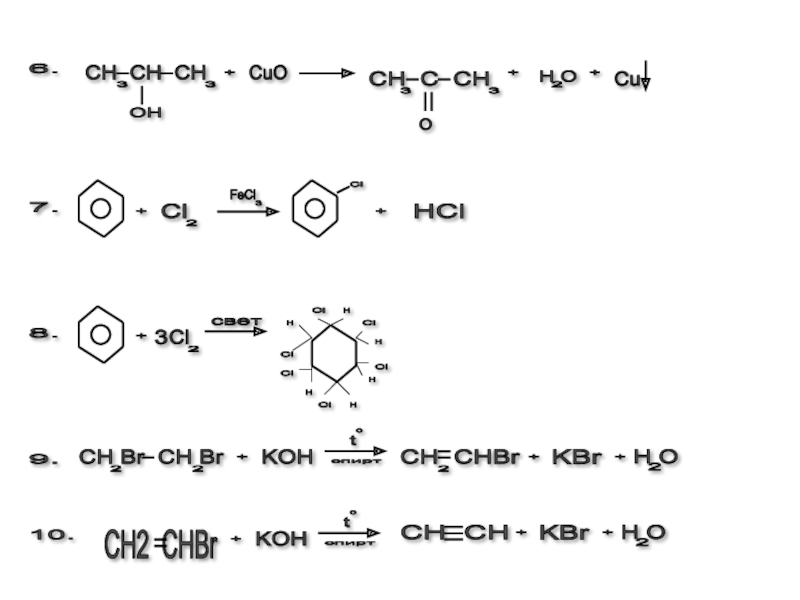
- 3. Необходимо знать: 1. Именные реакции
- 4. 1Именные реакции: Вюрца С 2Н
- 5. Изменение длины углеродной цепи:
- 6. Качественные реакции 1. С2
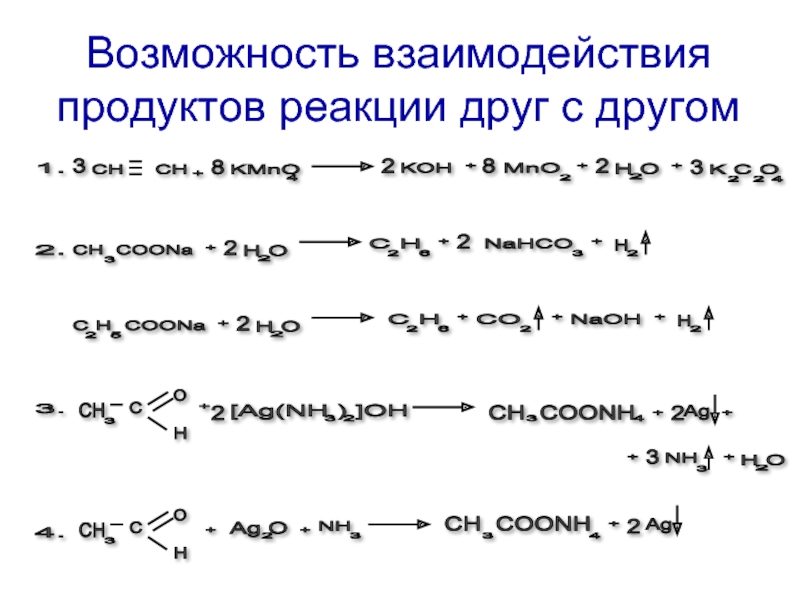
- 7. Условия протекания реакций 3. С Н
- 8. 7. + Cl 2
- 9. Возможность взаимодействия продуктов реакции друг с другом
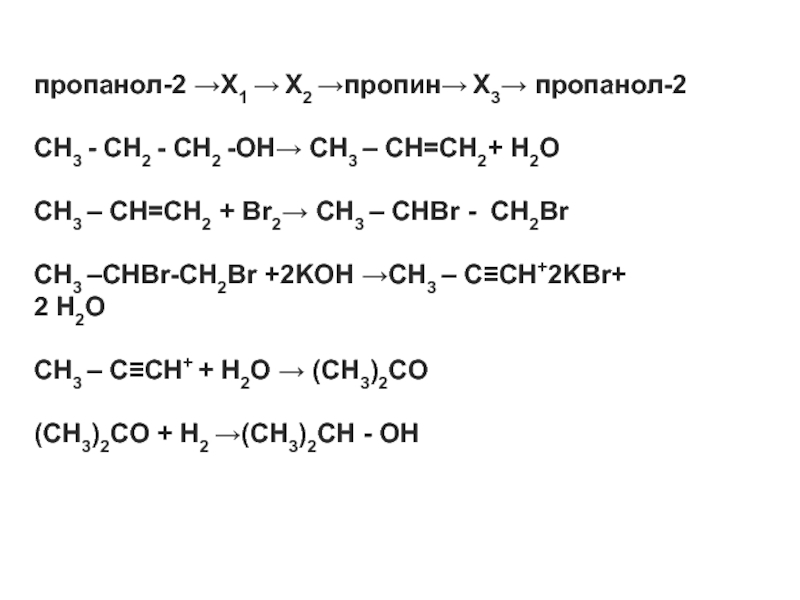
- 10. Цепочки превращений с различным объёмом информации о
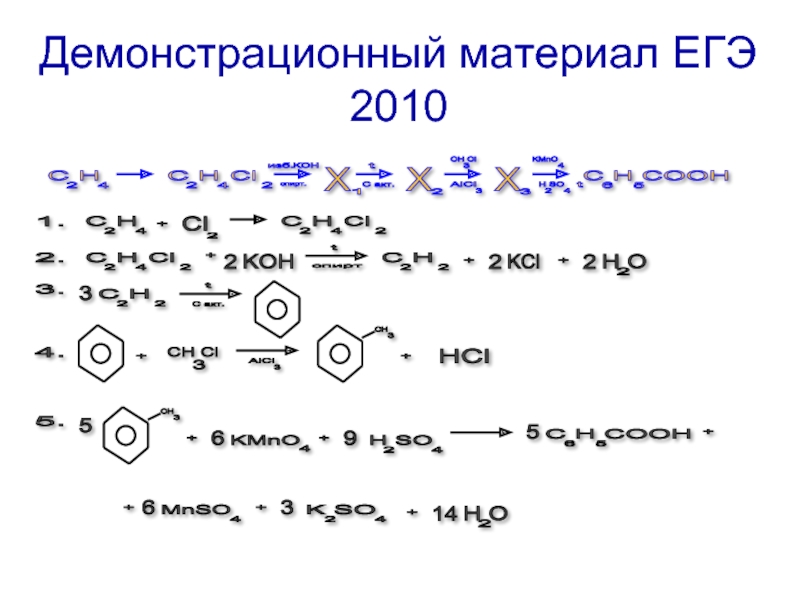
- 11. Демонстрационный материал ЕГЭ 2010 2 C
- 12. Тренировочный материал ЕГЭ 2010
- 13. C2H2 →X1 → X2
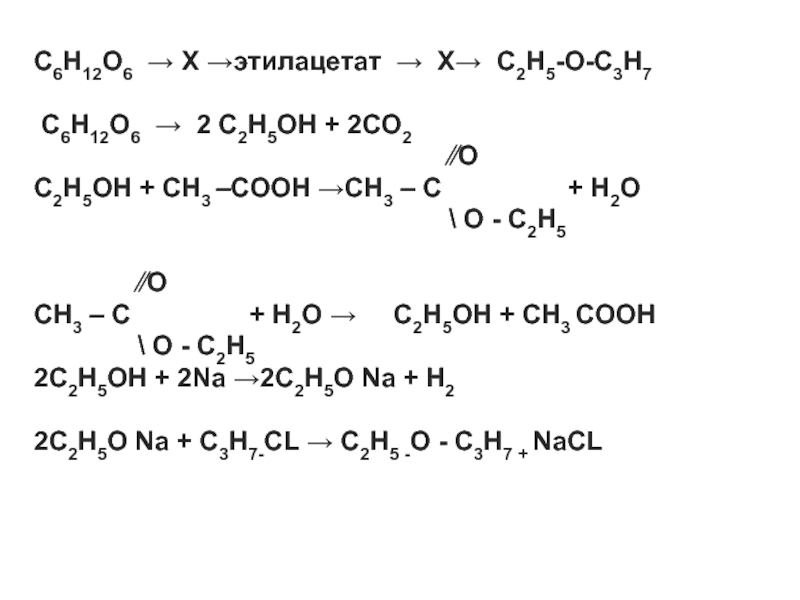
- 14. C6H12O6 → X →этилацетат
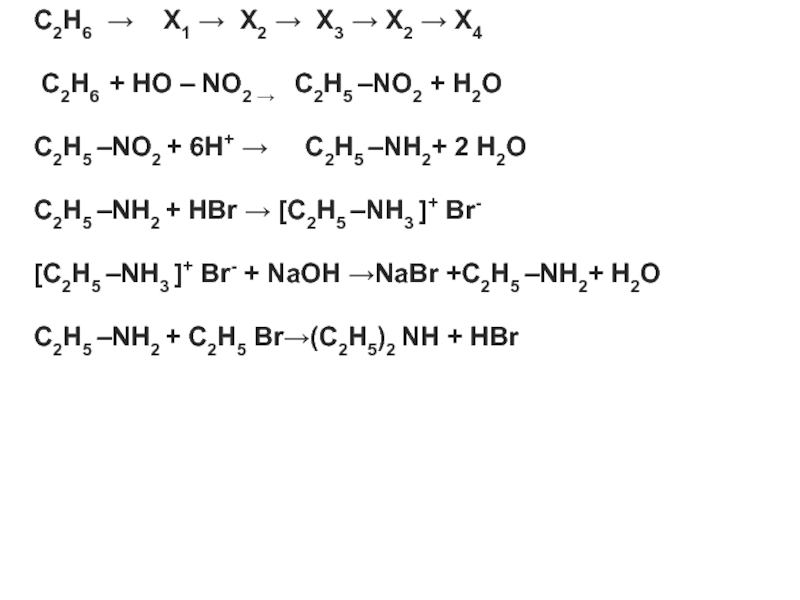
- 15. C2H6 →
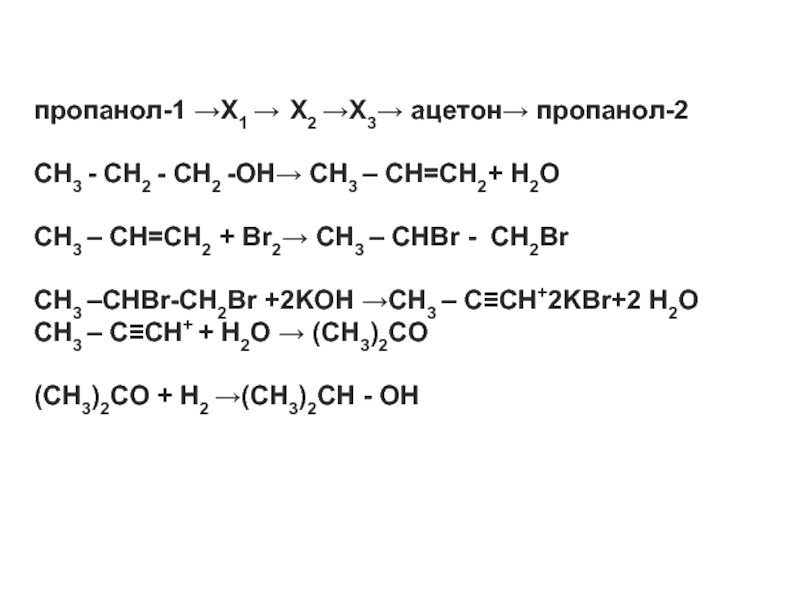
- 17. пропанол-1
- 18. CaCO3 →CaC2→X1→C2Ag2→ X1→ винилацетилен CaCO3+ 4С
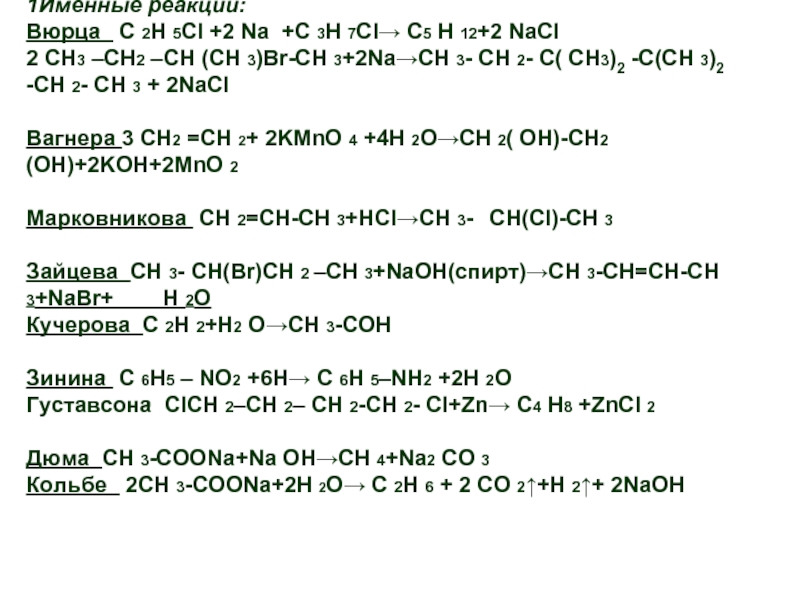
- 19. Этанол →X1 → X2
- 20. Список литературы 1. Каверина А.А,
Слайд 1Взаимосвязь классов органических соединений
Как подготовить учащихся к успешной сдаче ЕГЭ
Иштерякова
Заслуженный учитель РФ,
победитель конкурса «Лучших учителей РФ» в рамка ПНПО, руководитель МО учителей
химии Северного округа г. Оренбурга,
Учитель высшей квалификационной категории,
МОУ лицей № 3
Слайд 2 Элементы содержания блока С-3: - классификация химических реакций; -химические свойства классов
Слайд 3Необходимо знать: 1. Именные реакции (Вюрца, Вагнера, Марковникова, З айцева,К
Слайд 41Именные реакции: Вюрца С 2Н 5Cl +2 Na +C 3H
Слайд 5 Изменение длины углеродной цепи: 1. Реактив Гриньяра СН3 -Mg –Cl+C 2H5
Слайд 6 Качественные реакции 1. С2 Н2 + 2 {Ag(NH 3) 2}
Слайд 7Условия протекания реакций
3.
С Н
2
5
ОН
2
425
о
ZnO
CH CH CH CH
2
2
+
H O
2
(реакция Лебедева)
2
+
H
2
5.
+
CuO
CH
3
C
O
H
+
H O
2
+
Cu
1.
+
180
о
H O
2
CH CH
2
2
Слайд 87.
+
Cl
2
FeCl
3
Cl
+
HCl
10.
СH2
+
KOH
спирт
t
о
СH CH
+
KBr
+
9.
СH Br CH Br
2
2
+
KOH
спирт
t
о
СH CHBr
+
KBr
+
2
8.
+
Cl
2
3
свет
Cl
Cl
Cl
Cl
Cl
Cl
H
H
H
H
H
H
6.
СH CH CH
3
3
ОН
+
CuO
СH C CH
O
3
3
+
H O
2
+
Cu
Слайд 9Возможность взаимодействия продуктов реакции друг с другом
1.
3
+
NH
2
3
KMnO
4
KOH
2
+
MnO
2
8
+
2
+
2.
СH COONa
+
2
C H
6
+
NaHCO
3
+
H
2
2
С H COONa
2
5
+
2
2
C H
6
+
CO
2
+
NaOH
+
H
2
3.
CH
3
C
O
H
+
[Ag(NH ) ]OH
3
2
СH COONH
3
4
+
Ag
4.
CH
3
C
O
H
+
Ag O
2
+
3
СH COONH
3
4
+
Ag
K C O
3
2
2
4
СH CH
8
2
2
NH
3
+
3
+
+
2
Слайд 10Цепочки превращений с различным объёмом информации о веществах
Открытая
Полуоткрытая
Полузакрытая
Закрытая
Сверхзакрытая
A
Б
В
+Г
A
В
...
...
...
+Б
A
...
...
Г
+Б
-В
A
+В
-Д
+Г
...
...
...
+В
...
-Б
+А
...
Слайд 11Демонстрационный материал ЕГЭ 2010
2
C H
4
2
C H
4
Сl
2
X
X
X
2
1
3
C H COOH
6
5
KOH
спирт.
t
изб.
С акт.
t








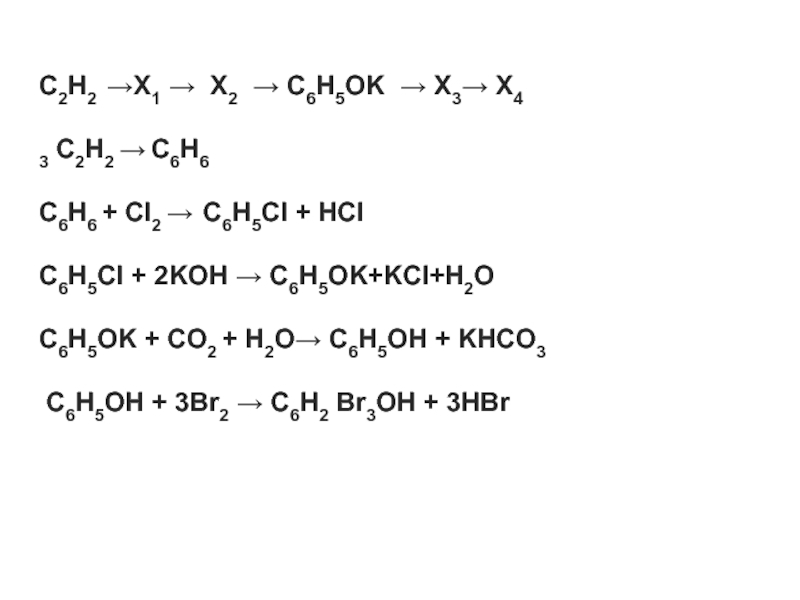
![CaCO3 →CaC2→X1→C2Ag2→ X1→ винилацетилен CaCO3+ 4С →CaC2 + 3СО C2H2 + 2[Ag (NH3)2]OH→ AgC≡CAg +](/img/tmb/3/206352/e92d381dd9a73d590ea304debaaad67a-800x.jpg)