- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Возможности информационно-вычислительного комплекса PhDi для расчета парожидкостного равновесия презентация
Содержание
- 1. Возможности информационно-вычислительного комплекса PhDi для расчета парожидкостного равновесия
- 2. Входные данные - критические свойства веществ Параметры
- 3. Цель работы Проанализировать различные системы на совместимость
- 4. Эмпирические уравнения состояния (1873) (1949)
- 5. (1972) (1976)
- 7. Теоретические уравнения состояния Уравнение состояния Карнахана-Старлинга(1972)
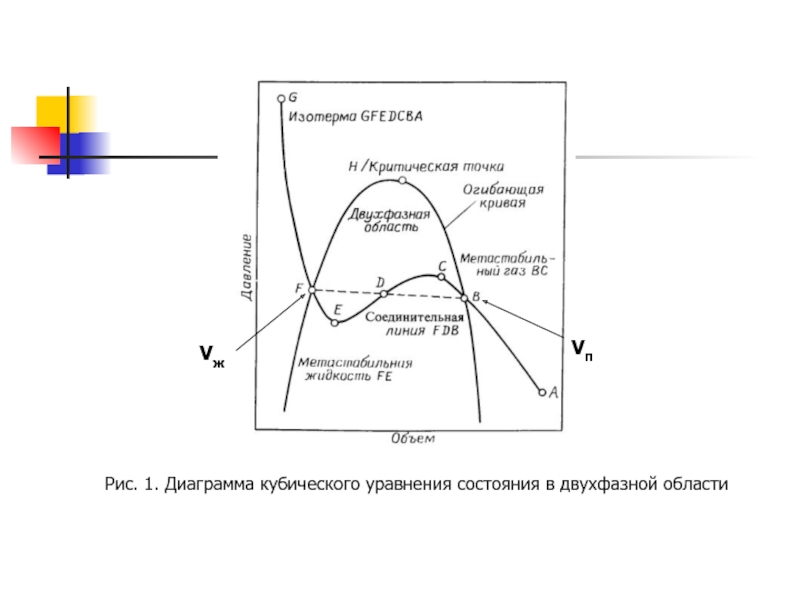
- 8. Рис. 1. Диаграмма кубического уравнения состояния в двухфазной области Vп Vж
- 9. Уравнение Ван-дер-Ваальса Уравнение
- 10. Соотношение для расчета избыточного значения энергии Гельмгольца: Уравнение Ван-дер-Ваальса Уравнение Редлиха-Квонга Уравнение Пенга-Робинсона Уравнение Соава
- 12. 1)Азот + др. газы Рис.1. T-x диаграмма
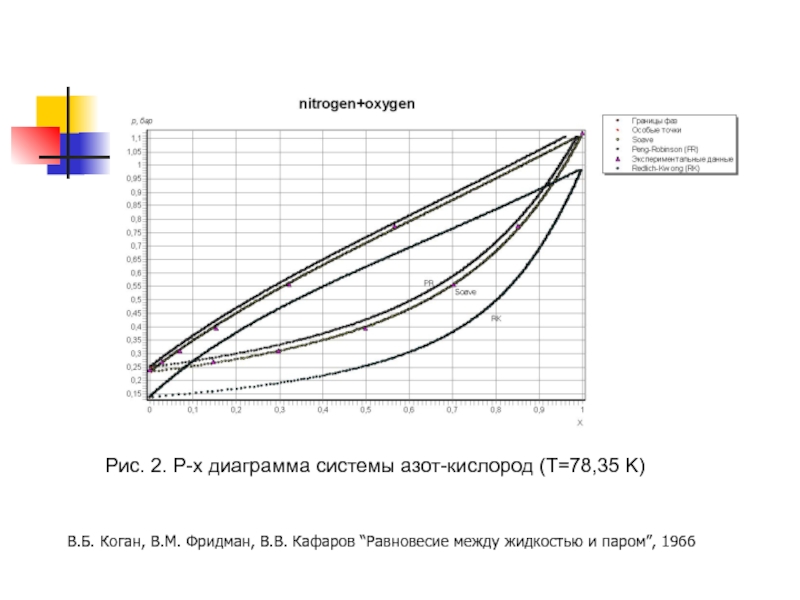
- 13. Рис. 2. P-x диаграмма системы азот-кислород (T=78,35
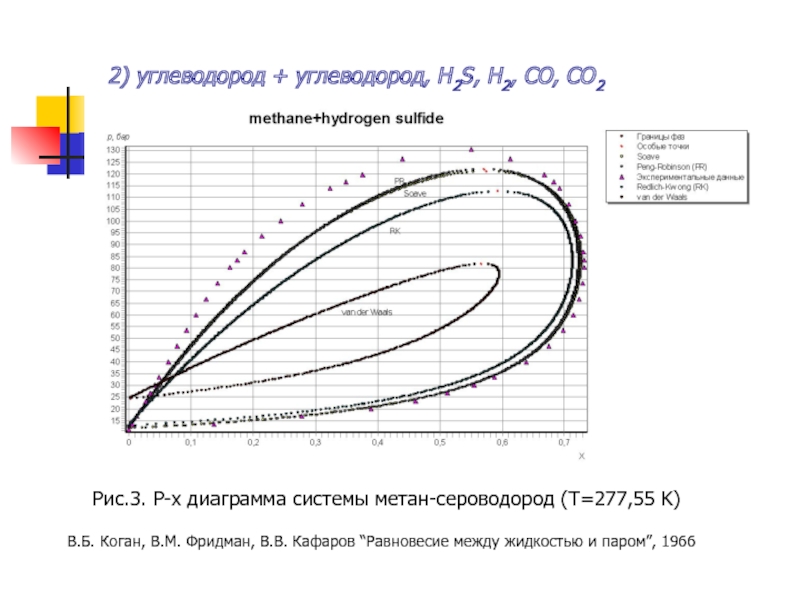
- 14. 2) углеводород + углеводород, H2S, H2, CO,
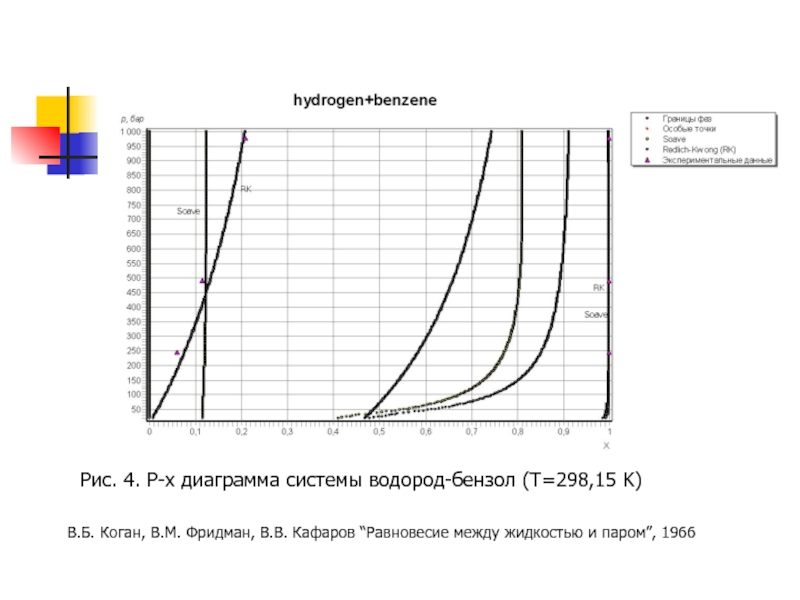
- 15. Рис. 4. P-x диаграмма системы водород-бензол (T=298,15
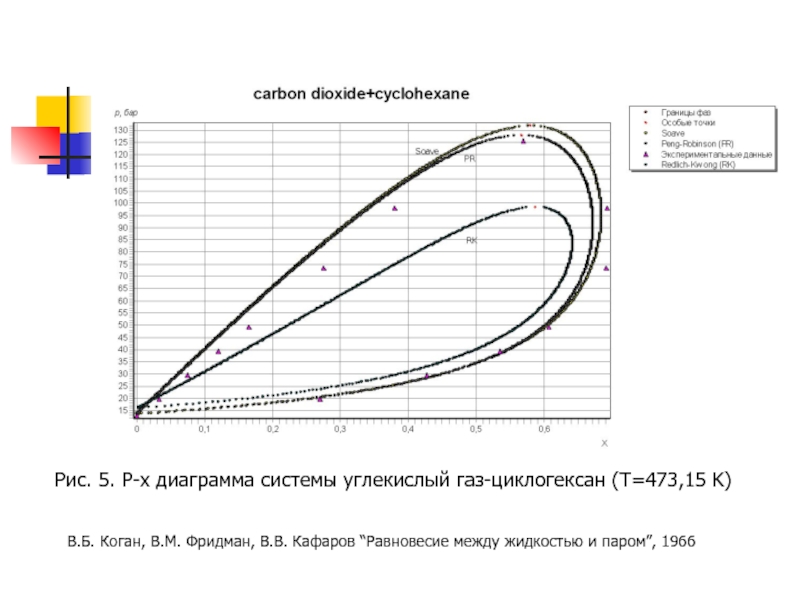
- 16. Рис. 5. P-x диаграмма системы углекислый газ-циклогексан
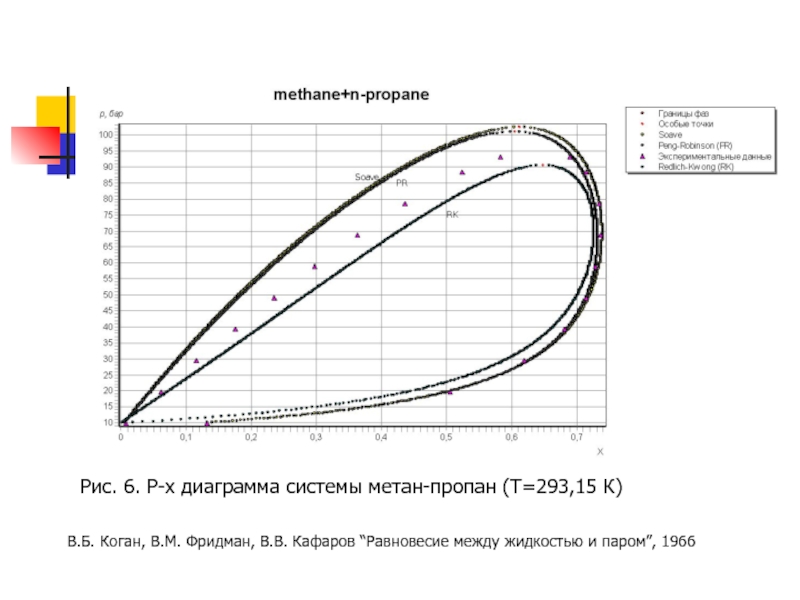
- 17. Рис. 6. P-x диаграмма системы метан-пропан (T=293,15
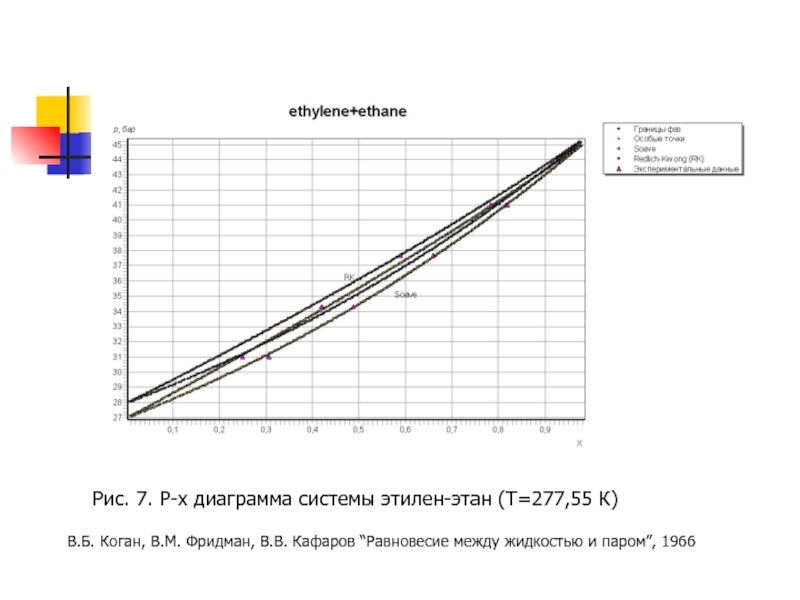
- 18. Рис. 7. P-x диаграмма системы этилен-этан (T=277,55
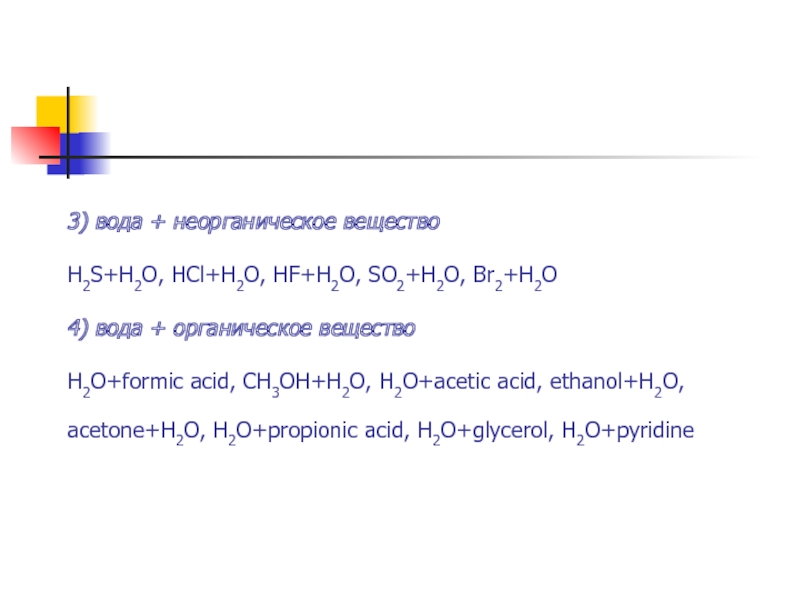
- 19. 3) вода + неорганическое вещество H2S+H2O,
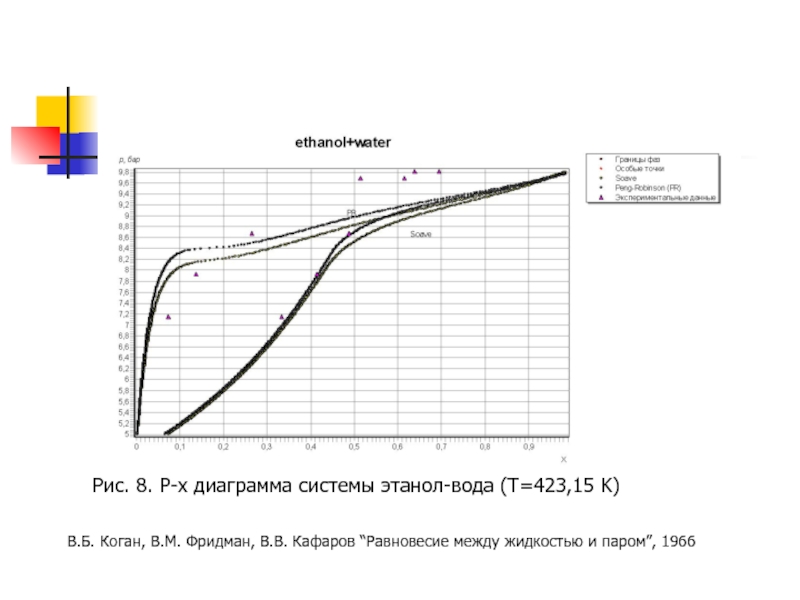
- 20. Рис. 8. P-x диаграмма системы этанол-вода (T=423,15
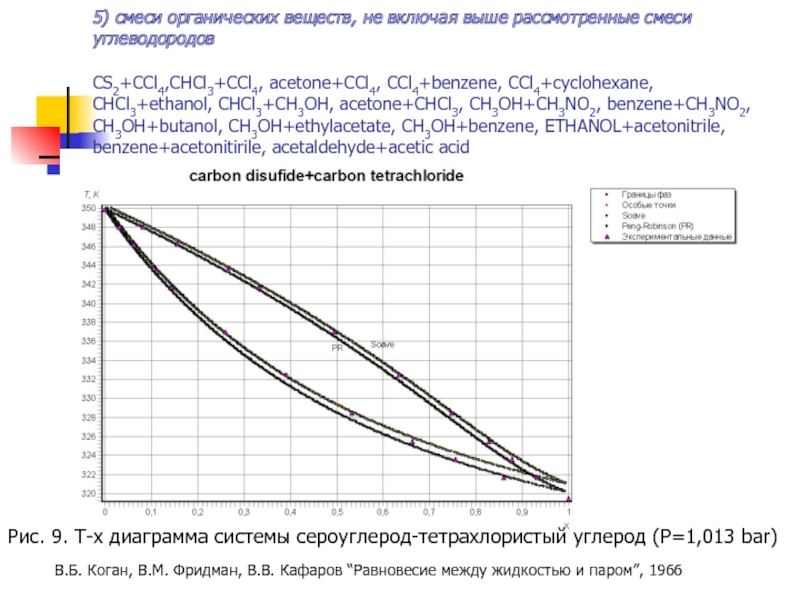
- 21. Рис. 9. T-x диаграмма системы сероуглерод-тетрахлористый углерод
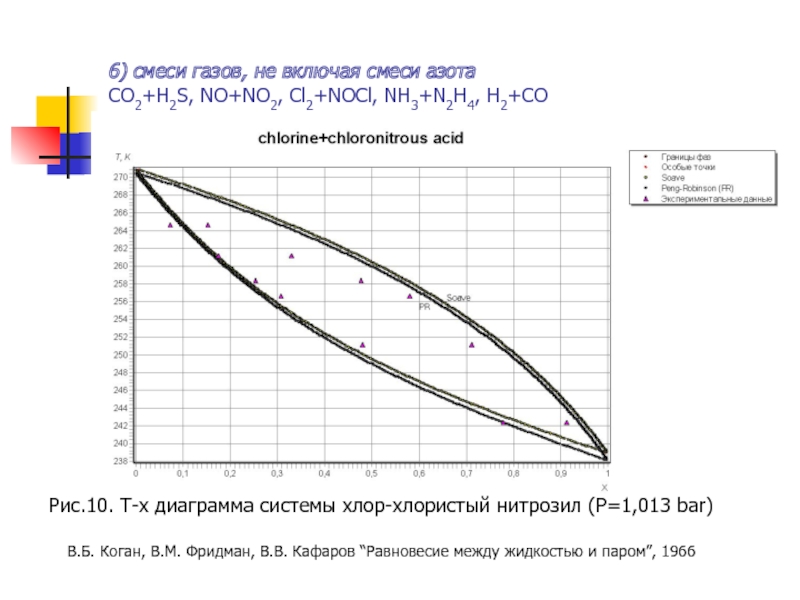
- 22. 6) смеси газов, не включая смеси азота
- 23. Rodrigues W.L., Mattedi S., Abreu J.C.N,
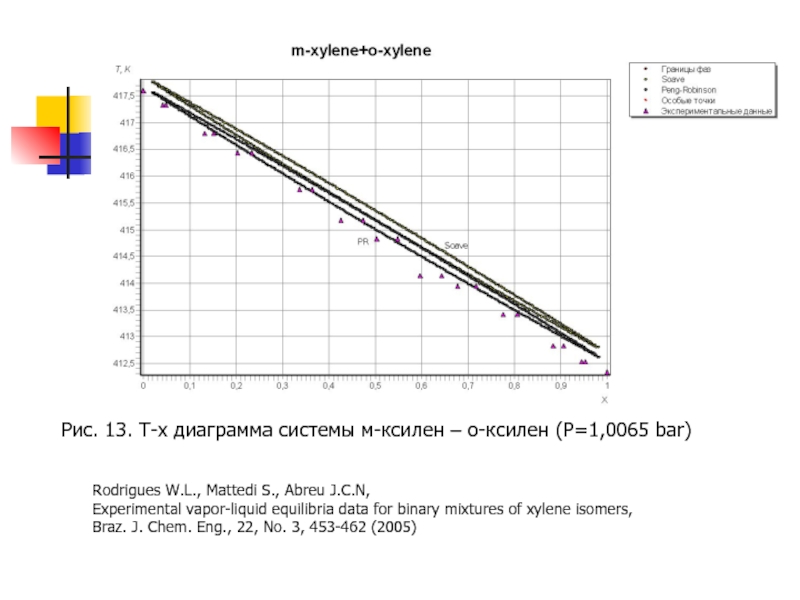
- 24. Рис. 13. T-x диаграмма системы м-ксилен –
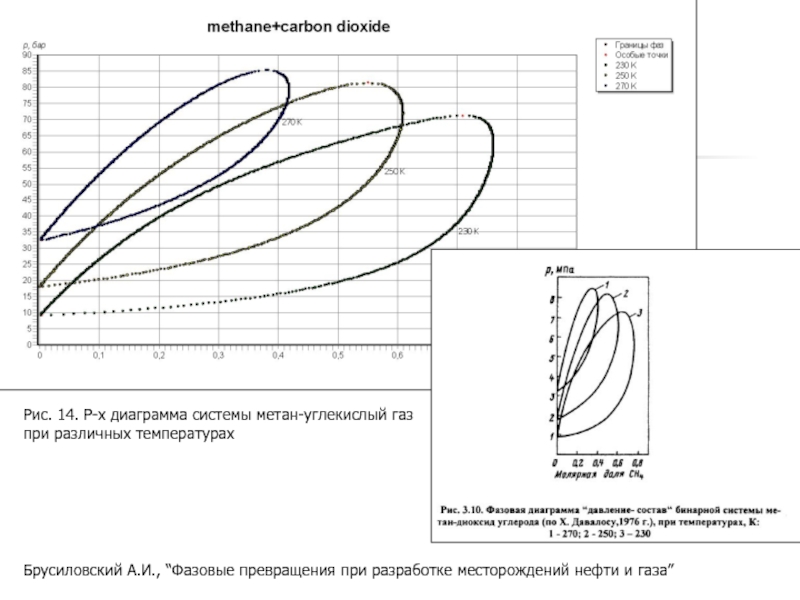
- 25. Брусиловский А.И., “Фазовые превращения при разработке месторождений
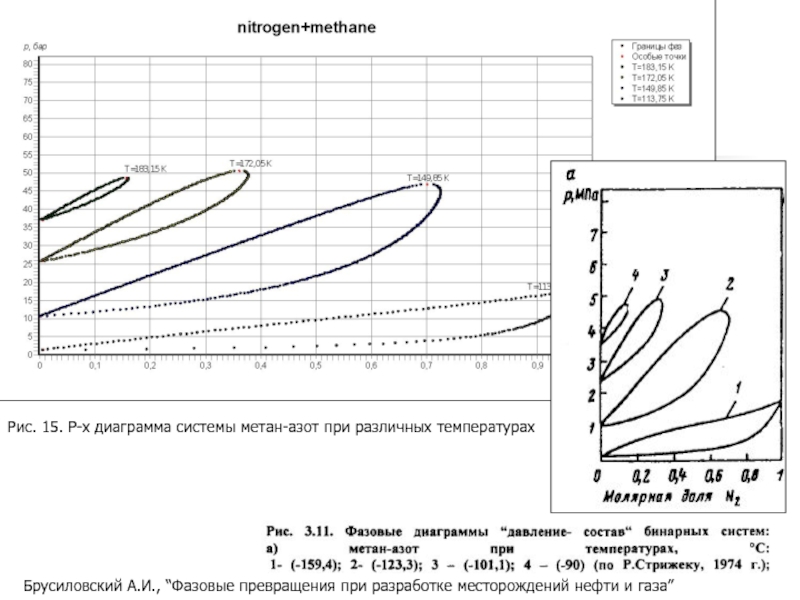
- 26. Брусиловский А.И., “Фазовые превращения при разработке месторождений
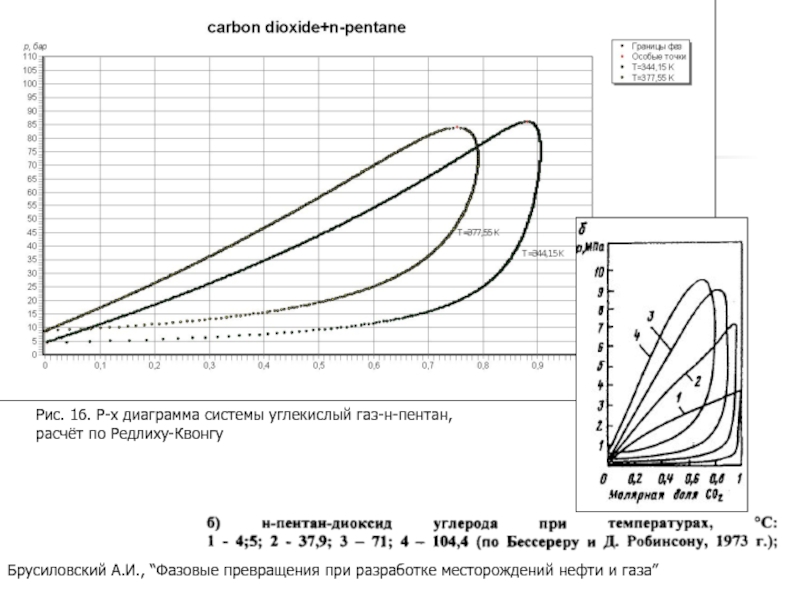
- 27. Брусиловский А.И., “Фазовые превращения при разработке месторождений
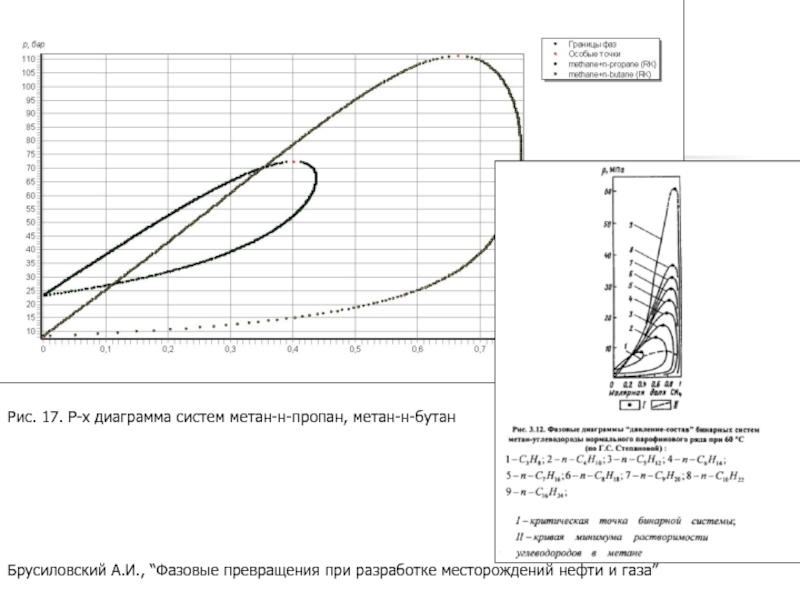
- 28. Брусиловский А.И., “Фазовые превращения при разработке месторождений
- 29. Выводы Информационно-вычислительный комплекс PhDi с
- 30. Уравнения Соава и Пенга-Робинсона можно использовать для
Слайд 1Возможности информационно-вычислительного комплекса PhDi для расчета парожидкостного равновесия
Лаборатория химической термодинамики, Кафедра
Химический факультет, МГУ
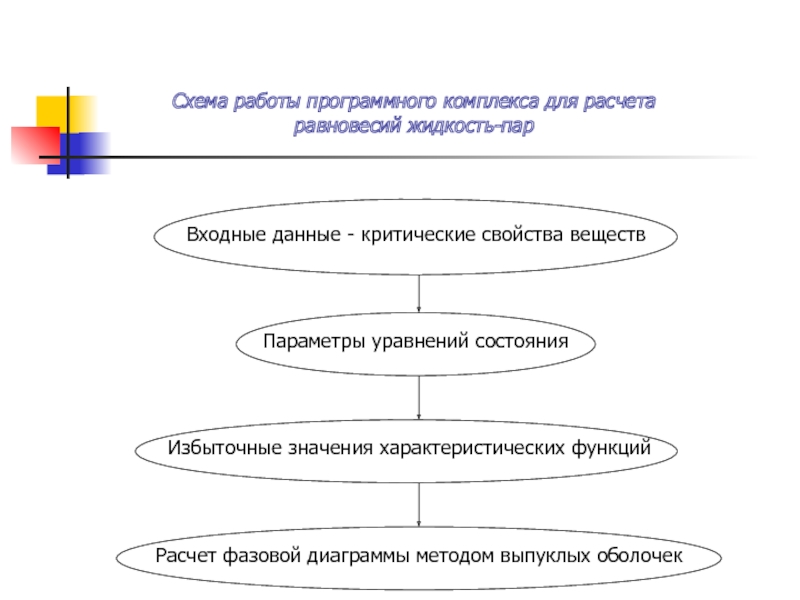
Слайд 2Входные данные - критические свойства веществ
Параметры уравнений состояния
Избыточные значения характеристических функций
Расчет
Схема работы программного комплекса для расчета
равновесий жидкость-пар
Слайд 3Цель работы
Проанализировать различные системы на совместимость экспериментальных данных по равновесию между
Оценить возможность использования данных уравнений для описания различного рода систем.
Слайд 9
Уравнение Ван-дер-Ваальса
Уравнение Редлиха-Квонга
Уравнение Пенга-Робинсона
Уравнение Соава
Соотношение для расчета избыточного значения
Слайд 10Соотношение для расчета избыточного значения энергии Гельмгольца:
Уравнение Ван-дер-Ваальса
Уравнение Редлиха-Квонга
Уравнение Пенга-Робинсона
Уравнение Соава
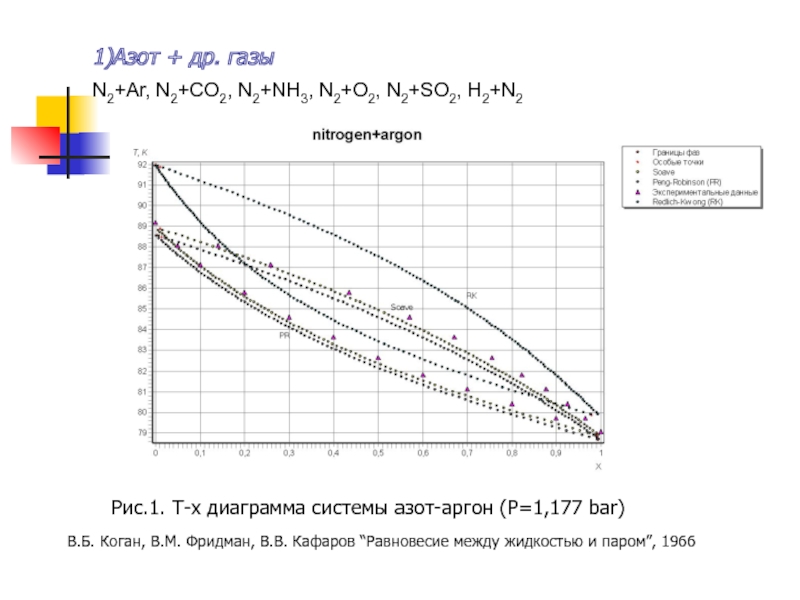
Слайд 121)Азот + др. газы
Рис.1. T-x диаграмма системы азот-аргон (P=1,177 bar)
N2+Ar, N2+CO2,
В.Б. Коган, В.М. Фридман, В.В. Кафаров “Равновесие между жидкостью и паром”, 1966
Слайд 13Рис. 2. P-x диаграмма системы азот-кислород (T=78,35 K)
В.Б. Коган, В.М. Фридман,
Слайд 142) углеводород + углеводород, H2S, H2, CO, CO2
Рис.3. P-x диаграмма системы
В.Б. Коган, В.М. Фридман, В.В. Кафаров “Равновесие между жидкостью и паром”, 1966
Слайд 15Рис. 4. P-x диаграмма системы водород-бензол (T=298,15 K)
В.Б. Коган, В.М. Фридман,
Слайд 16Рис. 5. P-x диаграмма системы углекислый газ-циклогексан (T=473,15 K)
В.Б. Коган, В.М.
Слайд 17Рис. 6. P-x диаграмма системы метан-пропан (T=293,15 К)
В.Б. Коган, В.М. Фридман,
Слайд 18Рис. 7. P-x диаграмма системы этилен-этан (T=277,55 К)
В.Б. Коган, В.М. Фридман,
Слайд 193) вода + неорганическое вещество H2S+H2O, HCl+H2O, HF+H2O, SO2+H2O, Br2+H2O 4) вода
Слайд 20Рис. 8. P-x диаграмма системы этанол-вода (T=423,15 K)
В.Б. Коган, В.М. Фридман,
Слайд 21Рис. 9. T-x диаграмма системы сероуглерод-тетрахлористый углерод (P=1,013 bar)
5) смеси органических
В.Б. Коган, В.М. Фридман, В.В. Кафаров “Равновесие между жидкостью и паром”, 1966
Слайд 226) смеси газов, не включая смеси азота
CO2+H2S, NO+NO2, Cl2+NOCl, NH3+N2H4, H2+CO
Рис.10.
В.Б. Коган, В.М. Фридман, В.В. Кафаров “Равновесие между жидкостью и паром”, 1966
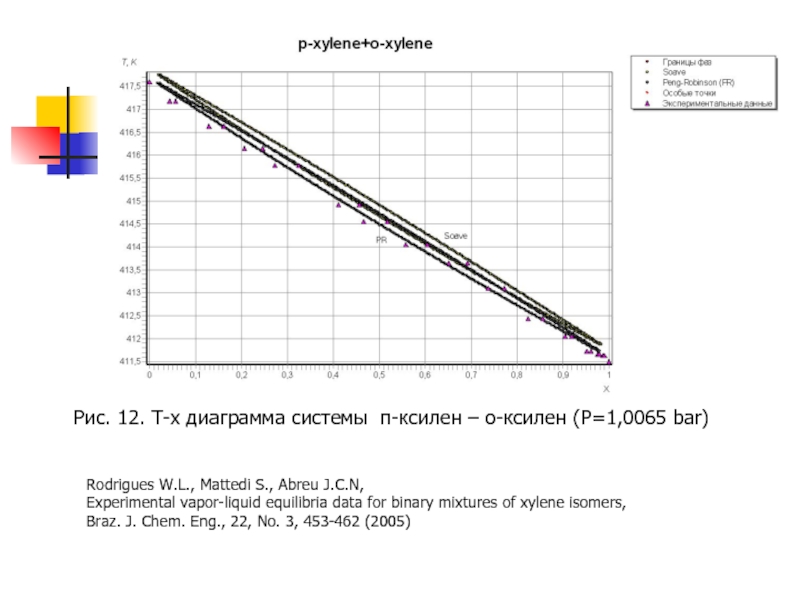
Слайд 23Rodrigues W.L., Mattedi S., Abreu J.C.N,
Experimental vapor-liquid equilibria data for
Braz. J. Chem. Eng., 22, No. 3, 453-462 (2005)
Rodrigues W.L., Mattedi S., Abreu J.C.N,
Experimental vapor-liquid equilibria data for binary mixtures of xylene isomers,
Braz. J. Chem. Eng., 22, No. 3, 453-462 (2005)
Рис. 12. T-x диаграмма системы п-ксилен – о-ксилен (P=1,0065 bar)
Слайд 24Рис. 13. T-x диаграмма системы м-ксилен – о-ксилен (P=1,0065 bar)
Rodrigues W.L.,
Experimental vapor-liquid equilibria data for binary mixtures of xylene isomers,
Braz. J. Chem. Eng., 22, No. 3, 453-462 (2005)
Слайд 25Брусиловский А.И., “Фазовые превращения при разработке месторождений нефти и газа”
Рис.
при различных температурах
Слайд 26Брусиловский А.И., “Фазовые превращения при разработке месторождений нефти и газа”
Рис.
Слайд 27Брусиловский А.И., “Фазовые превращения при разработке месторождений нефти и газа”
Рис.
расчёт по Редлиху-Квонгу
Слайд 28Брусиловский А.И., “Фазовые превращения при разработке месторождений нефти и газа”
Рис.
Слайд 29Выводы
Информационно-вычислительный комплекс PhDi с использованием уравнений состояния можно использовать для расчёта
Уравнение Редлиха-Квонга возможно использовать для описания смесей углеводородов и углеводородов с простыми веществами, но лучше использовать его модификации. В некоторых областях их вытеснили уравнения Соава и Пенга-Робинсона, хотя для достижения высокой степени точности при применении указанных уравнений требуется существенно больший объем информации о компонентах смеси, в частности, данные об ацентрическом коэффициенте и параметрах бинарного взаимодействия.
Слайд 30Уравнения Соава и Пенга-Робинсона можно использовать для описания широкого круга смесей,
Выводы