- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Водород презентация
Содержание
- 1. Водород
- 2. Генри Кавендиш Выделение горючего газа при взаимодействии
- 3. Антуан Лавуазье Французский химик А. ЛавуазьеФранцузский химик
- 4. Происхождение названия А.Лавуазье
- 5. Физические свойства При обычных условиях водород -
- 6. Распространённость Земная кора
- 7. Во Вселенной Водород —
- 8. Получение В лаборатории 1.Действие разбавленных кислот
- 9. Zn Zn + H H Cl
- 10. Взаимодействие кальция с водой. Ca + H
- 12. Химические свойства Молекулы водорода Н2 довольно
- 13. Химические свойства. С большинством же металлов и
- 14. Химические свойства. С неметаллами: F2 + H2
- 15. Особенности обращения Водород при
- 16. Применение водорода. Водород используется для
- 17. Химическая промышленность При производстве аммиакаПри производстве аммиака, мылаПри производстве аммиака, мыла и пластмасс
- 18. Пищевая промышленность При производстве маргарина из
- 19. Метеорология. Водород очень лёгок и в
- 20. Но в 30-х гг. XX в. произошло
- 21. Водород топливо. Водородные двигатели не
- 22. Тест. Какое из приведенных утверждений неверно:
- 23. п. 6.1 – 6.6; Конспект в
Слайд 2Генри Кавендиш
Выделение горючего газа при взаимодействии кислот и металлов наблюдали в
История открытия.
Слайд 3Антуан Лавуазье
Французский химик А. ЛавуазьеФранцузский химик А. Лавуазье совместно с инженером
История открытия.
Слайд 4 Происхождение названия
А.Лавуазье дал водороду название hydrogène
(от др.-греч. ὕδωρ —
Слайд 5Физические свойства
При обычных условиях водород - газ без цвета и запаха.
Водород - самый легкий из всех элементов: в 14,5 раза легче воздуха, слабо растворим в воде (в 100 объемах воды при комнатной температуре растворяются 2 объема водорода).
При температуре -253 °С и атмосферном давлении водород переходит в жидкое состояние, а при -259 °С затвердевает.
При повышенной температуре водород хорошо растворим во многих металлах (никеле, платине, палладии).
Слайд 6Распространённость
Земная кора
Массовая доля водорода в земной коре
Слайд 7 Во Вселенной
Водород — самый распространённый элемент во Вселенной. На
В условиях звёздных температур (например, температура поверхности Солнца ~ 6000 °С) и межзвёздного пространства, пронизанного космическим излучением, этот элемент существует в виде отдельных атомов.
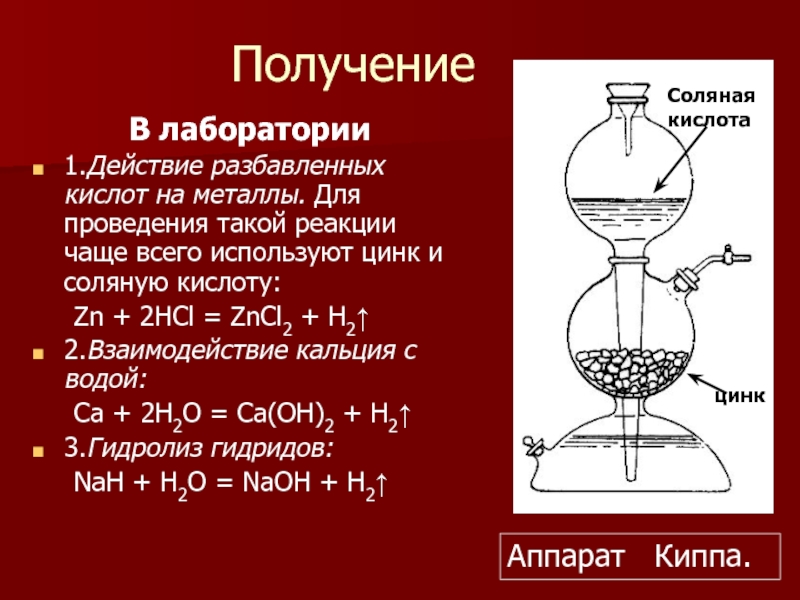
Слайд 8Получение
В лаборатории
1.Действие разбавленных кислот на металлы. Для проведения такой реакции
Zn + 2HCl = ZnCl2 + H2↑
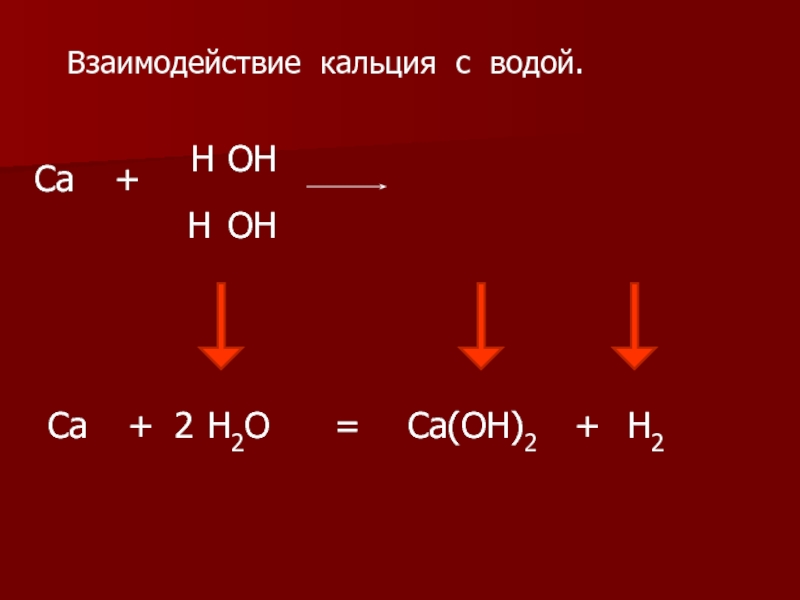
2.Взаимодействие кальция с водой:
Ca + 2H2O = Ca(OH)2 + H2↑
3.Гидролиз гидридов:
NaH + H2O = NaOH + H2↑
Аппарат Киппа.
Соляная кислота
цинк
Слайд 12Химические свойства
Молекулы водорода Н2 довольно прочны, и для того, чтобы
Н2 = 2Н − 432 кДж
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция:
Ca + Н2 = СаН2
и с единственным неметаллом — фтором, образуя фтороводород:
F2 + H2 = 2HF
Слайд 13Химические свойства.
С большинством же металлов и неметаллов водород реагирует при повышенной
CuO + Н2 = Cu + Н2O
Записанное уравнение отражает реакцию восстановления. Реакциями восстановления называются процессы, в результате которых от соединения отнимается кислород; вещества, отнимающие кислород, называются восстановителями (при этом они сами окисляются).
Слайд 14Химические свойства.
С неметаллами:
F2 + H2 = 2HF, реакция протекает со взрывом
Cl2 + H2 = 2HCl (хлороводород) реакция протекает со взрывом, только на свету.
С азотом образует газ аммиак(в особых условиях)
N2 + 3H2 = 2NH3
Слайд 15Особенности обращения
Водород при смеси с воздухомВодород при смеси с
Слайд 17Химическая промышленность
При производстве аммиакаПри производстве аммиака, мылаПри производстве аммиака, мыла и
Слайд 18Пищевая промышленность
При производстве маргарина из жидких растительных масел
Зарегистрирован в качестве
Слайд 19Метеорология.
Водород очень лёгок и в воздухеВодород очень лёгок и в воздухе
Слайд 20Но в 30-х гг. XX в. произошло несколько ужасных катастроф, когда
Метеорология.
Слайд 21Водород топливо.
Водородные двигатели не загрязняют окружающей среды и выделяют только
Слайд 22Тест.
Какое из приведенных утверждений неверно:
а)водород хорошо растворим в воде; б)
2. С какими из перечисленных веществ реагирует водород:
а) с солями; б) с оксидами металлов; в) с кислотами; г) с водой.
3. Опаснее всего подносить огонь к сосуду, в котором находится:
а) азот; б) кислород; в) смесь азота с водородом; г) смесь водорода с кислородом.
4. Вещества, отнимающие кислород, называются:
а) окислители; б) катализаторы; в) индикаторы; г) восстановители.
5. В состав молекулы любой кислоты входят атомы:
а) металла; б) водорода; в) хлора; г)кислорода.
Ответы: 1 – а; 2 – б; 3 – в; 4 – г; 5 – б.
Слайд 23 п. 6.1 – 6.6;
Конспект в тетради;
Творческое задание «Почему водород называют
Домашнее задание: