- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
В отличие от Kfs, нефелин содержит избыточный нормативный кремнезем в форме NaAlSi3O8. Причем его растворимость в твердом растворе нефелина есть функция температуры: чем выше Т, тем больше альбита растворяется в натровой части Ness. Это приводит к смещени презентация
Содержание
- 1. В отличие от Kfs, нефелин содержит избыточный нормативный кремнезем в форме NaAlSi3O8. Причем его растворимость в твердом растворе нефелина есть функция температуры: чем выше Т, тем больше альбита растворяется в натровой части Ness. Это приводит к смещени
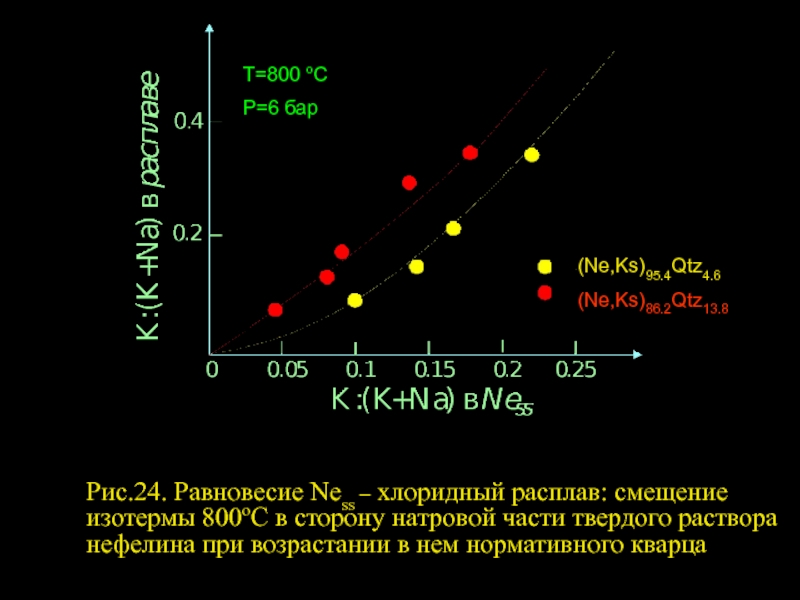
- 2. (Ne,Ks)95.4Qtz4.6 (Ne,Ks)86.2Qtz13.8 Т=800 оС Р=6 бар
- 3. Рис.25. Равновесие Ness-Kfs: смещение изотермы 700оС в
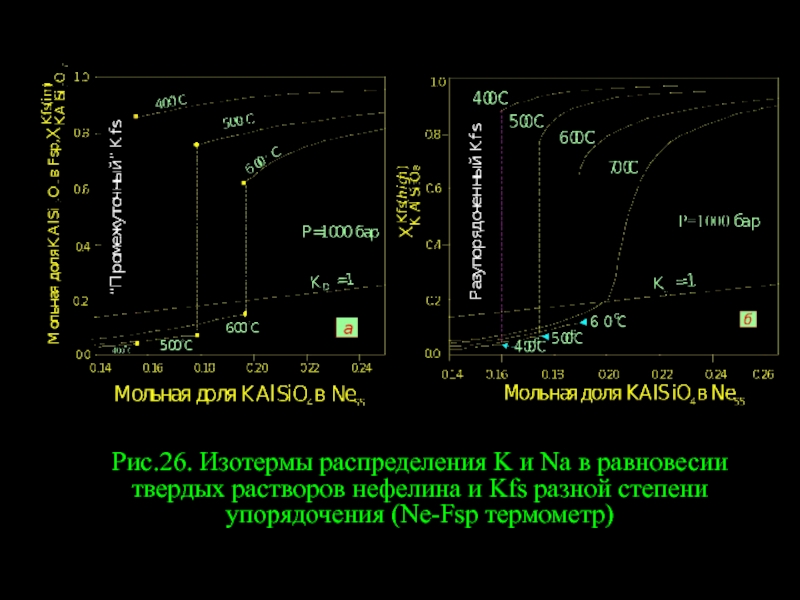
- 4. Рис.26. Изотермы распределения K и Na в
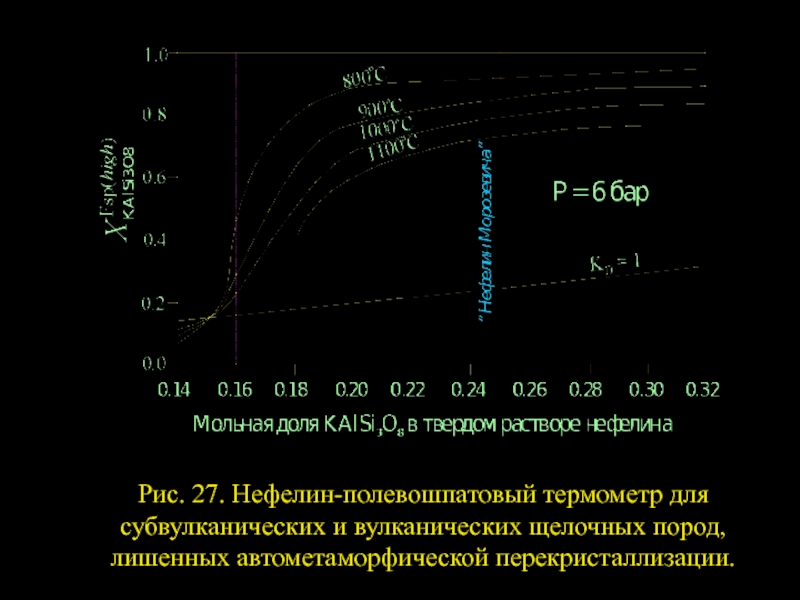
- 5. Рис. 27. Нефелин-полевошпатовый термометр для субвулканических и вулканических щелочных пород, лишенных автометаморфической перекристаллизации.
- 6. МАГНЕТИТ-ИЛЬМЕНИТОВЫЙ ТЕРМОМЕТР ЛИНДСЛИ В 50-х годах
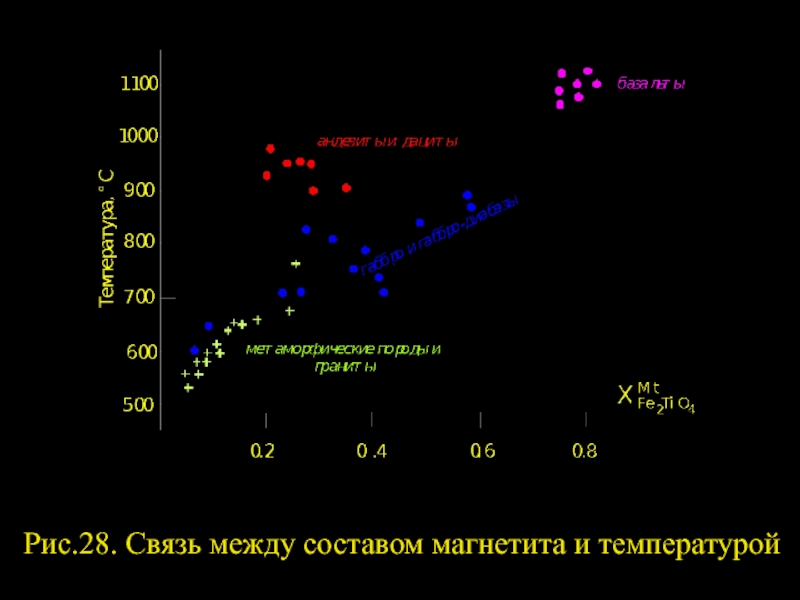
- 7. Рис.28. Связь между составом магнетита и температурой
- 8. Константа этой реакции
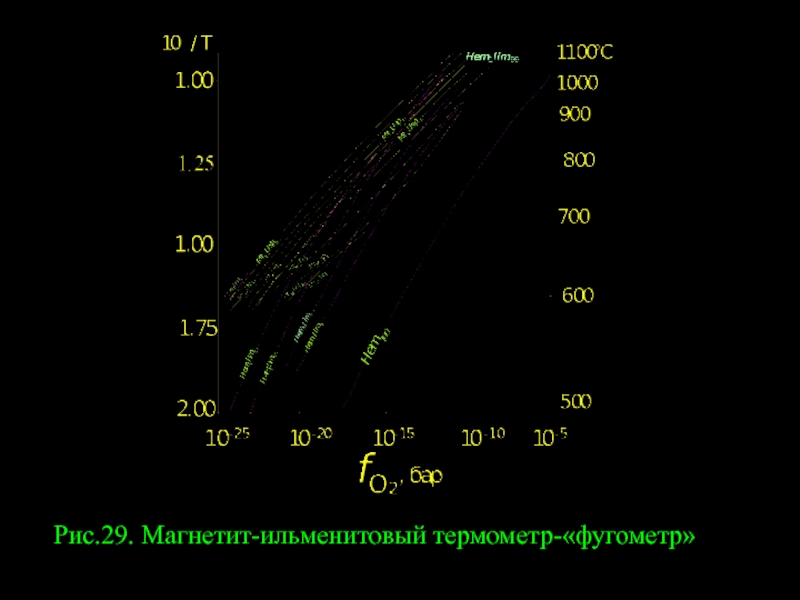
- 10. Рис.29. Магнетит-ильменитовый термометр-«фугометр»
- 11. ФАЗОВОЕ СООТВЕТСТВИЕ Fe-Mg-МИНЕРАЛОВ И ВЫВОД СИСТЕМЫ
- 12. Часть из них и по сей день
- 13. АМФИБОЛ – ПЛАГИОКЛАЗОВЫЙ ТЕРМОМЕТР Парагенезис этих
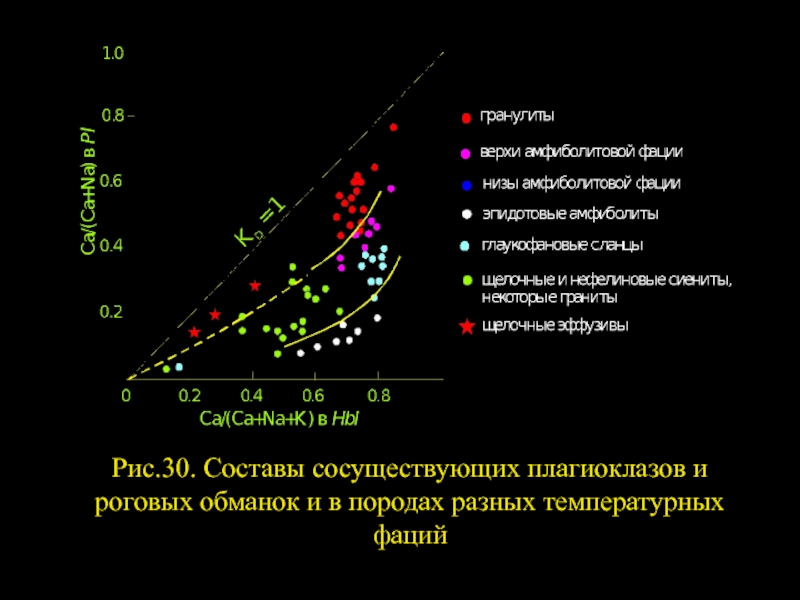
- 14. Рис.30. Составы сосуществующих плагиоклазов и роговых обманок и в породах разных температурных фаций
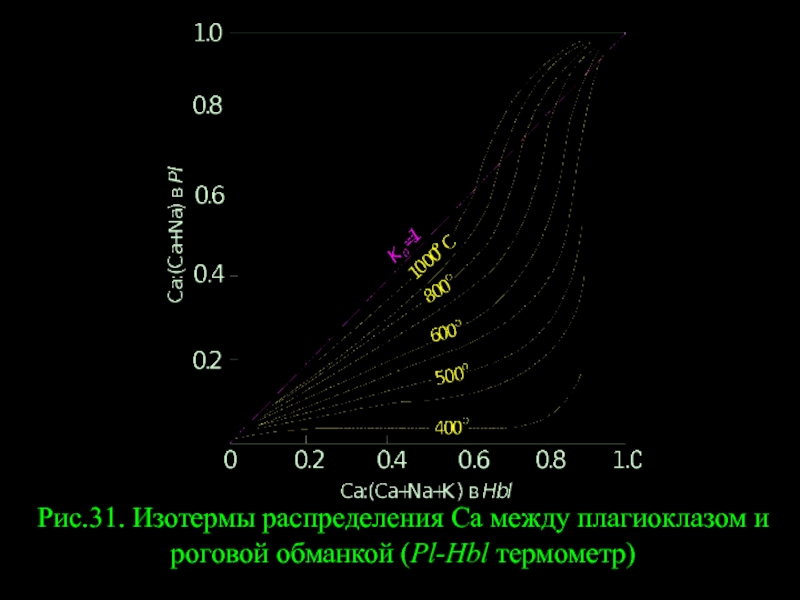
- 15. Рис.31. Изотермы распределения Са между плагиоклазом и роговой обманкой (Pl-Hbl термометр)
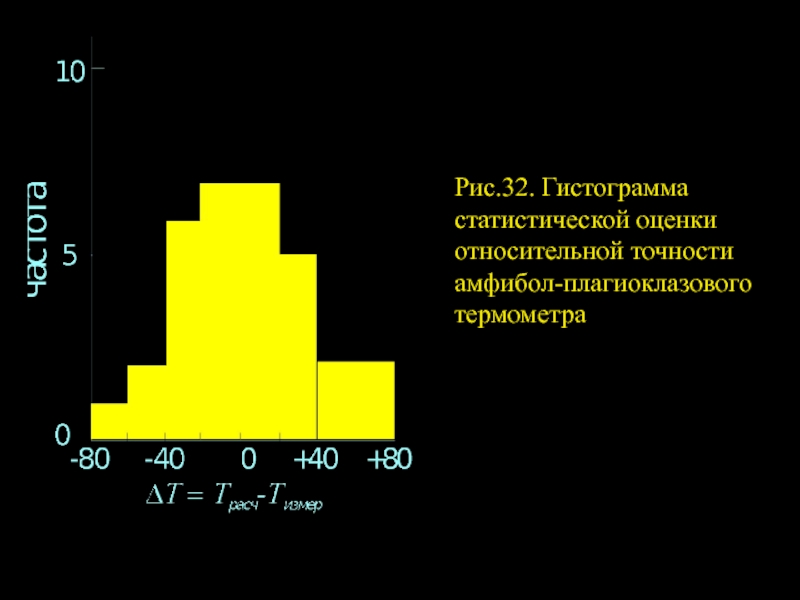
- 16. Рис.32. Гистограмма статистической оценки относительной точности амфибол-плагиоклазового термометра
- 17. Это типичный парагенезис гранатовых амфиболитов, эклогитов, глаукофановых
- 18. KD должен в значительной мере зависеть
- 19. Значительные отклонения составов сосуществующих Нbl и Grt
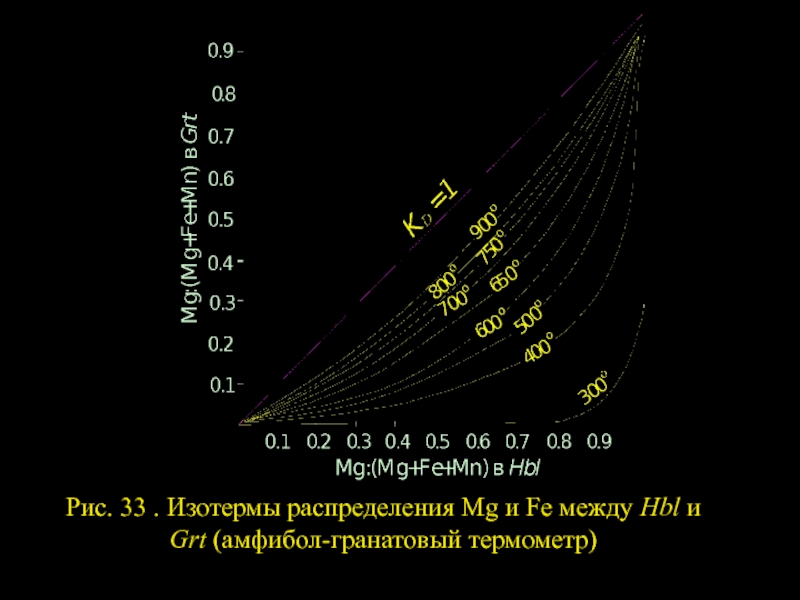
- 20. Рис. 33 . Изотермы распределения Mg и Fe между Hbl и Grt (амфибол-гранатовый термометр)
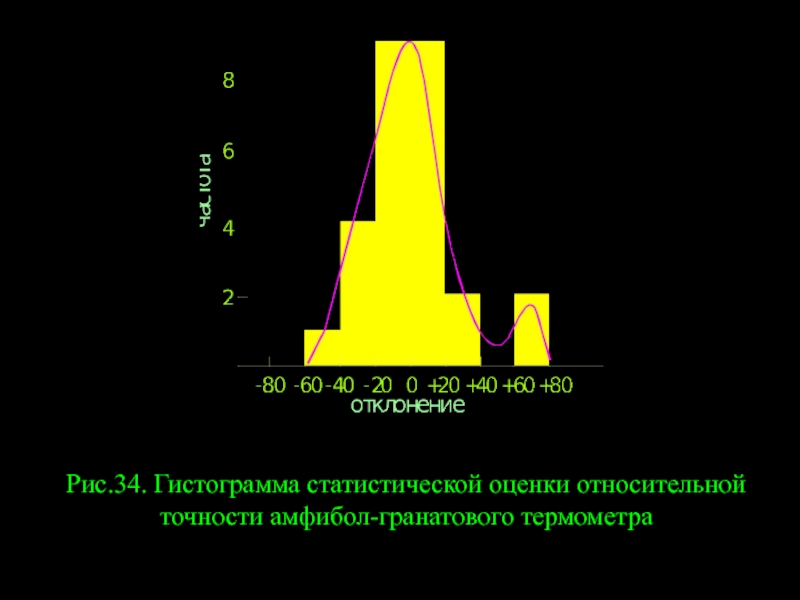
- 21. Рис.34. Гистограмма статистической оценки относительной точности амфибол-гранатового термометра
- 22. Этот парагенезис чрезвычайно широко распространен в самых
- 23. HblMg+CpxFe=CpxMg+HblFe
- 24. Распределение компонентов между Hbl и Срх не
- 25. Распределение Fe и Mg между , Срх
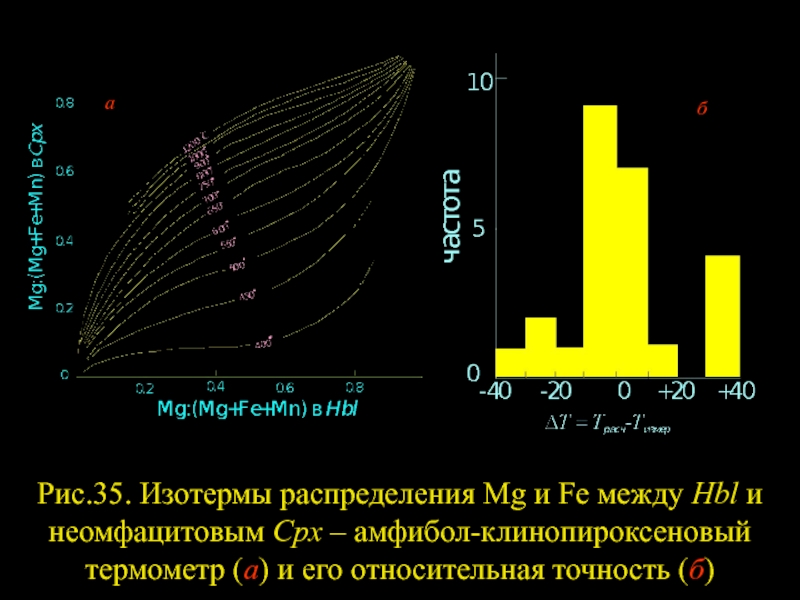
- 26. Рис.35. Изотермы распределения Mg и Fe между
- 27. Любые значительные отклонения от статистически средних составов
- 28. В высокобарных ассоциациях амфиболы часто представлены глаукофаном,
- 29. В эклогитах и глаукофановых сланцах амфиболы представлены
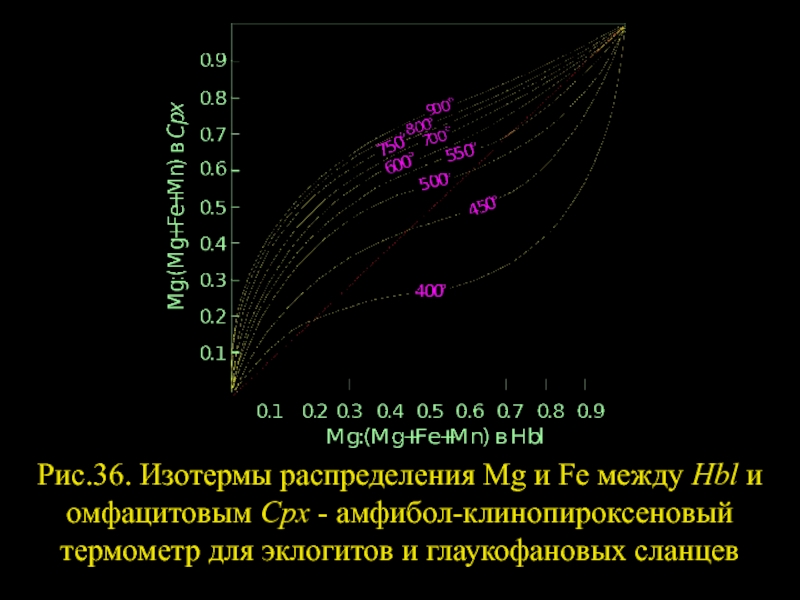
- 30. Рис.36. Изотермы распределения Mg и Fe
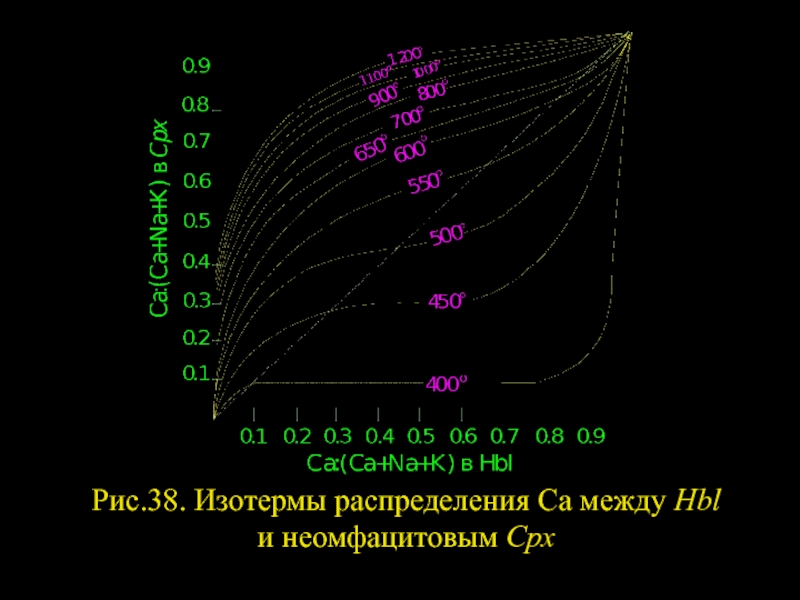
- 31. Распределение Са и щелочей между Hbl и
- 32. Рис.38. Изотермы распределения Ca между Hbl и неомфацитовым Срх
- 33. АМФИБОЛ - ОРТОПИРОКСЕН Это типичная ассоциация высокотемпературных
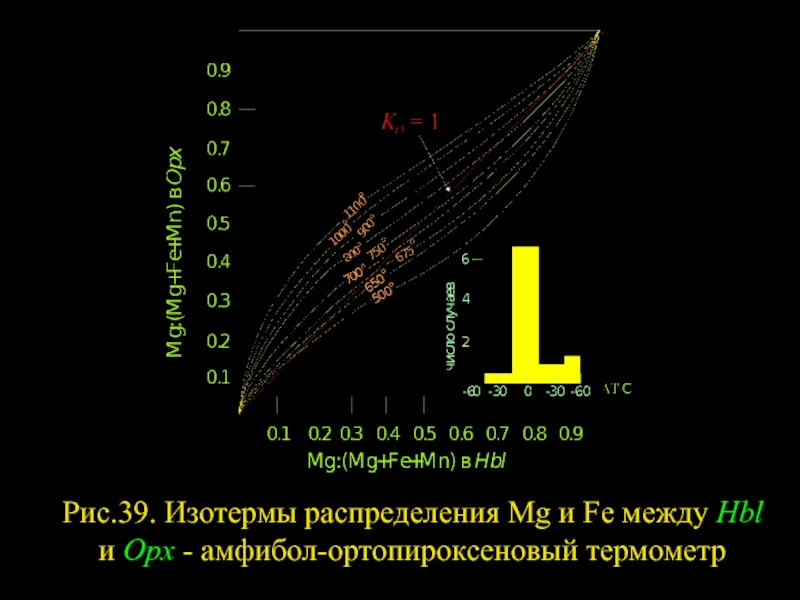
- 34. Рис.39. Изотермы распределения Mg и Fe между Hbl и Opx - амфибол-ортопироксеновый термометр
- 35. На диаграмме рис.36 изотермы пересекают диагональ, где
- 36. Рис.37. Экстремальные соотношения составов (XMg) равновесных Opx
- 37. БИОТИТ – КЛИНОПИРОКСЕН Ассоциация биотита с клинопироксеном
- 38. Распределение Fe и Mg между Bt и
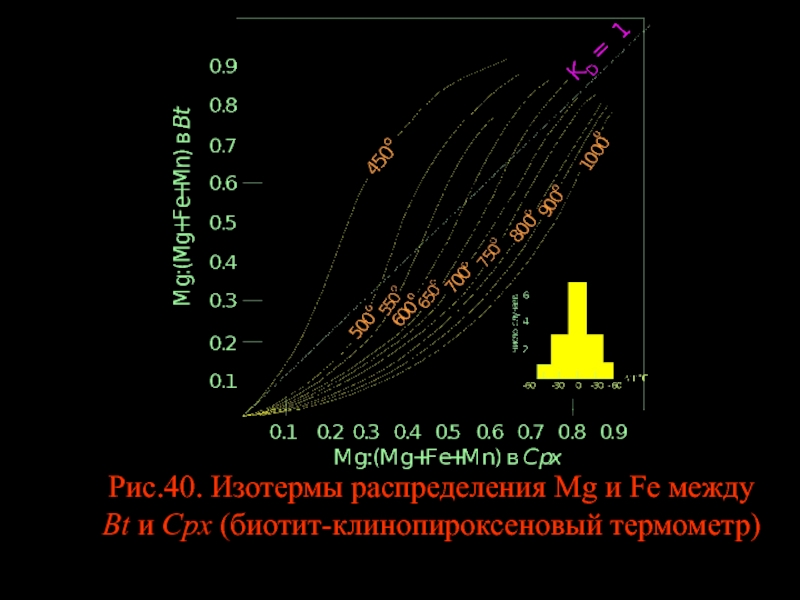
- 39. Рис.40. Изотермы распределения Mg и Fe между Bt и Cpx (биотит-клинопироксеновый термометр)
- 40. Как и в равновесиях Hbl-Cpx и Hbl-Орх,
- 41. БИОТИТ-ГРАНАТОВЫЙ ТЕРМОМЕТР И НЕКОТОРЫЕ ЕГО ПРОИЗВОДНЫЕ Биотит+гранат
- 42. BtMg+GrtFe=GrtMg+BtFe,
- 43. Это позволяет линейно экстраполировать величину
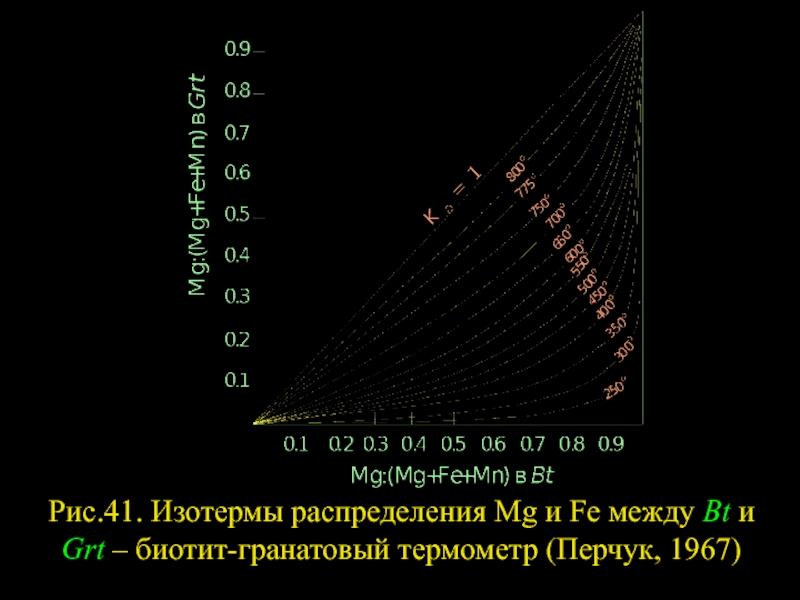
- 44. Рис.41. Изотермы распределения Mg и Fe
- 45. Заслуживают внимание лишь две из них (Ferry,
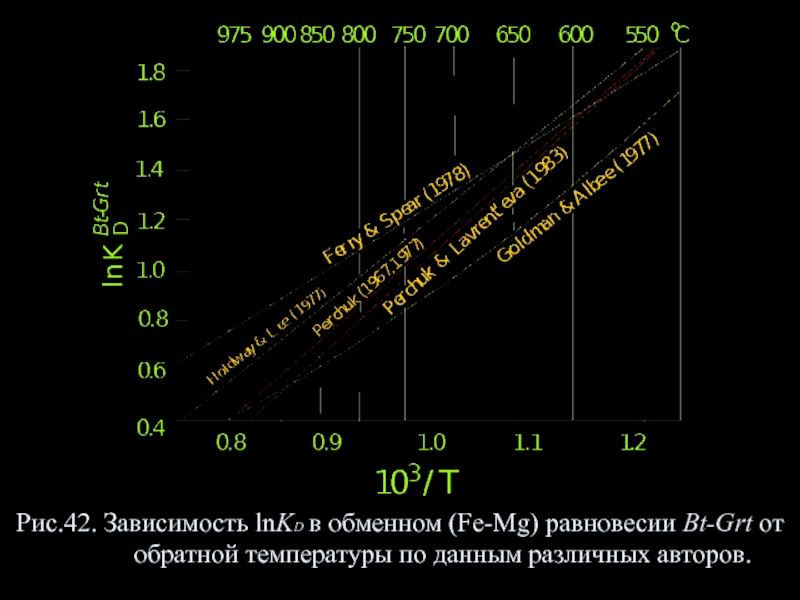
- 46. Рис.42. Зависимость lnKD в обменном (Fe-Mg) равновесии Bt-Grt от обратной температуры по данным различных авторов.
- 47. Биотит-гранатовый термометр лег в основу вывода целой
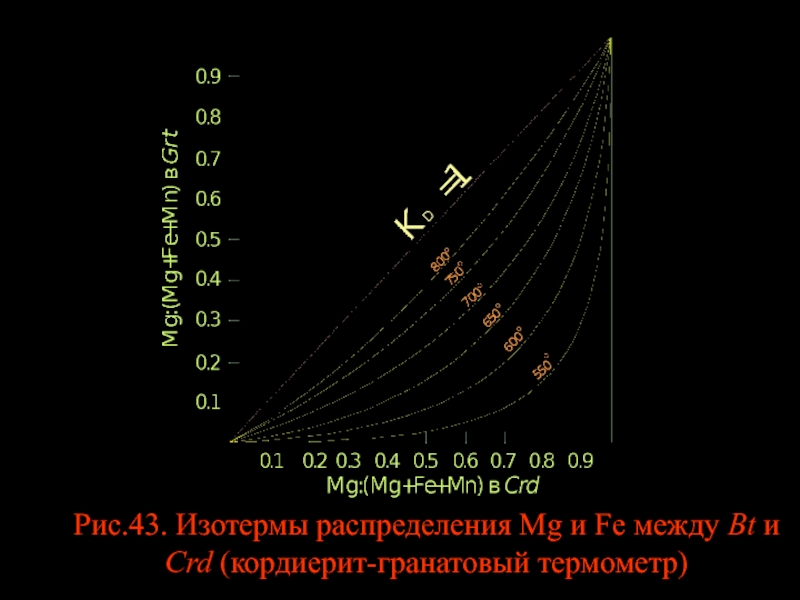
- 48. Рис.43. Изотермы распределения Mg и Fe между Bt и Crd (кордиерит-гранатовый термометр)
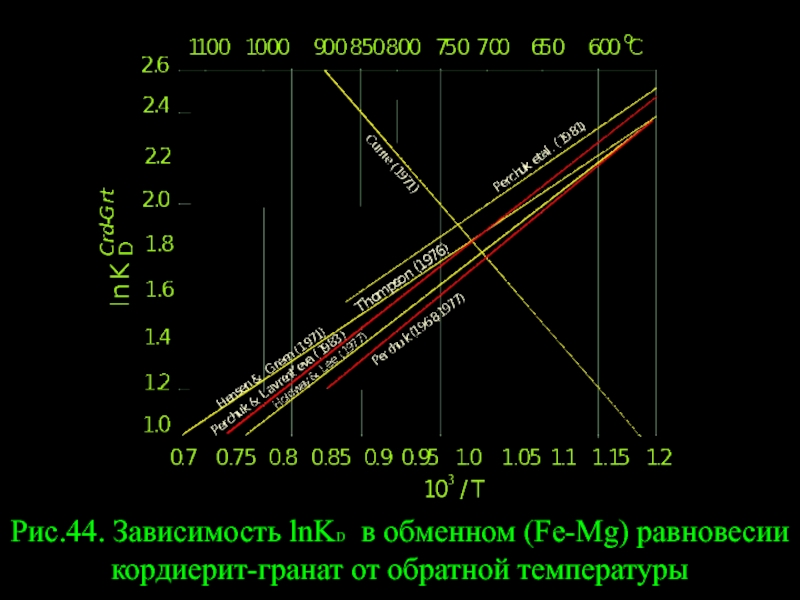
- 49. Рис.44. Зависимость lnKD в обменном (Fe-Mg) равновесии кордиерит-гранат от обратной температуры
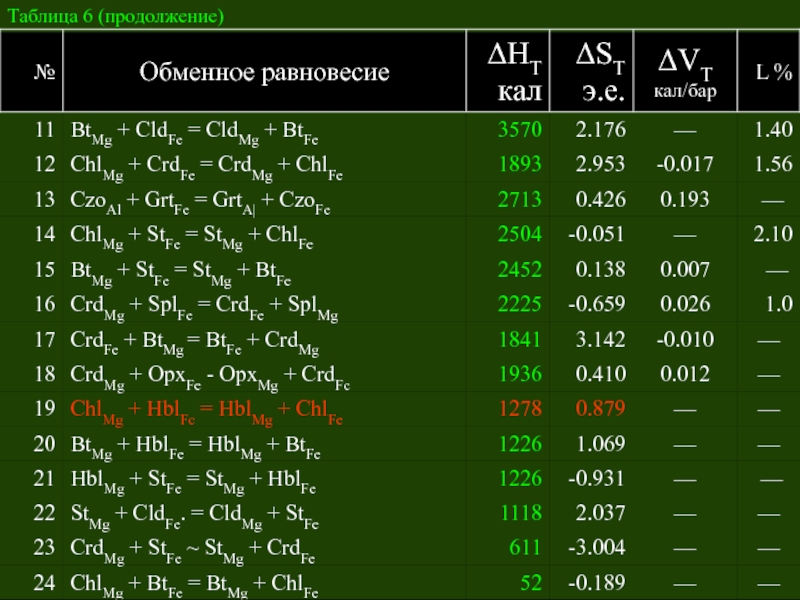
- 50. Таблица 6. Взаимосогласованные термодинамические данные для некоторых
- 51. Таблица 6 (продолжение)
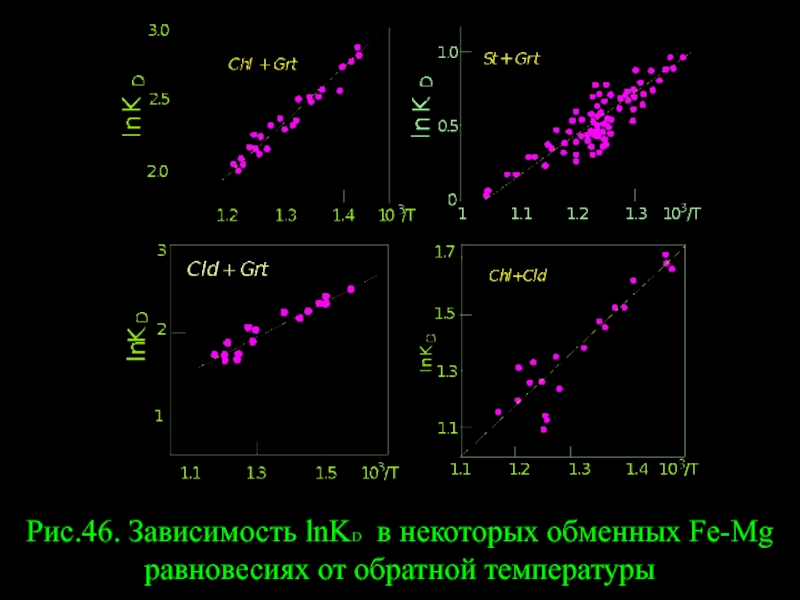
- 52. Рис.46. Зависимость lnKD в некоторых обменных Fe-Mg равновесиях от обратной температуры
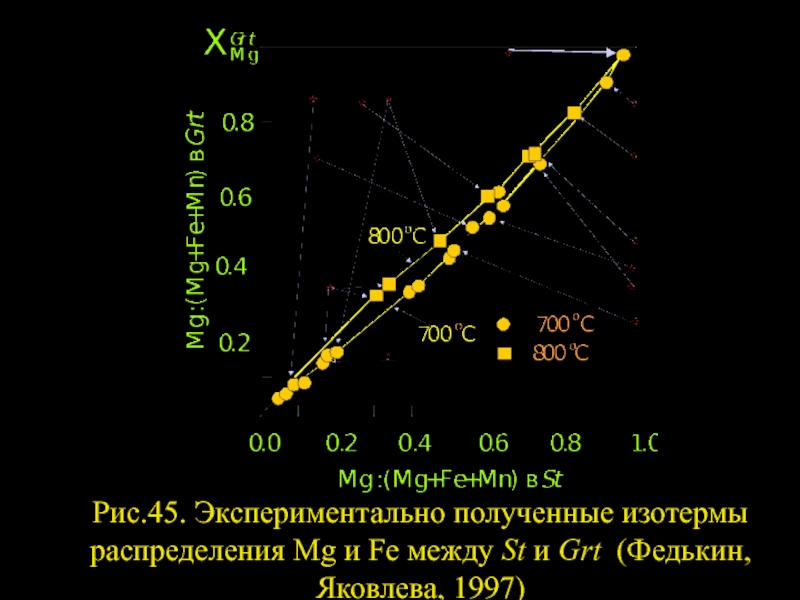
- 53. Рис.45. Экспериментально полученные изотермы распределения Mg и Fe между St и Grt (Федькин, Яковлева, 1997)
- 54. РАВНОВЕСИЕ АМФИБОЛ — БИОТИТ Парагенезис этих
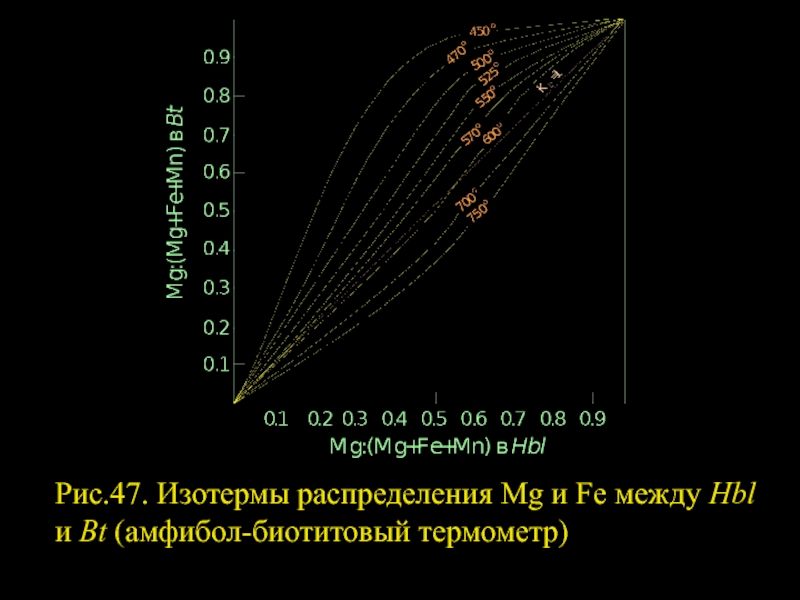
- 55. Рис.47. Изотермы распределения Mg и Fe между Hbl и Bt (амфибол-биотитовый термометр)
- 56. Это согласуется с положением Hbl и Bt
- 57. РАВНОВЕСИЕ ЭПИДОТ – ГРАНАТ Эпидот с
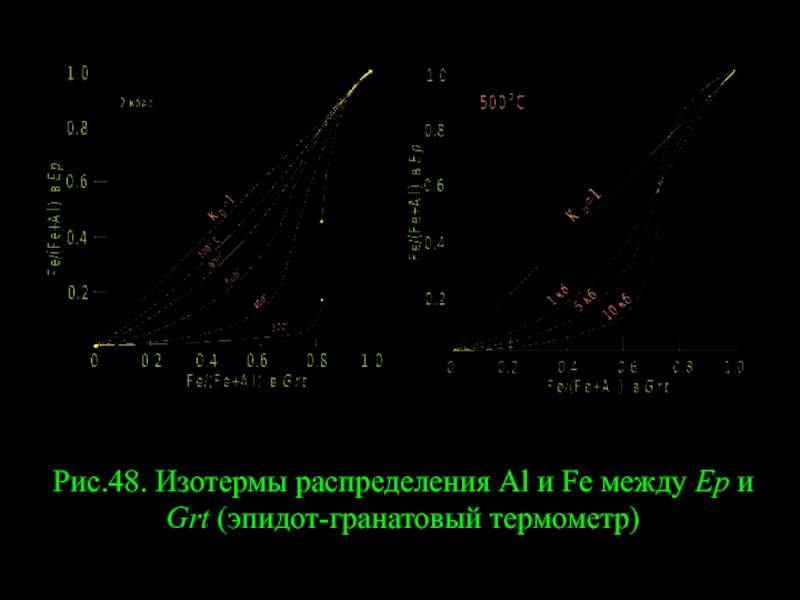
- 58. Рис.48. Изотермы распределения Al и Fe между Ep и Grt (эпидот-гранатовый термометр)
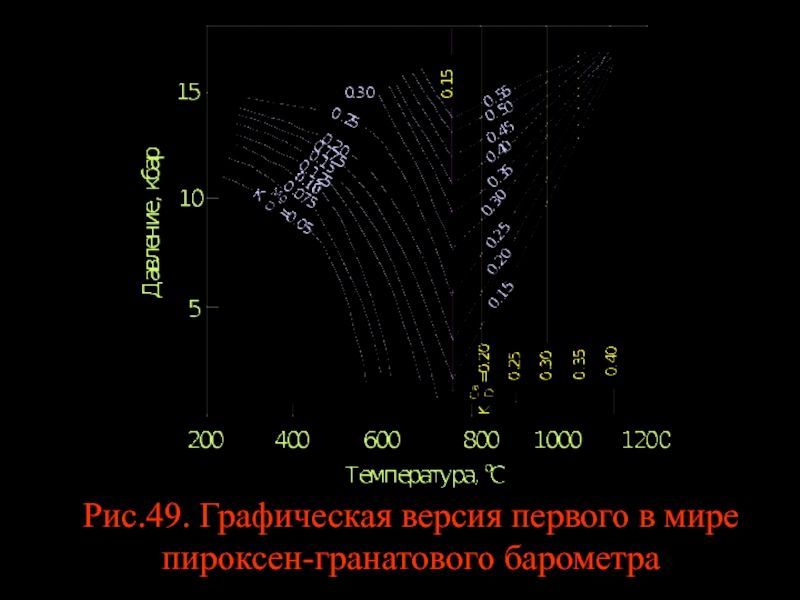
- 59. Рис.49. Графическая версия первого в мире пироксен-гранатового барометра
- 60. CМЕЩЕННЫЕ РАВНОВЕСИЯ В отличие от обменных, эти
- 61. Рис.50. Диаграммы температурной зависимости статистически средних составов
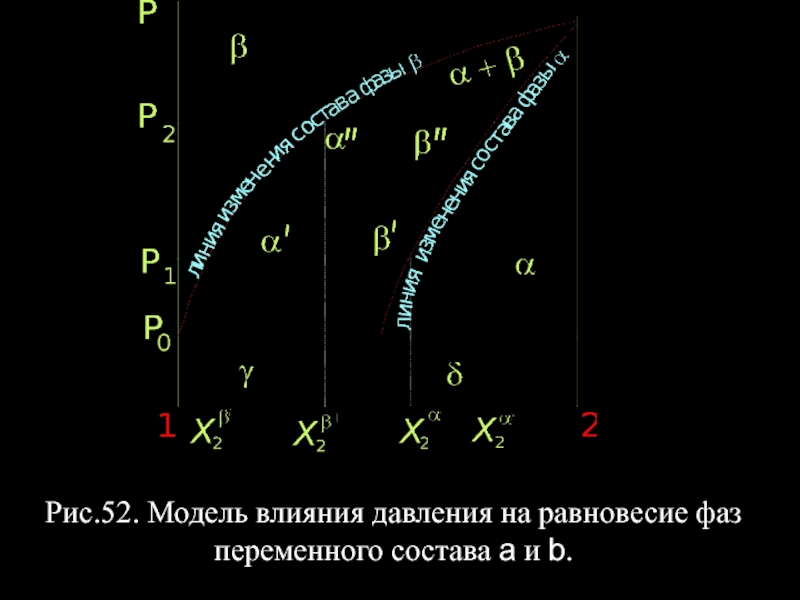
- 62. Рис.52. Модель влияния давления на равновесие фаз переменного состава a и b.
- 63. КОЭФФИЦИЕНТ РАЗДЕЛЕНИЯ Значение коэффициента распределения (239) для
- 64. α1 = β1 + nε
- 65. Пусть KD = 5, а составы равновесных
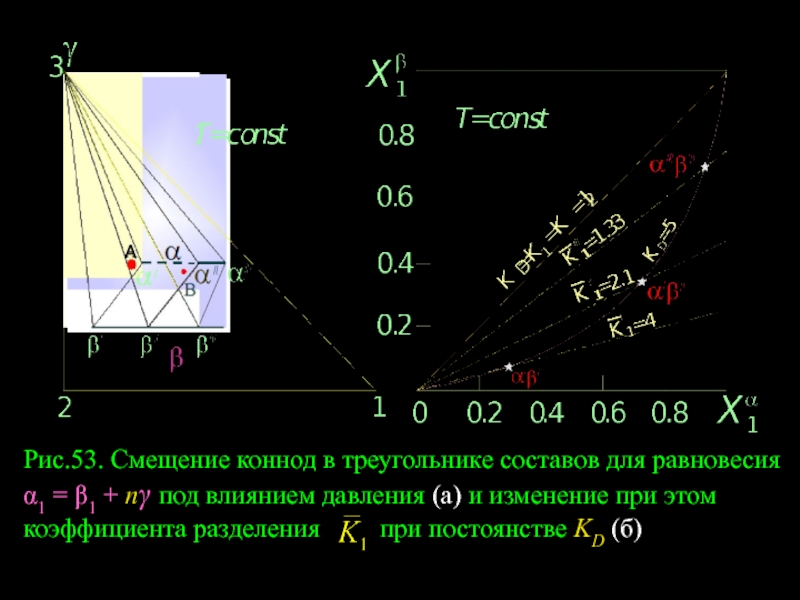
- 66. Рис.53. Смещение коннод в треугольнике составов
- 67. Рис.54. Одна из возможных схем смещения фигуративной
- 68. Наилучший пример рассмотренных соотношений – равновесие
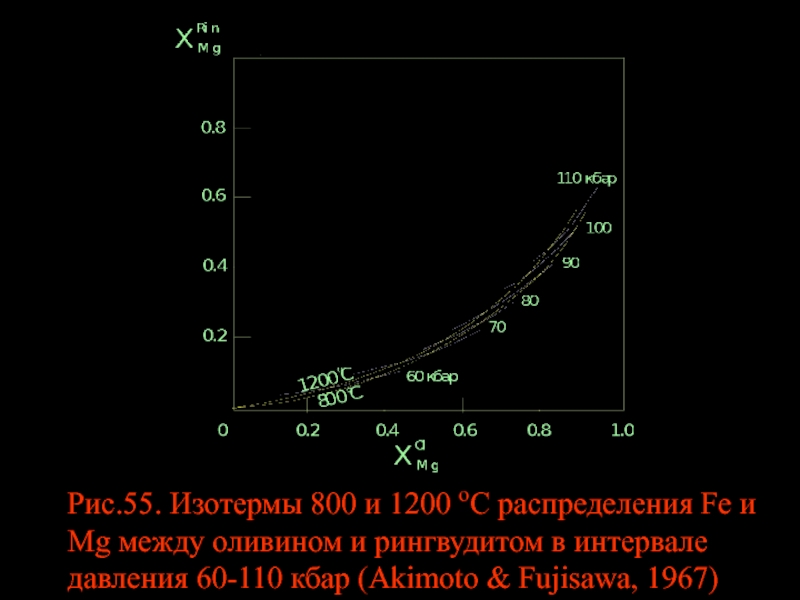
- 69. Рис.55. Изотермы 800 и 1200 oС распределения
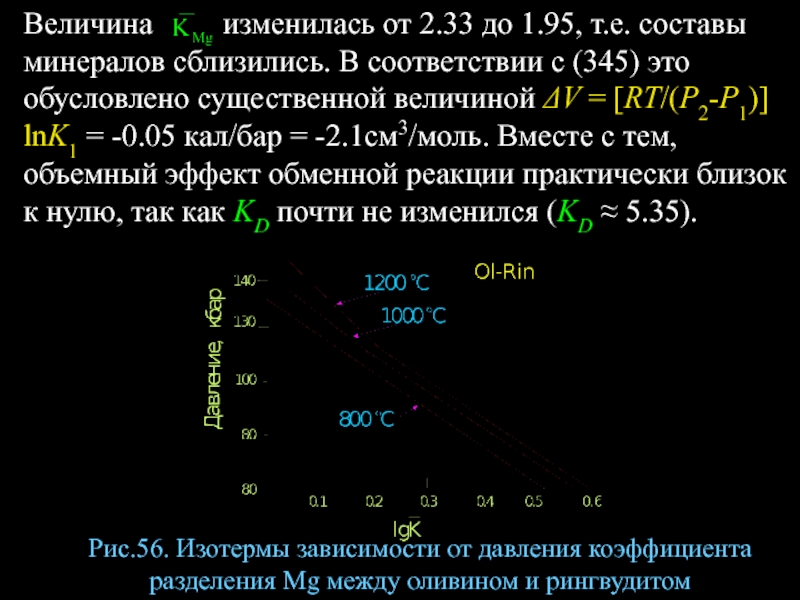
- 70. Величина изменилась
- 71. Мы рассмотрели одно из самых простых
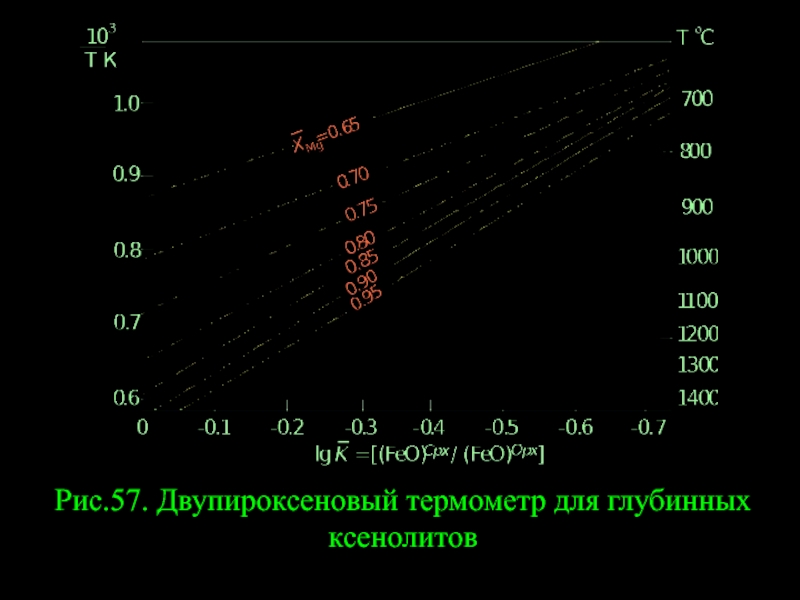
- 72. Рис.57. Двупироксеновый термометр для глубинных ксенолитов
- 73. Средняя мольная доля. Реакции, подобные (344) мы
- 74. Если, например, между фазами α, β,.........,ϕ есть
- 75. Здесь учтено сделанное выше допущение,
- 76. Аналогичным образом решаем систему (344) относительно
- 77. Подставляем (360) в (359) и, дифференцируя,
- 79. Производные (363) – (366) будут использованы для оценки точности диаграмм фазового соответствия – минералогических барометров.
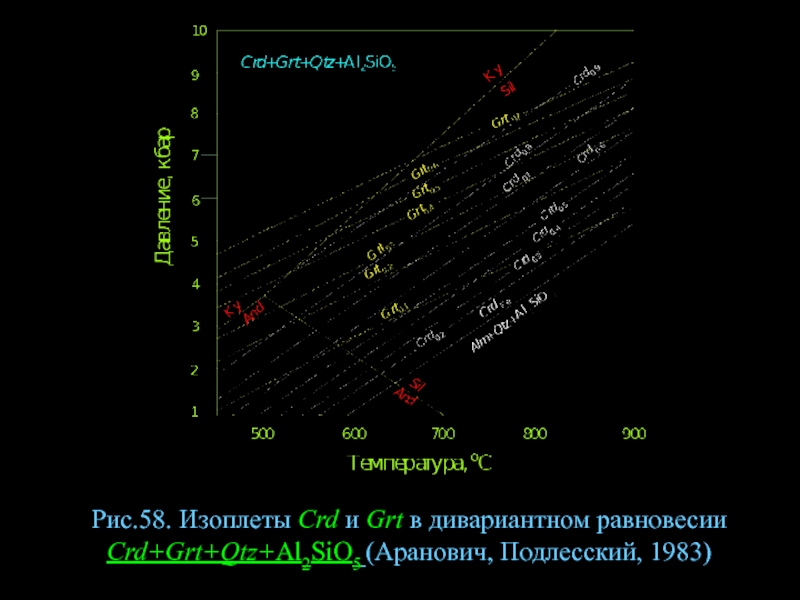
- 80. Рис.58. Изоплеты Crd и Grt в дивариантном равновесии Crd+Grt+Qtz+Al2SiO5 (Аранович, Подлесский, 1983)
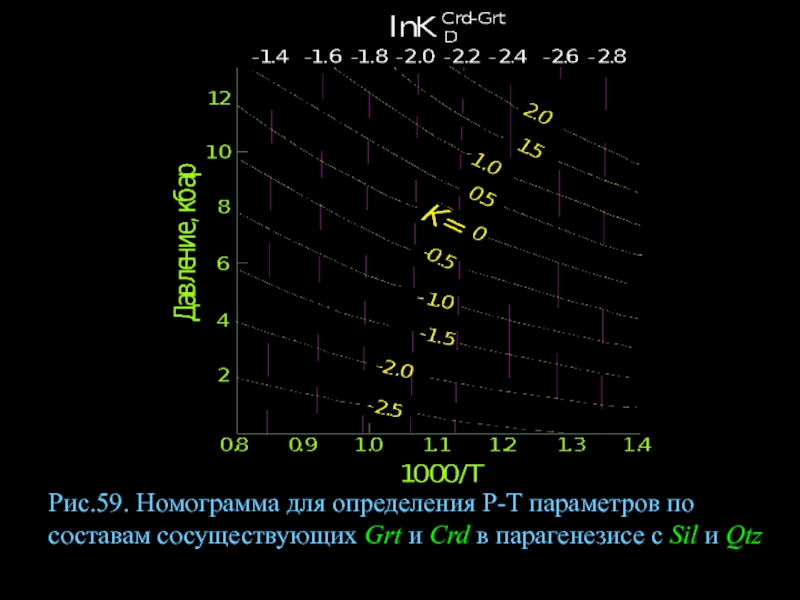
- 81. Рис.59. Номограмма для определения Р-Т параметров по
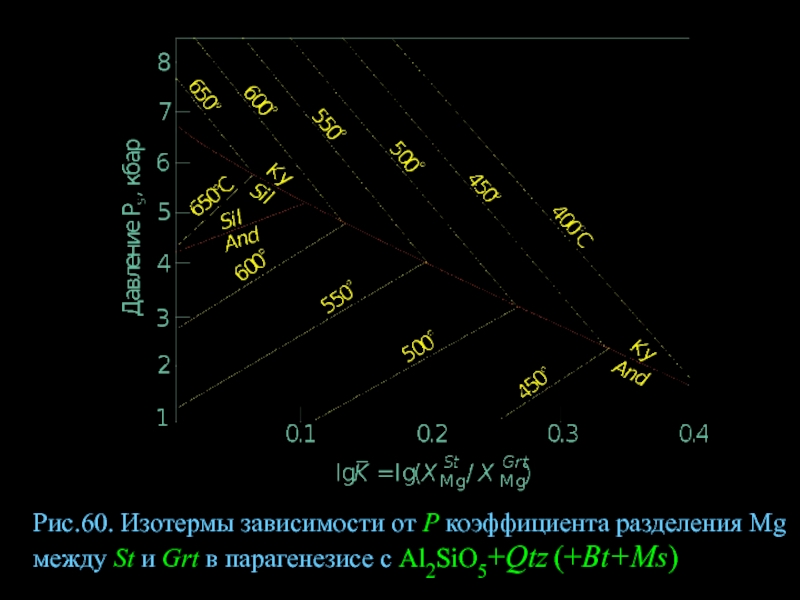
- 82. Рис.60. Изотермы зависимости от Р коэффициента разделения
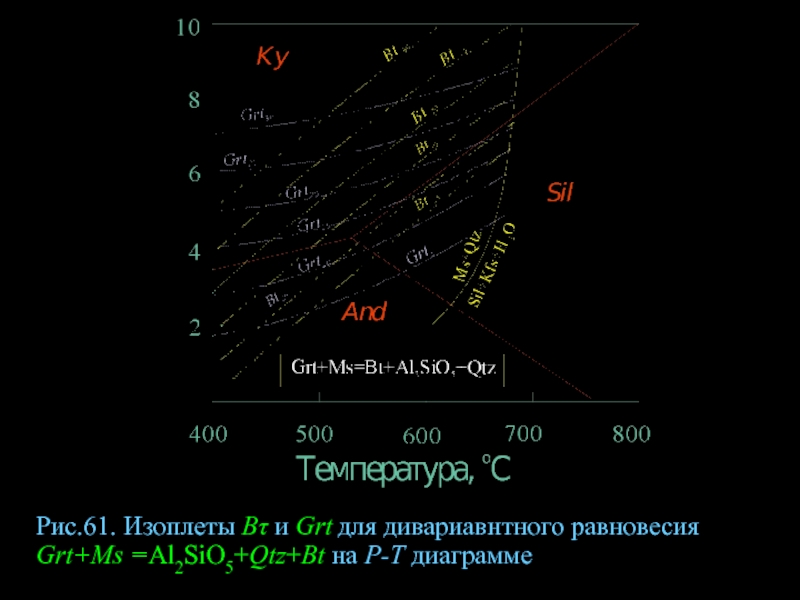
- 83. Рис.61. Изоплеты Βτ и Grt для дивариавнтного равновесия Grt+Ms =Al2SiO5+Qtz+Bt на Р-Т диаграмме
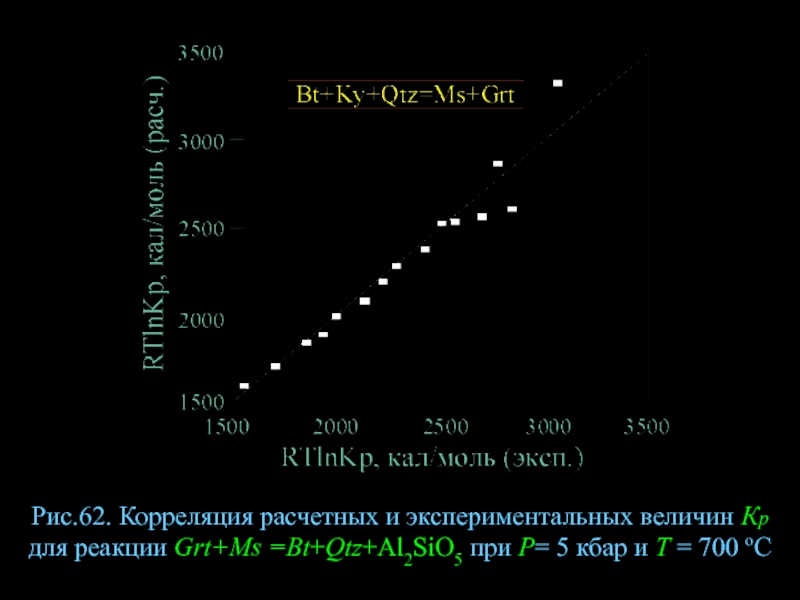
- 84. Рис.62. Корреляция расчетных и экспериментальных величин Кр
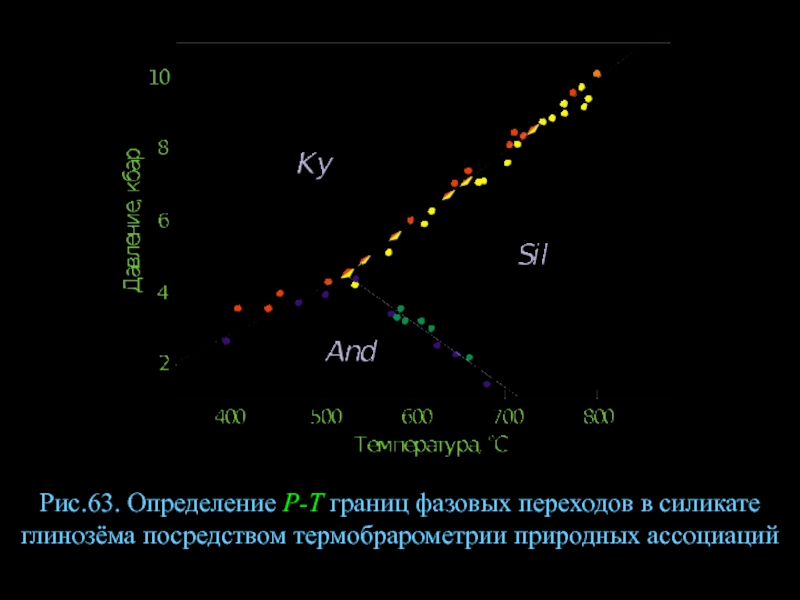
- 85. Рис.63. Определение Р-Т границ фазовых переходов в силикате глинозёма посредством термобрарометрии природных ассоциаций
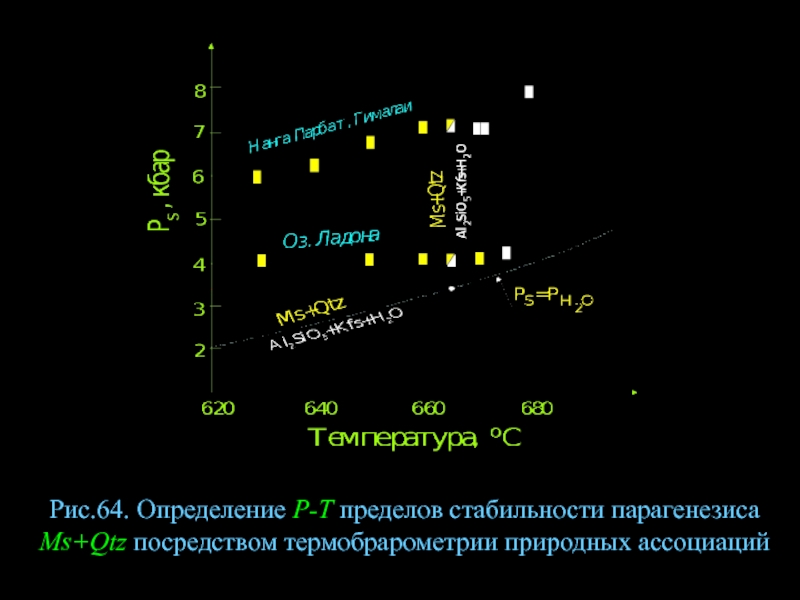
- 86. Рис.64. Определение Р-Т пределов стабильности парагенезиса Ms+Qtz посредством термобрарометрии природных ассоциаций
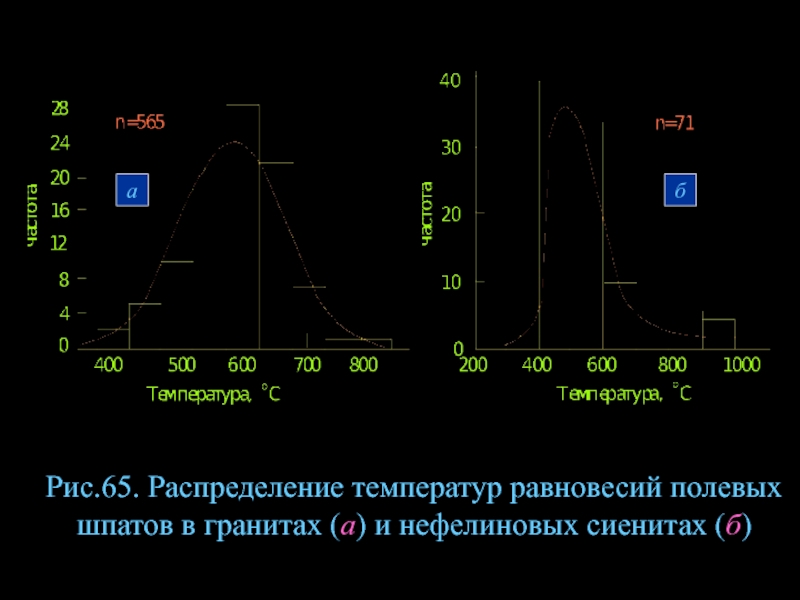
- 87. Рис.65. Распределение температур равновесий полевых шпатов в гранитах (а) и нефелиновых сиенитах (б) а б
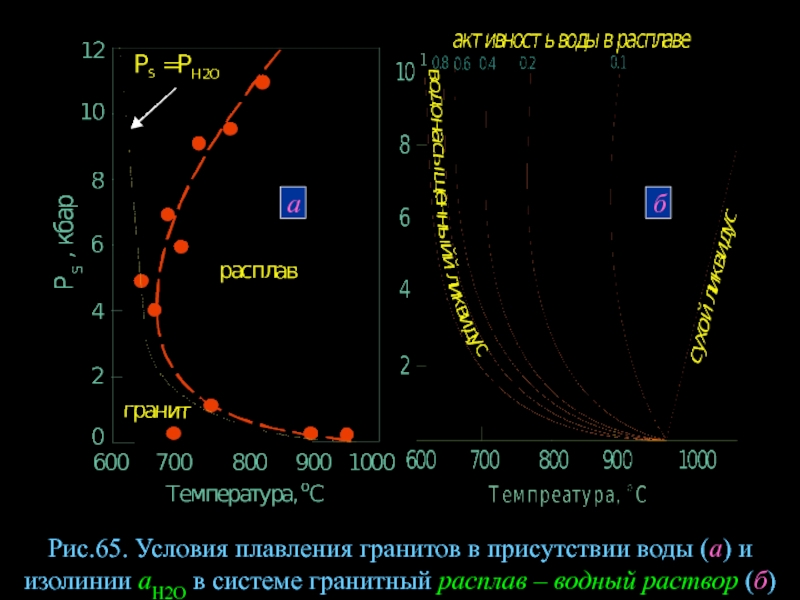
- 88. Рис.65. Условия плавления гранитов в присутствии
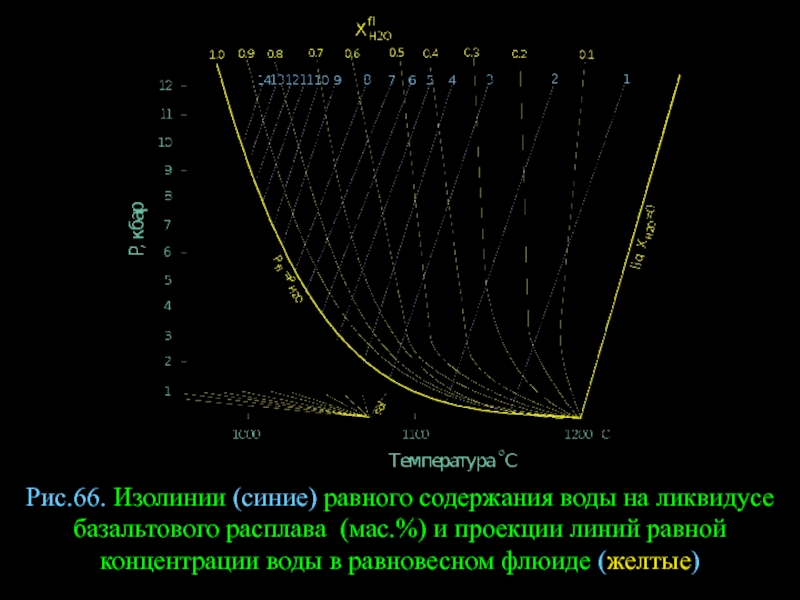
- 89. Рис.66. Изолинии (синие) равного содержания воды на
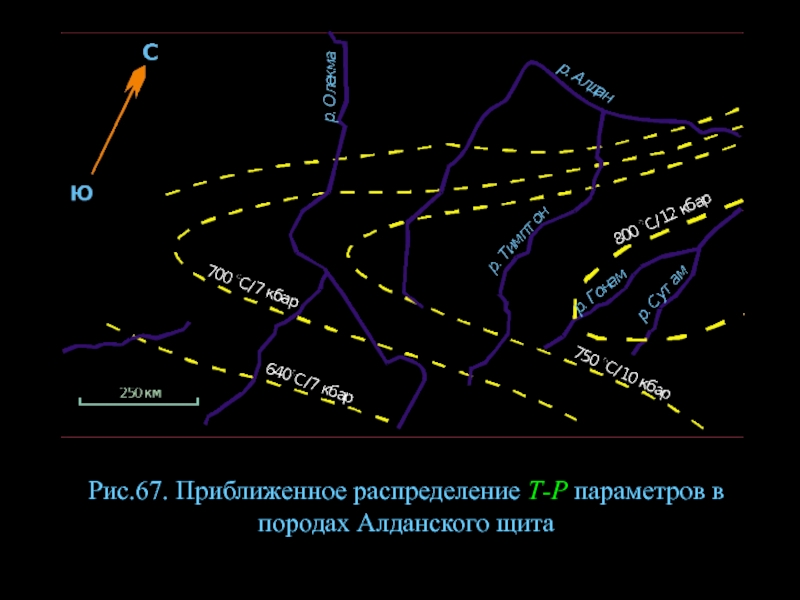
- 90. Рис.67. Приближенное распределение Т-Р параметров в породах Алданского щита
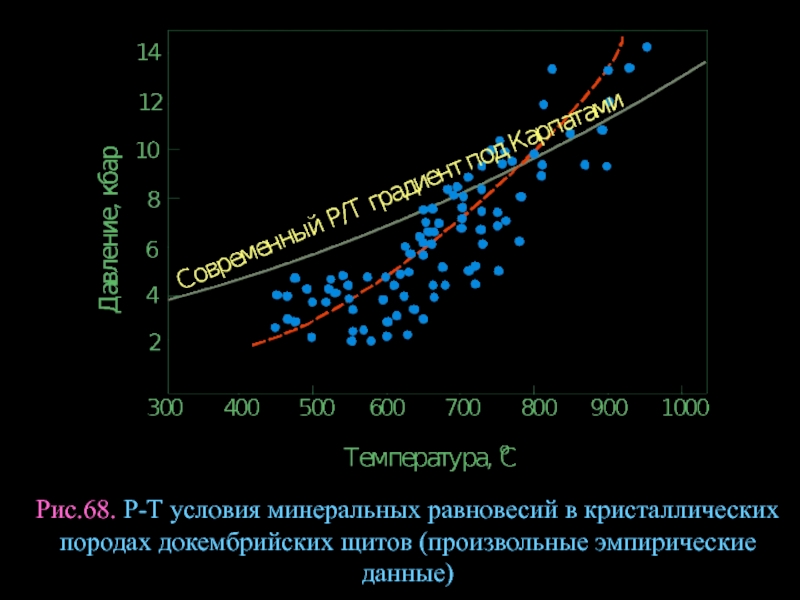
- 91. Рис.68. Р-Т условия минеральных равновесий в кристаллических породах докембрийских щитов (произвольные эмпирические данные)
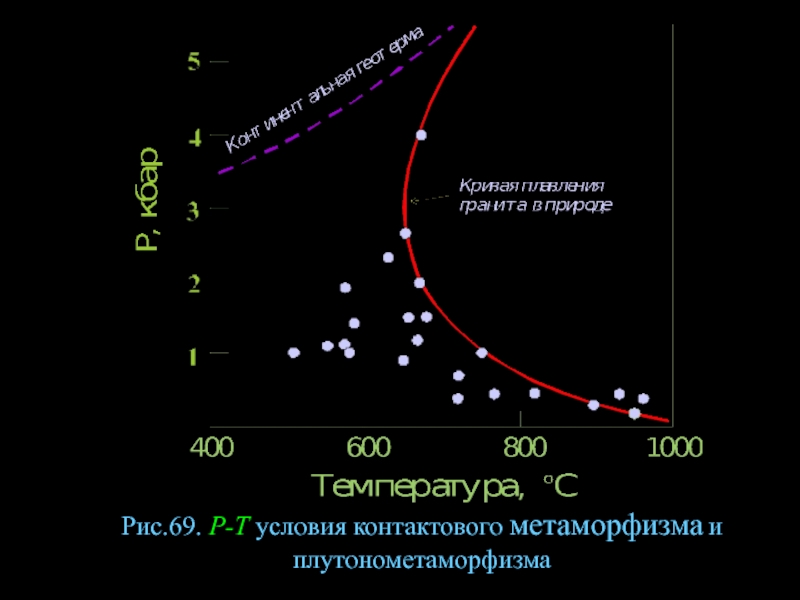
- 92. Рис.69. Р-Т условия контактового метаморфизма и плутонометаморфизма
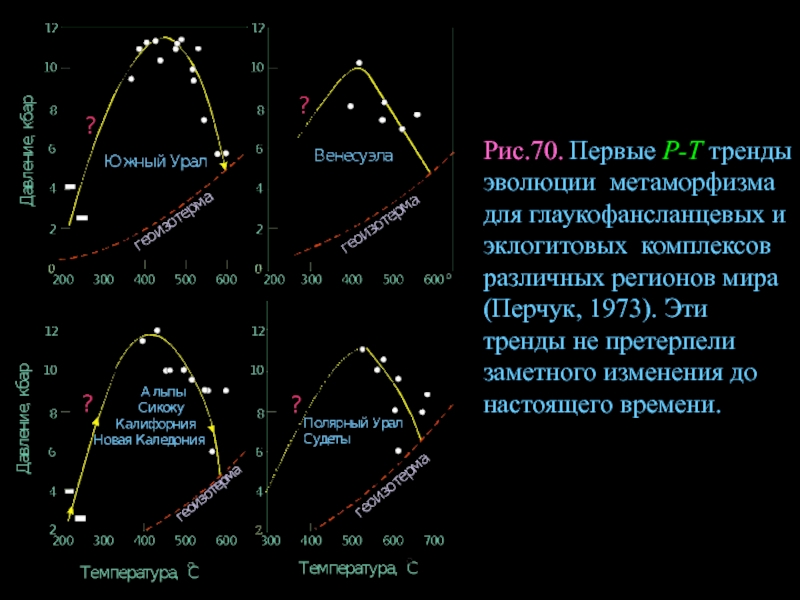
- 93. Рис.70. Первые Р-Т тренды эволюции метаморфизма для
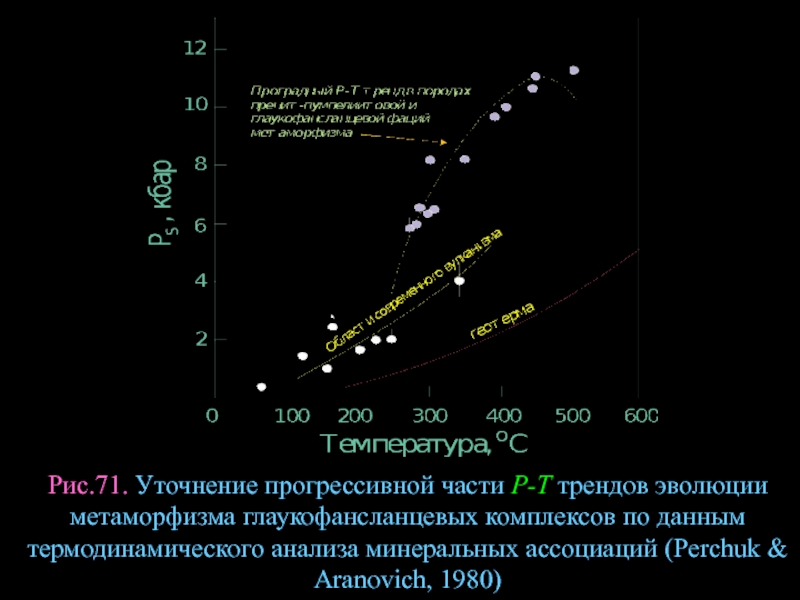
- 94. Рис.71. Уточнение прогрессивной части Р-Т трендов эволюции
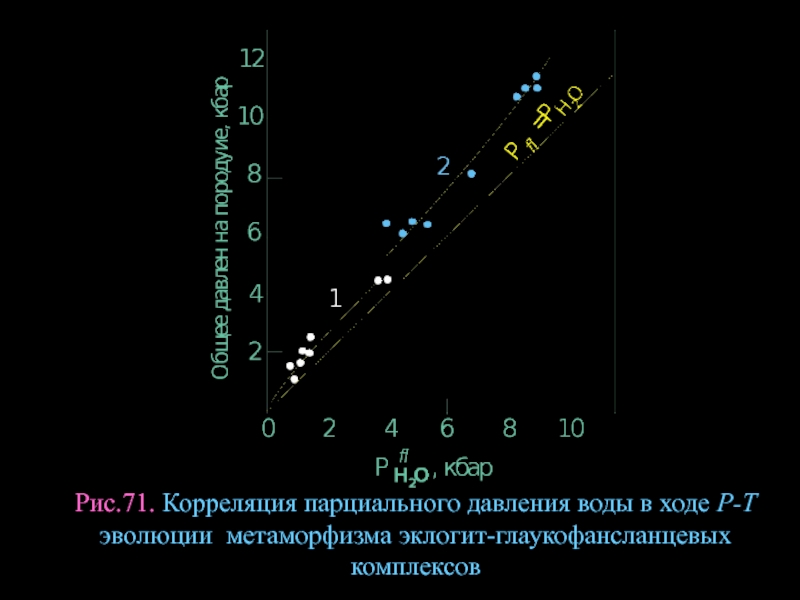
- 95. Рис.71. Корреляция парциального давления воды в ходе Р-Т эволюции метаморфизма эклогит-глаукофансланцевых комплексов
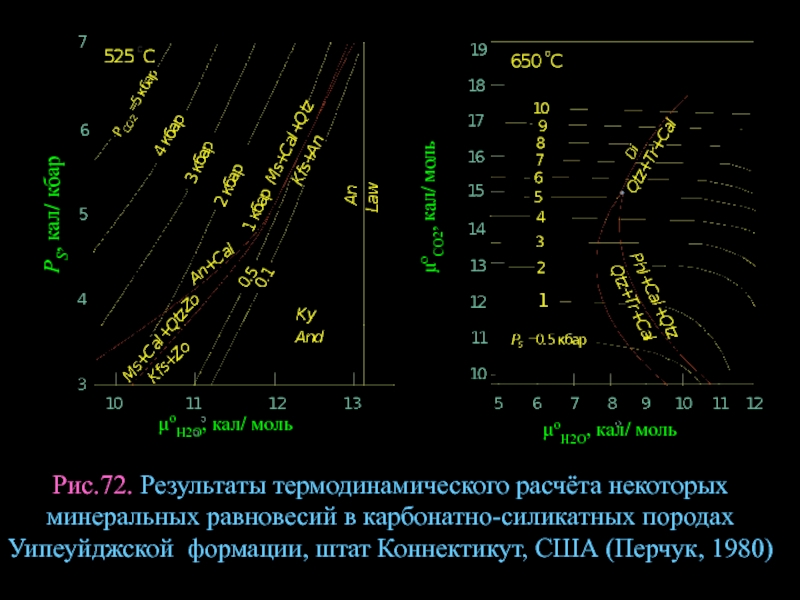
- 96. μoCO2, кал/ моль Рис.72. Результаты термодинамического расчёта
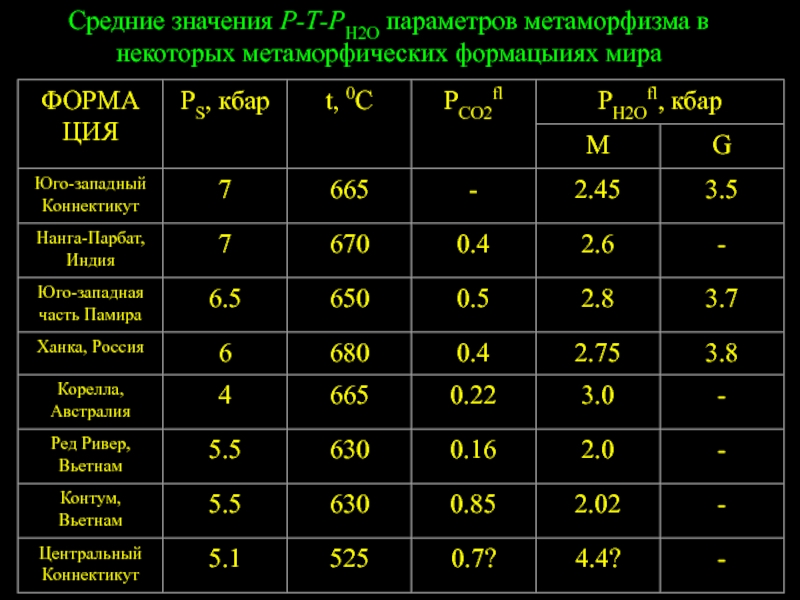
- 97. Средние значения Р-Т-РН2О параметров метаморфизма в некоторых метаморфических формацыиях мира
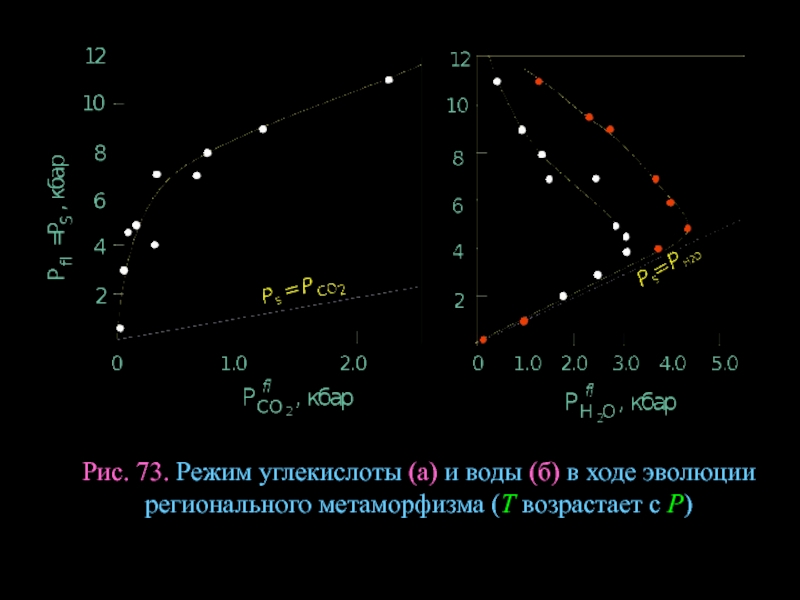
- 98. Рис. 73. Режим углекислоты (а) и воды
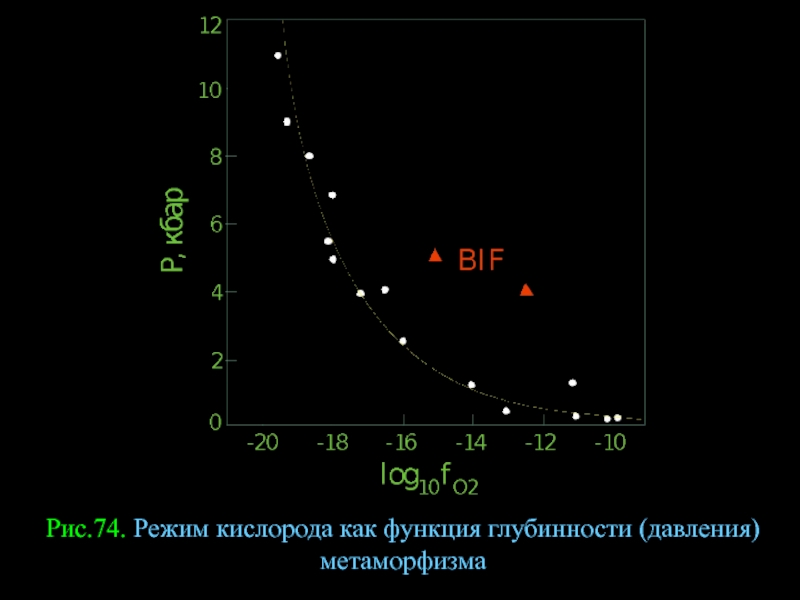
- 99. Рис.74. Режим кислорода как функция глубинности (давления) метаморфизма
- 100. Рис.75. Окисленность-восстановленность флюида как функция глубинности (давления) метаморфизма
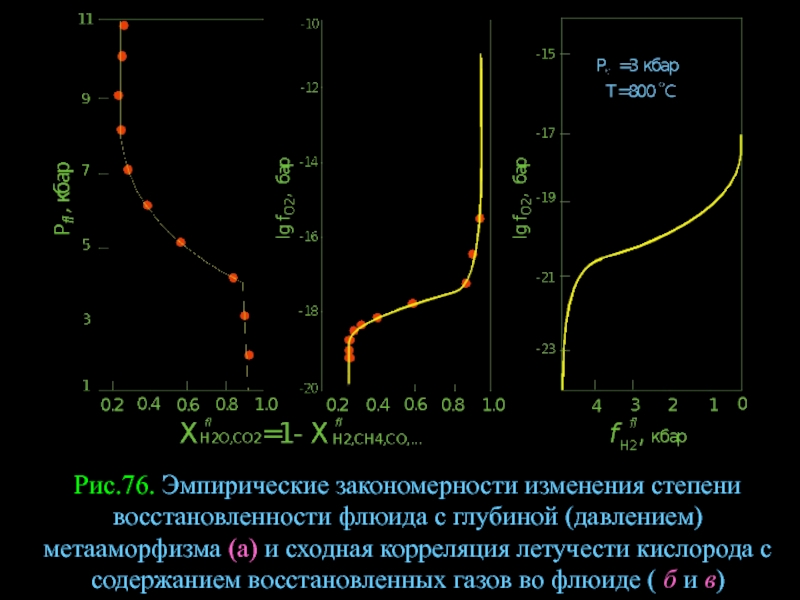
- 101. Рис.76. Эмпирические закономерности изменения степени восстановленности флюида
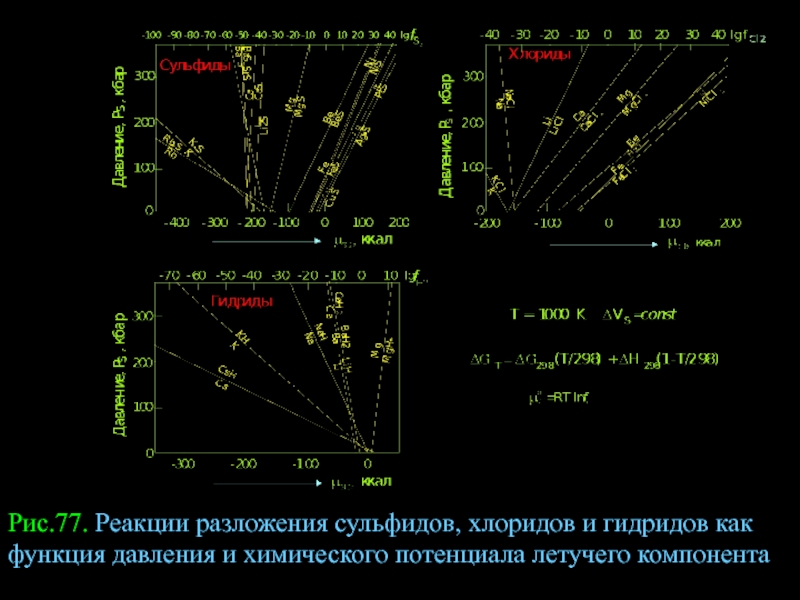
- 102. Рис.77. Реакции разложения сульфидов, хлоридов и гидридов
- 103. μοΟ2, ккал/моль μοF2, ккал/моль
Слайд 1В отличие от Kfs, нефелин содержит избыточный нормативный кремнезем в форме
Слайд 2
(Ne,Ks)95.4Qtz4.6
(Ne,Ks)86.2Qtz13.8
Т=800 оС
Р=6 бар
Рис.24. Равновесие Ness – хлоридный расплав: смещение изотермы 800оС
Слайд 3Рис.25. Равновесие Ness-Kfs: смещение изотермы 700оС в сторону натровой части твердого
Слайд 4Рис.26. Изотермы распределения K и Na в равновесии твердых растворов нефелина
Слайд 5Рис. 27. Нефелин-полевошпатовый термометр для субвулканических и вулканических щелочных пород, лишенных
Слайд 6МАГНЕТИТ-ИЛЬМЕНИТОВЫЙ ТЕРМОМЕТР ЛИНДСЛИ
В 50-х годах ХХ века американский ученый Бэддигтон нашел
Fe2O3 + Fe2TiO4 = FeTiO3 + Fe3O4 (319)
или же гематит+ульвошпинель=ильменит+магнетит
Слайд 8Константа этой реакции
есть функция температуры, давления и состава фаз. Вместе с тем Fe в магнетите и ильмените имеет переменную валентность, так что с ростом парциального давления кислорода оно будет окисляться в каждой из фаз даже при постоянных температуре и давлении:
3Fe2TiO4 + 1/2O2 = Fe3O4 +3FeTiO3 (321)
2FeTiO3 + 1/2O2 = Fe2O3 + 2TiO2 (322)
В экспериментальных исследованиях реакция окисления чистого магнетита в гематит обычно используется как минеральный буфер. Если в систему ввести титан, то с учетом твердых растворов этих минералов можно записать такие реакции окисления:
Слайд 9
Usp
Il
где составы сосуществующих Il и Mt при P = const находятся в зависимости от температуры и летучести кислорода.
Иными словами равновесие Hem = Mt+О2 становится дивариантным и на диаграмме Т- fO2 вместо моновариантной линии должно появиться поле (см. рис.29), где реакции (323) и (324) схематически отражают изотермический процесс изменения состава минералов при постоянной температуре. Эта диаграмма была экспериментально откалибрована Д.Линдсли в Геофизической лаборатории Института Карнеги (США).
Слайд 11ФАЗОВОЕ СООТВЕТСТВИЕ Fe-Mg-МИНЕРАЛОВ
И ВЫВОД СИСТЕМЫ ТЕРМОДИНАМИЧЕСКИ ВЗАИМОСОГЛАСОВАННЫХ ТЕРМОМЕТРОВ
Рассмотренные выше термометры
Слайд 12Часть из них и по сей день остаются лишь теоретиче-скими вариантами,
Слайд 13АМФИБОЛ – ПЛАГИОКЛАЗОВЫЙ ТЕРМОМЕТР
Парагенезис этих двух минералов чрезвычайно широко распространен в
Слайд 14Рис.30. Составы сосуществующих плагиоклазов и роговых обманок и в породах разных
Слайд 16Рис.32. Гистограмма статистической оценки относительной точности амфибол-плагиоклазового термометра
Слайд 17Это типичный парагенезис гранатовых амфиболитов, эклогитов, глаукофановых сланцев и других разновидностей
HblMg+GrtFe=GrtMg+HblFe (325)
должно обладать значительным энтропийным эффектом: максимальная разность порядковых номеров НЬl и Grt в этой таблице составляет 12. Так что коэффициент распределения
АМФИБОЛ - ГРАНАТ
Слайд 18
KD должен в значительной мере зависеть от температуры. Действительно, при ХMg=const
Слайд 19Значительные отклонения составов сосуществующих Нbl и Grt от среднестатистических составов могут
Слайд 21Рис.34. Гистограмма статистической оценки относительной точности амфибол-гранатового термометра
Слайд 22Этот парагенезис чрезвычайно широко распространен в самых различных типах кристаллических пород
АМФИБОЛ - КЛИНОПИРОКСЕН
Слайд 23HblMg+CpxFe=CpxMg+HblFe
которое с возрастанием температуры смещается вправо. Иначе говоря, при XMgHbl = const высокотемпературные породы содержат более магнезиальный Срх. Разность номеров Срх и Hbl в табл. 4 составляет 8, что свидетельствует о значительном тепловом эффекте реакции (329).
Слайд 24Распределение компонентов между Hbl и Срх не идеальное. Кроме того, низкотемпературные
HblCa+CpxNa=CpxCa+HblNa (333)
Слайд 25Распределение Fe и Mg между , Срх и Hbl следует рассматривать
Слайд 26Рис.35. Изотермы распределения Mg и Fe между Hbl и неомфацитовым Cpx
б
а
Слайд 27Любые значительные отклонения от статистически средних составов Hbl и Срх могут
Слайд 28 В высокобарных ассоциациях амфиболы часто представлены глаукофаном, реже смарагдитом и каринтином,
Слайд 29В эклогитах и глаукофановых сланцах амфиболы представлены смарагдитом, глаукофаном, а пироксены
Слайд 30
Рис.36. Изотермы распределения Mg и Fe между Hbl и омфацитовым Cpx
Слайд 31Распределение Са и щелочей между Hbl и Срх также представляет значительный
Слайд 33АМФИБОЛ - ОРТОПИРОКСЕН
Это типичная ассоциация высокотемпературных пород. Она встречается в кислых
HblMg+OpxFe=OpxMg+HblFe (334)
С ростом температуры она смещается вправо. Диаграмма на рис. 39 выведена на основе 25 парагенезисов, содержащих тройные (Hbl+Орх+Grt, Hbl+Орх+Pl, Hbl+Орх+Срх) и четверные (Hbl+Орх+Pl+Grt, Hbl+Орх+Pl+Cpx, Hbl+Орх+Срх+Grt) ассоциации. Она отличается значительной разрешающей способностью, хотя и охватывает лишь высокотемпературную область (600-1100° С). ΔV(334) не превышает 2 см3/атом (0.048 кал/бар), так что влиянием давления на равновесие (334) можно пренебречь.
Слайд 35На диаграмме рис.36 изотермы пересекают диагональ, где ХMgOpx = ХMgHbl В
Hbl+4Qtz = 3Opx+Cpx+Pl50+H2О (335)
достигаются максимальные значения μH2O и РS, но минимальное значение температуры. Частично это иллюстрируется диаграммами на рис.37, выведенными из анализа диаграммы фазового соответствия рис. 36. Диаграммы μH2O– ХMg составлены для четырех изотермических сечений и иллюстрируют смещение точки максимума μH2O в зависимости от температуры. Диаграмма Т оС– ХMg на рис.37 иллюстрирует Тmin при ХMg =0.2 и некоторых экстремальных значениях μH2O и РS.
Слайд 36Рис.37. Экстремальные соотношения составов (XMg) равновесных Opx и Hbl со смещением
Слайд 37БИОТИТ – КЛИНОПИРОКСЕН
Ассоциация биотита с клинопироксеном - одна из наиболее распространенных
Слайд 38Распределение Fe и Mg между Bt и Срх в зависимости от
CpxFe+BtMg = BtFe+CpxMg (336)
Ясно, что парагенезис Bt+Срх из вулканических пород отличается по составу от парагенезиса Bt+Срх из метасоматических пород. Однако изотермы на диаграмме рис.40 строились исходя из специфики состава низкотемпературных и высокотемпературных парагенезисов. Поэтому относительная точность диаграммы достаточно высокая (см. гистограмму на рис.40)
Слайд 40Как и в равновесиях Hbl-Cpx и Hbl-Орх, изотермы пересекают линию KD=1
Слайд 41БИОТИТ-ГРАНАТОВЫЙ ТЕРМОМЕТР И НЕКОТОРЫЕ ЕГО ПРОИЗВОДНЫЕ
Биотит+гранат – типичный парагенезис пород различных
Слайд 42BtMg+GrtFe=GrtMg+BtFe,
которая с повышением Т имеет тенденцию к смещению вправо. Обычно , где XMg = Mg:(Mg+Mn+FeΣ). Но в исключительных случаях (например, в ксенолитах гранатовых перидотитов из щелочных базальтов Оаху, Гавайи) . Эффект перераспределения Mg между Bt и Grt в зависимости от Т достаточно велик (см. табл. 4). В средне- и высокотемпературной области распределение Mg приближается к идеальному, т. е. KD = const при постоянной Т:
Слайд 43
Это позволяет линейно экстраполировать величину в зависимости от
Слайд 44
Рис.41. Изотермы распределения Mg и Fe между Bt и Grt –
Слайд 45Заслуживают внимание лишь две из них (Ferry, Spear, 1978; Perchuk &
T oC = 7843.7 + 0,076 (P-6000)/ 1,987lnKD + 5,699 (341)
где Р – в барах. Точность оценки Т, не превышает 5 % отклонений от экспериментальных данных, но часто она составляет ±10-15°. XСаGrt =Ca:(Ca+Mg+Mn+Fe2+) и XMnGrt= Mn:(Mg+Mn+FeΣ) слабо влияют на KD при постоянной Т, но поправки на высокую XMnGrt в случае изоморфизма Mg<=>Mn предусмотрены. Кроме того, Л.Я.Аранович с сотр.(1987) учли влияние XAlBt на определяемую Т.
Слайд 46Рис.42. Зависимость lnKD в обменном (Fe-Mg) равновесии Bt-Grt от обратной температуры
Слайд 47Биотит-гранатовый термометр лег в основу вывода целой серии взаимостогласованных минералогических термометров
Кордиерит-гранатовый термометр
Он представляет интерес для оценки Т равновесий в метапелитах. Впервые Crd-Grt термометр был откалиброван в 1968 г. (рис.43). Позднее появилось несколько эмпирических и одна экспериментальная калибровка. На рис.44 видно, что результаты не однозначны, но подавляющее число данных правильно отражает температурную зависимость lnKD от 1/T. Аналитическое выражение для Crd-Grt термометра такое:
T oC = 6 211+ 0,035(P-6000)/(1,987lnKD + 5,79) (342)
Слайд 49
Рис.44. Зависимость lnKD в обменном (Fe-Mg) равновесии кордиерит-гранат от обратной температуры
Слайд 50Таблица 6. Взаимосогласованные термодинамические данные для некоторых обменных равновесий – минералогических
Слайд 53Рис.45. Экспериментально полученные изотермы распределения Mg и Fe между St и
Слайд 54РАВНОВЕСИЕ АМФИБОЛ — БИОТИТ
Парагенезис этих минералов широко распространен в гранитоидах,
BtMg+HblFe=HblMg+BtFe
вправо с возрастанием T.
Слайд 56Это согласуется с положением Hbl и Bt в табл. 4. Оба
На рис. 47 видно, что распределение Mg и Fe отличается от идеального, вплоть до появления экстремальных, причём характер смещения экстремальных точек такой же, как и на диаграммах для парагенезисов Hbl+Срх, Hbl +Орх и Bt+Срх: с увеличением температуры точки экстремумов смещаются в магнезиальную область диаграммы фазового соответствия.
Для оценок температуры диаграмма на рис.47 не пригодна. Нужны специальные экспериментальные и термодинамические исследования.
Слайд 57РАВНОВЕСИЕ ЭПИДОТ – ГРАНАТ
Эпидот с андрадит-гроссуляровым гранатом встречается в основном
Исследование этого равновесия проводилось только экспериментально, на основе метода «минерал – водный раствор хлоридов Al и Fe3+» на буфере Hem-Mag (Perchuk & Aranovich, 1979). Результаты обработаны термодинамически и рассчитана диаграмма фазового соответствия, представленная на рис. 48.
Слайд 60CМЕЩЕННЫЕ РАВНОВЕСИЯ
В отличие от обменных, эти равновесия полиминеральны, а изменения составов
na ’<1+mβ ’<1 => kα” >2+lb ”>2 , (344)
где коэффициенты n…l перед фазами α и b, которые сложенны компонентами 1 и 2.
Слайд 61Рис.50. Диаграммы температурной зависимости статистически средних составов сосуществующих Bt и Grt
Слайд 63КОЭФФИЦИЕНТ РАЗДЕЛЕНИЯ
Значение коэффициента распределения (239) для обменной реакции
α1 + β2 =
включает в себя два других коэффициента
__
K1 = X1β/X1α (346)
__
K2 = X2β/X2α (347)
которые мы будем называть коэффициентами разделения компонентов 1 и 2 между фазами α и β, так что
KD = / = exp(ΔG(345)/RT) (348)
Эти коэффициенты несут иную смысловую нагрузку по сравнению с величиной KD. Например, если твердые растворы α и β идеальны, значения коэффициентов разделения связаны с изменением свободной энергии ΔG в реакциях разложения типа
Слайд 64α1 = β1 + nε
α2 = β2 + nε (350)
где величины G определяют полные свободные энергии Гиббса фаз α, β и ε. Если из (349) вычесть (350), получим уравнение обменной реакции
α1 + β2 = β1 + α2 (351)
Однако производные и по температуре и давлению будут определяться тепловым и объемным эффектами не (351) реакции, а (349) и (350). Для наглядной иллюстрации соотношений KD и или
примем, что ΔV(351) ≈ 0 и ΔH(349) ≈ 0, а ΔH(351) и ΔV(349) имеют максимальное возможное значение. Тогда, при Т = const в случае идеального распределения компонентов 1 и 2 между α и β величина будет изменяться с изменением давления при постоянном значении KD .
Слайд 65Пусть KD = 5, а составы равновесных фаз изменяются с возрастанием
(352)
Слайд 66
Рис.53. Смещение коннод в треугольнике составов для равновесия α1 = β1
Слайд 67Рис.54. Одна из возможных схем смещения фигуративной точки составов равновесных минералов
Слайд 68
Наилучший пример рассмотренных соотношений – равновесие оливина с рингвудитом (см. рис.54).
Fe2SiО4+ Mg2SiО4= Mg2SiО4+ Fe2SiО4
Fe-рингвудит форстерит Mg-рингвудит фаялит
так и смещенным равновесиями. Например, при возрастании давления от 81 до 90 кбар при 1000оС оливин реагирует с рингвудитом по схеме:
1.2Mg 0,6Fe1,4SiО4 + 0.4Mg1,4Fe0,6SiO4 →1.6Mg0,8Fe1,2SiO4,
рингвудит-1 α-оливин рингвудит-2
где составы фаз взяты из работы S.Akimoto and H.Fujisawa (1968). Это равноценно повышению магнезиальности обеих фаз, Ol и Rin с ростом Р за счет увеличения количественного соотношения Rin/Ol:
2.32Mg1,4Fe0,6SiO4 + 0.88Mg0,6Fe1,4SiO4 →
оливин-1 рингвудит -1 → 1.6Mg1,56Fe0,44SiO4 + 1.6Mg0,8Fe1,2SiO4
оливин-2 рингвудит-2
Слайд 69Рис.55. Изотермы 800 и 1200 oС распределения Fe и Mg между
Слайд 70
Величина изменилась от 2.33 до 1.95, т.е.
Рис.56. Изотермы зависимости от давления коэффициента разделения Mg между оливином и рингвудитом
Слайд 71
Мы рассмотрели одно из самых простых смещенных равновесий, обусловленное фазовым переходом
Слайд 73Средняя мольная доля.
Реакции, подобные (344) мы будем здесь называть смещенными под
Пусть сумма мольных долей изоморфных компонентов в кристаллохимических формулах минералов тождественно равна числу атомов Х1 + Х2 =1, а система состоит из “к” компонентов и ϕ фаз. Для термодинамического описания этой системы достаточно иметь к + 2 параметров (Т, Р, μ1.......μк). Их изменение выражается следующей системой из ϕ уравнений:
Слайд 74Если, например, между фазами α, β,.........,ϕ есть взаимо-действие, то корреляцию интенсивных
Слайд 75
Здесь учтено сделанное выше допущение, что n1+n2=X1+X2=1. Определитель системы (353) имеет
Слайд 76
Аналогичным образом решаем систему (344) относительно dμ2:
Рассмотрим простейший случай, когда твердые
Слайд 77
Подставляем (360) в (359) и, дифференцируя, находим:
И поскольку компоненты 1 и
(361)
Слайд 79Производные (363) – (366) будут использованы для оценки точности диаграмм фазового
Слайд 80Рис.58. Изоплеты Crd и Grt в дивариантном равновесии Crd+Grt+Qtz+Al2SiO5 (Аранович, Подлесский,
Слайд 81Рис.59. Номограмма для определения Р-Т параметров по составам сосуществующих Grt и
Слайд 82Рис.60. Изотермы зависимости от Р коэффициента разделения Mg между St и
Слайд 83Рис.61. Изоплеты Βτ и Grt для дивариавнтного равновесия Grt+Ms =Al2SiO5+Qtz+Bt
Слайд 84Рис.62. Корреляция расчетных и экспериментальных величин Кр для реакции Grt+Ms =Bt+Qtz+Al2SiO5
Слайд 85Рис.63. Определение Р-Т границ фазовых переходов в силикате глинозёма посредством термобрарометрии
Слайд 86Рис.64. Определение Р-Т пределов стабильности парагенезиса Ms+Qtz посредством термобрарометрии природных ассоциаций
Слайд 87Рис.65. Распределение температур равновесий полевых шпатов в гранитах (а) и нефелиновых
а
б
Слайд 88
Рис.65. Условия плавления гранитов в присутствии воды (а) и изолинии аН2О
а
б