- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
В этой презентации представлены материалы из пособия по химии Решение расчетных задач школьного курса химии 8-11 классов Решение задач 1-го типа Решение. презентация
Содержание
- 1. В этой презентации представлены материалы из пособия по химии Решение расчетных задач школьного курса химии 8-11 классов Решение задач 1-го типа Решение.
- 2. В этой презентации представлены материалы из пособия
- 3. Какова масса
- 4. Алгоритм решения 1-го типа задач. Какова
- 5. Условие примера: Какая масса оксида фосфора (V)
- 6. определяем избыток и недостаток .ν 1/K1 сравниваем
- 7. Производим расчет массы оксида фосфора (V). m(P2O5)=0,088
- 8. Определяем , фосфор или кислород
- 9. Сведения о пособии, авторы. Автор пособия: Тархов
Слайд 2В этой презентации представлены материалы из пособия по химии «Решение расчетных
Решение задач 1-го типа
Решение задач 2-го типа
Слайд 3
Какова масса образовавшегося оксида фосфора (V), если сгорело 5 грамм фосфора?
Дано:
m(P)=5г.
m(P2O5)=?
5г.
4 P + 5 O2 = 2 P2O5
m=ν*M
M(P2O5)=142г/моль
ν1=( К1 / К2 )ν2
ν(P2O5)=(2/4)ν(P)
ν=m/M
M(P)=31г/моль
ν(Р)=5/31=0,16моль
ν(P2O5)=(2/4)*0,16=0,08моль
m(P2O5)=0.08*142=11,45г.
Решения 1-го типа задач.
Слайд 4Алгоритм решения 1-го типа задач.
Какова масса образовавшегося оксида фосфора (V),
Производим расчет массы оксида фосфора (V). m(P2O5)=0.08*142=11,45г.
Масса равна произведению количества вещества на молярную массу вещества.
-молярную массу рассчитываем по ПСХЭ M(P2O5)=142г/моль
-количество оксида выражаем через количество фосфора ν1=( К1 / К2 )ν2
Коэффициент 2/4 берем из уравнения химической реакции
ν(P2O5)=(2/4)ν(P)
4 P + 5 O2 = 2 P2O5
Количество фосфора равно отношению массы к молярной массе фосфора. ν=m/M
-молярную массу фосфора определяем по ПСХЭ M(P)=31г/моль
-масса фосфора дана по условию m(P)=5г.
Производим расчет количества фосфора ν(Р)=5/31=0,16моль
Производим расчет количества оксида фосфора (V) ν(P2O5)=(2/4)*0,16=0,08моль
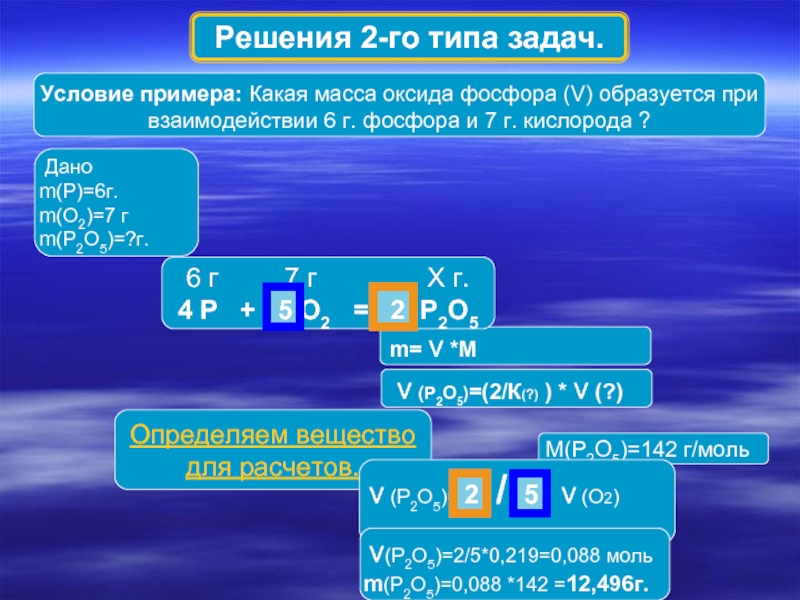
Слайд 5Условие примера: Какая масса оксида фосфора (V) образуется при взаимодействии 6
m= ν *M
Дано
m(P)=6г.
m(O2)=7 г
m(P2O5)=?г.
6 г 7 г Х г.
4 P + 5 O2 = 2 P2O5
M(P2O5)=142 г/моль
Определяем вещество для расчетов.
Решения 2-го типа задач.
ν (P2O5)= 2 / 5 ν (O2)
ν (P2O5)=(2/К(?) ) * ν (?)
ν(P2O5)=2/5*0,219=0,088 моль
m(P2O5)=0,088 *142 =12,496г.
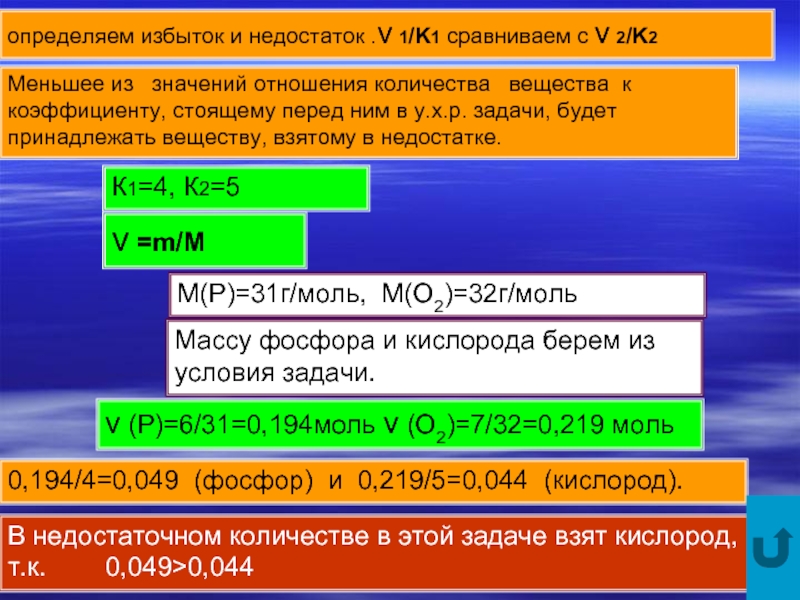
Слайд 6определяем избыток и недостаток .ν 1/K1 сравниваем с ν 2/K2
Меньшее
ν =m/M
M(P)=31г/моль, М(О2)=32г/моль
Массу фосфора и кислорода берем из условия задачи.
ν (P)=6/31=0,194моль ν (O2)=7/32=0,219 моль
0,194/4=0,049 (фосфор) и 0,219/5=0,044 (кислород).
В недостаточном количестве в этой задаче взят кислород, т.к. 0,049>0,044
К1=4, К2=5
Слайд 7Производим расчет массы оксида фосфора (V). m(P2O5)=0,088 *142 =12,496г.
Алгоритм решения 2-го
Условие примера:Какая масса оксида фосфора (V) образуется при взаимодействии 6 г. фосфора и 7 г. кислорода ?
Масса вещества равна произведению количества вещества на молярную массу .
m= ν *M
-Молярную массу оксида рассчитываем по ПСХЭ. M(P2O5)=142 г/моль
-Количество оксида выражаем через количество вещества , взятого в
недостатке. ν1=(K1/K2)*ν2-
Производим расчет количества оксида фосфора (V).
ν(P2O5)=2/5*0,219=0,088 моль
Коэффициенты для оксида фосфора (V) и выбранного для расчетов вещества №2 берем из у.х.р.К1=2,К2=? кислород взят в недостатке , значит К2=5. Количество оксида фосфора ( V ) равно 2/5 от количества кислорода.
ν (P2O5)=2/5 ν (O2)
Слайд 8
Определяем , фосфор или кислород взяты в недостаточном количестве.
Количество вещества равно отношению массы вещества к молярной массе. ν=m/M
-Молярную массу фосфора и кислорода рассчитываем по ПСХЭ. -M(P)=31г/моль, М(О2)=32г/моль -Массу фосфора и кислорода берем из условия задачи.
Рассчитываем количество фосфора и кислорода.
ν (P)=6/31=0,194моль ν (O2)=7/32=0,219 моль
Рассчитываем отношение количества фосфора и кислорода к соответствующим им коэффициентам у.х.р. Сравниваем значения отношений и определяем вещество взятое в недостатке.
0,194/4=0,049 (фосфор) и 0,219/5=0,044 (кислород).
В недостаточном количестве в этой задаче взят кислород,
т.к. 0,049>0,044
Слайд 9Сведения о пособии, авторы.
Автор пособия: Тархов Сергей Вячеславович
Авторы презентации:
1)Бармута Александр Иванович-
-информатик
2)Жанайдарова Алмагуль Курмангалиевна-
-информатик сш№5;
3)Тархов Сергей Вячеславович-
-химик сш№5.
Пособие «Решение расчетных химических задач 8-11 классов.» содержит:
-решение расчетных химических задач школьного курса химии;
-классификацию типов решения задач;
-подробные решения наиболее важных задач, краткие решения и алгоритмы задач.
Объем работы 42 страницы.Пособие предлагает рассмотреть решение химической задачи.
Предназначена в помощь ученикам, может быть полезна учителям химии в подготовке и проведении уроков.
Серия КСТ. Лицензия №0297