2 сентября 2014 г.
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Урок 1. Вводный инструктаж по ТБ. Периодический закон. Строение атома. Виды химической связи презентация
Содержание
- 1. Урок 1. Вводный инструктаж по ТБ. Периодический закон. Строение атома. Виды химической связи
- 2. Вводный инструктаж по ТБ. Общие положения 1.
- 3. Вводный инструктаж по ТБ. Требования безопасности перед
- 4. Вводный инструктаж по ТБ. 4. Вход в
- 5. Вводный инструктаж по ТБ. Требования безопасности при
- 6. Вводный инструктаж по ТБ. 5. Обо всех
- 7. Вводный инструктаж по ТБ. Требования безопасности по
- 8. Вводный инструктаж по ТБ. Требования безопасности в
- 9. Вводный инструктаж по ТБ. 4. В случае,
- 10. Цели: Знать
- 11. Формулировки периодического закона
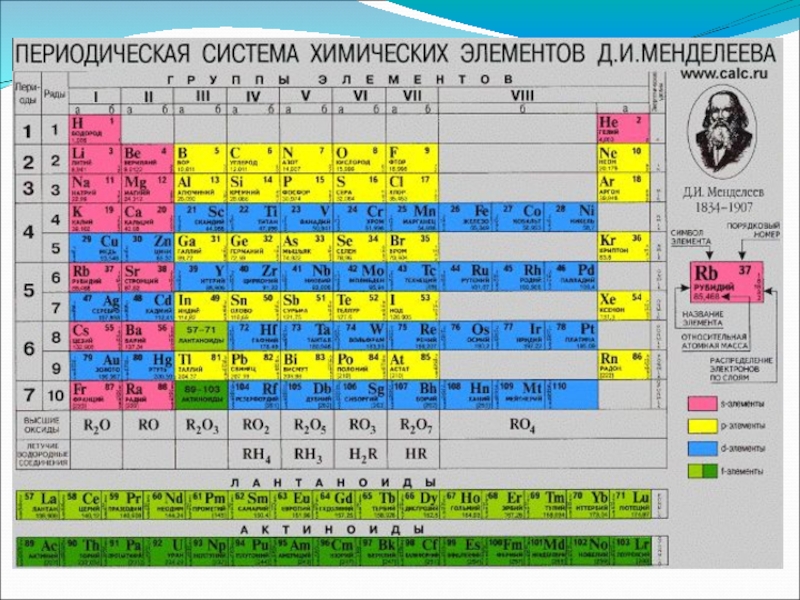
- 13. Структура периодической таблицы 1. Что такое период?
- 14. Структура периодической таблицы 1. Что в периодической
- 15. Как изменяются металлические и неметаллические
- 16. Строение атома 1. Расскажите о строении атома.
- 17. Строение атома 2. Как определить количество энергетических
- 18. Химическая связь 1. Какие существуют виды химической
- 19. 2. Что такое электроотрицательность? Как изменяется электроотрицательность
- 20. Задание 1. Дайте характеристику химическим элементам калию
- 21. План характеристики химического элемента 1. Положение элемента
- 22. Тест. Ответы 1) 2
- 23. Домашнее задание 1. Повторить пройденный
Слайд 1Урок 1. Вводный инструктаж по ТБ. Периодический закон. Строение атома. Виды
Слайд 2Вводный инструктаж по ТБ.
Общие положения
1. Соблюдение требований настоящей инструкции обязательно для
химические ожоги при работе с химреактивами;
термические ожоги при работе с нагревательными приборами;
порезы рук при небрежном обращении с лабораторной посудой;
отравления токсичными веществами.
Слайд 3Вводный инструктаж по ТБ.
Требования безопасности перед началом работы
1. Перед началом работы
3. Нельзя устранять неисправности самостоятельно. 4. При проведении работ, связанных с нагреванием жидкостей до температур кипения, использованием разъедающих растворов, необходимо использовать защитные очки. 5. Подготовьте рабочее место, уберите все лишнее.
Слайд 4Вводный инструктаж по ТБ.
4. Вход в кабинет химии только по приглашению
Слайд 5Вводный инструктаж по ТБ.
Требования безопасности при работе
1. Работать необходимо аккуратно, неукоснительно
Слайд 6Вводный инструктаж по ТБ.
5. Обо всех разливах химических жидкостей, а также
Слайд 7Вводный инструктаж по ТБ.
Требования безопасности по окончании работы
Погасите спиртовку специальным колпачком,
Слайд 8Вводный инструктаж по ТБ.
Требования безопасности в аварийных ситуациях
1. При возникновении в
Слайд 9Вводный инструктаж по ТБ.
4. В случае, если разбилась лабораторная посуда, не
Слайд 10Цели:
Знать формулировки периодического закона, определение электроотрицательности, структуру
Слайд 11Формулировки периодического закона
Менделеевская:
Свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса.
Свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Слайд 13Структура периодической таблицы
1. Что такое период? Сколько периодов в периодической системе?
Период – это горизонтальный ряд элементов, начинающийся щелочным металлом и заканчивающийся благородным газом. 7 периодов. Малые и большие.
2. Какие периоды являются малыми, какие – большими и почему?
Малые – 1, 2, 3 (содержат 2 или 8 элементов).
Большие – 4, 5, 6, 7 (содержат 18 или 32 элемента).
Слайд 14Структура периодической таблицы
1. Что в периодической системе называют группой? Сколько групп
Группа – это вертикальный ряд элементов (8)
главные (А) побочные (Б)
(содержат элементы (содержат элементы
и малых, и больших только больших
периодов. периодов.
Слайд 15 Как изменяются металлические и неметаллические свойства элементов в периодах?
Как изменяются металлические и неметаллические свойства элементов в группах?
Металлические
свойства
увеличиваются,
неметаллические свойства уменьшаются.
Слайд 16Строение атома
1. Расскажите о строении атома. Как, пользуясь ПСХЭ, определить количество
Количество протонов (p+) и электронов (е-) равно порядковому номеру элемента.
Количество нейтронов (nº) = атомная масса – порядковый номер.
Слайд 17Строение атома
2. Как определить количество энергетических уровней (электронных слоев)в электронной оболочке
Количество электронных слоев равно номеру периода.
1 слой – не более 2 е-; 2 слой – не более 8е-; 3 слой – не более 18 е-.
3. Как определить количество электронов на внешнем электронном слое?
Количество электронов на внешнем слое равно номеру группы (для элементов главных подгрупп). У элементов побочных подгрупп на внешнем слое 2 е- ( IВ и VIВ – 1 е-).
Слайд 18Химическая связь
1. Какие существуют виды химической связи? Между какими химическими элементами
Ионная, ковалентная полярная, ковалентная неполярная.
Ионная – связь между ионами; образуется между металлом и неметаллом.
Ковалентная неполярная – связь в простых веществах-неметаллах.
Ковалентная полярная – связь между атомами разных неметаллов.
Слайд 192. Что такое электроотрицательность? Как изменяется электроотрицательность элементов в периодах и
Электроотрицательность – свойство атомов химического элемента притягивать к себе электроны от других атомов в соединении.
увеличивается в периоде слева направо
уменьшается в группе сверху вниз
Слайд 20Задание 1.
Дайте характеристику химическим элементам калию и фосфору.
Задание 2.
Определите вид химической
Задание 3.
Определите вид химической связи и запишите схемы их образования в следующих веществах: O2; H2S; K3P.
Слайд 21План характеристики химического элемента
1. Положение элемента в ПСХЭ Д.И. Менделеева (порядковый
2. Состав ядра атома.
3. Общее количество электронов в атоме, схема строения электронной оболочки.
4. Металл или неметалл.
5. Сравнение свойств с соседними по периоду и подгруппе элементами.
6. Формула, название высшего оксида, характер его свойств.
7. Формула, название высшего гидроксида (кислота, основание или амфотерный гидроксид).
8. Формула летучего водородного соединения (для неметалла).
Слайд 22Тест. Ответы
1) 2
2) 2 12) 2
3) 2 13) 3
4) 3 14) 4
5) 1 15) 1
6) 1 16) 1
7) 3 17) 4
8) 2 18) 2
9) 2 19) 4
10) 1 20) 4
Слайд 23Домашнее задание
1. Повторить пройденный материал.
2. Задание: дать
Посмотреть презентацию можно на сайте: www.himoxi.ucoz.ru в разделе «9класс. К очередному уроку химии».