- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Урок 1. Биогенные элементы презентация
Содержание
- 1. Урок 1. Биогенные элементы
- 2. Таблица кларков по декадам (по А.Е. Ферсману, 1932 г.)
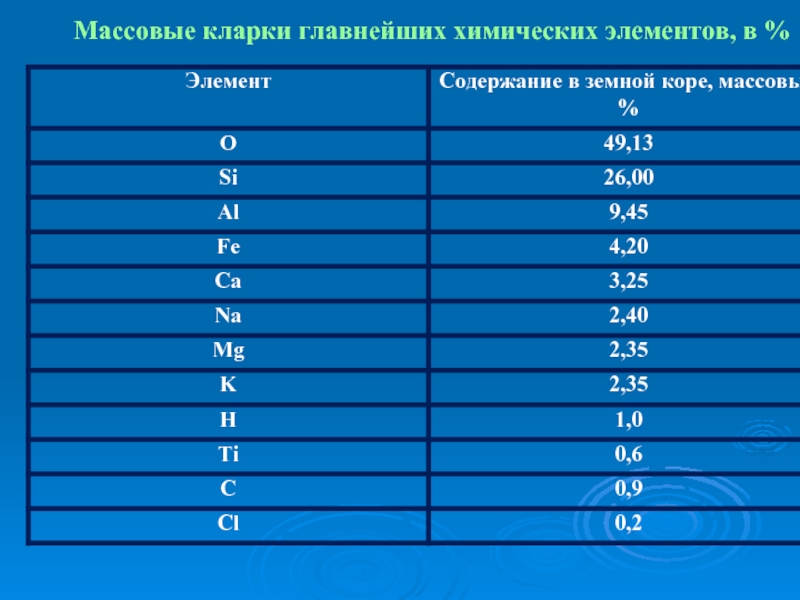
- 3. Массовые кларки главнейших химических элементов, в %
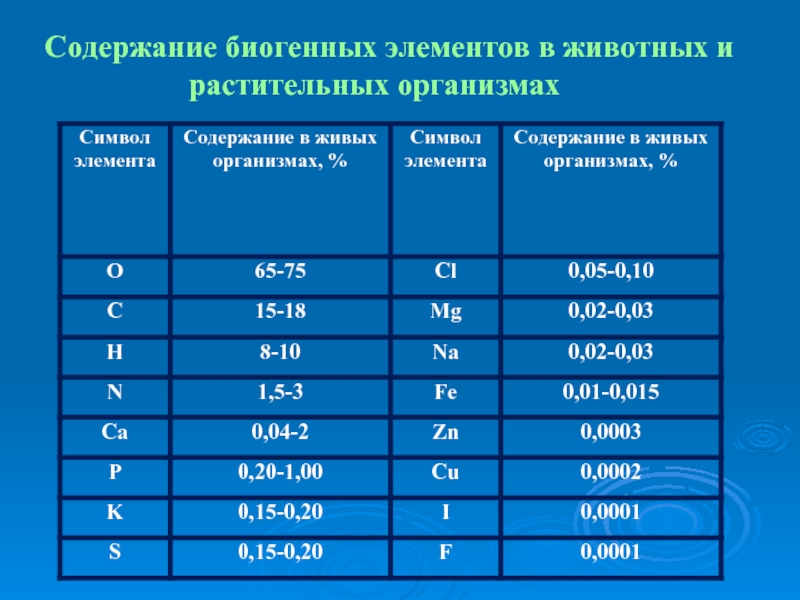
- 4. Содержание биогенных элементов в животных и растительных организмах
- 5. Значение биогенных элементов
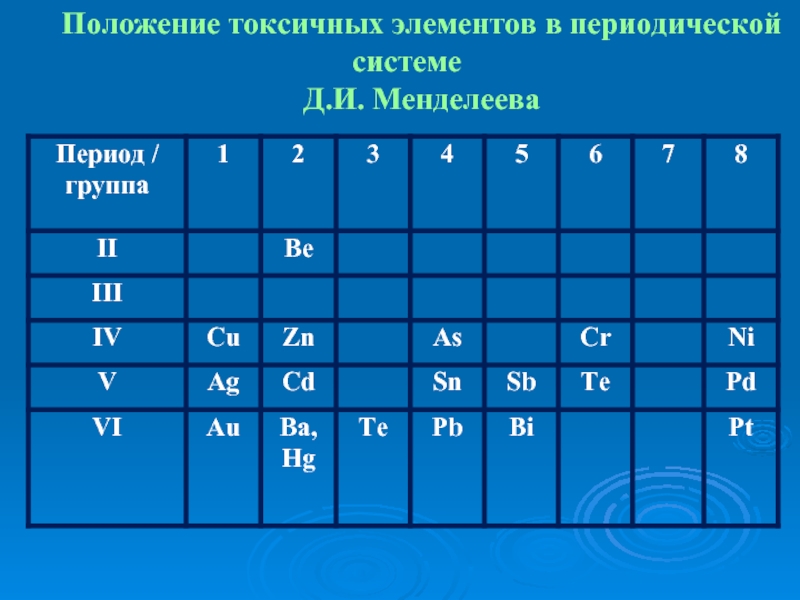
- 8. Положение токсичных элементов в периодической системе Д.И. Менделеева
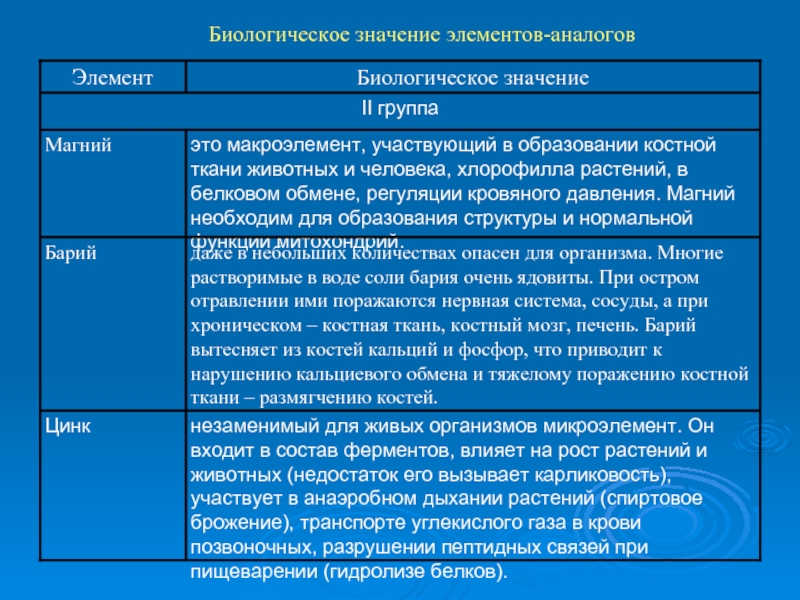
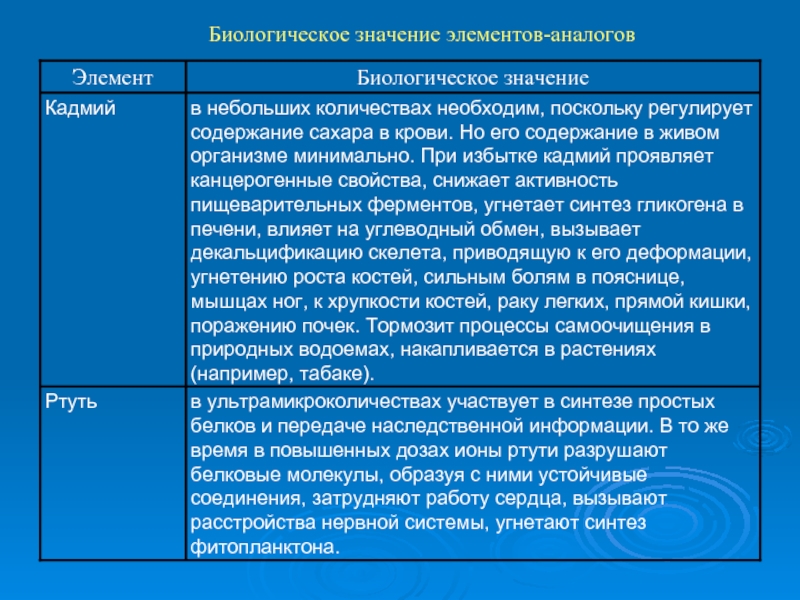
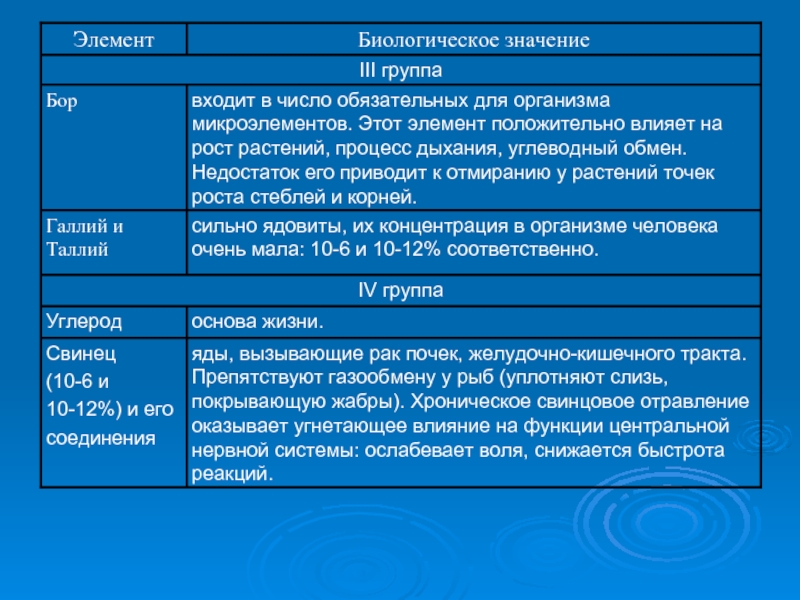
- 9. Биологическое значение элементов-аналогов
- 10. Биологическое значение элементов-аналогов
- 13. Урок 2. Вода и сельское хозяйство
- 14. Вода и селькое хозяйство «Вода! Вода, у
- 15. Аномальные свойства воды
- 16. СТРОЕНИЕ МОЛЕКУЛЫ ВОДЫ. МОЛЕКУЛА ВОДЫ СОСТОИТ
- 17. ФИЗИЧЕСКИЕ СВОЙСТВА ВОДЫ. ЧИСТАЯ (ДИСТИЛЛИРОВАННАЯ)
- 18. ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ. С МЕТАЛЛАМИ.
- 19. б) средние по активности металлы при взаимодействии
- 20. 2. С ОКСИДАМИ. а) оксиды металлов
- 21. 3. РАЗЛОЖЕНИЕ (ЭЛЕКТРОЛИЗ) 2H2O = 2H2 + O2
- 22. Вода и сельское хозяйство
- 23. Урок 3. Вода. Источники и виды загрязнения воды
- 24. Вода. Источники и виды загрязнения воды
- 25. Аквафор Аквариум Акваланг Акварель Акватория
- 26. 1. Среди указанных физических свойств выберите те,
- 27. 2. Вода, содержащая много растворённых солей, является:
- 28. 4. Вода, не содержащая никаких примесей, является:
- 29. Основные виды загрязнения воды
- 30. Основные факторы, загрязняющие окружающую среду. канализационные стоки
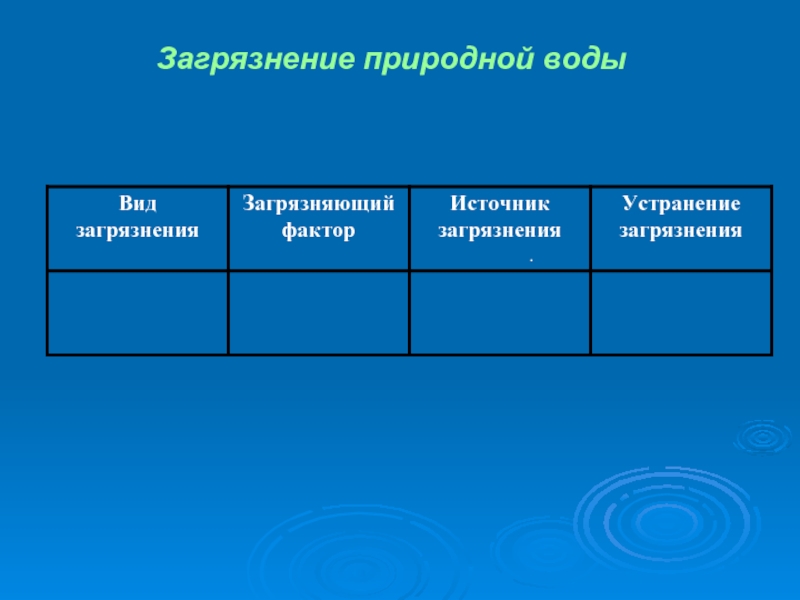
- 31. Загрязнение природной воды .
- 32. КАК ОЧИЩАЮТ ВОДУ? Питьевая вода, должна отвечать
- 33. Урок 4. Определение чистоты воды
- 34. Определение чистоты воды «Вода стоит особняком в
- 35. Объект исследования: вода из разных источников. Исследуемые
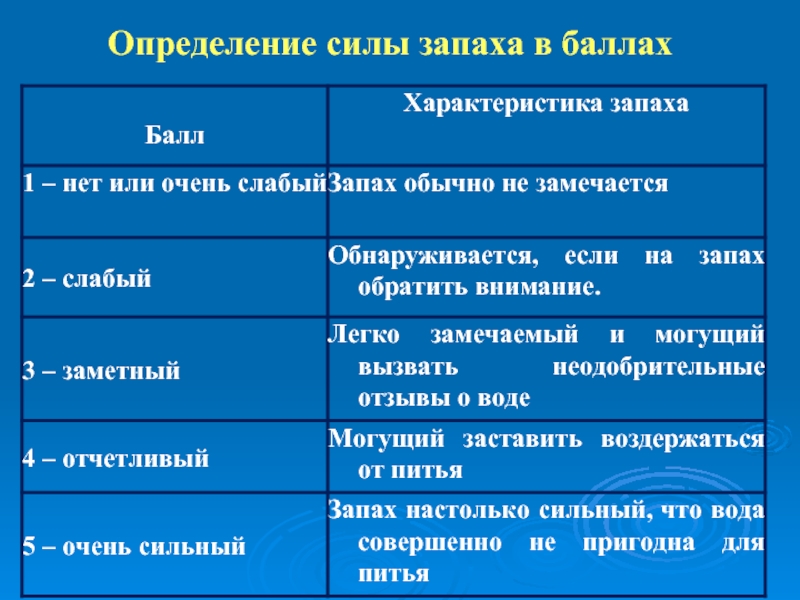
- 36. Определение силы запаха в баллах
- 37. Определение концентрации ионов водорода. Питьевая вода должна иметь рН в пределах 6,5 – 9,6
- 38. Зависимость окраски раствора от концентрации ионов железа (II)
- 39. Зависимость окраски раствора от концентрации ионов железа (III)
- 40. Зависимость интенсивности помутнения раствора от концентрации хлорид-ионов
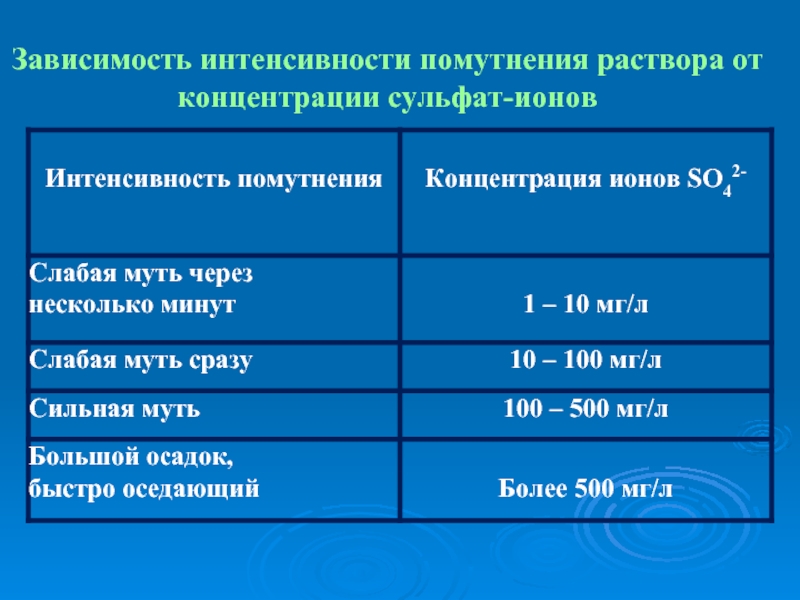
- 41. Зависимость интенсивности помутнения раствора от концентрации сульфат-ионов
- 42. Зависимость окраски раствора от концентрации ионов аммония
- 43. Характеристика анализируемых показателей
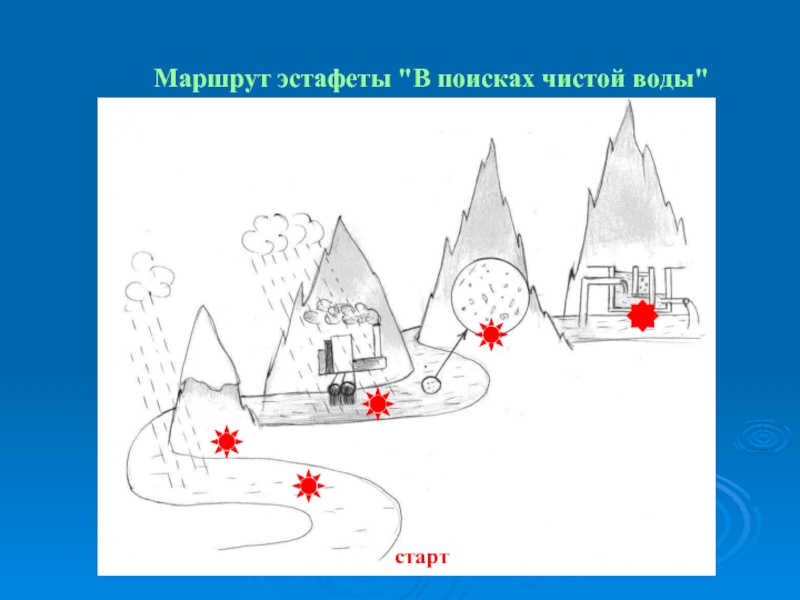
- 44. Урок 5. В поисках чистой воды
- 45. Маршрут эстафеты "В поисках чистой воды" старт
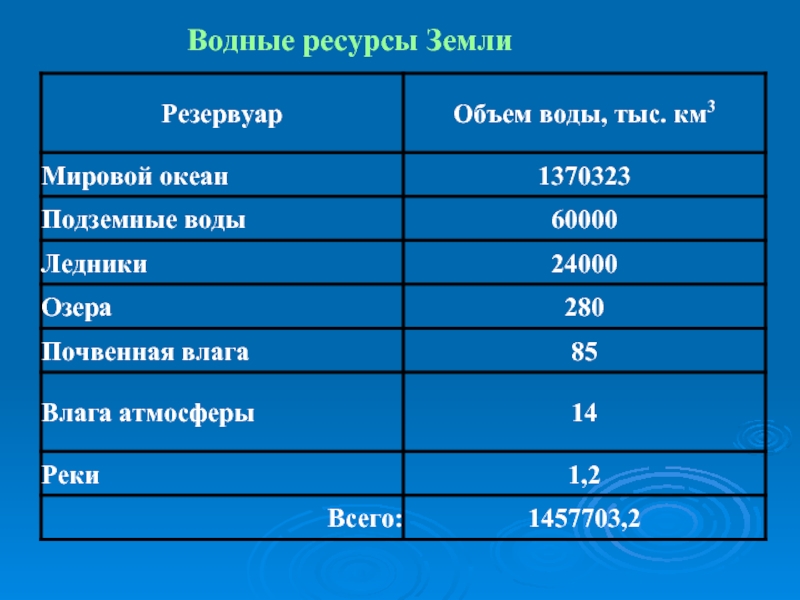
- 46. Водные ресурсы Земли
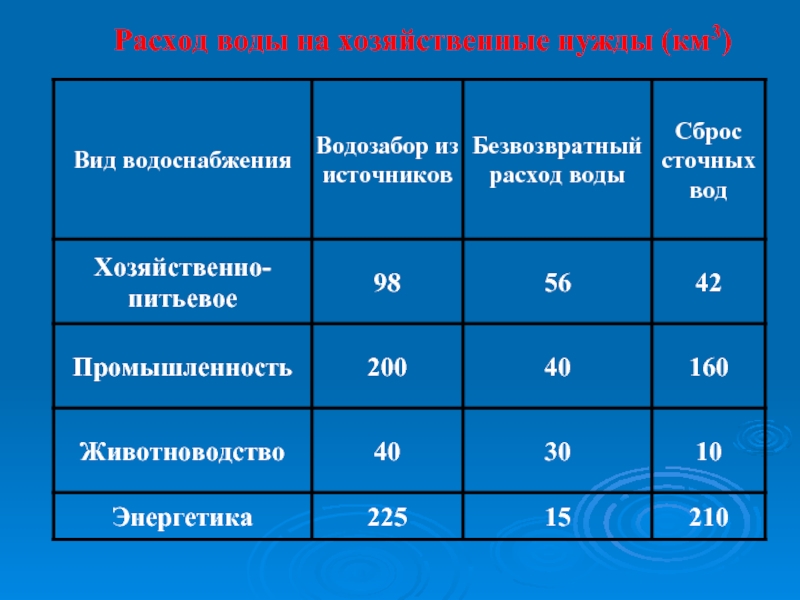
- 47. Расход воды на хозяйственные нужды (км3)
- 49. Каковы последствия загрязнения сточными водами? Проведите соответствие.
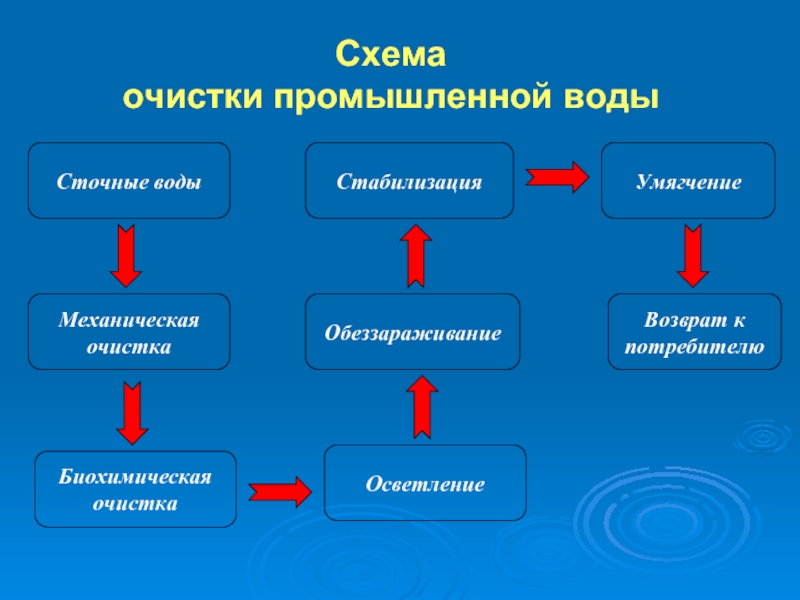
- 50. Схема очистки промышленной воды
- 51. Схема очистки питьевой воды
- 52. Урок 6. Кислотность почв путешествие
- 53. Маршрут по Кислотной области Станция 1.
- 54. Станция 1. Почвенная Фазы почвы: газовая,
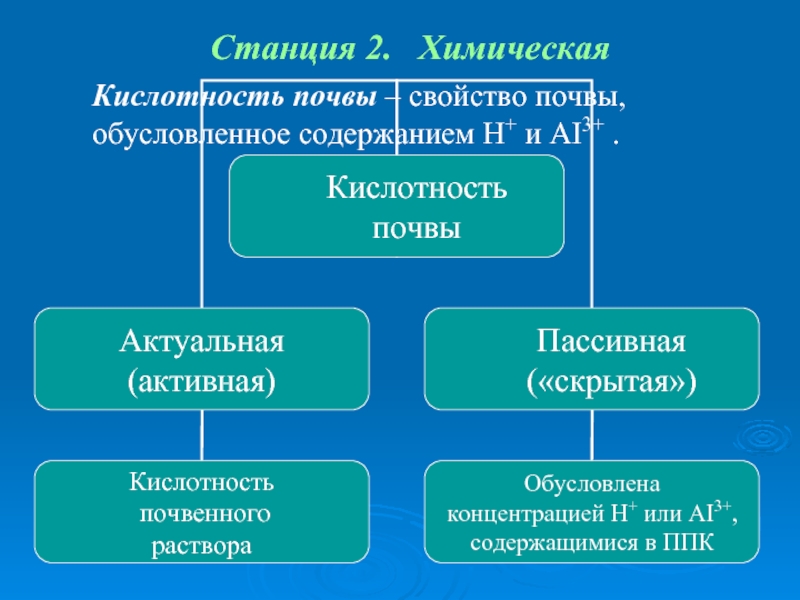
- 55. Станция 2. Химическая Кислотность почвы – свойство почвы, обусловленное содержанием H+ и AI3+ .
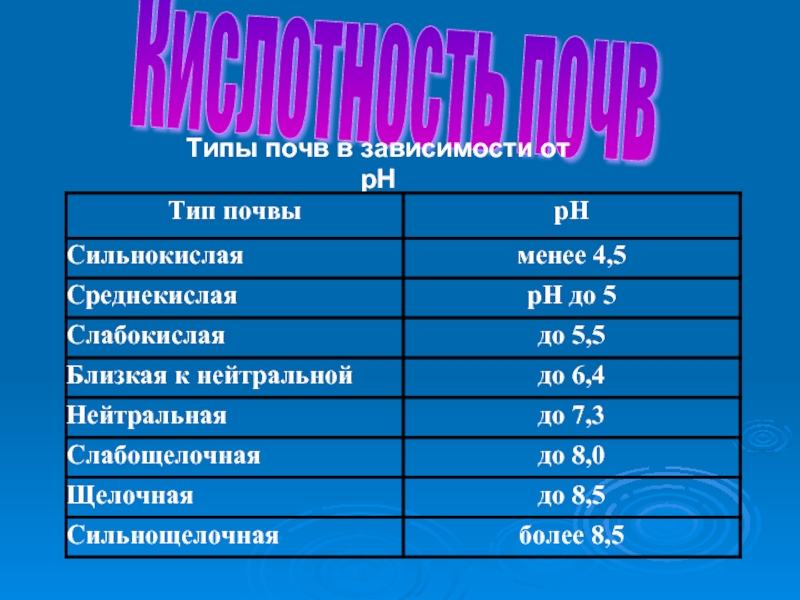
- 56. Кислотность почв Типы почв в зависимости от pH
- 57. Станция 3. Сельскохозяйственная Опасность кислых почв
- 58. Оптимальная кислотность для различных растений
- 59. Станция 4. Индикаторная Индикаторы – вещества,
- 60. Станция 5. Известковая В целях преодоления
- 61. Урок 7. Минеральные удобрения
- 62. Минеральные удобрения
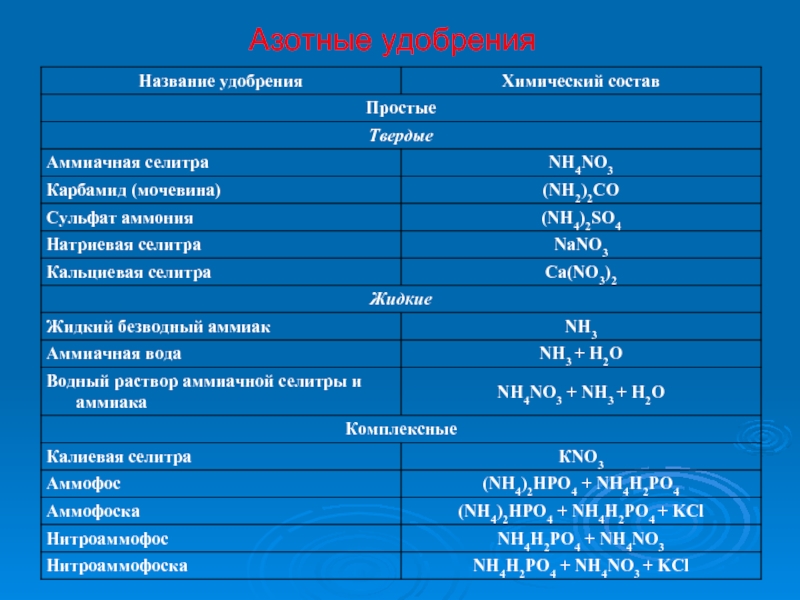
- 63. Азотные удобрения
- 64. Фосфорные удобрения
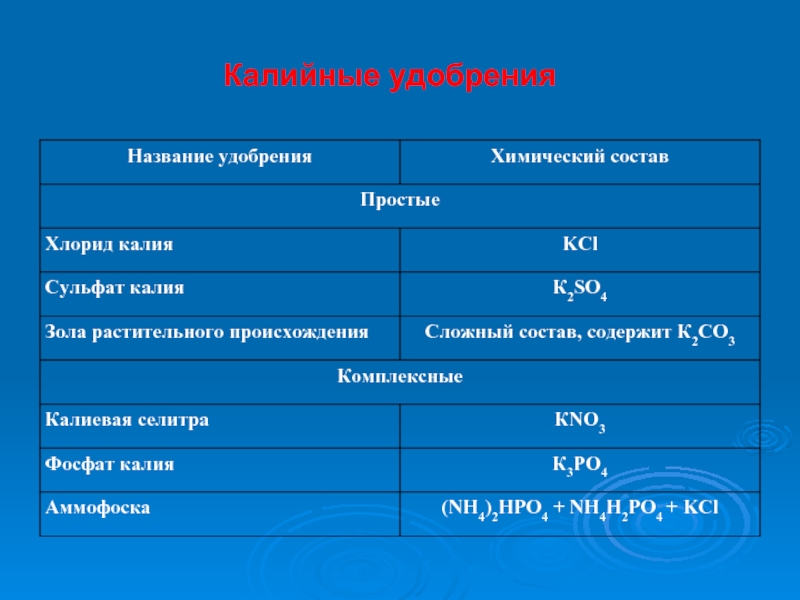
- 65. Калийные удобрения
- 66. закисление почвы Кластер «Негативное действие минеральных удобрений на окружающую среду»
- 67. Синквейн Удобрения Минеральные, органические Кормят, всасываются, загрязняют Удобрения увеличивают плодородие почвы Необходимы
Слайд 14Вода и селькое хозяйство
«Вода! Вода, у тебя нет ни вкуса, ни
Антуан де Сент-Экзюпери
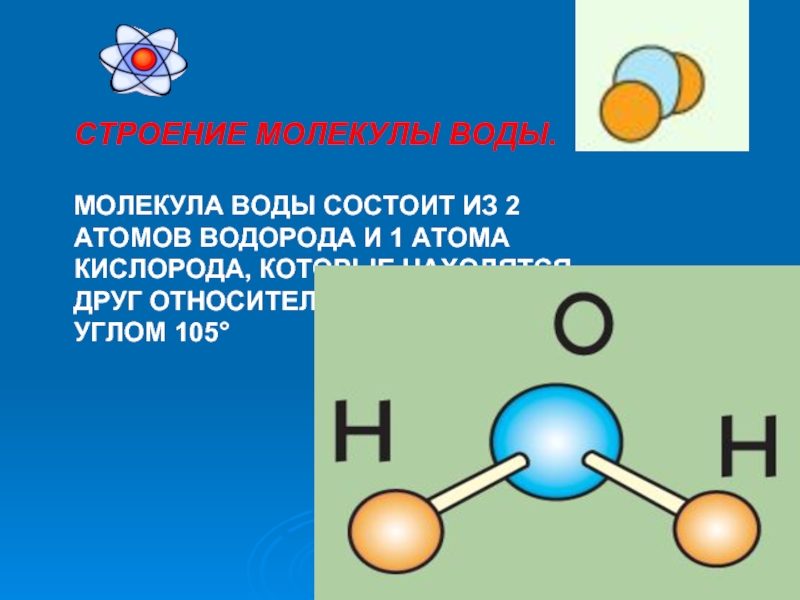
Слайд 16СТРОЕНИЕ МОЛЕКУЛЫ ВОДЫ.
МОЛЕКУЛА ВОДЫ СОСТОИТ ИЗ 2 АТОМОВ ВОДОРОДА И 1
Слайд 17ФИЗИЧЕСКИЕ СВОЙСТВА ВОДЫ.
ЧИСТАЯ (ДИСТИЛЛИРОВАННАЯ) ВОДА – БЕСЦВЕТНАЯ ЖИДКОСТЬ, БЕЗ ЗАПАХА
ЕДИНСТВЕННОЕ ВЕЩЕСТВО, КОТОРОЕ НА ЗЕМЛЕ СУЩЕСТВУЕТ В ТРЕХ АГРЕГАТНЫХ СОСТОЯНИЯХ
ТЕМПЕРАТУРА КИПЕНИЯ 100°С
ТЕМПЕРАТУРА КРИСТАЛЛИЗАЦИИ (ПЛАВЛЕНИЯ) 0°С
Слайд 18ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ.
С МЕТАЛЛАМИ.
а) очень активные металлы при взаимодействии с водой
2Na + 2H2O = 2NaOH + H2
гидроксид натрия
2K + 2H2O = 2KOH + H2
гидроксид калия
Ca + 2H2O = Ca(OH)2 + H2
гидроксид кальция
Слайд 19б) средние по активности металлы при взаимодействии с водой при нагревании
Zn + H2O = ZnO + H2
оксид цинка
в) малоактивные металлы с водой
не реагируют
Слайд 202. С ОКСИДАМИ.
а) оксиды металлов при взаимодействии с водой образуют гидроксиды
CaO
гидроксид кальция
б) оксиды неметаллов при взаимодействии с водой образуют кислоты
SO3 + H2O = H2SO4
серная кислота
Слайд 261. Среди указанных физических свойств выберите те, которые относятся к свойствам
а) бесцветная,
б) прозрачная,
в) имеет цвет,
г) кипит при температуре 900 С,
д) плотность равна 1г/мл
е) вязкая жидкость,
ж) кипит при температуре 1000 С,
з) замерзает при 00 С.
Слайд 272. Вода, содержащая много растворённых солей, является:
а) водопроводной,
б) дистиллированной,
в)
г) колодезной,
д) морской.
3. С каким свойством воды связано присутствие в ней растворимых примесей:
а) жидкость,
б) растворитель,
в) большая теплоемкость,
г) плотность.
Слайд 284. Вода, не содержащая никаких примесей, является:
а) водопроводной,
б) дистиллированной,
в) речной,
Слайд 30Основные факторы, загрязняющие окружающую среду.
канализационные стоки
кислотные дожди
опилки
минеральные удобрения
пластмассовые бутылки и пакеты
бензин
шлак
Соли тяжелых металлов и другие
Слайд 32КАК ОЧИЩАЮТ ВОДУ?
Питьевая вода, должна отвечать трем основным требованиям:
1.
2. Не содержать болезнетворных организмов.
3. Не иметь запаха, цвета, быть прозрачной и приятной на вкус.
Слайд 34Определение чистоты воды
«Вода стоит особняком в истории нашей планеты…. Нет земного
Слайд 35Объект исследования: вода из разных источников.
Исследуемые показатели:
Прозрачность
Запах
Концентрация ионов водорода
Содержание ионов
Содержание ионов железа (III)
Содержание хлорид-ионов
Содержание сульфат-ионов
Содержание ионов аммония
Наличие ионов кальция
Наличие нитрат-иона
Наличие сероводорода
Холодная окисляемость
Слайд 53Маршрут
по Кислотной области
Станция 1.
ПОЧВЕННАЯ
Станция 4.
ИНДИКАТОРНАЯ
Станция 5.
ИЗВЕСТКОВАЯ
Станция 2.
ХИМИЧЕСКАЯ
Станция 3.
СЕЛЬСКОХОЗЯЙСТВЕННАЯ
Слайд 54Станция 1. Почвенная
Фазы почвы: газовая, жидкая, твердая
Почвенный воздух содержит большое
Почвенный раствор содержит минеральные (анионы HCO3-, CI-, NO3-, SO42-, H2PO4- и катионы Ca2+, Mg2+, Na+, NH4+, K+, H+) и органические вещества, а также растворенные газы (CO2, NH3, O2 и др.).
Твердая фаза состоит из минеральной и органической части.
Почвенный поглощающий комплекс (ППК) – совокупность мелкодисперсных частиц почвы, как органических, так и минеральных, участвующих в обменных процессах с участием катионов. Имеет отрицательный заряд. В его состав входят поглощенные катионы: Ca2+, Mg2+, H+, AI3+, Na+, NH4+ и др.
Слайд 55Станция 2. Химическая
Кислотность почвы – свойство почвы, обусловленное содержанием H+
Слайд 57Станция 3. Сельскохозяйственная
Опасность кислых почв состоит в следующем:
в кислой среде
при высокой кислотности в почвенный раствор выделяются алюминий и марганец в избыточном количестве, которые являются вредными для растений;
кислая среда подавляет деятельность полезных бактерий.
Слайд 59Станция 4. Индикаторная
Индикаторы – вещества, способные менять свою окраску в
фенолфталеин,
лакмус,
метилоранжевый.
Слайд 60Станция 5. Известковая
В целях преодоления избыточной кислотности почвы с pH
CaCO3 + H2O + CO2 → Ca(HCO3)2
Ca(HCO3)2 + 2H2O↔ Ca(OH)2 + 2H2O + 2CO2