- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Убиквитин и его значение в онкологии презентация
Содержание
- 1. Убиквитин и его значение в онкологии
- 2. Убиквитин — небольшой белок (74 аминокислотных остатка, 8.5 кДа), открытый
- 3. Белок убиквитин получил название от англ. ubiquitous — «присутствующий везде».
- 4. Долгое время понять функцию убиквитина не удавалось.
- 5. Израильтяне Аарон Чихановер (Aaron Ciechanover), Аврам Хершко
- 6. Сначала была обнаружена уникальная система убиквитилирования белков.
- 7. Общий вид процесса убиквитилирования. Через сульфидную группу белок
- 8. Обнаружилось, что в роли «метки смерти» выступает
- 9. Потом обнаружилось, что есть два типа полимеров
- 10. Как системы клетки различают эти два полимера?
- 11. Учeные открыли такой молекулярный механизм, который может
- 12. Понимание молекулярного механизма разрушения «ненужных» белков может
- 13. В настоящее время ведутся интенсивные разработки различных
- 14. Заключение Разработанный убиквитиновый механизм открывает новые перспективы
Слайд 2Убиквитин — небольшой белок (74 аминокислотных остатка, 8.5 кДа), открытый в 1975 году.
Это один из самых
распространённых белков в природе. Он синтезируется во всех эукариотических клетках — от дрожжей до человека, а у человека — от клеток кожи до нейронов.
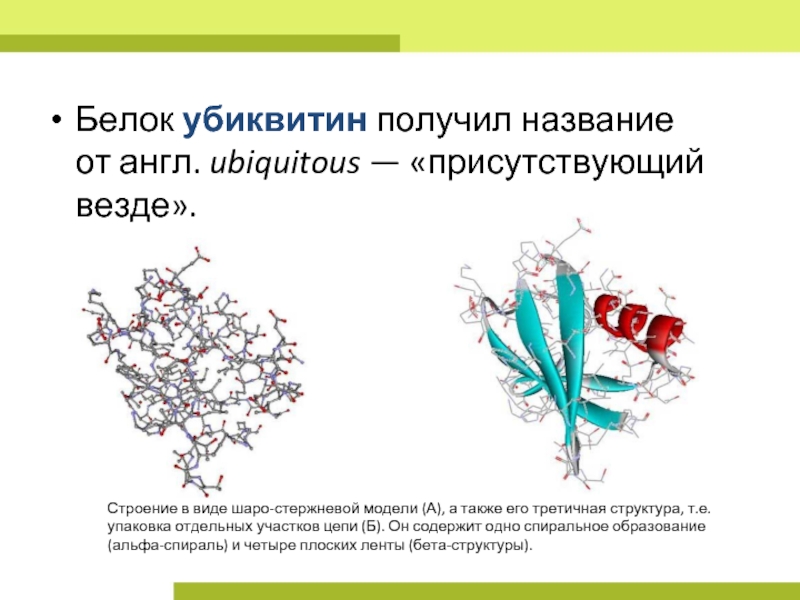
Слайд 3Белок убиквитин получил название от англ. ubiquitous — «присутствующий везде».
Строение в виде шаро-стержневой модели
(А), а также его третичная структура, т.е. упаковка отдельных участков цепи (Б). Он содержит одно спиральное образование (альфа-спираль) и четыре плоских ленты (бета-структуры).
Слайд 4Долгое время понять функцию убиквитина не удавалось. И вот, наконец, в
1980 году был открыт удивительный и неожиданный феномен — убиквитин является молекулярной «меткой смерти»!
Им метятся клеточные белки, которые по той или иной причине направляются на деградацию в специальные клеточные органеллы — протеасомы.
Им метятся клеточные белки, которые по той или иной причине направляются на деградацию в специальные клеточные органеллы — протеасомы.
вид сбоку
вид сверху
Слайд 5Израильтяне Аарон Чихановер (Aaron Ciechanover), Аврам Хершко (Avram Hershko) и американец
Ирвин Розе (Irwin Rose) в 2004 году получили Нобелевскую премию по химии, показав, что именно присоединение убиквитина к белкам вызывает их разрушение.
Irwin Rose
Avram Hershko
Aaron Ciechanover
Слайд 6Сначала была обнаружена уникальная система убиквитилирования белков.
Процесс «выписывания» «черной метки» довольно
сложен — в нем принимает участие комплекс из трёх ферментов, которые называются довольно тривиально — Е1, Е2 и Е3.
Е3 распознает белок, который нужно пометить; Е1 активирует мономер убиквитина; наконец, фермент Е2 соединяет активированный убиквитин с белком. В таком виде меченый белок может быть узнан протеасомой — белковым «шредером».
Е3 распознает белок, который нужно пометить; Е1 активирует мономер убиквитина; наконец, фермент Е2 соединяет активированный убиквитин с белком. В таком виде меченый белок может быть узнан протеасомой — белковым «шредером».
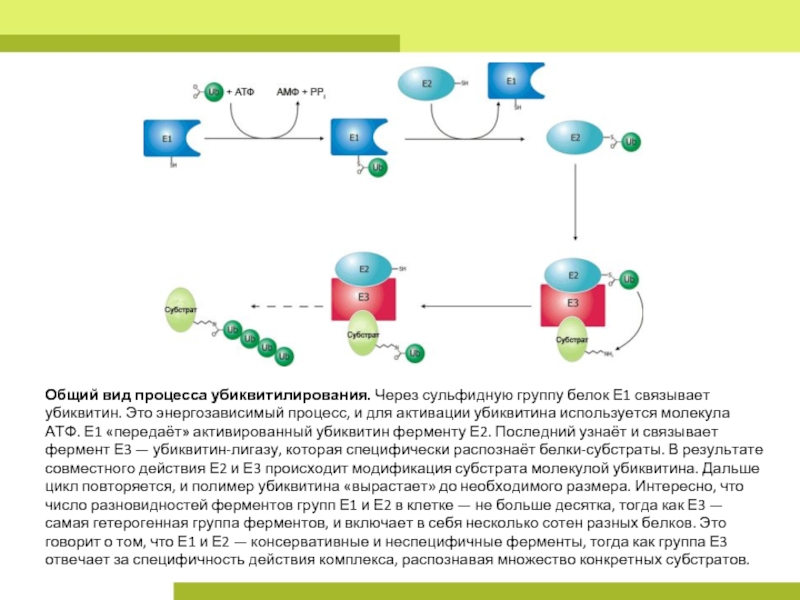
Слайд 7Общий вид процесса убиквитилирования. Через сульфидную группу белок Е1 связывает убиквитин. Это
энергозависимый процесс, и для активации убиквитина используется молекула АТФ. Е1 «передаёт» активированный убиквитин ферменту Е2. Последний узнаёт и связывает фермент Е3 — убиквитин-лигазу, которая специфически распознаёт белки-субстраты. В результате совместного действия Е2 и Е3 происходит модификация субстрата молекулой убиквитина. Дальше цикл повторяется, и полимер убиквитина «вырастает» до необходимого размера. Интересно, что число разновидностей ферментов групп Е1 и Е2 в клетке — не больше десятка, тогда как Е3 — самая гетерогенная группа ферментов, и включает в себя несколько сотен разных белков. Это говорит о том, что Е1 и Е2 — консервативные и неспецифичные ферменты, тогда как группа Е3 отвечает за специфичность действия комплекса, распознавая множество конкретных субстратов.
Слайд 8Обнаружилось, что в роли «метки смерти» выступает не одна молекула убиквитина,
а их полимер (т. е. молекула типа убиквитин — убиквитин — убиквитин -...-убиквитин). Потом обнаружилось, что есть два типа полимеров убиквитина, различающиеся по типу сшивки. Она может происходить через боковые цепи или 48-го, или 63-го остатка лизина.
Ленточная модель мономера убиквитина (жёлтым цветом показаны 7 боковых цепей лизина)
Слайд 9Потом обнаружилось, что есть два типа полимеров убиквитина, различающиеся по типу сшивки.
Она может происходить через боковые цепи или 48-го, или 63-го остатка лизина. И оказалось, что «смертельный» для белков полиубиквитин — это только один тип полимера, сшиваемый через 48-й лизиновый остаток(Ub-48).
Полимер убиквитина-63 (в котором мономеры сшиты между собой через 63-й остаток (Ub-63)) оказался намного более интересным. Он выполняет множественные регуляторные функции — активацию или ингибирование активности белков, участвует в их транспорте или процессинге, но никак не деградации.
Полимер убиквитина-63 (в котором мономеры сшиты между собой через 63-й остаток (Ub-63)) оказался намного более интересным. Он выполняет множественные регуляторные функции — активацию или ингибирование активности белков, участвует в их транспорте или процессинге, но никак не деградации.
Слайд 10Как системы клетки различают эти два полимера?
Скорее всего, различия в функциях
определяются пространственным строением этих полимеров, разным для различных вариантов межмолекулярной сшивки.
Слайд 11Учeные открыли такой молекулярный механизм, который может ликвидировать угрозу любой болезни
в зародыше, уничтожая опасные белки.
По этой причине Шведская академия наук заявила, что это открытие в будущем «даст возможность побороть рак: знания химических механизмов помогут создать нужные лекарства».
По этой причине Шведская академия наук заявила, что это открытие в будущем «даст возможность побороть рак: знания химических механизмов помогут создать нужные лекарства».
Слайд 12Понимание молекулярного механизма разрушения «ненужных» белков может быть полезно для лечения
рака и ряда других болезней путeм уничтожения определенного белка введением протеасомных стимуляторов. В других случаях, уменьшать или увеличивать содержание того или иного белка в дефектной или больной клетке.
Слайд 13В настоящее время ведутся интенсивные разработки различных лекарственных препаратов, основанные на
понимании механизма убиквитиновой защиты.
В 2004 г. в США было начато производство первого такого препарата – антиракового средства Velcade. Другое реализованное применение – создан надежный тест на бесплодие мужчин, использующий анализ на присутствие убиквитина.
В 2004 г. в США было начато производство первого такого препарата – антиракового средства Velcade. Другое реализованное применение – создан надежный тест на бесплодие мужчин, использующий анализ на присутствие убиквитина.
Слайд 14Заключение
Разработанный убиквитиновый механизм открывает новые перспективы в борьбе с различными заболеваниями.
Образование злокачественных образований или ослабление иммунной системы клетки так или иначе связаны с нарушением убиквитиновой защиты клетки от нежелательных белков. Процессы ненормального или неправильного расщепления белков приводят ко многим заболеваниям (например, болезнь Паркинсона, болезнь Альцгеймера, некоторые онкологические заболевания), а также связаны с процессами старения организма. Изученный механизм убиквитиновой защиты открывает возможность поиска различных воздействий на этот механизм с тем, чтобы запускать его в нужную сторону. Очевидно, что затормозить действие убиквитина можно, например, снизив концентрацию АТФ, поставляющего энергию, необходимую для протекания процесса. Возможны и другие способы воздействия на процесс.