- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Требования к безопасности лекарственных средствв меняющихся экономических условиях презентация
Содержание
- 1. Требования к безопасности лекарственных средствв меняющихся экономических условиях
- 2. Экономические условия
- 3. Всемирный экономический кризис, 2008 год Касается каждого
- 4. До экономического кризиса – картина становилась все
- 5. До экономического кризиса – картина становилась все
- 6. Следует ли ожидать задержки этих изменений? Пока
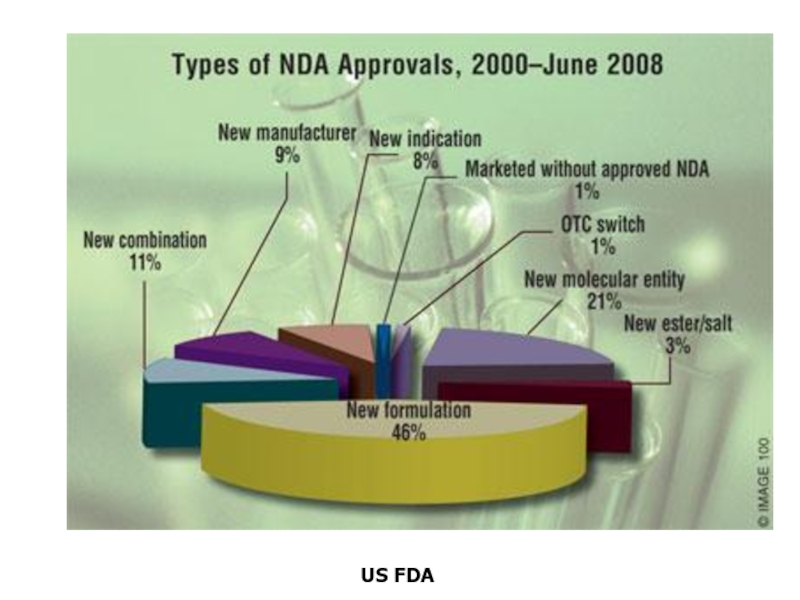
- 7. US FDA
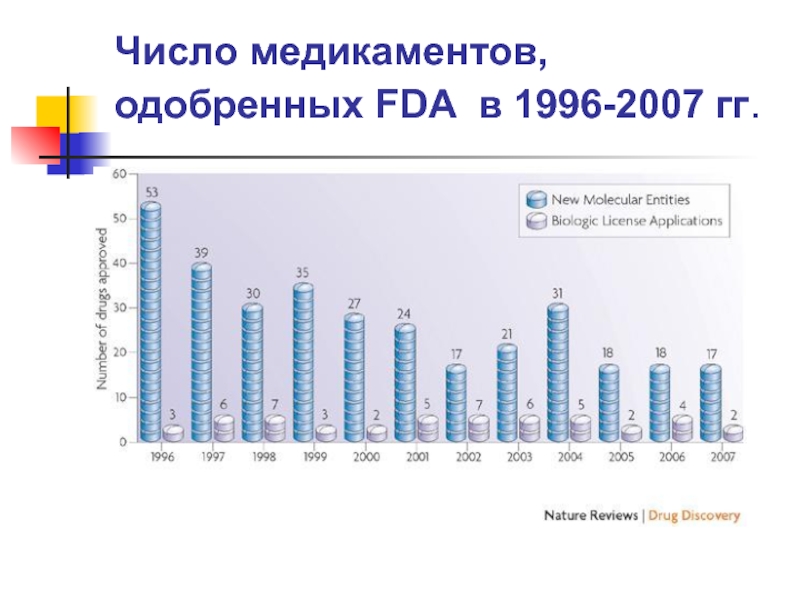
- 8. Число медикаментов, одобренных FDA в 1996-2007 гг.
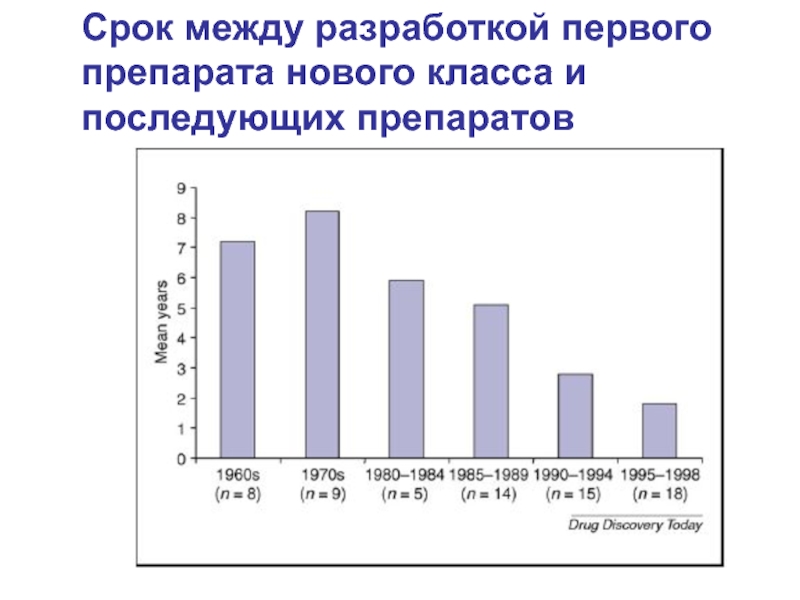
- 9. Срок между разработкой первого препарата нового класса и последующих препаратов
- 10. Расходы США на здравоохранение: $2,1
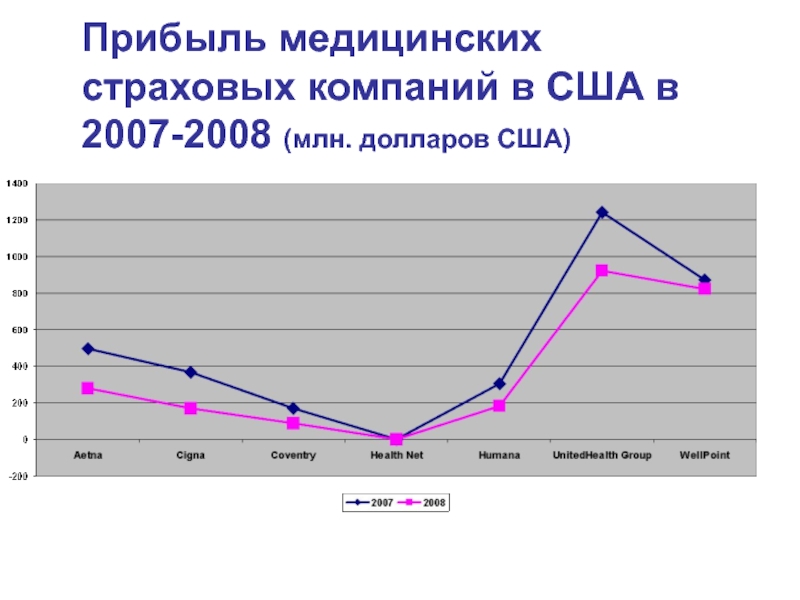
- 11. Прибыль медицинских страховых компаний в США в 2007-2008 (млн. долларов США)
- 12. Смена приоритетов в здравоохранении
- 13. Ноябрь 2008 г. Были представлены 75
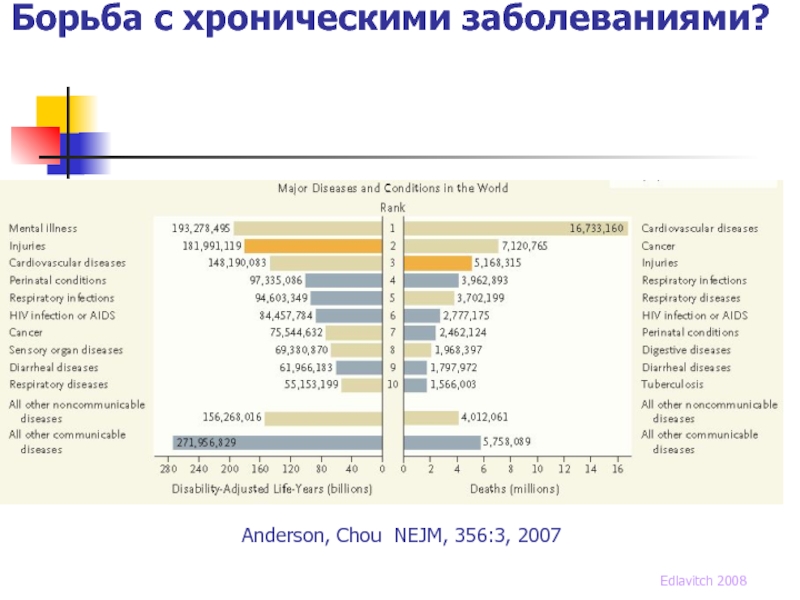
- 14. Борьба с хроническими заболеваниями? Edlavitch 2008 Anderson, Chou NEJM, 356:3, 2007
- 15. IARC ( 9 декабря 2008 г.) Смертность
- 16. Изменение числа курящих школьников за 10 лет
- 17. Безопасность лекарственных средств в США
- 18. Избранный президент США Барак ОБАМА Призвал к
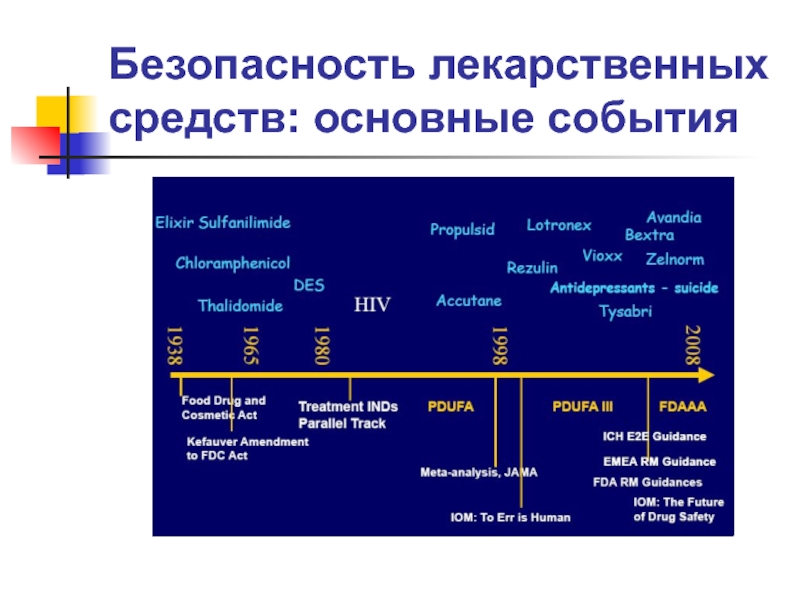
- 19. Безопасность лекарственных средств: основные события Leuftkens, 2008
- 20. Woodcock, Dept Commissioner FDA 2/27/2008 FDAAA и
- 21. Может ли FDA выполнить требования FDAAA? Да,
- 22. Может ли FDA выполнить требования FDAAA?
- 23. REMS (risk evaluation and management strategy)
- 24. Рекомендации ISPOR 2008
- 25. Рекомендации ISPOR в отношении усиления роли
- 26. Рекомендации ISPOR Систематическое сравнение рандомизированных клинических исследований
- 27. Проблемы
- 28. Процесс регистрации не является точной наукой Миллионы
- 29. Проблемы: Использование лекарств по показаниям, отличающимся от зарегистрированных
- 30. Использование медикаментов не по зарегистрированным назначениям
- 31. Проблемы: Приоритет – последнее слово за FDA?
- 32. Приоритеты – Levine против Wyeth Фармкомпании
- 33. Проблемы: Все данные становятся общедоступными
- 34. FDAAA: клинические испытания В будущем спонсор
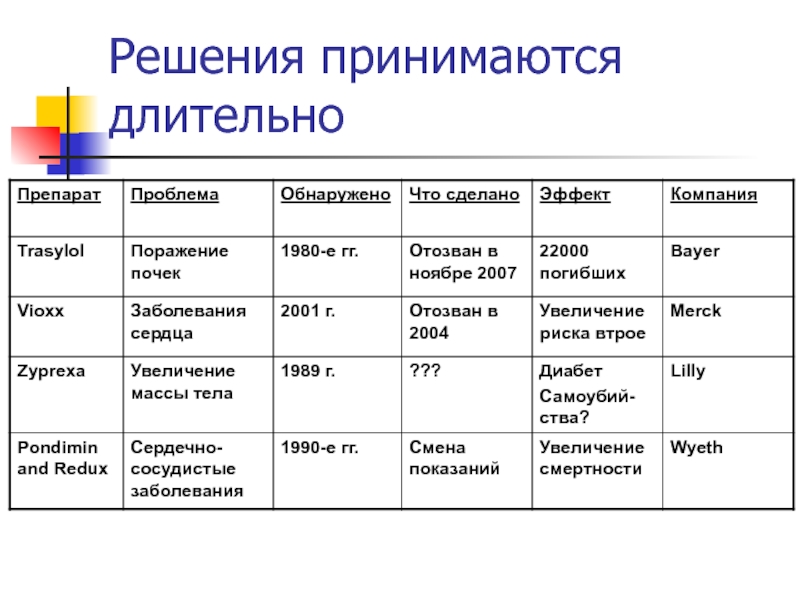
- 35. Решения принимаются длительно
- 36. Цена вопроса $700 миллионов Eli Lilly -
- 37. Законодательное стимулирование? Разработка медикаментов для «пренебрегаемых болезней»
- 38. Проблемы: Кто оценивает безопасность безрецептурных препаратов
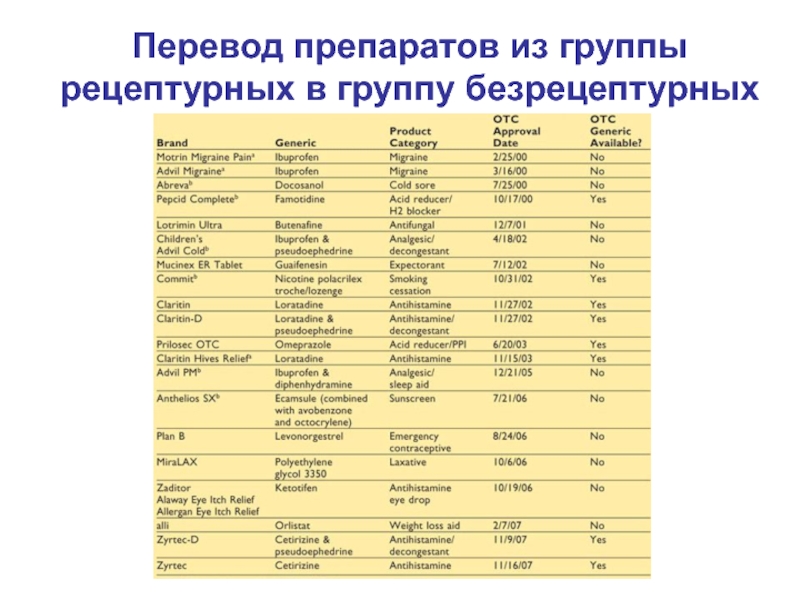
- 39. Перевод препаратов из группы рецептурных в группу безрецептурных
- 40. Витамины А, С, Е 20% американцев и европейцев принимают витамины Мета-анализ суммирует 47 исследований Безопасность???
- 41. Проблемы: Изменение поведения врача
- 42. Март 2008 – закончено исследование по лечению
- 43. Но изменение подходов не однозначно - ALLHAT
- 44. Изменение подходов не однозначно - ALLHAT Диуретики
- 45. Edlavitch 2008
- 46. ALLHAT – Почему нет? Ряд вопросов научного
- 47. Проблемы: Реклама, обращенная к потребителю
- 48. Расходы на медикаменты в США Среднедушевые расходы
- 49. Проблемы: Сравнение эффективности
- 50. Критерии для сравнения эффективности для Конгресса Edlavitch 2008
- 51. Институт сравнения эффективности Законодательно пока не утвержден
- 52. Проблемы: Опасения общественности
- 53. Опасения, что информация о безопасности/опасности лекарств для отдельных лиц станет общедоступной
- 54. Персонализованная медицина – Тестирование ДНК Некоторые пациенты
- 55. Проблемы для законодателей и исследователей Что мы
- 56. Заключение
- 57. Медицинская практика Регулирующие органы не регулируют медицинскую
- 58. Принцип «правильные лекарства для правильных пациентов
- 59. Блокбастеры или нет, вот что нам
- 60. Thank you. Спасибо за внимание!
Слайд 1Требования к безопасности лекарственных средств
в меняющихся экономических условиях
Стенли А. Эдлавич, Ph.D.,
Профессор эпидемиологии
Директор курса биоинформатики
Медицинский факультет Университета Миссури
+1 (816) 235-6617 edlavitchs@umkc.edu
МОООФИ
Москва
15 декабря 2008
Слайд 3Всемирный экономический кризис, 2008 год
Касается каждого
Никто не может предсказать ситуацию в
Индустрия
Врачи
Пациенты
Страховые компании
Исследователи
Масс-медиа
И другие ……
Edlavitch 2008
Слайд 4До экономического кризиса – картина становилась все яснее
Фармацевтическая промышленность – становилась
Особое внимание уделялось оценке «бремени заболеваемости» в будущем
Повышалась роль регуляторных органов, в т.ч. в области надзора
Развивалось международное сотрудничество
Edlavitch 2008
Слайд 5До экономического кризиса – картина становилась все яснее
Возрастало внимание к стоимости
Возрастало внимание к качеству лечения
Биоинформатика
Фармакогенетика
Индивидуальный подход к лечению
Ответственность больного
Edlavitch 2008
Слайд 6Следует ли ожидать задержки этих изменений?
Пока нельзя об этом судить
Экономические условия
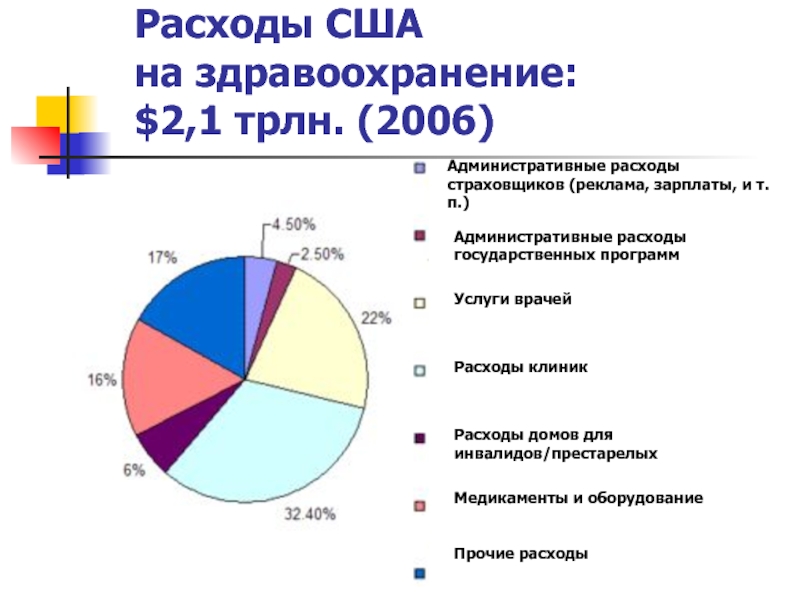
Слайд 10Расходы США
на здравоохранение:
$2,1 трлн. (2006)
Административные расходы государственных программ
Услуги врачей
Расходы
Расходы домов для инвалидов/престарелых
Медикаменты и оборудование
Прочие расходы
Административные расходы
страховщиков (реклама, зарплаты, и т.п.)
Слайд 13
Ноябрь 2008 г.
Были представлены 75 стран – национальные делегации от 55
Исследования в здравоохранении – любые дисциплины или их комбинации, задачей которых является оценка влияния здоровья населения на политику, программы, процессы, действия или события происходящие в любом секторе.
Включают биологические, экономические, природные, политические, социальные и другие детерминанты здоровья, способствуют разработке таких методов лечения, которые помогают предотвратить или уменьшить неблагоприятные эффекты, а также вносят вклад в развитие справедливости в здравоохранении и улучшении здоровья для всех
Этическая ответственность
Особое внимание - соблюдению прав человека для обеспечения социальной справедливости и завоевания доверия общества
Слайд 15IARC ( 9 декабря 2008 г.)
Смертность от рака превысит смертность от
Удвоение числа случаев рака и смертности во всем мире к 2030 г.
Рост числа курильщиков в развивающихся странах, особенно в Китае и Индии
Тенденция к снижению инфекционной заболеваемости
12 миллионов случаев рака регистрируется в мире
Смертность вследствие рака – 9 миллионов
Наибольший прирост: в России, Индии и Китае
Слайд 18Избранный президент США Барак ОБАМА
Призвал к лидерству в области здравоохранения, что
В фармацевтической промышленности
В FDA
Вследствие рекламы, напрямую адресованной потребителям
Число незастрахованных в США (15%)
Число лиц со страховкой без полного покрытия (47%)
Слайд 20Woodcock, Dept Commissioner FDA 2/27/2008
FDAAA
и усиление деятельности по обеспечению безопасности медикаментов
Усиление
Международный уровень качества
498 оценок зарубежных компаний на соответствие GMP
Улучшение обмена информацией
Издание «Drug Safety Newsletter»
Консультативный комитет FDA по коммуникациям
Усиление Оперативного Управления в области безопасности лекарств
Новые позиции в подразделениях, занимающихся оценкой медикаментов
Новое подразделение OSE (Office of Surveillance and Epidemiology) – зарегистрированные названия, ошибки в назначении медикаментов, обсервационные эпидемиологические исследования
Приоритеты, отслеживание интенсивности, соблюдение сроков, ответственность за выполнение постмаркетинговых обязательств
Слайд 21Может ли FDA выполнить требования FDAAA?
Да, если сможет найти достаточно сотрудников
Нагрузка на персонал была чрезмерна даже до принятия последних законодательных актов
Повышение финансирования не означает немедленного увеличения физических возможностей
FDA планирует прием на работу 1300 новых сотрудников
Sandy Kweder, MD Deputy Director New Drugs
APHA, Nov. 2008
Слайд 22Может ли FDA выполнить требования FDAAA?
Права, ответственность, и требования к
Законодательство необыкновенно сложное
Документация весьма основательна
Мы все спрашиваем: как это все будет работать?
Sandy Kweder, MD Deputy Director New Drugs
APHA, Nov. 2008
Слайд 23REMS (risk evaluation and management strategy)
Требуется разработка Стратегии по Оценке
(1) Выдачи каждому больному руководства по назначению медикаментов и вкладыша в упаковку для пациента;
(2) Плана по распространению информации для медицинских учреждений
(3) Мероприятий по обеспечению безопасности
Создается Совет по надзору за безопасностью медикаментов
Слайд 25Рекомендации ISPOR в отношении усиления роли экономики здравоохранения в принятии решений
Проведение большего числа рандомизированных клинических исследований в тех условиях, где будут приниматься решения, например, в лечебных учреждениях
Использование как можно более естественного дизайна исследований, включая максимальную имитацию обычных способов лечения, для более широкой применимости результатов
Минимизация или либерализация критериев включения и исключения
Использование сравнения не с плацебо, а с реально используемыми препаратами
Слайд 26Рекомендации ISPOR
Систематическое сравнение рандомизированных клинических исследований и обсервационных исследований в отношении
Использование методологических подходов других дисциплин (психологии, социологии, маркетинговых исследований), особенно в области сбора данных, их анализа и обработки
Использование данных электронных историй болезни
Слайд 28Процесс регистрации не является точной наукой
Миллионы людей могут принимать годами лекарство,
Некоторые лекарства оцениваются агентством в ускоренном режиме
Нет длительного отслеживания эффектов лекарств
NEJM—“фармацевтические компании [часто] узнают об опасностях применения своих медикаментов задолго до FDA [ и не] раскрывают эту информацию FDA”
Слайд 30Использование медикаментов не по зарегистрированным назначениям Данные NDTI – IMS Rx
56 110 пар показаний для лекарств
1,8 млрд. случаев использования
18 показаний на 1 лекарство согласно NDTI
Слайд 32Приоритеты – Levine против Wyeth
Фармкомпании и FDA спорят, является ли позиция
Может ли больной подать иск к фармкомпании, если продукт уже был допущен на рынок FDA
Drug and Device Law
Thursday, November 06, 2008
Слайд 34FDAAA: клинические испытания
В будущем спонсор испытаний должен будет регистрировать все клинические
Edlavitch 2008
Слайд 36Цена вопроса
$700 миллионов Eli Lilly - Zyprexa - 2005
$15 миллиардов Wyeth
$5,78 миллиардов Merck Vioxx 2008 (потенциально $30 миллиардов)
? Trasylol – 78 исков - Bayer
Edlavitch 2008
Слайд 37Законодательное стимулирование?
Разработка медикаментов для «пренебрегаемых болезней» — проблема с обещанным FDA
Aaron S. Kesselheim, M.D., J.D., M.P.H.
NEJM 359; 19 November 6, 2008
Edlavitch 2008
Слайд 40Витамины А, С, Е
20% американцев и европейцев принимают витамины
Мета-анализ суммирует 47
Безопасность???
Слайд 42Март 2008 – закончено исследование по лечению тяжелой гипертензии
Результаты могут изменить
Комбинация ИАПФ-БКК снижает риск сердечно-сосудистых заболеваний сильнее, чем комбинация ИАПФ-диуретики
Оба варианта лучше, чем диуретики, в качестве препарата первого выбора
Снижение риска сердечно-сосудистых заболеваний на 20%
Снижение абсолютного риска на 2,2%
Слайд 43Но изменение подходов не однозначно - ALLHAT 6 лет, 42 тыс. больных,
ALLHAT (Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial) –закончено в 2002 г.
Диуретики в 20 раз дешевле, более эффективны и безопасны, чем БКК и ингибиторы АПФ
Норваск (БКК): +38% риск сердечной недостаточности
Ингибитор АПФ: +15% риск инсульта и +19% риск сердечной недостаточности
Edlavitch 2008
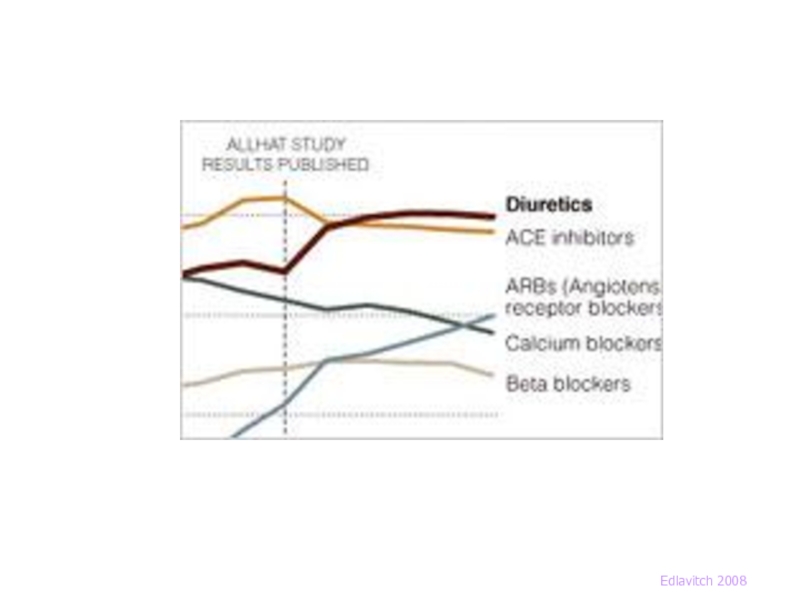
Слайд 44Изменение подходов не однозначно - ALLHAT
Диуретики
Ингибиторы АПФ $250/год
Блокаторы Ca- каналов $500/год
Edlavitch 2008
Слайд 46ALLHAT – Почему нет?
Ряд вопросов научного плана
Агрессивная рекламная компания
Мы недостаточно знаем,
Edlavitch 2008
Слайд 48Расходы на медикаменты в США
Среднедушевые расходы в США на 92% выше,
Расходы на рекламу для потребителей (DTC) увеличились на 330% за 1996 - 2006
DTC - $4,2 миллиарда в 2006 г.
Расходы на обеспечение безопасности – около $400 миллионов
Edlavitch 2008
Слайд 51Институт сравнения эффективности
Законодательно пока не утвержден
Малый первоначальный бюджет – планируется рост
21 член совета:
Секретарь Департамента Здравоохранения США
Директор Национального института здоровья
Частные плательщики
Фармацевтические и другие компании.
Пациенты и потребители медицинских услуг
Врачи
Органы, администрирующие программы общественного здравоохранения
Слайд 53Опасения, что информация о безопасности/опасности лекарств для отдельных лиц станет общедоступной
Слайд 54Персонализованная медицина – Тестирование ДНК
Некоторые пациенты опасаются, что страховщики, работодатели, военные
Преимущества в диагностике и лечении:
Рак молочной железы
Рак кишечника
Дефицит альфа1-антитрипсина
Рак простаты
Болезнь Хантингтона
Гемохроматоз
Слайд 55Проблемы для законодателей и исследователей
Что мы могли бы делать ?
Выводить эффективные
Исследовать растительные препараты и средства альтернативной медицины
Иметь доказательства безопасности препаратов в момент регистрации и после нее
Обеспечивать безопасное применение препаратов врачами и пациентами
Слайд 57Медицинская практика
Регулирующие органы не регулируют медицинскую практику
Регулирование медицинской практики производится на
Регистрация препаратов в Евросоюзе и США производится не на основании оценки их экономической эффективности
Слайд 58
Принцип «правильные лекарства для правильных пациентов в правильной дозе» означает меньше
Бывший руководитель FDA Kessler
Слайд 59
Блокбастеры или нет, вот что нам нужно:
Высококвалифицированные ученые
Более научные походы
Интеграция дисциплин
Способность
Приоритет общественного здоровья
Внимание к решению тех проблем здравоохранения, значение которых может возрасти в будущем
Вера в то, что приоритетность общественного здоровья сохранится и в это сложное время