- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Термодинамика. презентация
Содержание
- 1. Термодинамика.
- 2. Внутренняя энергия Идеальный газ U = ∑Eki
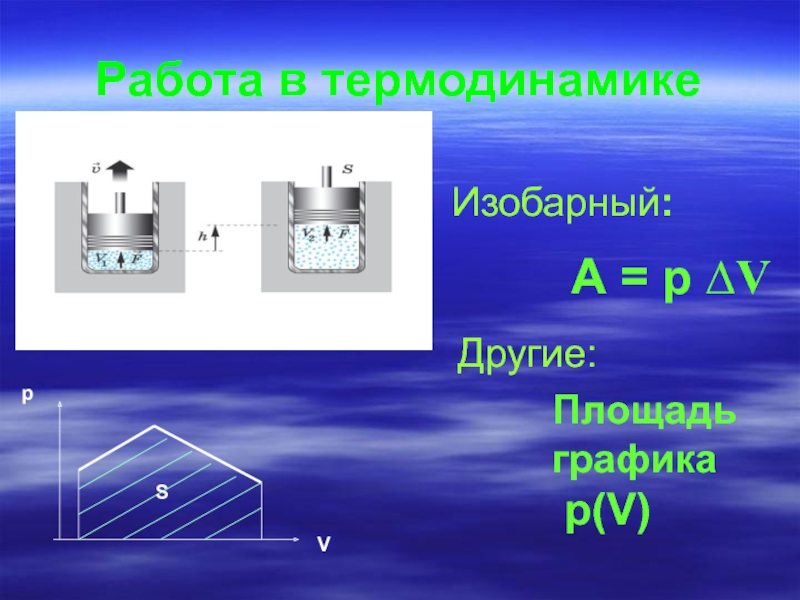
- 3. Работа в термодинамике Изобарный: А = p
- 4. I закон термодинамики Невозможность создания вечного двигателя I рода
- 5. II закон термодинамики Направление тепловых процессов: от
- 6. ТЕПЛОВЫЕ ДВИГАТЕЛИ T1 - температура нагревателя Q1
- 7. Взаимные превращения Парообразование: испарение
- 8. Твердые тела Дальний порядок в расположении частиц;
- 9. Жидкости Силы поверхностного натяжения - поверхность стремится
- 10. ВЛАЖНОСТЬ ВОЗДУХА p – парциальное давление
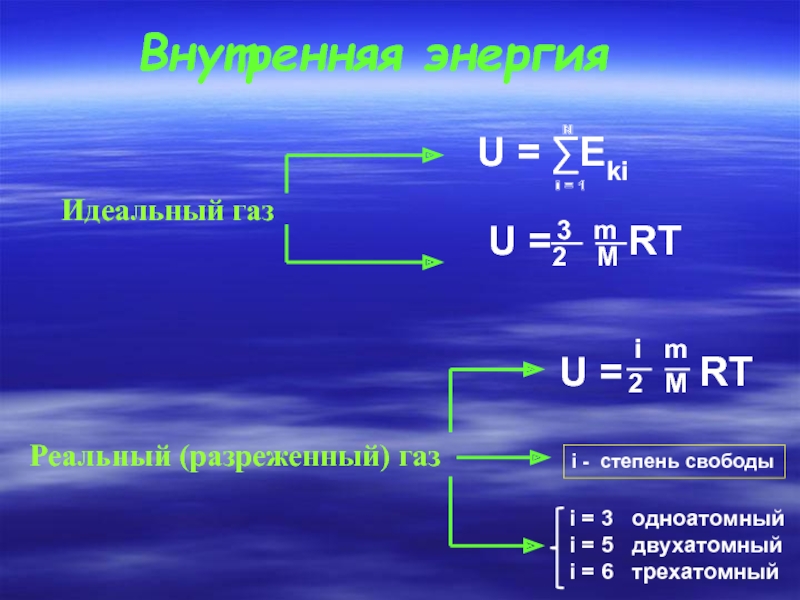
Слайд 2Внутренняя энергия
Идеальный газ
U = ∑Eki
N
i = 1
U =
3 m
2 M
i - степень свободы
Реальный (разреженный) газ
U = RT
i m
2 M
i = 3 одноатомный
i = 5 двухатомный
i = 6 трехатомный
Слайд 5II закон термодинамики
Направление тепловых процессов: от более нагретых к менее нагретым.
Невозможность
Необратимость процессов связана со стремлением систем к переходу в наиболее вероятностное состояние.
Слайд 6ТЕПЛОВЫЕ ДВИГАТЕЛИ
T1 - температура нагревателя
Q1 – от нагревателя раб. телу
T2 -
Q2 – от раб. тела холодильнику
T =
= T
1
2
η =
Q1 – Q2
Q1
η =
T1 – T2
T1
Слайд 7
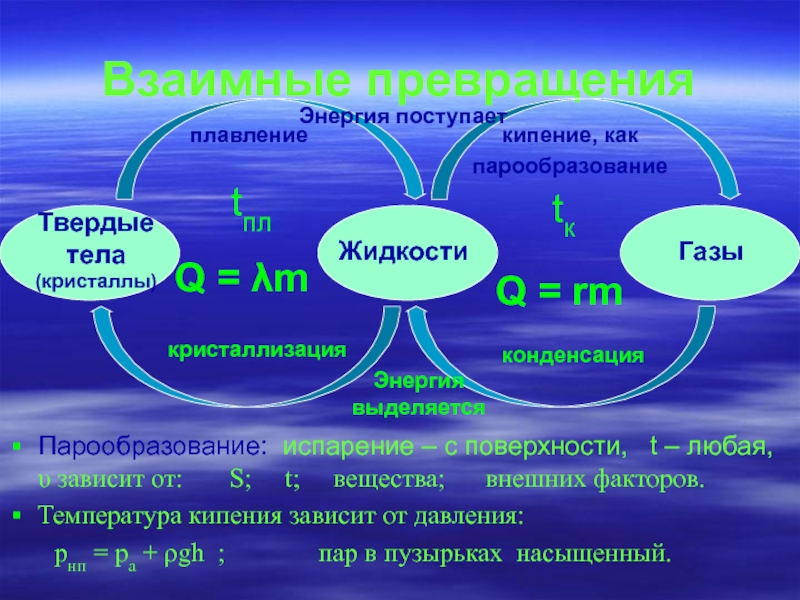
Взаимные превращения
Парообразование: испарение – с поверхности, t – любая, υ
Температура кипения зависит от давления:
pнп = pa + ρgh ; пар в пузырьках насыщенный.
Твердые
тела
(кристаллы)
Жидкости
Газы
Энергия поступает
Энергия
выделяется
tпл
tк
Q = λm
Q = rm
плавление
парообразование
кристаллизация
конденсация
кипение, как
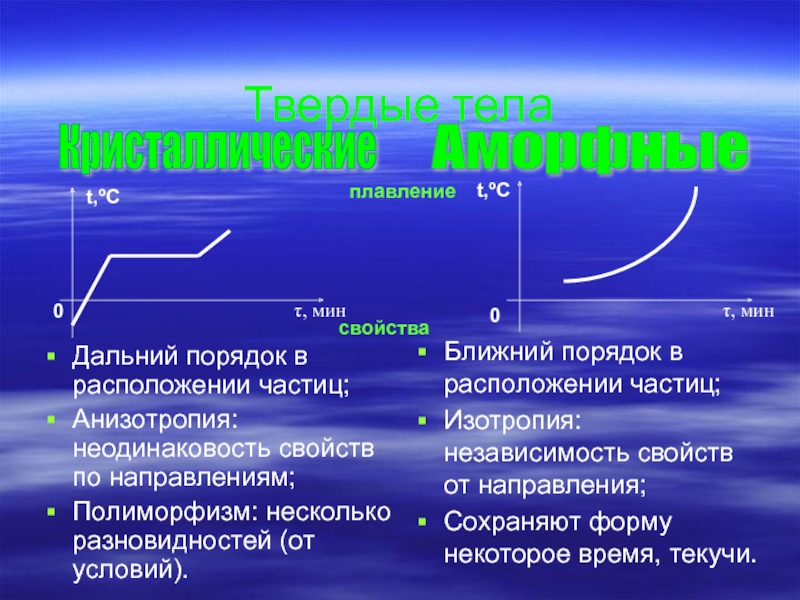
Слайд 8Твердые тела
Дальний порядок в расположении частиц;
Анизотропия: неодинаковость свойств по направлениям;
Полиморфизм: несколько
Ближний порядок в расположении частиц;
Изотропия: независимость свойств от направления;
Сохраняют форму некоторое время, текучи.
Кристаллические
Аморфные
t,ºC
0
τ, мин
плавление
t,ºC
τ, мин
0
свойства
Слайд 9Жидкости
Силы поверхностного натяжения - поверхность стремится к сокращению.
Избыток потенциальной энергии на
На границе жидкость – твердое тело.
Давление меньше внешнего (смачивание),
больше внешнего (нет).
Поверхностное натяжение
Капиллярные явления
смачивает
Не смачивает
Слайд 10ВЛАЖНОСТЬ ВОЗДУХА
p – парциальное давление газа
p0 – давление насыщенного
ρ – абсолютная влажность воздуха
φ - относительная влажность воздуха
T росы - точка росы: пар становится насыщенным