- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Сущность и классификация химических реакций презентация
Содержание
- 1. Сущность и классификация химических реакций
- 2. Задачи урока: Повторить и обобщить сведения о
- 3. Сущность химических процессов: Разрыв химических связей в
- 4. Внешний вид продукта реакции: Нерастворимое вещество в
- 5. Укажите химические процессы: Скисание молока. Горение свечи.
- 6. Химические уравнения - запись химического
- 7. Найдите правильную запись химического процесса: СН4 =
- 8. Историческая справка. В 1748 году сформулирован закон
- 9. коэффициенты Это числа, указывающие на количество молекул
- 10. Классификация химических реакций Тип химической реакции.
- 12. Окислительно-восстановительные реакции. Окислитель Восстановитель Окисление Восстановление Нулевая степень окисления
- 13. Обратимость процесса Реакции, протекающие в одном направлении. Реакции, протекающие в обоих направлениях.
- 14. Участие катализатора Вещество, замедляющее процесс химической реакции
- 15. Тепловой эффект Экзотермические реакции Эндотермические реакции
- 16. Наличие раздела фаз Гомогенный процесс Гетерогенный процесс
- 17. Основной вывод по теме: Независимо
- 18. Практическое использование знаний химических процессов:
Слайд 2Задачи урока:
Повторить и обобщить сведения о классификации химических реакций.
Рассмотреть закон сохранения
массы веществ при химических реакциях.
Применить полученные знания при решении химических задач.
Применить полученные знания при решении химических задач.
Слайд 3Сущность химических процессов:
Разрыв химических связей в исходных веществах.
Возникновение новых связей в
продуктах реакции.
Получение готового продукта, возможность выделить его из общей массы веществ.
Получение готового продукта, возможность выделить его из общей массы веществ.
Слайд 4Внешний вид продукта реакции:
Нерастворимое вещество в виде осадка.
Получение газообразного вещества.
Получение раствора,
где одним из продуктов будет вода.
Слайд 5Укажите химические процессы:
Скисание молока.
Горение свечи.
Измельчение куска мела.
Испарение воды.
Ржавление железа.
Гниение продукта.
Плавление воска.
Взбивание
масла.
Слайд 6Химические уравнения -
запись химического процесса,
показывающая количество вступивших реагентов и полученных продуктов.
2H2 + O2 = 2 H2O
2H2 + O2 = 2 H2O
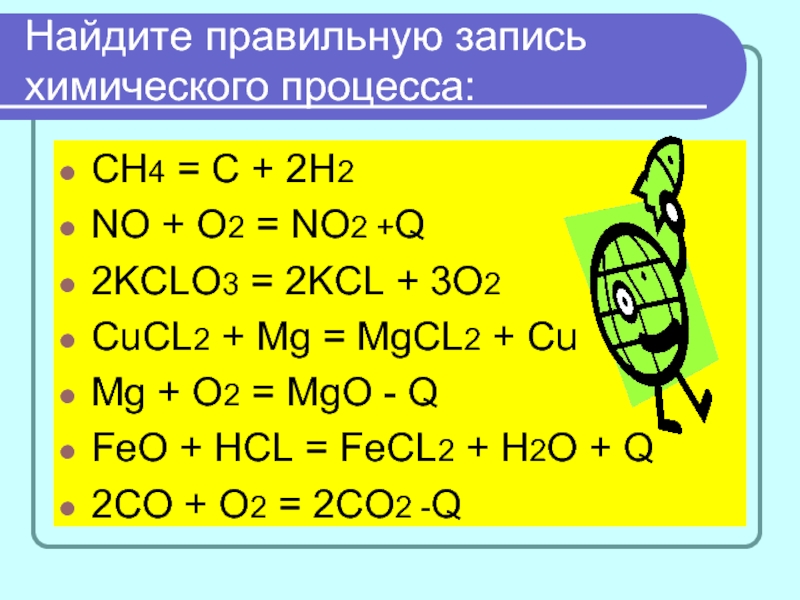
Слайд 7Найдите правильную запись химического процесса:
СН4 = С + 2Н2
NO + O2
= NO2 +Q
2KCLO3 = 2KCL + 3O2
CuCL2 + Mg = MgCL2 + Cu
Mg + O2 = MgO - Q
FeO + HCL = FeCL2 + H2O + Q
2CO + O2 = 2CO2 -Q
2KCLO3 = 2KCL + 3O2
CuCL2 + Mg = MgCL2 + Cu
Mg + O2 = MgO - Q
FeO + HCL = FeCL2 + H2O + Q
2CO + O2 = 2CO2 -Q
Слайд 8Историческая справка.
В 1748 году сформулирован закон сохранения массы веществ, согласно которому
« масса реагентов, вступивших в реакцию, равна массе продуктов реакции»
М.В.Ломоносов
Слайд 9коэффициенты
Это числа, указывающие на количество молекул вещества, участвующего в химическом процессе:
N2
+ 3H2 =2NH3
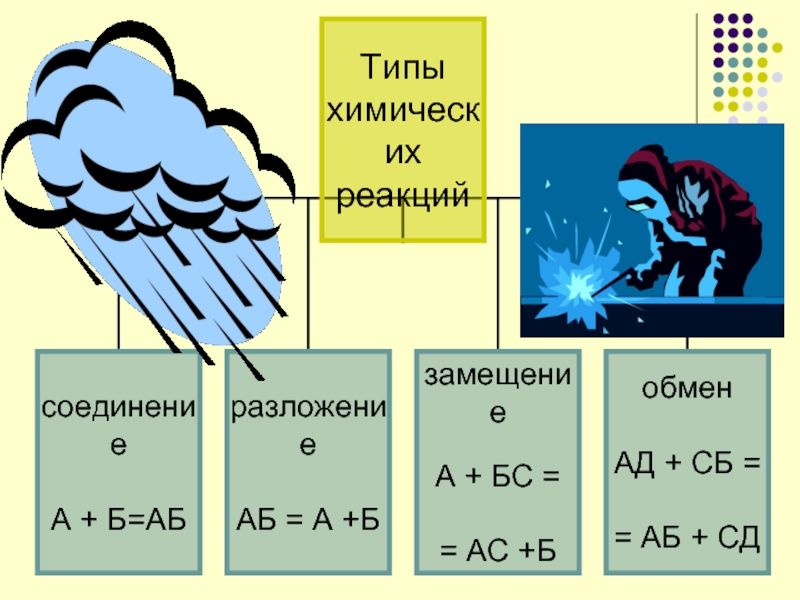
Слайд 10Классификация химических реакций
Тип химической реакции.
Изменение степеней окисления элементов (окислительно-восстановительные реакции).
Обратимость процесса.
Участие
катализатора.
Тепловой эффект реакции.
Наличие раздела фаз (гомо- или гетерогенный процесс).
Тепловой эффект реакции.
Наличие раздела фаз (гомо- или гетерогенный процесс).
Слайд 12Окислительно-восстановительные реакции.
Окислитель
Восстановитель
Окисление
Восстановление
Нулевая степень окисления
Слайд 13Обратимость процесса
Реакции, протекающие в одном направлении.
Реакции, протекающие в обоих направлениях.
Слайд 14Участие катализатора
Вещество, замедляющее процесс химической реакции – ингибитор.
Вещество, ускоряющее процесс химической
реакции – катализатор.
Слайд 17Основной вывод по теме:
Независимо от того, между какими веществами
– органическими или неорганическими – происходит химическое превращение, для них характерны одни и те же закономерности.
Слайд 18Практическое использование знаний химических процессов:
Вычислите массу цинка, который надо
растворить в серной кислоте, чтобы получить водород, необходимый для восстановления оксида меди массой 14,4 г.
Схема реакций:
Zn + H2SO4 = ZnSO4 + H2
H2 + CuO = Cu + H2O
Коковина Лилия Евгеньевна
Схема реакций:
Zn + H2SO4 = ZnSO4 + H2
H2 + CuO = Cu + H2O
Коковина Лилия Евгеньевна