- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Соли азотной кислоты, применение презентация
Содержание
- 1. Соли азотной кислоты, применение
- 2. знать и уметь называть соли азотной
- 3. Игра «КРЕСТИКИ- НОЛИКИ Раствор азотной кислоты реагирует с каждым из веществ.
- 4. К каким классам неорганических веществ принадлежат эти
- 5. Закончите уравнения реакций и объясните, какие классы
- 6. Даны пары веществ, составьте возможные уравнения реакций
- 7. Перечислите соли полученные в результате возможных реакций.
- 8. Нитраты – твердые кристаллические вещества, тугоплавки, определите
- 9. Физические свойства нитратов Какие вещества называют солями?
- 10. Химические свойства нитратов Взаимодействие нитратов
- 11. Занимательная история Любознательный химик изучил типы химических
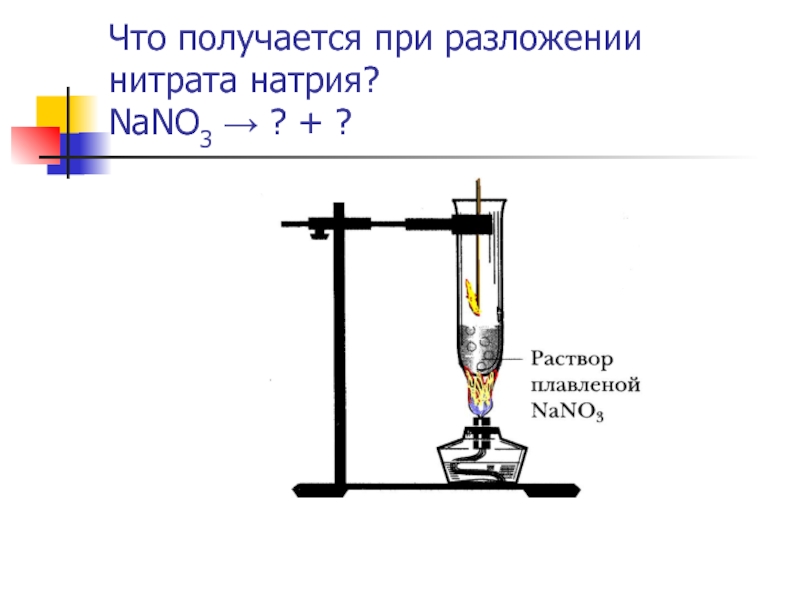
- 12. Что получается при разложении нитрата натрия? NaNO3 → ? + ?
- 13. После первого опыта юный химик решил проверить,
- 14. Cu(NO3)2 → А + В +? Cu(NO3)2 → … + ...+ …
- 15. Разложение нитрата меди (II)
- 16. Все нитраты термически неустойчивы. При нагревании они
Слайд 1Соли азотной кислоты, применение
Девиз урока
«Au, Na, Ar, Ne, It, Eu –
Л. Н. Толстой
Слайд 2знать и уметь
называть соли азотной кислоты, определять какие свойства окислительные
определять: степень окисления химических элементов в формулах солей; типы химических реакций, в которых они могут участвовать;
характеризовать: общие химические свойства солей азотной кислоты;
Слайд 4К каким классам неорганических веществ принадлежат эти вещества?
1.Назовите
2. Составьте в тетради молекулярные уравнения реакций получения нитратов.
Слайд 5Закончите уравнения реакций и объясните, какие классы соединений при взаимодействии могут
ВаО + НNO3→
ВаО + N2О5 →
Ba(NO3)2 + Na2SO4 →
Слайд 6Даны пары веществ, составьте возможные уравнения реакций
а) гидроксид натрия и
б) гидроксид калия и оксид азота (V),
в) оксид кальция и азотная кислота,
г) аммиак и азотная кислота,
д) сульфат бария и нитрат кальция,
е) хлорид натрия и нитрат бария,
Какие из реакций невозможны и почему?
Слайд 7Перечислите соли полученные в результате возможных реакций.
Нитраты калия, натрия, кальция и
KNO3 – нитрат калия (индийская селитра), NаNО3 – нитрат натрия (чилийская селитра), Са(NО3)2 – нитрат кальция (норвежская селитра)
NH4NO3 – нитрат аммония (аммиачная или аммонийная селитра, ее месторождений в природе нет).
Германская промышленность считается первой в мире, получившей соль NH4NO3 из азота N2 воздуха и водорода воды, пригодную для питания растений.
Слайд 8Нитраты – твердые кристаллические вещества, тугоплавки, определите по таблице растворимости, к
Слайд 9Физические свойства нитратов
Какие вещества называют солями?
Нужно построить логическую цепочку: вид химической
Слайд 10 Химические свойства нитратов
Взаимодействие нитратов с металлами,
кислотами, щелочами, солями
Cu(NO3)2 +
AgNO3 + HCl … ,
Cu(NO3)2 + NaOH … ,
AgNO3 + BaCl2 … .
Слайд 11Занимательная история
Любознательный химик изучил типы химических реакций и заметил, что нерастворимые
Когда соль нагрелась и расплавилась, он опустил в пробирку тлеющую лучину, она внезапно вспыхнула. К каким выводам пришел юный химик?
Слайд 13После первого опыта юный химик решил проверить, как будут разлагаться другие
При разложении нитрат меди(II) образовалось вещество (А) черного цвета и выделился газ (В) бурого цвета. Cu(NO3)2 → А + В +?
Составьте уравнение реакции разложения этой соли, применяя закон сохранения массы вещества.
Укажите окислитель, восстановитель.
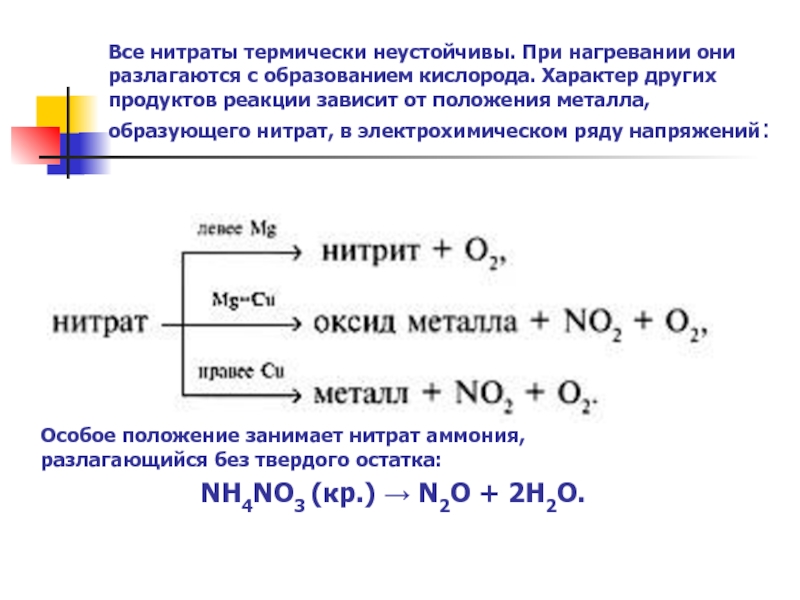
Слайд 16Все нитраты термически неустойчивы. При нагревании они разлагаются с образованием кислорода.
Особое положение занимает нитрат аммония,
разлагающийся без твердого остатка:
NH4NO3 (кр.) → N2O + 2H2O.