- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
соли презентация
Содержание
- 1. соли
- 2. Определение Метn NO3 (PO4)2
- 3. Определение Соли – это сложные вещества,
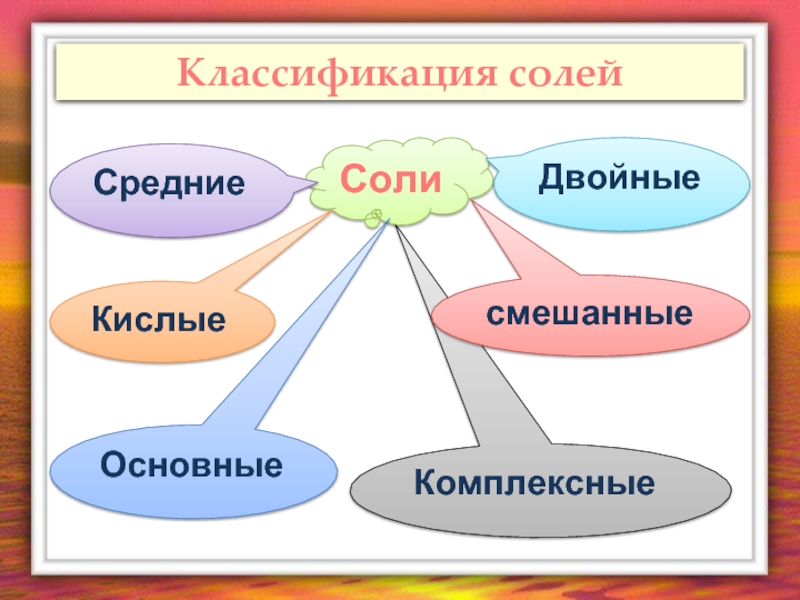
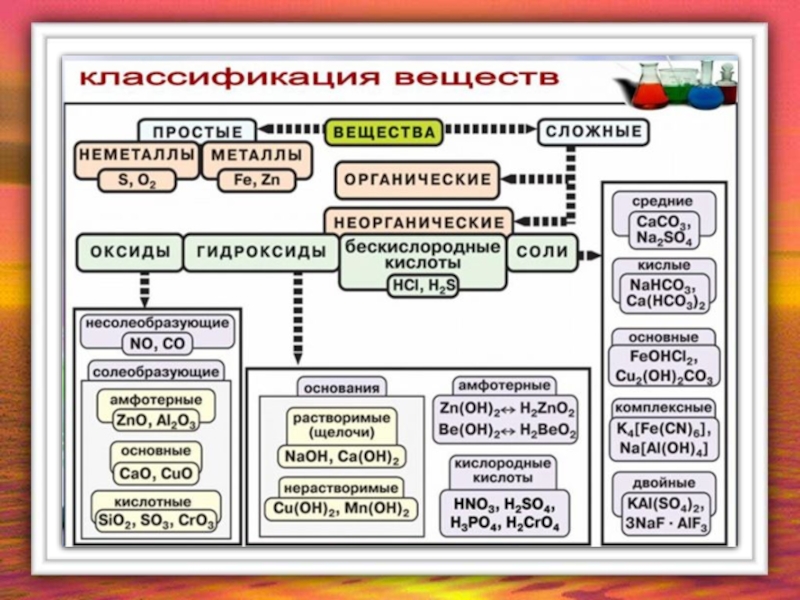
- 4. Комплексные Классификация солей Соли Средние Основные смешанные Кислые Двойные
- 5. Средние соли Средние соли – сложные вещества,
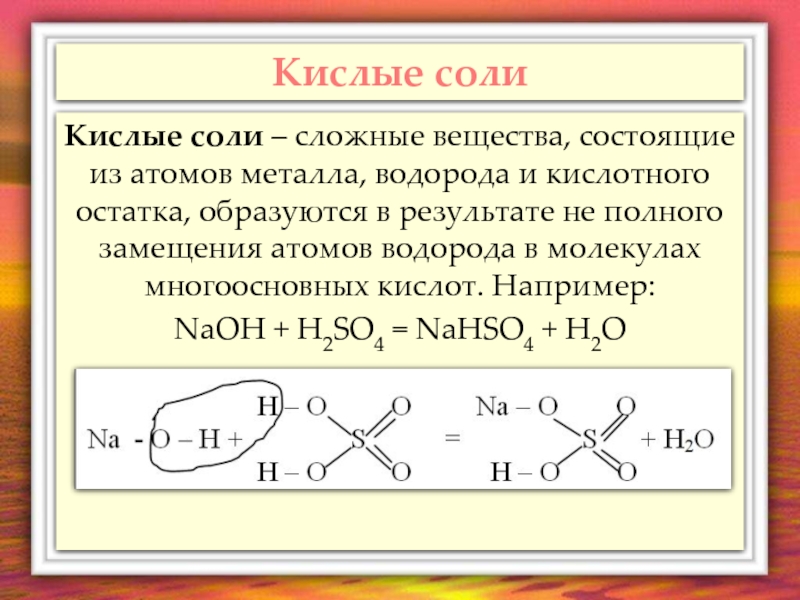
- 6. Кислые соли Кислые соли – сложные вещества,
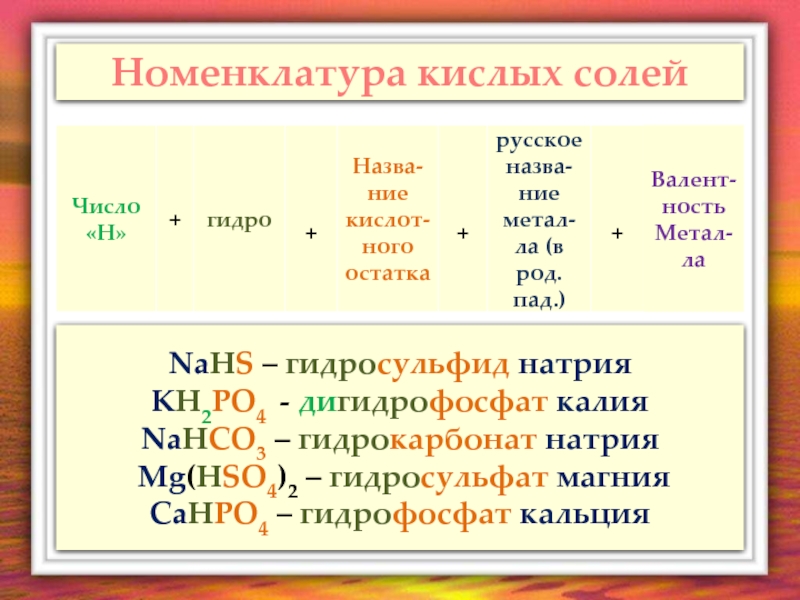
- 7. Номенклатура кислых солей NaHS – гидросульфид натрия
- 8. Пример H3PO4 Полное 3 атома Н
- 9. Основные соли Основные соли – сложные
- 10. Номенклатура основных солей MgOHCl – гидроксохлорид магния
- 11. Пример Fe(OH)3 Полное Fe(NO3)3
- 12. Двойные соли Двойные соли – сложные
- 13. Смешанные соли – сложные вещества, состоящие из
- 14. Физические свойства солей Большинство солей – твердые
- 15. Химические свойства солей Растворяются в воде (см.
- 16. Химические свойства солей 3. Растворы солей взаимодействуют
- 17. Химические свойства солей 5. Растворы солей взаимодействуют
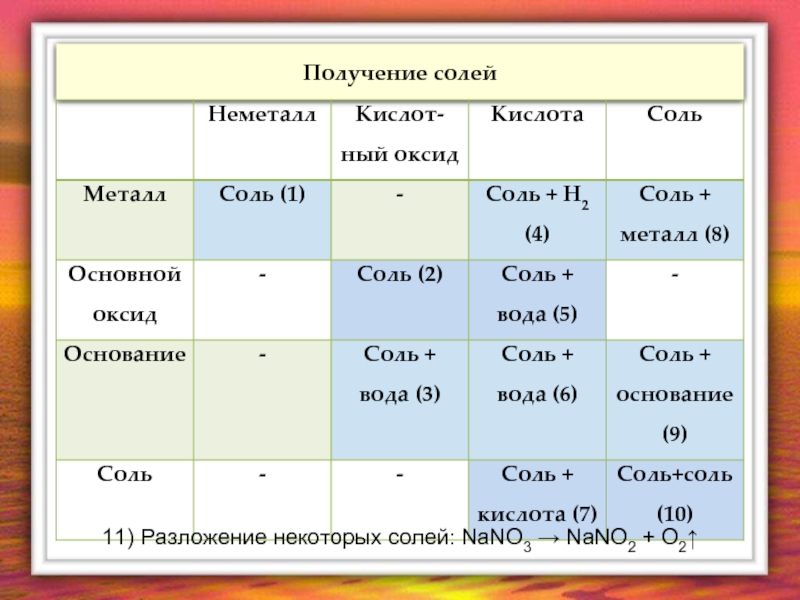
- 18. Получение солей 11) Разложение некоторых солей: NaNO3 → NaNO2 + O2↑
Слайд 3Определение
Соли – это сложные вещества, которые являются продуктом замещения водорода
Слайд 5Средние соли
Средние соли – сложные вещества, состоящие из атомов металла и
Номенклатура:
CuSO4 – СУЛЬФАТ МЕДИ (II)
Na3PO4 – ОРТОФОСФАТ НАТРИЯ
Слайд 6Кислые соли
Кислые соли – сложные вещества, состоящие из атомов металла, водорода
NaOH + H2SO4 = NaHSO4 + H2O
Слайд 7Номенклатура кислых солей
NaHS – гидросульфид натрия
KH2PO4 - дигидрофосфат калия
NaHCO3 – гидрокарбонат
Mg(HSO4)2 – гидросульфат магния
CaHPO4 – гидрофосфат кальция
Слайд 8Пример
H3PO4
Полное 3 атома Н
Na3PO4
Неполное 2 атома Н
Na2HPO4
Неполное 1 атом
NaH2PO4
H3PO4 + NaOH →
Средняя соль – ортофосфат натрия
Кислая соль – дигидрофосфат натрия
Кислая соль – гидрофосфат натрия
Слайд 9Основные соли
Основные соли – сложные вещества, состоящие из атомов металла,
Mg(OH)2 + HCl = MgOHCl + H2O
Слайд 10Номенклатура основных солей
MgOHCl – гидроксохлорид магния
(CuOH)2CO3 – гидроксокарбонат меди (ІІ)
AI(OH)2NO3 –
(Fe(OH)2)2 CrO4 – дигидроксохромат железа (ІІІ)
Слайд 11Пример
Fe(OH)3
Полное
Fe(NO3)3
Неполное 2 ОН
FeOH(NO3)3
Неполное 1 ОН
Fe(OH)2NO3
Fe(OH)3 + HNO3 →
Средняя соль
Основная соль - гидроксонитрат железа (ІІІ)
Основная соль – дигидроксо-нитрат железа (ІІІ)
Слайд 12Двойные соли
Двойные соли – сложные вещества, в состав которых входят
KNaSO4 - cульфат калия – натрия
KAl(SO4)2 – сульфат калия-алюминия.
Слайд 13Смешанные соли – сложные вещества, состоящие из атомов металла и двух
CaClOCl – хлорид-гипохлорит кальция
PbFCl – фторид-хлорид свинца (ІІ)
Смешанные соли
Слайд 14Физические свойства солей
Большинство солей – твердые вещества белого цвета, некоторые соли
Слайд 15Химические свойства солей
Растворяются в воде (см. таблицу растворимости).
2. Соли взаимодействуют с
МЕТАЛЛ’ + СОЛЬ’ = МЕТАЛЛ” + СОЛЬ”
Fe + CuCl2 = Cu + FeCl2
Слайд 16Химические свойства солей
3. Растворы солей взаимодействуют со щелочами, если образуется осадок
СОЛЬ’
4.Растворы солей взаимодействуют с кислотами, если образуется газ или осадок
СОЛЬ’ + КИСЛОТА’ = СОЛЬ” + КИСЛОТА”↑↓
FeCl3 + NaOH →
NaCl + Fe(OH)3 ↓
3
3
CaCO3 + HCl →
H2O + CO2 ↑+ CaCl2
2
Слайд 17Химические свойства солей
5. Растворы солей взаимодействуют между собой, если образуется осадок
СОЛЬ’
CuSO4 + Ba(NO3)2 = Cu(NO3)2 + BaSO4↓
6. Некоторые соли разлагаются при нагревании (нитраты, карбонаты)
CaCO3 → CaO + CO2