- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Соли презентация
Содержание
- 1. Соли
- 2. Определение солей Со́ли — вещества, состоящие из катионов
- 3. Классификация
- 4. Физические свойства солей Как все
- 5. Химические свойства Взаимодействие с
- 6. Химические свойства Взаимодействие со щелочами:
- 7. Химические свойства Взаимодействие солей друг
- 8. Химические свойства
- 9. Химические свойства Взаимодействие с водой:
- 10. Соли в природе Многие минералы — соли, образующие
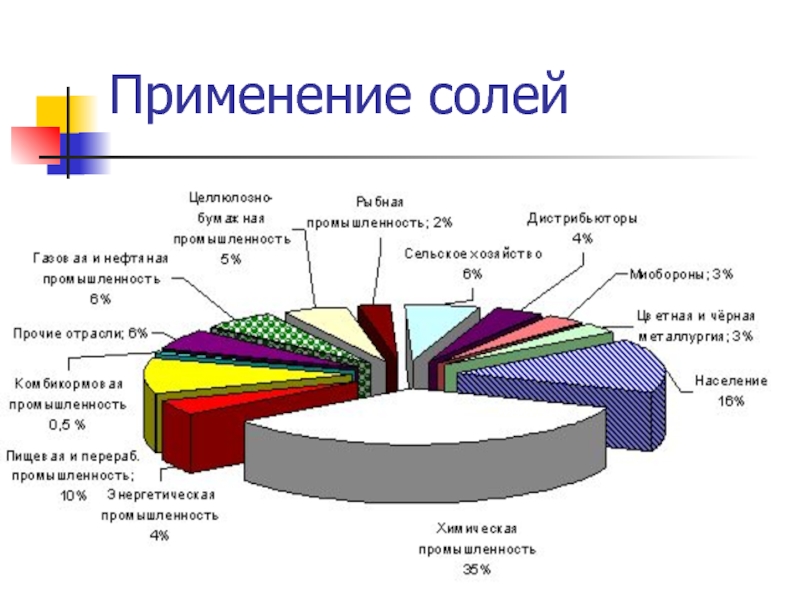
- 12. Применение солей
- 13. Выполните задания: 1. Установите соответствие между химической формулой
- 14. 2. Установите соответствие между химической формулой вещества и
- 15. Общие способы синтеза солей 1.Получение
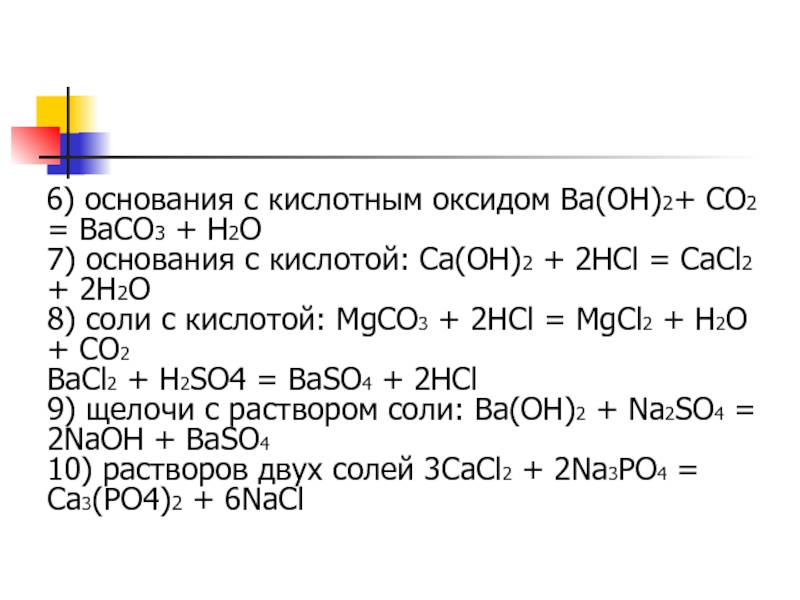
- 16. 6) основания с кислотным оксидом
- 17. 2.Получение кислых солей: 1.
- 18. 3.Получение основных солей: 1.
- 19. 4.Получение комплексных солей:
- 20. Домашнее задание Параграф 41 № 1, 2, 5 (письменно)
Слайд 2Определение
солей
Со́ли — вещества, состоящие из катионов металла (или катионов аммония NH4
Со́ли — электролиты, которые в водном растворе диссоциируют с образованием катионов металла и анионов кислотного остатка.
+
+
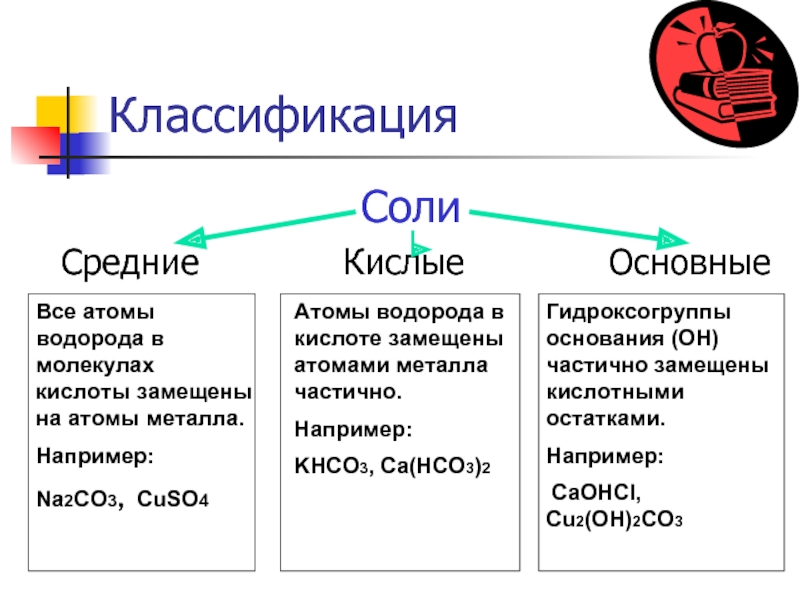
Слайд 3Классификация
Средние Кислые Основные
Все атомы водорода в молекулах кислоты замещены на атомы металла.
Например:
Na2CO3, CuSO4
Атомы водорода в кислоте замещены атомами металла частично.
Например:
KHCO3, Ca(HCO3)2
Гидроксогруппы основания (OH) частично замещены кислотными остатками.
Например:
CaOHCl, Cu2(OH)2CO3
Слайд 4Физические свойства солей
Как все ионные вещества, соли при н.у.
Окраска зависит от окраски катионов и анионов.
Растворимость различна. (См. таблицу растворимости)
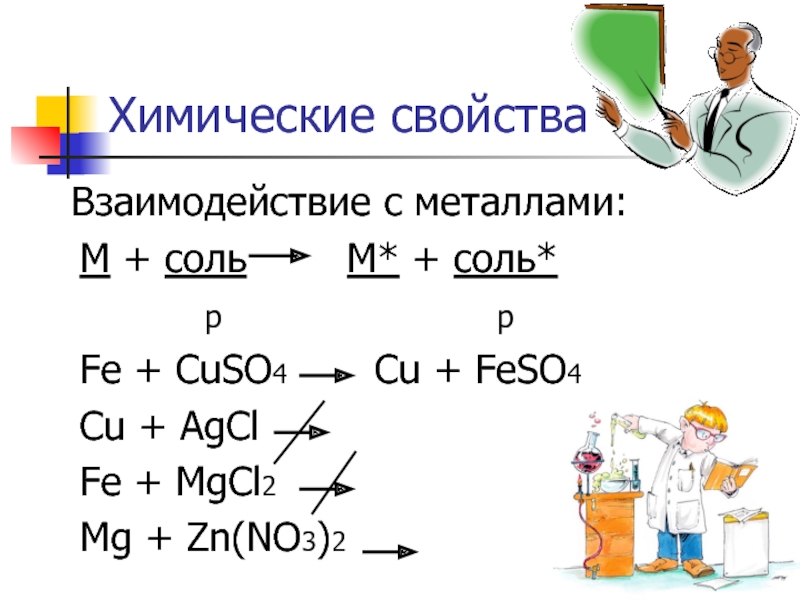
Слайд 5Химические свойства
Взаимодействие с металлами:
М + соль
р р
Fe + CuSO4 Cu + FeSO4
Cu + AgCl
Fe + MgCl2
Mg + Zn(NO3)2
Слайд 6Химические свойства
Взаимодействие со щелочами:
NaOH + CuSO4
NaOH + K2CO3
Взаимодействие с кислотами:
NaCl + HNO3
K2CO3 + HCl
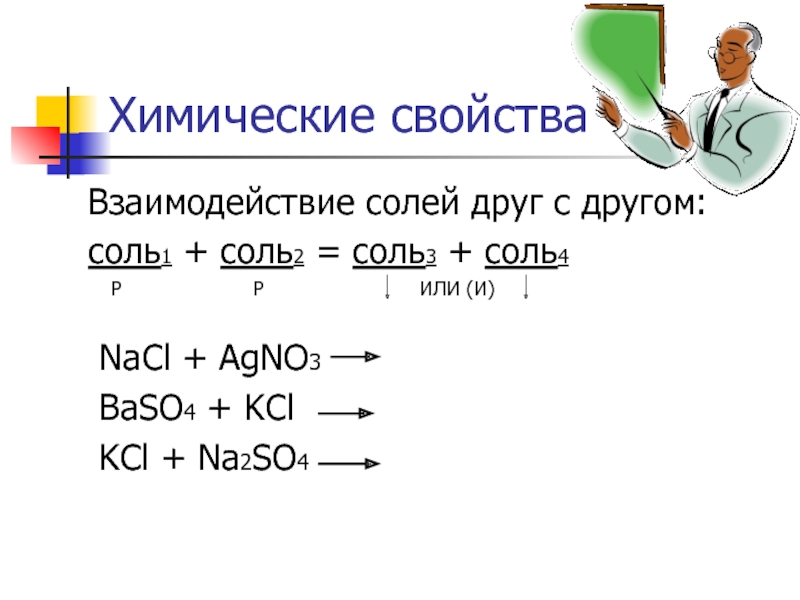
Слайд 7Химические свойства
Взаимодействие солей друг с другом:
соль1 +
Р Р ИЛИ (И)
NaCl + AgNO3
BaSO4 + KCl
KCl + Na2SO4
Слайд 9Химические свойства
Взаимодействие с водой:
CuSO4 + 5H2O
Al2S3 + 6H2O 2Al(OH)3 + 3H2S
.
Слайд 10Соли в природе
Многие минералы — соли, образующие залежи (например, галит NaCl, сильвин
Слайд 13Выполните задания:
1. Установите соответствие между химической формулой соли и классом, к которому
1) NaHCO3 А. средние соли
2) Сu(ОН)Сl Б. кислые соли
3) Na2CO3 В. основные соли
4) Na2KPO4 Г. двойные соли
Слайд 14 2. Установите соответствие между химической формулой вещества и его названием.
1) FeCl3
2) Cu(NO3)2 Б. карбонат калия
3) Al2(SO4)3 B. хлорид железа(III) 4) К2СО3 Г. нитрит меди(П) Д. сульфат алюминия
Слайд 15Общие способы синтеза солей
1.Получение средних солей:
1) металла
Слайд 16 6) основания с кислотным оксидом Ba(OH)2+ CO2 = BaCO3
Слайд 172.Получение кислых солей:
1. Взаимодействие кислоты с недостатком основания.
3. Взаимодействие средней соли с кислотой Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4)2
Слайд 183.Получение основных солей:
1. Добавление (по каплям) небольших количеств
3. Гидролиз солей, образованных слабым основанием и сильной кислотой ZnCl2+ H2O = Zn(OH)Cl + HCl
Слайд 19 4.Получение комплексных солей:
1. Реакции солей с лигандами:
AgCl + 2NH3 = [Ag(NH3)2]Cl FeCl3 + 6KCN] = K3[Fe(CN)6] + 3KCl 5.Получение двойных солей:
1.Совместная кристаллизация двух солей: Cr2(SO4)3 + K2SO4 + 24H2O = 2[KCr(SO4)2 • 12H2O]













![4.Получение комплексных солей: 1. Реакции солей с лигандами: AgCl + 2NH3 = [Ag(NH3)2]Cl](/img/tmb/2/146511/3385c595be8a8c9d12263dbb70d76dd3-800x.jpg)






