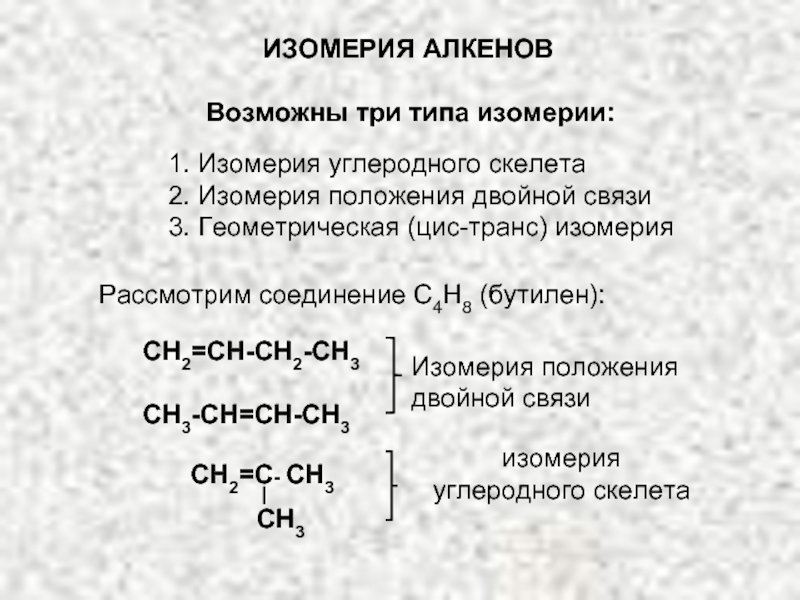
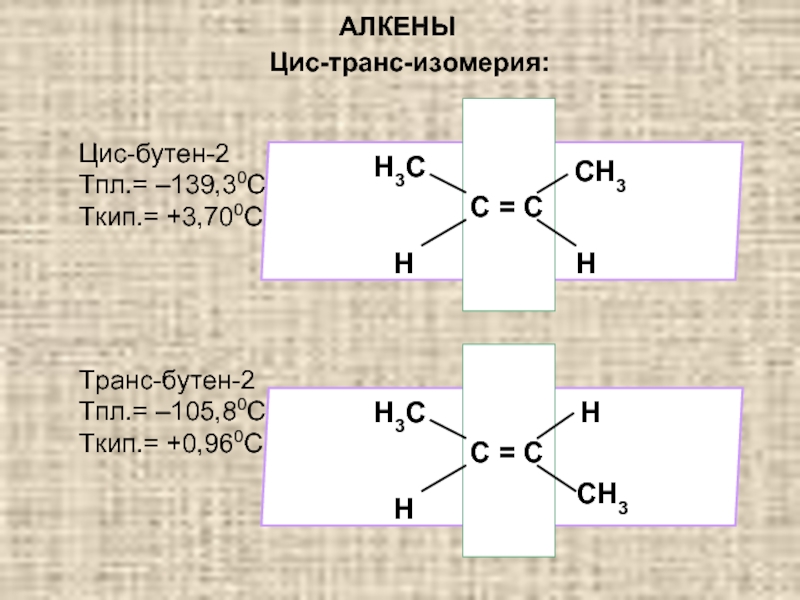
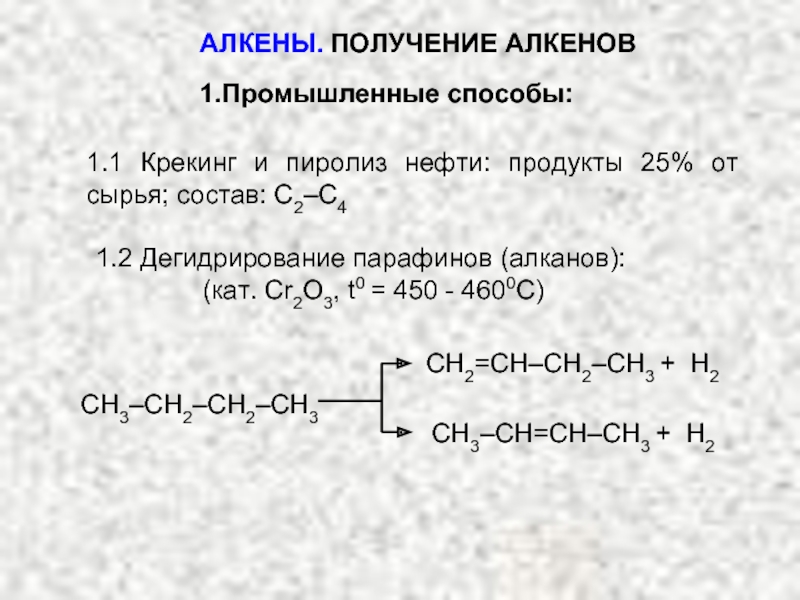
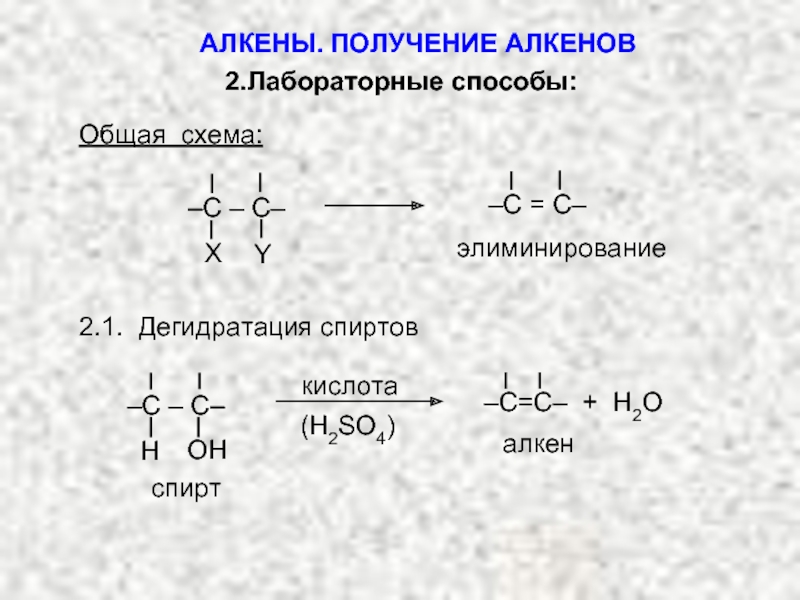
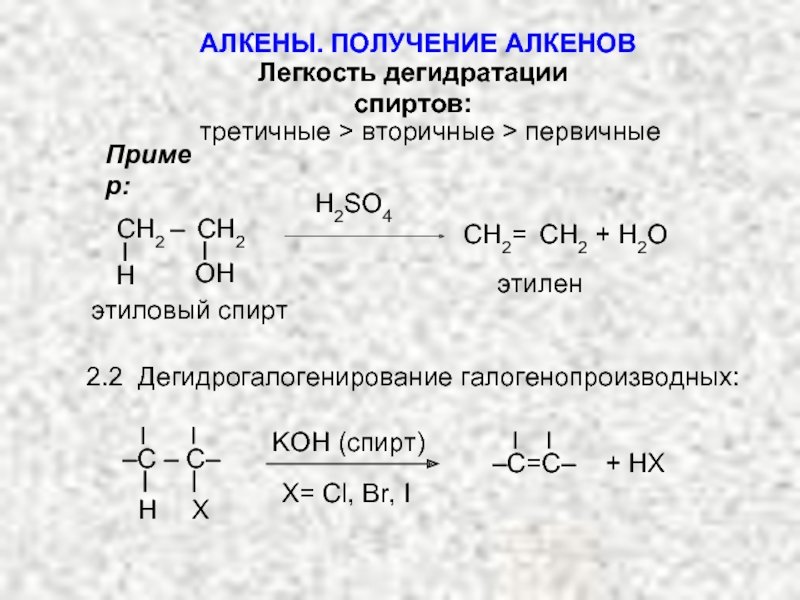
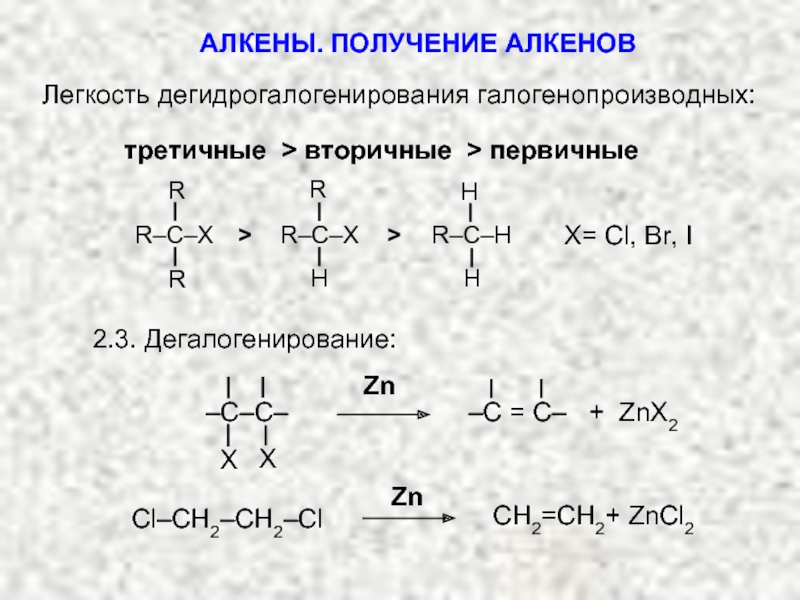
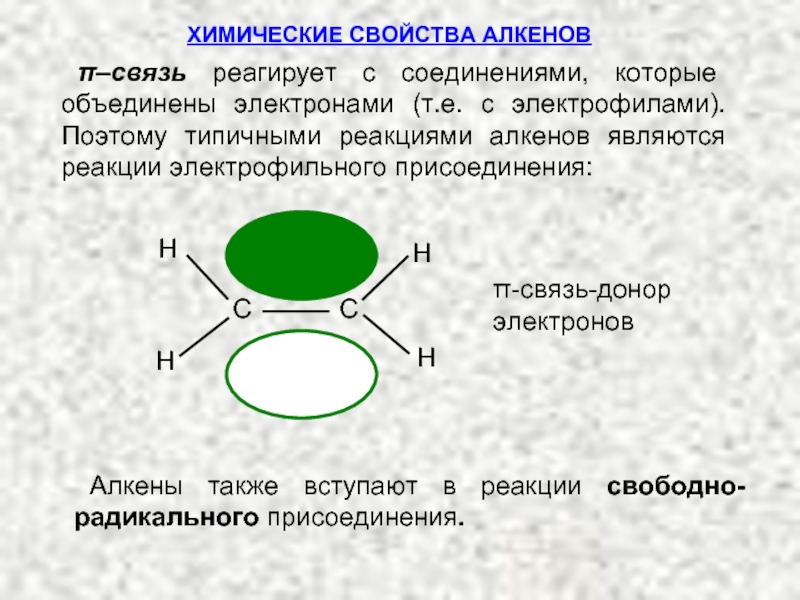
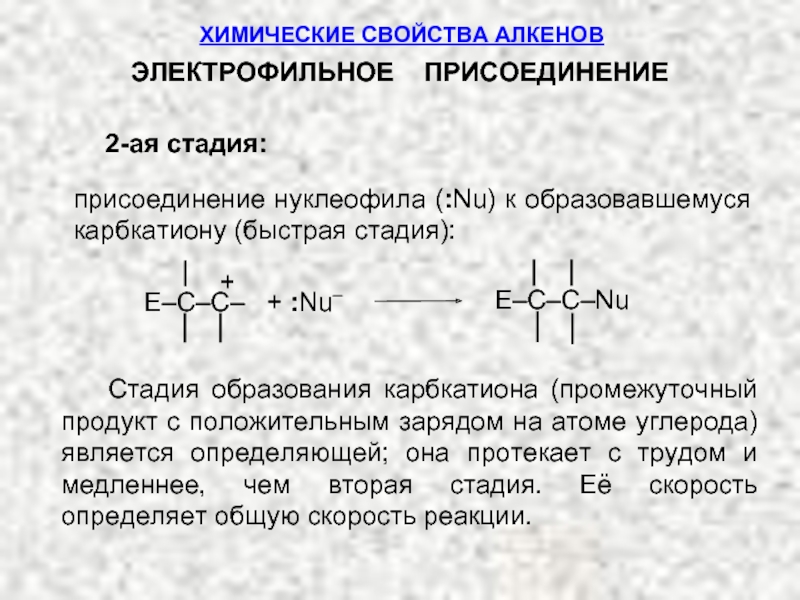
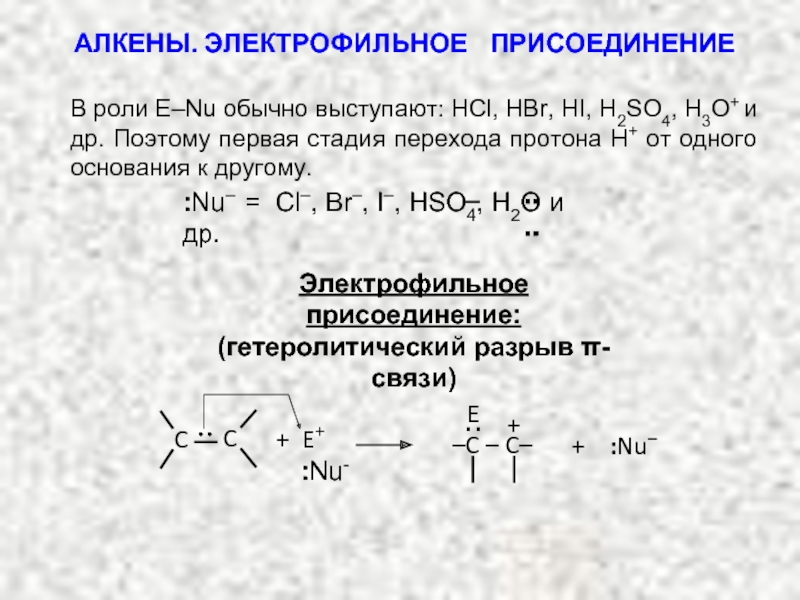
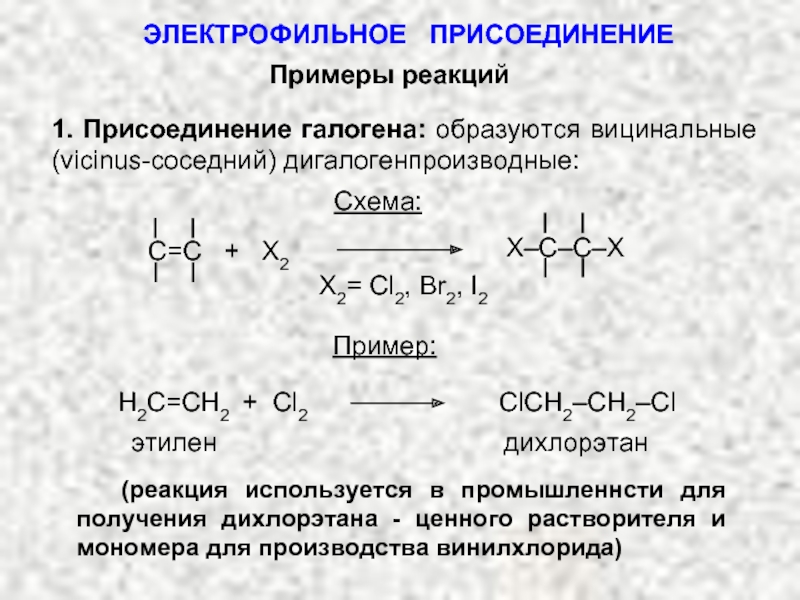
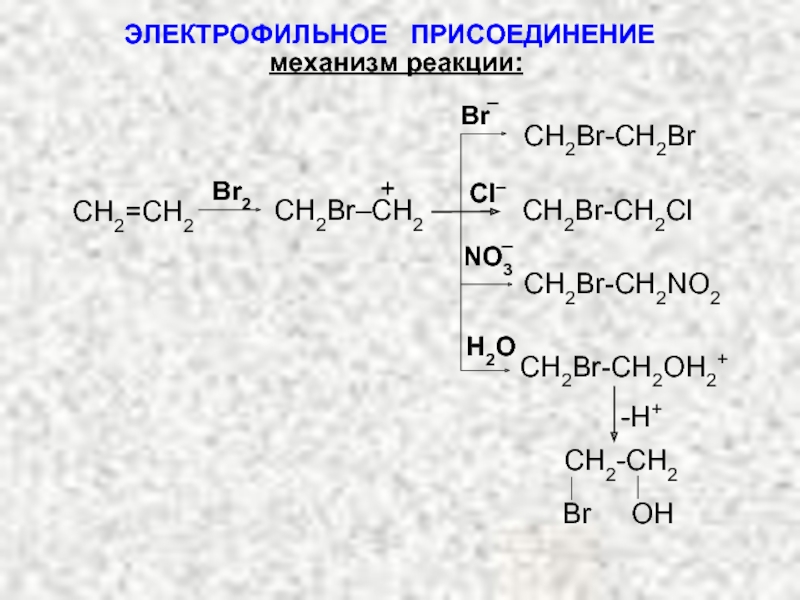
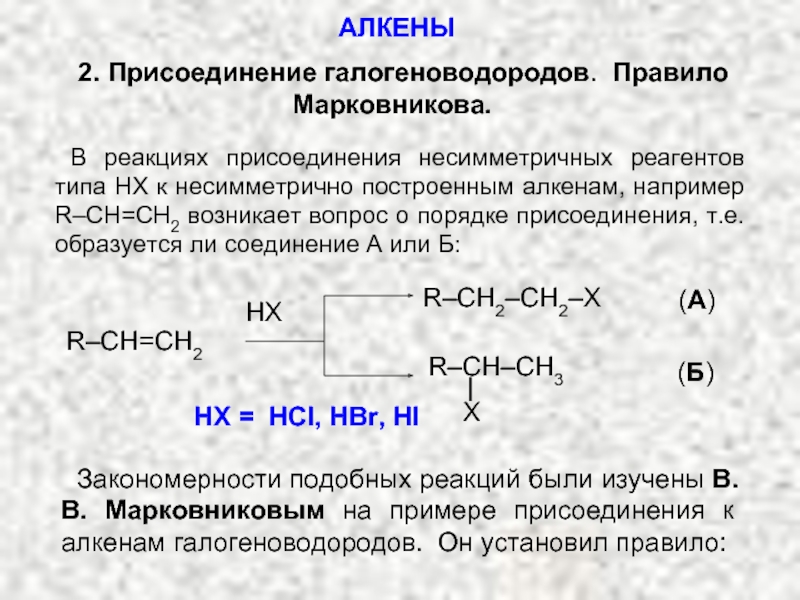
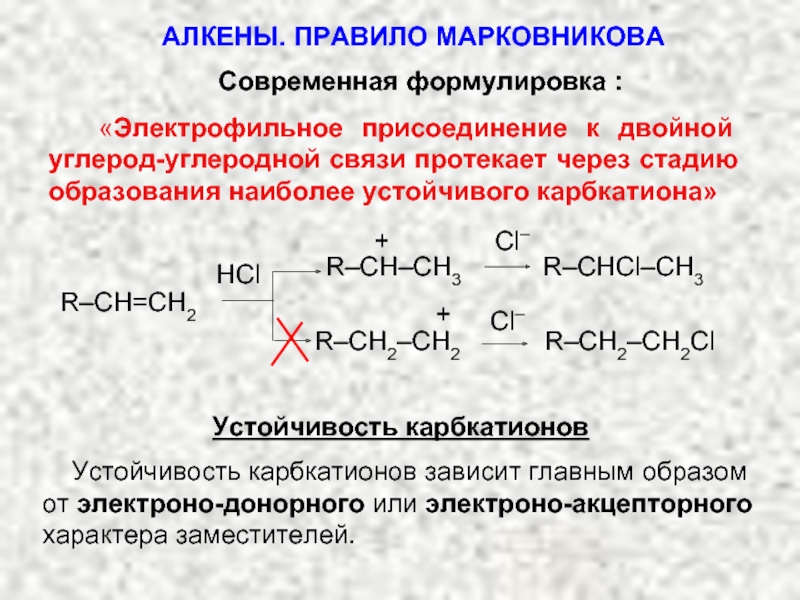
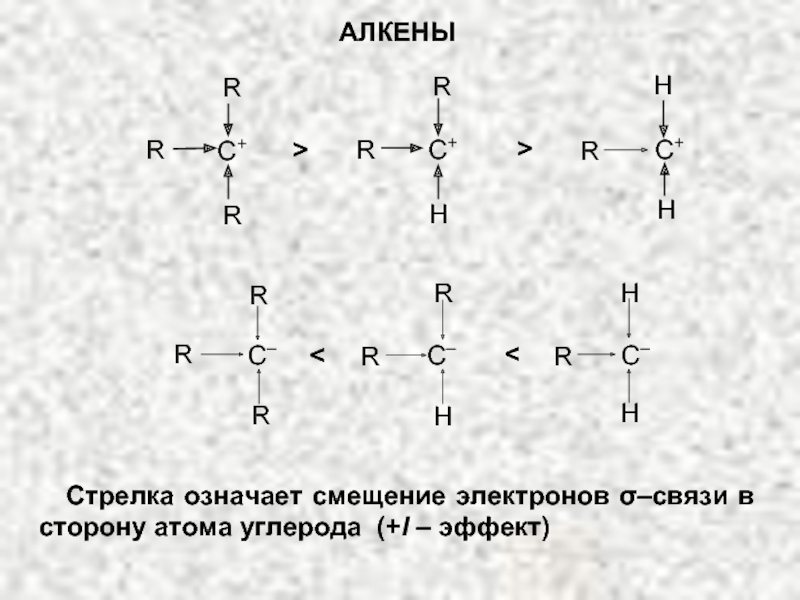
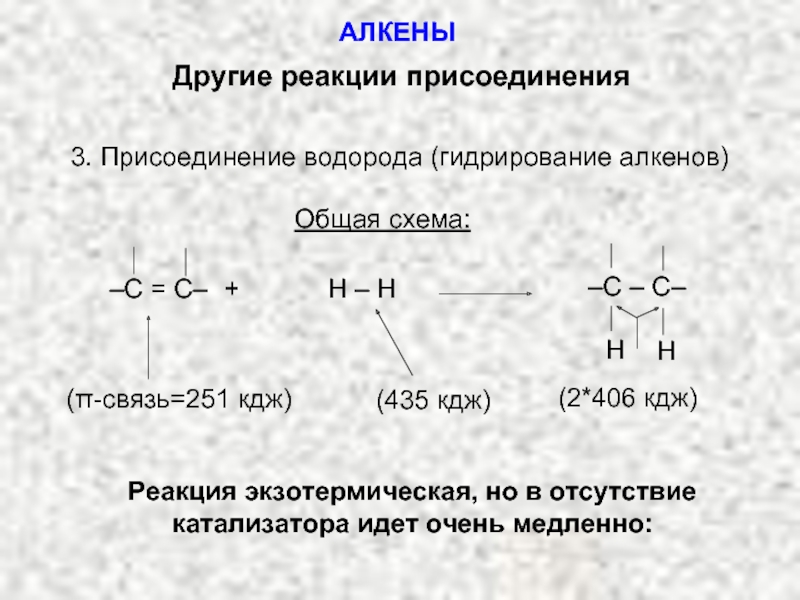
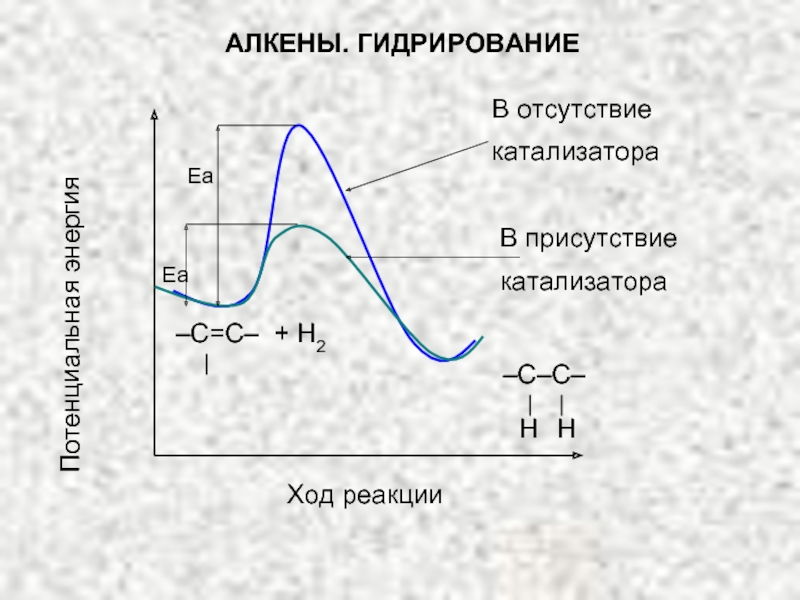
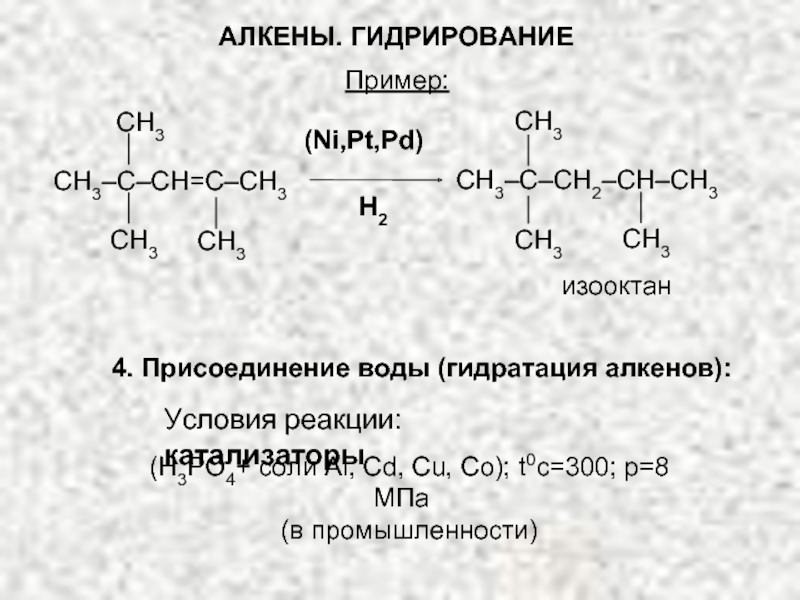
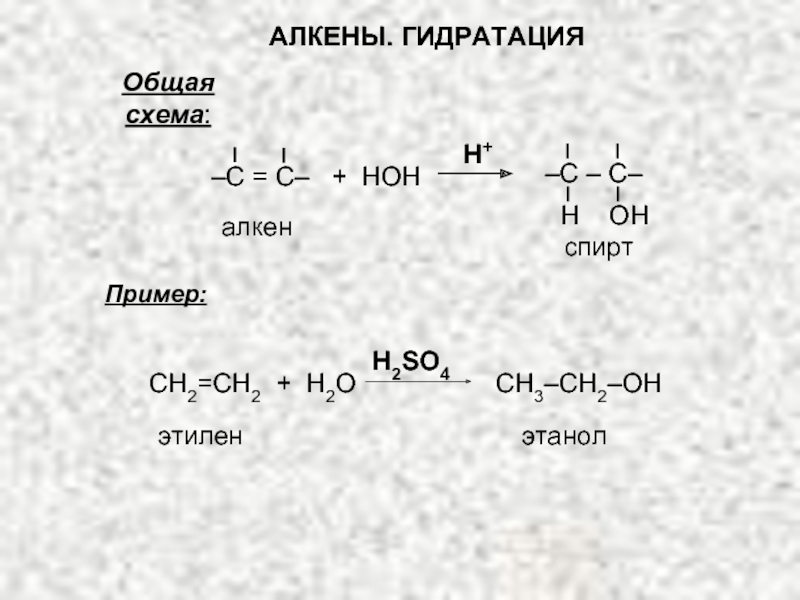
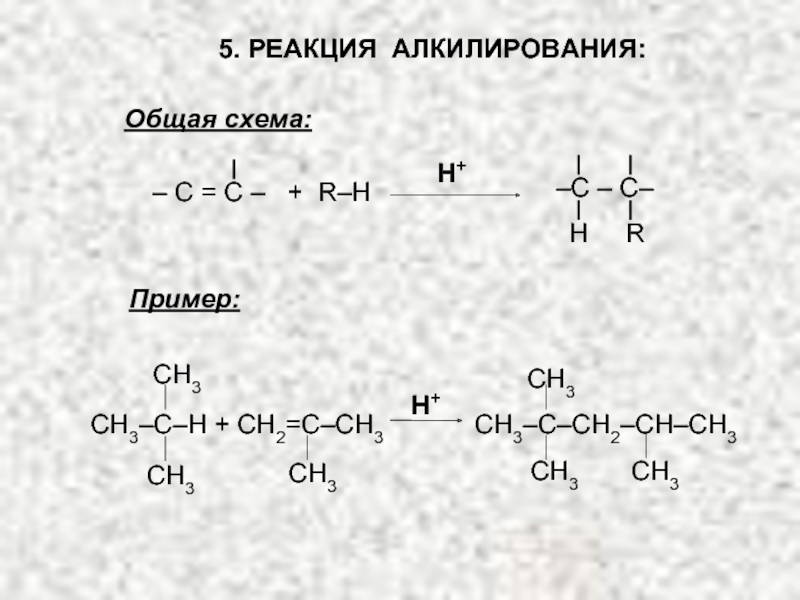
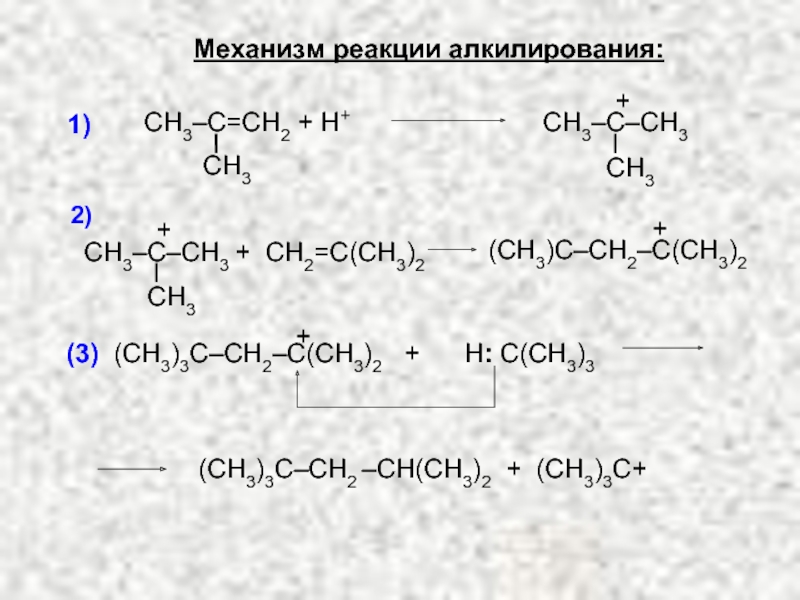
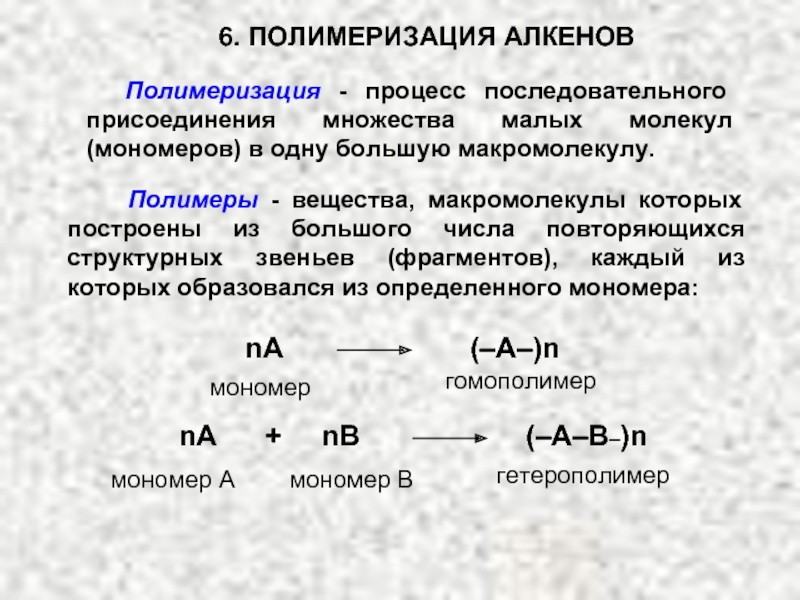
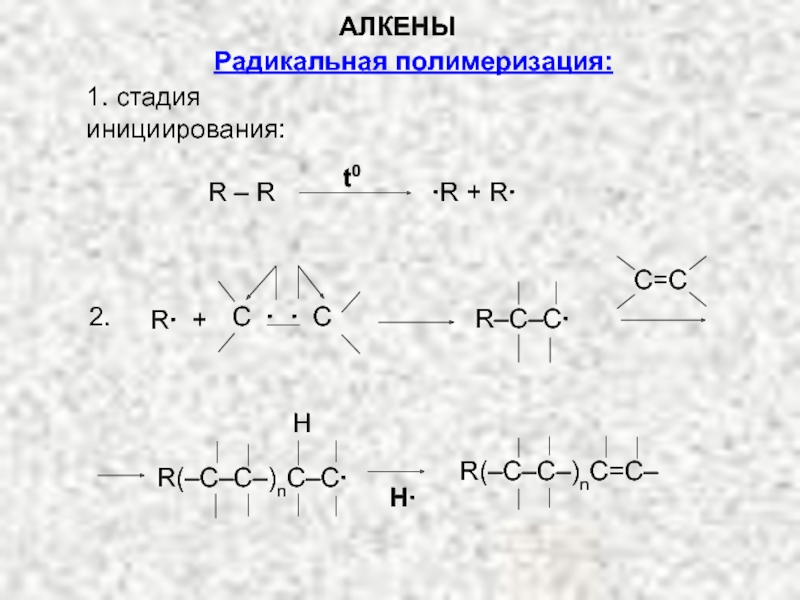
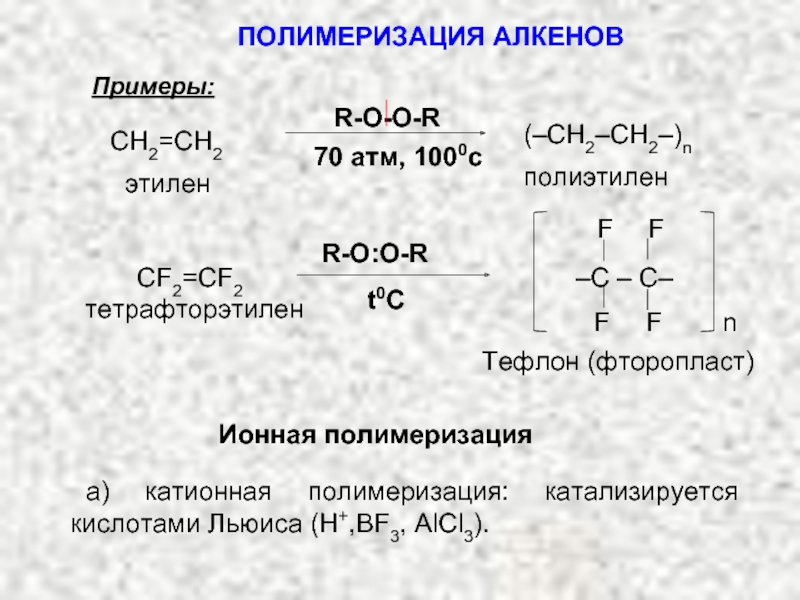
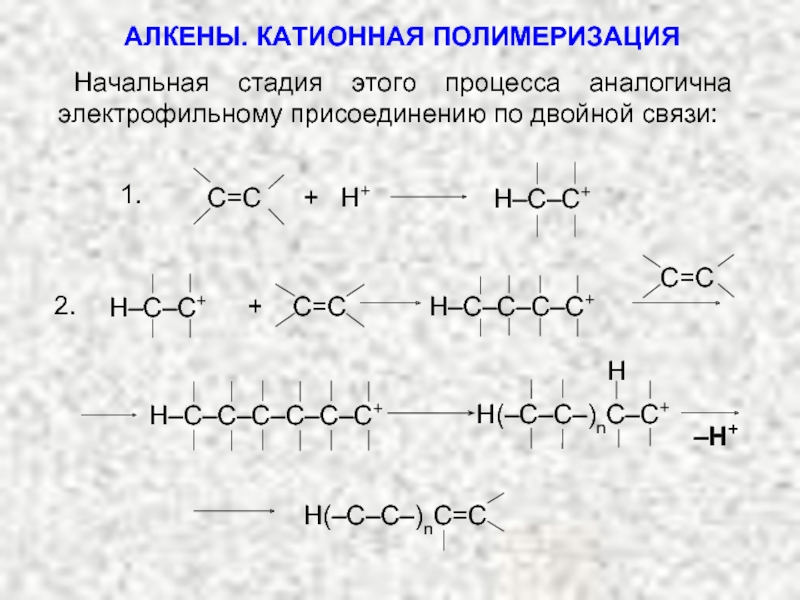
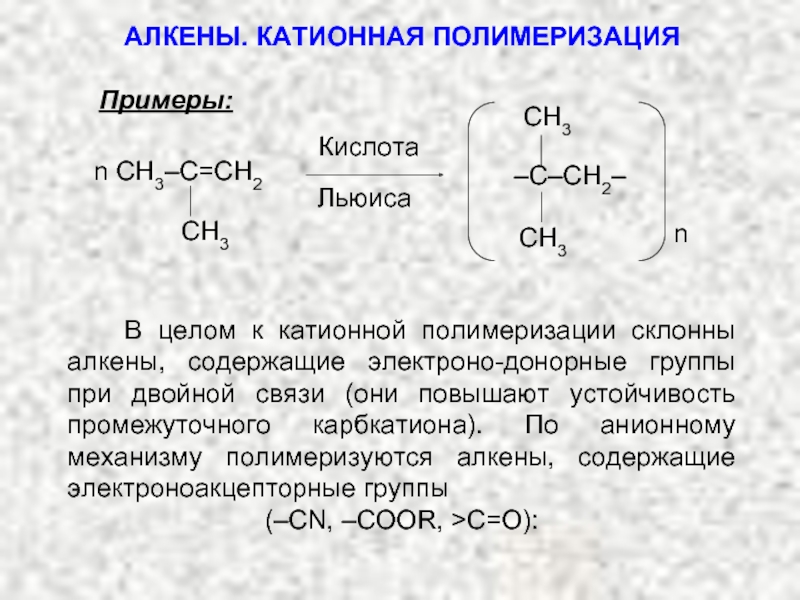
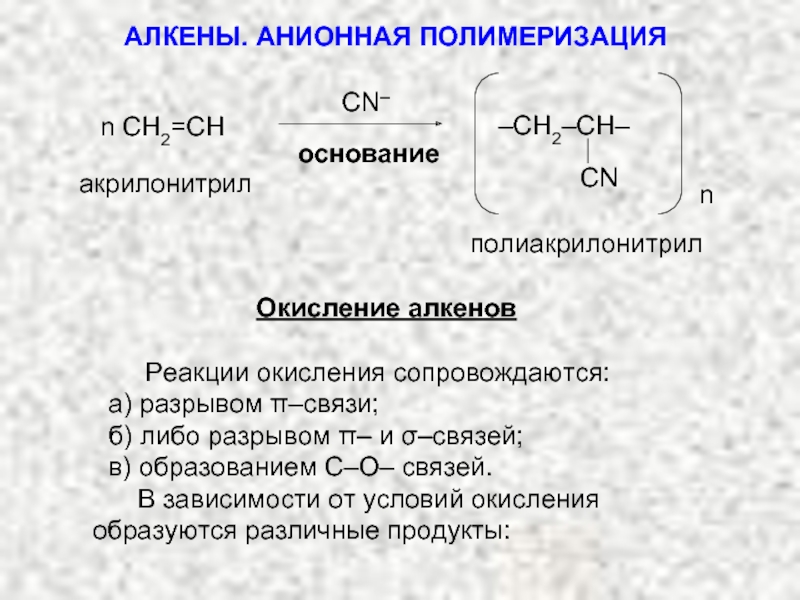
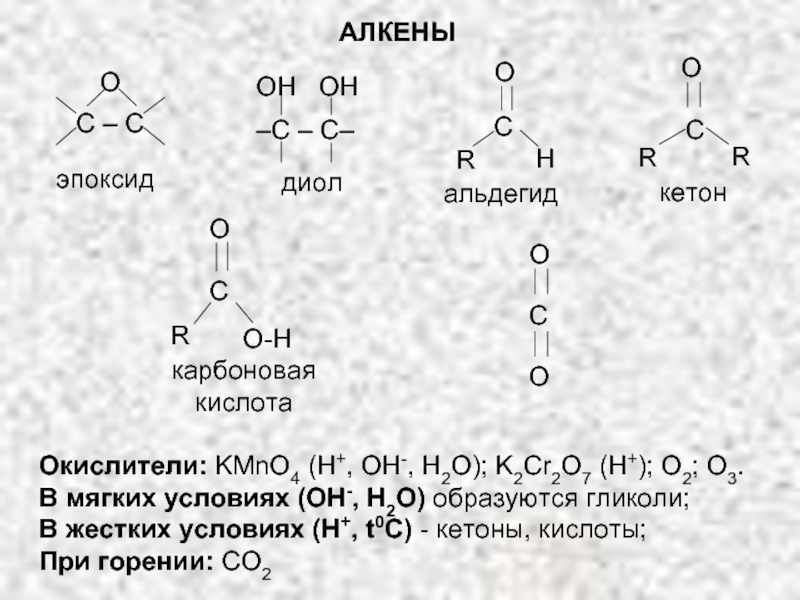
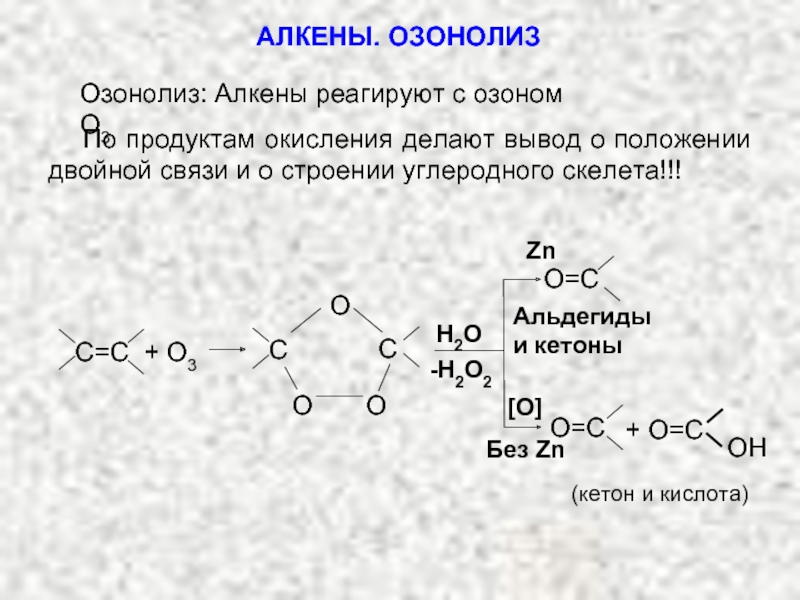
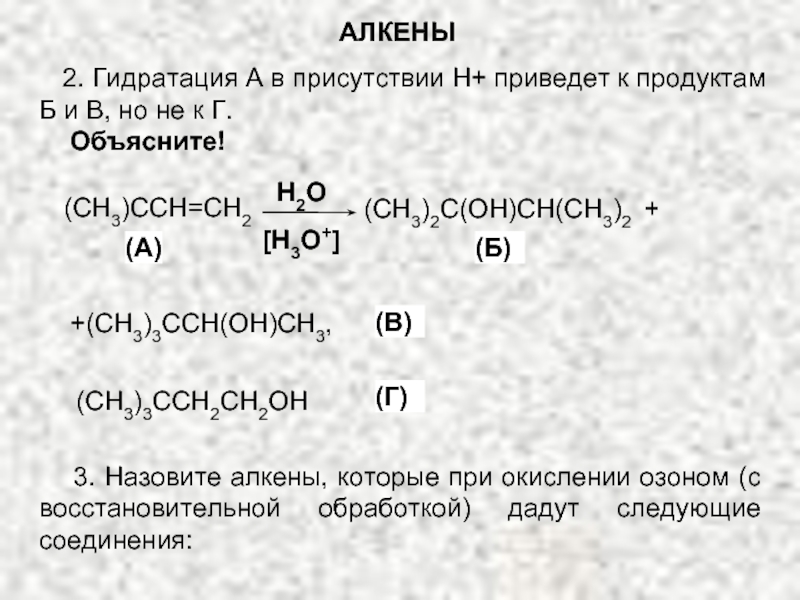
Ненасыщенные соединения, содержащие двойную связь, называются алкенами или олефинами. Их общая формула:
СnH2n
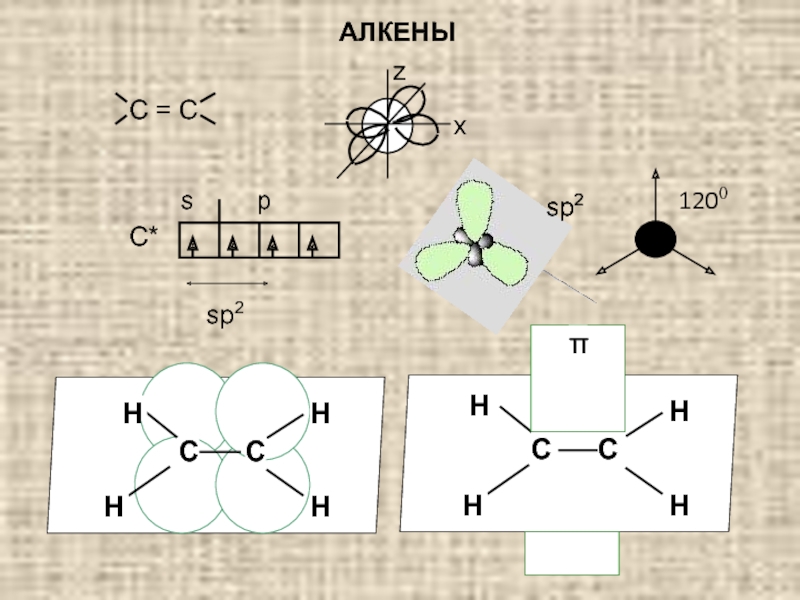
Строение алкенов:
Отличительной особенностью строения алкенов является двойная углерод-углеродная связь:
С1- С4……газы
С4- С15……жидкости
С16 и далее……твердые вещества