- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Скрининг и ранняя диагностика рака предстательной железы презентация
Содержание
- 1. Скрининг и ранняя диагностика рака предстательной железы
- 2. Отсутствие клинических симптомов на ранних стадиях
- 3. Чаще всего РПЖ заболевают
- 4. Скрининговые мероприятия целесообразно начинать
- 5. Верхняя возрастная граница для
- 6. Периодичность проведения скринингового обследования 1
- 7. Идеального диагностического теста на
- 8. Анализ крови на простатический специфический
- 9. Главный компонент скрининга –
- 10. ПСА впервые выделен в
- 11. Наиболее частые причины повышения уровня
- 12. Обладая органоспецифичностью, ПСА не
- 13. 6,5 Уровень ПСА увеличивается с
- 14. Верхняя граница
- 15. Наибольшие диагностические трудности вызывает
- 16. Для
- 17. Соотношение свободного ПСА к общему (пороговое
- 18. У части
- 19. Немногим более 10
- 20. При пальпации обращают внимание
- 21. Распространение процесса за пределы
- 22. Значительные проблемы возникают при
- 23. Таким образом, результаты
- 24. УЗИ – обязательный компонент
- 25. Трансректальное УЗИ используется преимущественно на ранних
- 26. ТРУЗИ способно визуализировать центральную и транзиторную
- 27. Главным
- 28. Вышеизложенная характеристика трех основных методов исследования
- 29. ПСА
- 30. ПСА=4-10 нг/мл ↓ ПРИ ↙
- 31. ПСА>10 ↓ ПРИ ↓ Мультифокальная биопсия
- 32. Благодарим за внимание
Слайд 2
Отсутствие клинических симптомов на ранних стадиях рака предстательной железы (РПЖ) определило
необходимость разработки системы скрининга мужского населения с целью активного выявления пациентов, страдающих локализованными формами болезни.
Особую актуальность диагностика опухолей предстательной железы в доклинической стадии приобрела в последние 15-20 лет, благодаря появлению реальных шансов на радикальное излечение
Особую актуальность диагностика опухолей предстательной железы в доклинической стадии приобрела в последние 15-20 лет, благодаря появлению реальных шансов на радикальное излечение
Слайд 3
Чаще всего РПЖ заболевают в возрасте 50 лет и
старше; однако среди мужчин с отягощенной наследственность (сыновья и братья больных РПЖ) вероятность заболевания увеличивается с 40 лет
Слайд 4
Скрининговые мероприятия целесообразно начинать с 40-50 лет.
В
то же время, как показывает клинический опыт, пациенты могут быть значительно моложе 40 лет, в связи с чем молодой возраст никогда не должен рассматриваться в качестве аргумента для исключения у больных РПЖ. Можно предположить, что по мере усовершенствования методики и удешевления скрининга контингент обследуемых будет расширяться за счет лиц более молодого возраста
Слайд 5
Верхняя возрастная граница для лиц, подлежащих профилактическому обследованию с целью выявления
доклинических форм РПЖ:
70 – 75 лет
70 – 75 лет
Слайд 6
Периодичность проведения скринингового обследования
1 раз в год
Для лиц, отнесенных к группе
повышенного риска
- 1 раз в 6 мес.
- 1 раз в 6 мес.
Слайд 7
Идеального диагностического теста на РПЖ, т.е. теста, обладающего высокой
чувствительностью и абсолютной специфичностью, до настоящего времени нет. Поэтому скрининг базируется на сочетанном использовании трех методов исследования:
Слайд 8
Анализ крови на простатический специфический антиген (ПСА)
Пальпация предстательной железы
через прямую кишку (ПРИ)
ТРУЗИ
ТРУЗИ
Слайд 9
Главный компонент скрининга – определение уровня ПСА в сыворотке
крови
Тест характеризуется:
хорошей воспроизводимостью
высокой чувствительностью
неинвазивностью
небольшой стоимостью
возможностью обследования больших групп мужского населения
не требуется непосредственного контакта пациента с врачом
Тест характеризуется:
хорошей воспроизводимостью
высокой чувствительностью
неинвазивностью
небольшой стоимостью
возможностью обследования больших групп мужского населения
не требуется непосредственного контакта пациента с врачом
Слайд 10
ПСА впервые выделен в 1979 году M.Wang. Представляет собой
гликопротеид, продуцируемый секреторными клетками эпителия предстательной железы. Основное количество ПСА является составной частью простатического секрета. В норме 0,1% всего ПСА проникает в кровь. В крови ПСА находится как в свободной так и в связанной формах
Слайд 11
Наиболее частые причины повышения уровня ПСА:
Воспалительные процессы (простатит, абсцесс)
Урологические манипуляции,
травмирующие предстательную железу
Доброкачественная гиперплазия (ДГП)
Злокачественные новообразования
Доброкачественная гиперплазия (ДГП)
Злокачественные новообразования
Слайд 12
Обладая органоспецифичностью, ПСА не является опухолеспецифичным маркером, чем объясняется
значительное количество ложно-положительных заключений при использовании ПСА в процедуре скрининга
Слайд 136,5
Уровень ПСА увеличивается с возрастом, поэтому верхняя граница нормы
для различных возрастов различно и колеблется от 2,5 нг/мл в 40-49 лет до 6,5 нг/мл в 70-79 лет
Слайд 14
Верхняя граница нормы ПСА = 4 нг/мл
Однако, в последние годы детально обследуются лица с меньшим уровнем ПСА, вплоть до 2,5 нг/мл
Слайд 15
Наибольшие диагностические трудности вызывает увеличение ПСА, обусловленное ДГП
Повышение ПСА в диапазоне 4-10 нг/мл (так называемая «серая зона») в 70% случаев вызывается доброкачественной гиперплазией
Это вызывает значительное количество ложно-положительных заключений, что приводит к увеличению числа биопсий предстательной железы
Это вызывает значительное количество ложно-положительных заключений, что приводит к увеличению числа биопсий предстательной железы
Слайд 16
Для повышения точности дифференциальной диагностики между ДГП
и РПЖ был разработан ряд дополнительных диагностических признаков:
Слайд 17
Соотношение свободного ПСА к общему (пороговое значение = 0,15 или 15%).
>15 характерно для ДГП, <15 патогномонично для рака. Для определения этого показателя уровень общего ПСА должен быть от 4 до 10 нг/мл.
Динамический прирост ПСА во времени. Вероятность развития рака считается достаточно высокой при ежегодном увеличении уровня на 0,75-1,0 нг/мл или более
Определение плотности ПСА (отношение уровня общего ПСА к объему предстательной железы, вычисленному при ТРУЗИ)
Динамический прирост ПСА во времени. Вероятность развития рака считается достаточно высокой при ежегодном увеличении уровня на 0,75-1,0 нг/мл или более
Определение плотности ПСА (отношение уровня общего ПСА к объему предстательной железы, вычисленному при ТРУЗИ)
Слайд 18
У части больных РПЖ уровень ПСА не превышает нормы.
Доля больных раком, имеющих уровень ПСА ниже 4,0 нг/мл может достигать 23%
Слайд 19
Немногим более 10 лет назад практически единственным методом скрининга
РПЖ являлась пальпация через прямую кишку. Однако метод совершенно непригоден для выявления опухолей I стадии, хотя в диагностике РПЖ более поздних стадий может оказать значительную помощь.
Слайд 20
При пальпации обращают внимание на:
Размеры
Форму
Консистенцию
Характер поверхности
Выраженность срединной и латеральных
бороздок
Классический признак рака – очаг уплотнения ткани увеличенной предстательной железы
Классический признак рака – очаг уплотнения ткани увеличенной предстательной железы
Слайд 21
Распространение процесса за пределы капсулы приводит к тому, что
поверхность становится бугристой, контур нечетким. Иногда, несмотря на большие размеры опухоли и местное распространение, пальпаторная картина представляется не столь типичной. Так бывает при локализации опухоли в транзиторной зоне, либо в неувеличенной ПЖ, либо если опухоль имеет эластическую консистенцию, соответствующую ДГП
Слайд 22
Значительные проблемы возникают при ректально-циркулярном распространении опухоли, что делает
ее неотличимой от рака прямой кишки.
Симулируют картину рака изменения, вызванные неопухолевыми процессами:
Камни простаты
Поражения при туберкулезе
Гранулематозный простатит
Плотные узлы ДГП
Симулируют картину рака изменения, вызванные неопухолевыми процессами:
Камни простаты
Поражения при туберкулезе
Гранулематозный простатит
Плотные узлы ДГП
Слайд 23
Таким образом, результаты ПРИ обязательно должны быть проверены, уточнены
и дополнены
- данными ТРУЗИ,
- анализом крови на ПСА
- биопсией простаты
- данными ТРУЗИ,
- анализом крови на ПСА
- биопсией простаты
Слайд 24
УЗИ – обязательный компонент скринингового исследования. Может быть выполнено
в форме трансабдоминальной или трансректальной эхографии.
Трансабдоминальное УЗИ не дает полноценного отображения структуры железы, но позволяет судить о количестве остаточной мочи, состоянии верхних мочевых путей и поражении забрюшинных л/у. Применяется для уточнения стадии и выбора метода лечения при уже установленном диагнозе рака.
Трансабдоминальное УЗИ не дает полноценного отображения структуры железы, но позволяет судить о количестве остаточной мочи, состоянии верхних мочевых путей и поражении забрюшинных л/у. Применяется для уточнения стадии и выбора метода лечения при уже установленном диагнозе рака.
Слайд 25
Трансректальное УЗИ используется преимущественно на ранних этапах диагностики. Позволяет получить информацию
о возможном наличии опухолевых очагов, их размерах, количестве и локализации. Опухоль как правило гипоэхогенна. Развивается:
68% - из периферических отделов
24% - из транзиторной зоны
8% - из центральной зоны
68% - из периферических отделов
24% - из транзиторной зоны
8% - из центральной зоны
Слайд 26
ТРУЗИ способно визуализировать центральную и транзиторную зоны, что делает его незаменимым
в выявлении предполагаемых очагов опухолевого роста, расположенных на значительном расстоянии от периферических отделов железы, которые не могут быть определены пальпаторно. Способствует выявлению вовлечения в патологический процесс капсулы ПЖ, парапростатической клетчатки, семенных пузырьков, мочевого пузыря и прямой кишки.
Слайд 27
Главным направлением использования ТРУЗИ является обеспечение
прицельного
характера
биопсии предстательной железы под визуальным контролем
биопсии предстательной железы под визуальным контролем
Слайд 28
Вышеизложенная характеристика трех основных методов исследования позволяет рекомендовать их в качестве
алгоритма скрининговых исследований с целью раннего выявления РПЖ.
Обязательными диагностическими процедурами являются определение уровня ПСА и ПРИ. Для исключения артефактов забор крови должен предшествовать пальпации.
Обязательными диагностическими процедурами являются определение уровня ПСА и ПРИ. Для исключения артефактов забор крови должен предшествовать пальпации.
Слайд 29
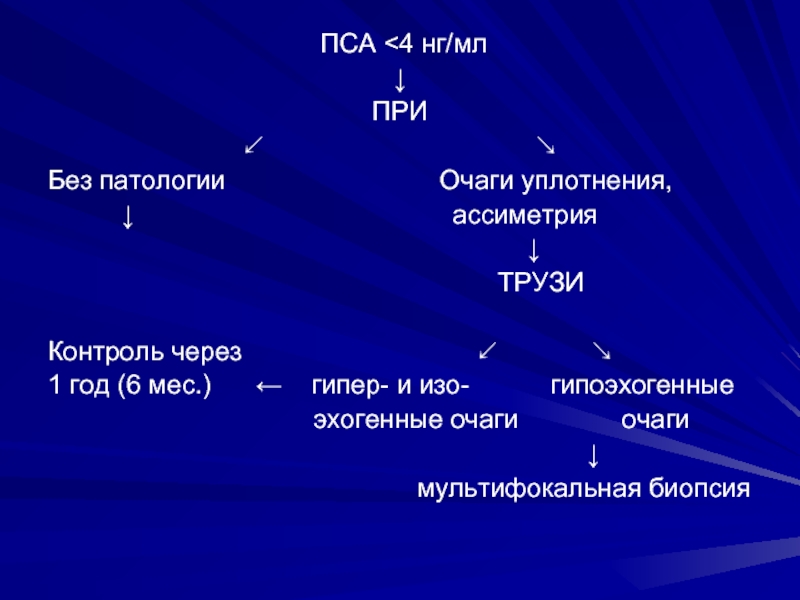
ПСА
↘
Без патологии Очаги уплотнения,
↓ ассиметрия
↓
ТРУЗИ
Контроль через ↙ ↘
1 год (6 мес.) ← гипер- и изо- гипоэхогенные
эхогенные очаги очаги
↓
мультифокальная биопсия
Без патологии Очаги уплотнения,
↓ ассиметрия
↓
ТРУЗИ
Контроль через ↙ ↘
1 год (6 мес.) ← гипер- и изо- гипоэхогенные
эхогенные очаги очаги
↓
мультифокальная биопсия
Слайд 30
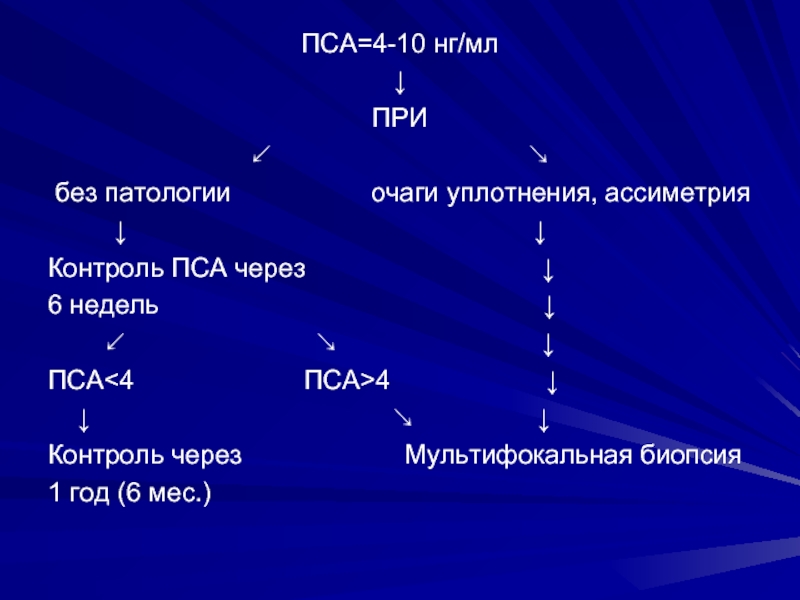
ПСА=4-10 нг/мл
↓
ПРИ
↙
↘
без патологии очаги уплотнения, ассиметрия
↓ ↓
Контроль ПСА через ↓
6 недель ↓
↙ ↘ ↓
ПСА<4 ПСА>4 ↓
↓ ↘ ↓
Контроль через Мультифокальная биопсия
1 год (6 мес.)
без патологии очаги уплотнения, ассиметрия
↓ ↓
Контроль ПСА через ↓
6 недель ↓
↙ ↘ ↓
ПСА<4 ПСА>4 ↓
↓ ↘ ↓
Контроль через Мультифокальная биопсия
1 год (6 мес.)