900igr.net
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Щелочноземельные металлы презентация
Содержание
- 1. Щелочноземельные металлы
- 2. Общая характеристика Be Mg Ca Sr Ba
- 3. Бериллий Бериллий сходствует с алюминием и магнием…Получил
- 4. Распространение в природе Берилл 3Be *
- 5. Получение В виде простого вещества бериллий получили
- 6. BeF2+Mg=Be+MgF2
- 7. Металл светло-серого цвета, покрытый тончайшей оксидной плёнкой
- 8. Химические свойства Обладая высокой химической активностью бериллий
- 9. Магний Магний был открыт при анализе воды
- 10. Поучение Впервые магний был получен в
- 11. Физические свойства Мягкий и пластичный
- 12. Распространение в природе Входит в состав
- 13. Химические свойства Горение на воздухе
- 14. Применение Mg Твёрдые и прочные сплавы с
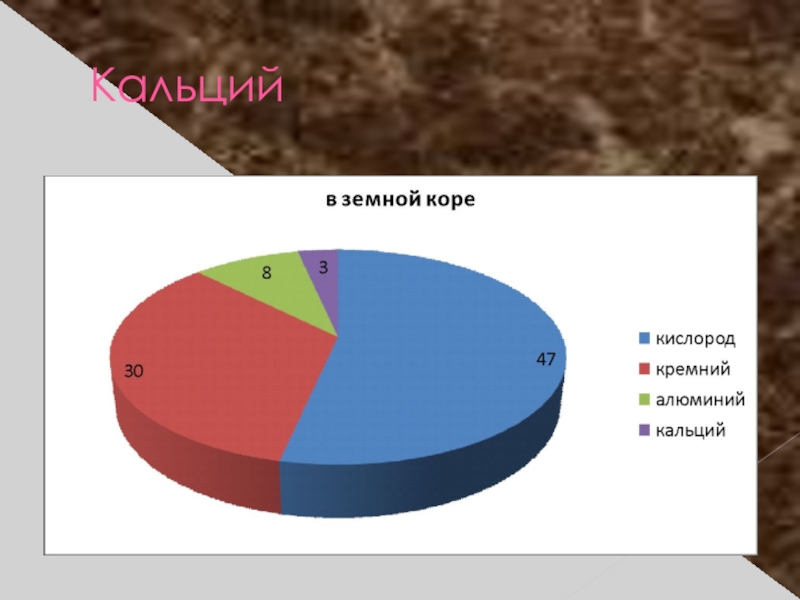
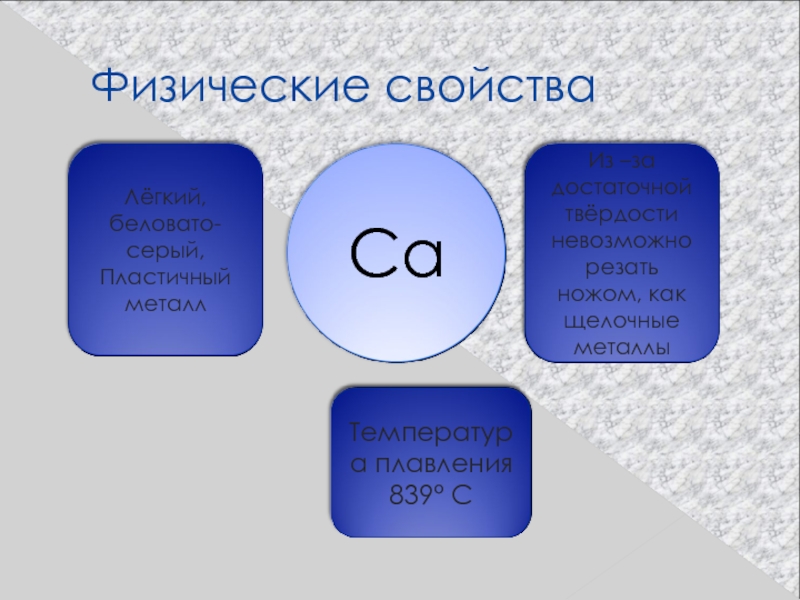
- 15. Кальций
- 16. Распространение в природе
- 17. Получение
- 18. Физические свойства
- 19. Химические свойства С простыми веществами Ca+H2=CaH2
- 20. Химические свойства Со сложными веществами Ca+2NH3=Ca(NH2)2 +H2 Ca+2H2O=Ca(OH)2+H2 Ca+2HCl=CaCl2+H2 любая кислота кроме азотной
- 21. Стронций и барий
- 22. Применение Соединения кальция, стронция и бария применяют
- 23. Спасибо за внимание Презентацию выполнила учитель химии Тихомирова И.Ю. МОУ лицей № 20 г.Кострома
Слайд 1Щелочноземельные металлы
Вторая группа главная подгруппа наряду с семейством щелочноземельных металлов включает
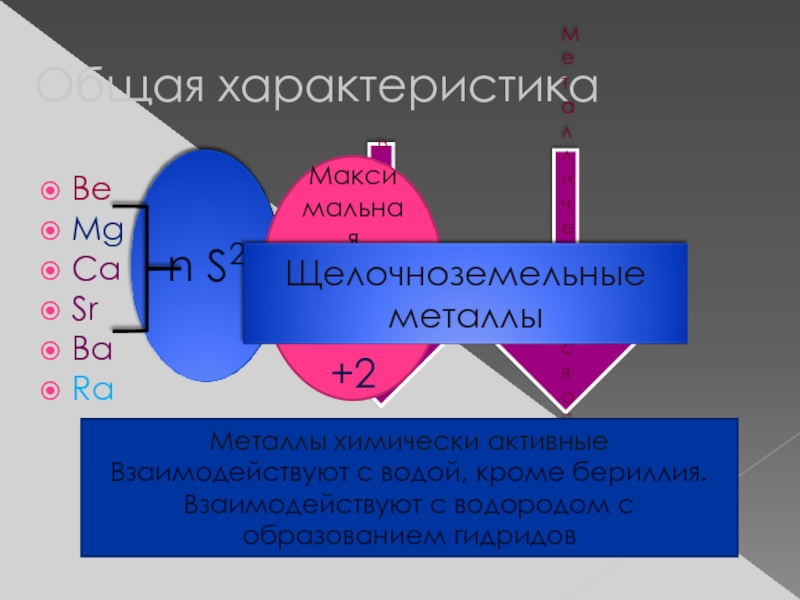
Слайд 2Общая характеристика
Be
Mg
Ca
Sr
Ba
Ra
Радиус атома
Металлические свойства
Максимальная степень окисления
+2
Металлы химически активные
Взаимодействуют с
Взаимодействуют с водородом с образованием гидридов
Слайд 3Бериллий
Бериллий сходствует с алюминием и магнием…Получил своё название потому, что находится
Слайд 4Распространение в природе
Берилл
3Be * Al2O3 *6SiO2
аквамарин
изумруд
«Изумруд капризный, как женщина
Встречается совсем
Благодаря насыщенному зелёному цвету и твёрдости очень популярен у ювелиров, чудесная окраска вызвана наличием ионов хрома или ванадия. Зелёный минерал образует кристаллы в форме шестигранных призм
Слайд 5Получение
В виде простого вещества бериллий получили в 1828году немецкий учёный Фридрих
BeCl2+2K=Be+2KCl
Слайд 6
BeF2+Mg=Be+MgF2
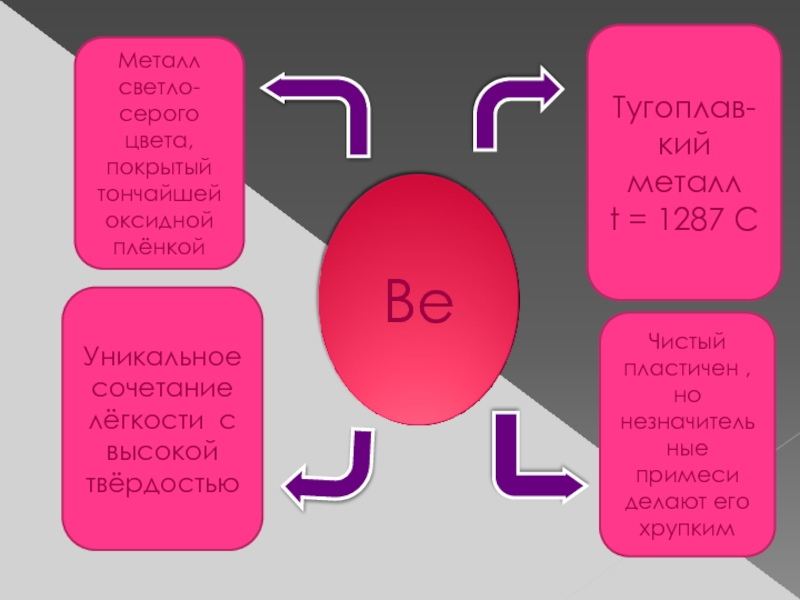
Слайд 7Металл светло-серого цвета, покрытый тончайшей оксидной плёнкой
Тугоплав-
кий металл
t = 1287 C
Уникальное
Чистый пластичен , но незначительные примеси делают его хрупким
Слайд 8Химические свойства
Обладая высокой химической активностью бериллий вступает в реакции с галогенами,
Be+2NaOH+2H2O= Na2 [ Be(OH)4 ] +H2
Слайд 9Магний
Магний был открыт при анализе воды из минерального источника вблизи города
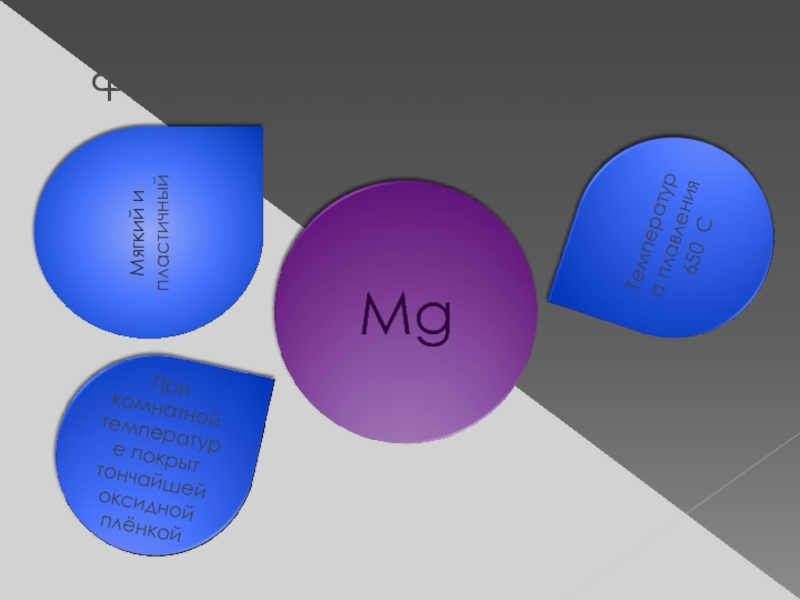
Слайд 10Поучение
Впервые магний был получен в 1808г Гемфри Деви при электролизе
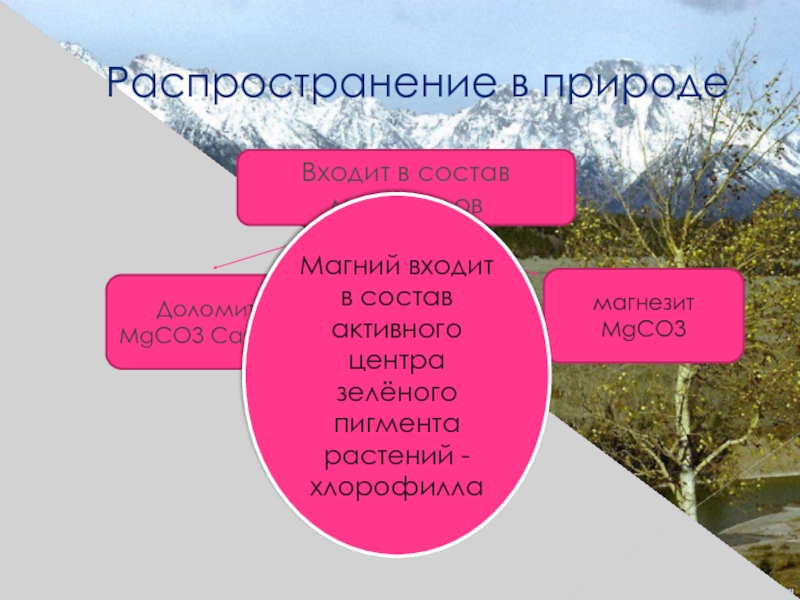
Слайд 12Распространение в природе
Входит в состав минералов
магнезит MgCO3
Доломит MgCO3 CaCO3
Магний входит
Слайд 13Химические свойства
Горение на воздухе
При комнатной температуре не взаимодействует с водой, лишь при кипячении Mg+2H2O=Mg(OH)2 +H2
Магний легко взаимодействует с разбавленными кислотами
Химически активен
Сильный восстанови-
тель
Слайд 14Применение
Mg
Твёрдые и прочные сплавы с алюминием магналий- 30% Mg
Электрон –включает цинк,
Автомобильная , авиационная и ракетная промышленность
В медицине
Оксид магния -для понижения кислотности желудка
Сульфат магния - слабительное
Слайд 20Химические свойства
Со сложными веществами
Ca+2NH3=Ca(NH2)2 +H2
Ca+2H2O=Ca(OH)2+H2
Ca+2HCl=CaCl2+H2 любая кислота кроме азотной
Слайд 22Применение
Соединения кальция, стронция и бария применяют в разных отраслях промышленности и
Соединения стронция(нитрат, карбонат ,хлорид, оксалат) используют в производстве осветительных ракет, химического и термически устойчивого стекла. Оксид стронция входит в состав эмалей для защиты металлических предметов.