- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Сера. Строение атома, аллотропия, свойства и применение серы. презентация
Содержание
- 1. Сера. Строение атома, аллотропия, свойства и применение серы.
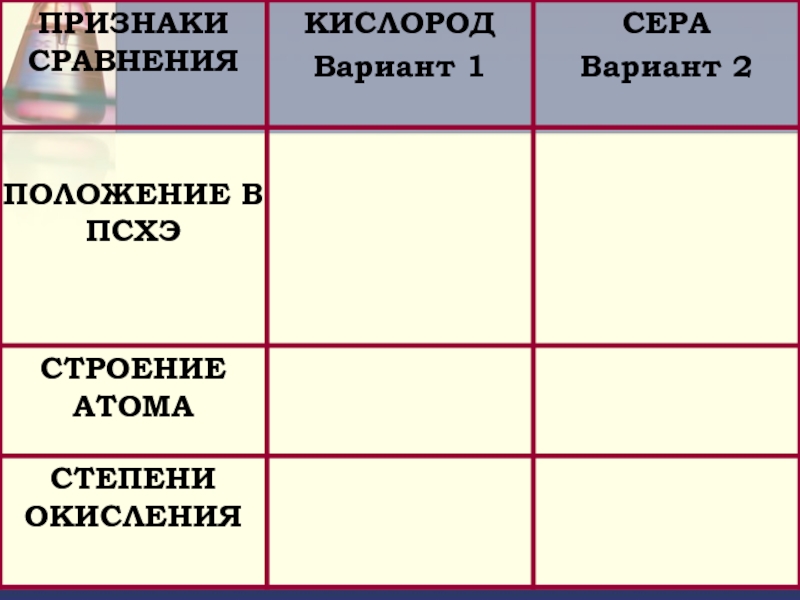
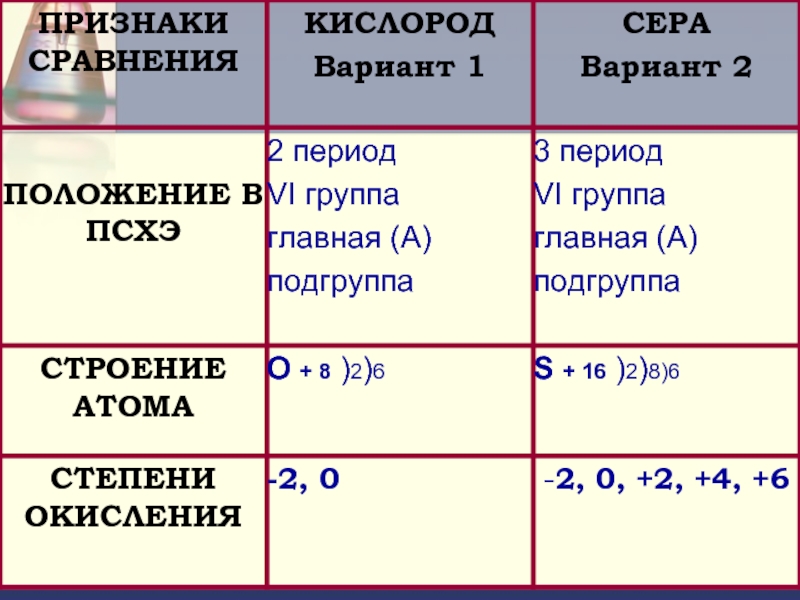
- 2. Цель: Определить положение серы в периодической системе
- 3. «В древней магии присутствую при рождении огня, называют серой издавна меня»
- 4. Сера. Строение атома, аллотропия, свойства и применение серы.
- 5. Положение серы в периодической системе химических элементов Д.И. Менделеева ?
- 8. Валентные состояния атома серы
- 9. Нахождение серы в природе Самородная сера Сульфатная
- 10. Физические свойства серы Твердое кристаллическое вещество желтого
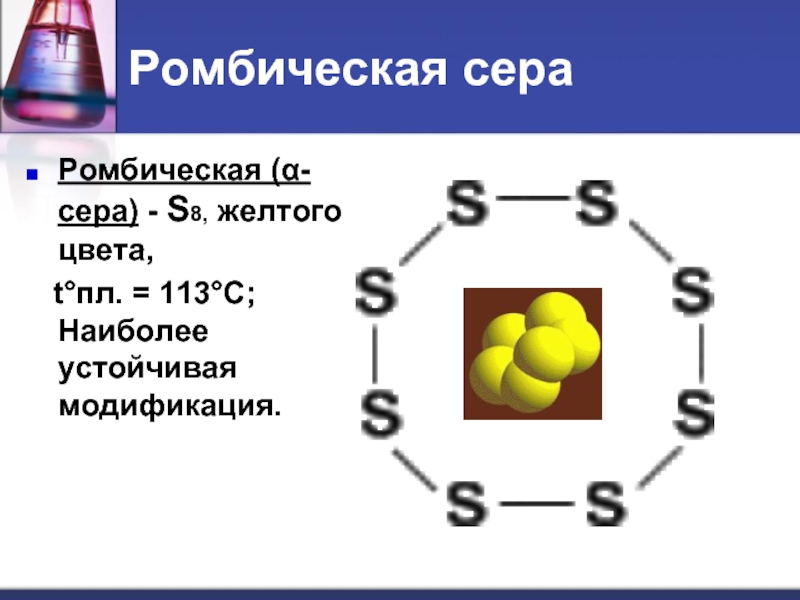
- 12. Ромбическая сера Ромбическая (α-сера) - S8,
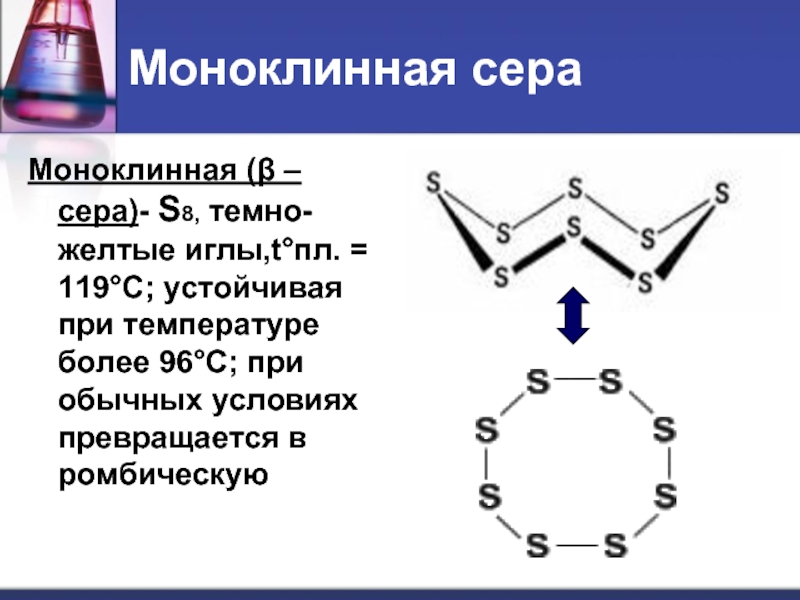
- 13. Моноклинная сера Моноклинная (β –сера)- S8,
- 14. Пластическая сера Пластическая сера- коричневая
- 15. Химические свойства серы Взаимодействие серы с
- 16. Применение серы Медицина Производство серной кислоты
- 17. ОТВЕТЬТЕ НА ВОПРОСЫ: Охарактеризуйте положение серы в периодической системе химических элементов Д.И. Менделеева.
- 18. Выберите правильный ответ: В каком соединении сера
- 19. ОТВЕТЬТЕ НА ВОПРОСЫ: В каком виде сера находится в природе?
- 20. ОТВЕТЬТЕ НА ВОПРОСЫ: Охарактеризуйте физические свойства серы.
- 21. Выберите правильный ответ: С каким веществом реагирует
- 22. Домашнее задание § 22, упр. 3
Слайд 1Сера. Строение атома, аллотропия, свойства и применение серы.
МБОУ «Новотинчуринская ООШ»
Учитель
Слайд 2Цель:
Определить положение серы в периодической системе химических элементов Д.И. Менделеева;
Рассмотреть строение
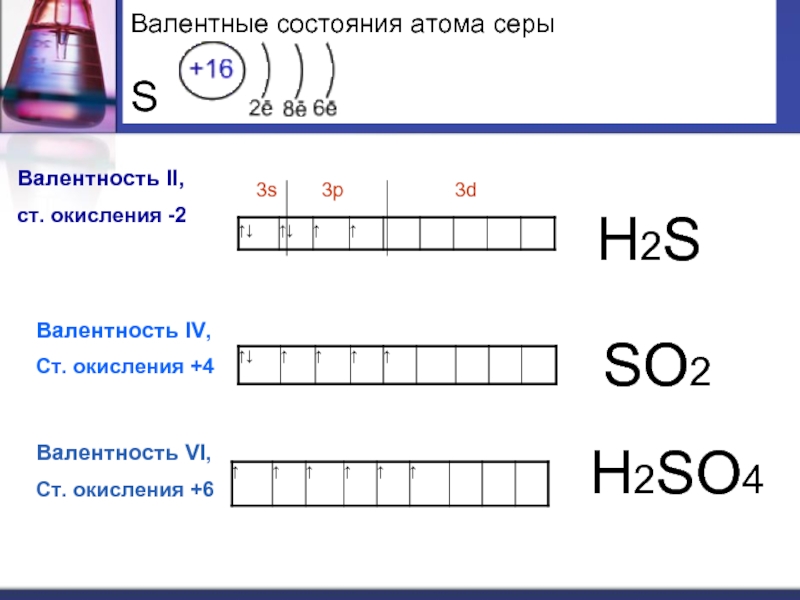
Слайд 8 Валентные состояния атома серы S
Валентность II,
ст. окисления -2
3s 3p 3d
Валентность IV,
Ст. окисления +4
Валентность VI,
Ст. окисления +6
Н2S
SО2
Н2SО4
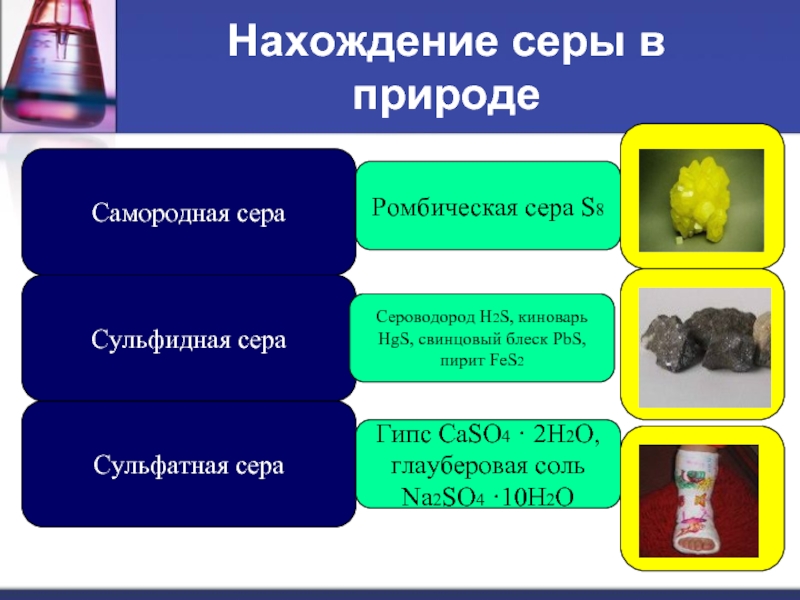
Слайд 9Нахождение серы в природе
Самородная сера
Сульфатная сера
Сульфидная сера
Ромбическая сера S8
Сероводород H2S, киноварь
Гипс CaSO4 · 2H2O, глауберовая соль Na2SO4 ·10H2O
Слайд 10Физические свойства серы
Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой
Слайд 12Ромбическая сера
Ромбическая (α-сера) - S8, желтого цвета,
t°пл. =
Слайд 13Моноклинная сера
Моноклинная (β –сера)- S8, темно-желтые иглы,t°пл. = 119°C; устойчивая
Слайд 14Пластическая сера
Пластическая сера- коричневая резиноподобная (аморфная) масса.
Она неустойчива и
превращается в ромбическую серу.
Слайд 15Химические свойства серы
Взаимодействие серы с простыми веществами
Сера реагирует:
А) с металлами,
Hg + S→ HgS
Б) с неметаллами (водородом, кислородом, фтором…)
1) H2 + S → H2S 2) S + O2 → SO2
Слайд 16Применение серы
Медицина
Производство
серной
кислоты
Сельское хозяйство
Производство спичек
Производство резины
Производство взрывчатых
веществ
Красители
Слайд 17ОТВЕТЬТЕ НА ВОПРОСЫ:
Охарактеризуйте положение серы в периодической системе химических элементов Д.И.
Слайд 18Выберите правильный ответ:
В каком соединении сера проявляет степень окисления +4?
А) H2S
Б)
В) H2SO4