- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Сера презентация
Содержание
- 1. Сера
- 2. История открытия Так как сера встречается в
- 3. Нахождение в природе Сера – относится к
- 4. Способы получения В лаборатории оксид серы (IV)
- 5. Общая характеристика Се́ра — элемент VI группы, главной подгруппы,
- 6. Общая характеристика Степени окисления серы: −2
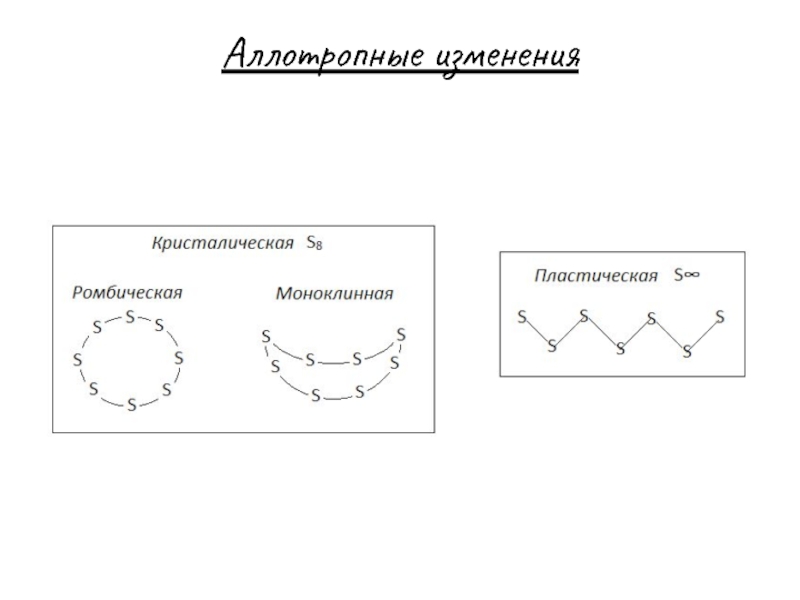
- 7. Аллотропные изменения
- 8. Физические свойства Сера – твердое кристаллическое вещество,
- 9. Химические свойства Взаимодействие с металлами. Сера проявляет
- 10. Соединения серы Самородная сера, серный
- 11. Применение серы Сера применяется в первую очередь
- 12. Источники: http://chemistry.narod.ru/ http://www.xumuk.ru/ http://ru.wikipedia.org/
Слайд 2История открытия
Так как сера встречается в природе в самородном состоянии, она
была известна человеку уже в глубокой древности. Большое внимание уделяли сере алхимики. Многим из них была уже известна серная кислота. Василий Валентин в XV в. подробно описал ее получение (нагреванием железного купороса). Фабричным способом серная кислота была получена впервые в Англии в середине XVIII в.
Слайд 3Нахождение в природе
Сера – относится к числу распространенных элементов: земная
кора содержит 0,047% серы по массе, Земля в целом – 0,7%.
Основные месторождения самородной серы: Мексика, Польша, США, Япония, Италия, в России – по берегам Волги.
В живой природе:
Входит в состав животных и растительных белков, витаминов, гормонов.
В живой природе:
Входит в состав животных и растительных белков, витаминов, гормонов.
Слайд 4Способы получения
В лаборатории оксид серы (IV) получают взаимодействием гидросульфита натрия с
серной кислотой: а также нагреванием меди с концентрированной серной кислотой: Оксид серы (IV) образуется также при сжигании серы.
В промышленных условиях SO2 получают при обжиге пирита FeS2 или сернистых руд цветных металлов (цинковой обманки ZnS, свинцового блеска PbS и др.). Образующийся в этих условиях оксид серы (IV) SO2 употребляется главным образом для получения оксида серы (VI) SO3 и серной кислоты. Структурная формула молекулы SO2
В промышленных условиях SO2 получают при обжиге пирита FeS2 или сернистых руд цветных металлов (цинковой обманки ZnS, свинцового блеска PbS и др.). Образующийся в этих условиях оксид серы (IV) SO2 употребляется главным образом для получения оксида серы (VI) SO3 и серной кислоты. Структурная формула молекулы SO2
Слайд 5Общая характеристика
Се́ра — элемент VI группы, главной подгруппы, третьего периода периодической системы химических элементов Д. И. Менделеева,
с атомным номером 16. Проявляет неметаллические свойства. Обозначается символом S (лат. Sulfur). В водородных и кислородных соединениях находится в составе различных ионов, образует многие кислоты и соли. Многие серосодержащие солималорастворимы в воде.
Атомная масса: 32,066
Электронная конфигурация: 3s2 3p4
Атомная масса: 32,066
Электронная конфигурация: 3s2 3p4
Слайд 6Общая характеристика
Степени окисления серы:
−2 (окислительные свойства); 0;
+2, +4, +6
(восстановительные свойства).
n=16
p+=16
ē=16
z=+16
1s22s22p63s23p4
S – 3 период, VI группа, главная подгруппа
S
Слайд 8Физические свойства
Сера – твердое кристаллическое вещество, не имеет запаха.
Не растворяется в
воде. Хорошо растворяется в сероуглероде.
Плохо проводит тепло и электричество. Она типичный диэлектрик (изолятор).
Плохо проводит тепло и электричество. Она типичный диэлектрик (изолятор).
Слайд 9Химические свойства
Взаимодействие с металлами. Сера проявляет окислительные свойства, в результате взаимодействия
образуются сульфиды: Cu + S = CuS.
Взаимодействие с водородом происходит при 150–200 °С: H2 + S = H2S.
Взаимодействие с кислородом. Сера горит в кислороде при 280 °С, на воздухе при 360 °С, при этом образуется смесь оксидов: S + O2 = SO2.
Взаимодействие с фосфором и углеродом. При нагревании без доступа воздуха сера реагирует с фосфором, углеродом, проявляя окислительные свойства: 2P + 3S = P2S3.
Взаимодействие с фтором. В присутствии сильных окислителей проявляет восстановительные свойства: S + 3F2 = SF6.
Взаимодействие со сложными веществами. При взаимодействии со сложными веществами сера ведет себя как восстановитель: S + 2HNO3 = 2NO + H2SO4.
Реакция диспропорционирования. Сера способна к реакциям диспропорционирования, при взаимодействии со щелочью образуются сульфиды и сульфиты: 3S + 6KOH = K2S+4 O3 + 2K2S-2 + 3H2O.
Взаимодействие с водородом происходит при 150–200 °С: H2 + S = H2S.
Взаимодействие с кислородом. Сера горит в кислороде при 280 °С, на воздухе при 360 °С, при этом образуется смесь оксидов: S + O2 = SO2.
Взаимодействие с фосфором и углеродом. При нагревании без доступа воздуха сера реагирует с фосфором, углеродом, проявляя окислительные свойства: 2P + 3S = P2S3.
Взаимодействие с фтором. В присутствии сильных окислителей проявляет восстановительные свойства: S + 3F2 = SF6.
Взаимодействие со сложными веществами. При взаимодействии со сложными веществами сера ведет себя как восстановитель: S + 2HNO3 = 2NO + H2SO4.
Реакция диспропорционирования. Сера способна к реакциям диспропорционирования, при взаимодействии со щелочью образуются сульфиды и сульфиты: 3S + 6KOH = K2S+4 O3 + 2K2S-2 + 3H2O.
Слайд 10Соединения серы
Самородная сера, серный колчедан FeS2, медный колчедан CuFeS2, свинцовый
блеск PbS с цинковой обманкой ZnS
Ангидрит CaSO4, гипс CaSO4∙2H2O и гипс пластинчатый
Слайд 11Применение серы
Сера применяется в первую очередь для получения серной кислоты; в
бумажной промышленности (для получения сульфитцеллюлозы); в сельском хозяйстве (для борьбы с болезнями растений, главным образом винограда и хлопчатника); в резиновой промышленности (вулканизующий агент); в производстве красителей и светящихся составов; для получения черного (охотничьего) пороха; в производстве спичек; в медицине.