НК, ПЦР, секвенирование ДНК».
Работу выполнила: Лаптиева А.Н
257 - ОМ
Астана 2011
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
презентация по микре 16 презентация
Содержание
- 1. презентация по микре 16
- 2. План: 1.Введение 2.Молекулярно-биологические методы: а)гибридизация НК, б)ПЦР, в)секвенирование ДНК 3.Список литературы
- 3. Бурное развитие науки
- 4. Полимеразная цепная реакция —
- 5. Ход выполнения. В пробирки «Эппендорф» вносят
- 6. Гибридизация нуклеиновых
- 7. Первоначальные
- 8. Автоматическое секвенирование (принцип)
- 9. 3.Список литературы: 1.Курашвили Л.В., Васильков В.Г.,
Слайд 1АО «Медицинский университет Астана»
Кафедра микробиологии и вирусологии
Презентация на тему:
«Молекулярно-биологические методы: гибридизация
Слайд 2План:
1.Введение
2.Молекулярно-биологические методы:
а)гибридизация НК,
б)ПЦР,
в)секвенирование ДНК
3.Список литературы
Слайд 3 Бурное развитие науки за последние несколько десятилетий
и исследования в области молекулярной биологии, медицинской генетики, биохимии, биофизики, тесно смыкающиеся с микробиологией, иммунологией, онкологией, эпидемиологией и т.д., привели к созданию и активному внедрению в практику диагностических лабораторий молекулярно-биологических методов исследований генома человека, животных, растений, бактерий и вирусов. Эти методы чаще всего называют ДНК-исследованиями.
Методы ДНК-исследований позволяют осуществлять раннюю и более полную диагностику различных заболеваний, своевременно проводить дифференциальную диагностику и осуществлять контроль эффективности терапии. Они незаменимы в пренатальной диагностике наследственных заболеваний, позволяют проводить геномную дактилоскопию по следам крови, спермы и других тканей (выявление личности, отцовства и др.). Дополнительные возможности открываются при использовании методов генодиагностики для определения совместимости тканей по HLA-типированию первого и второго классов, значительно превосходящие по своим возможностям HLA — серотипирование лейкоцитов доноров и реципиентов. Активное развитие методов ДНК-диагностики и внедрение их в практику позволяют предположить, что недалек тот момент, когда эти методы значительно сузят круг задач более традиционных диагностических исследований, какими являются методы цитогенетики, а может, и вытеснят их из практической медицины в научную сферу.
В настоящее время имеется два направления ДНК-диагностики: гибридизационный анализ нуклеиновых кислот и диагностика с использованием полимеразной цепной реакции.
Методы ДНК-исследований позволяют осуществлять раннюю и более полную диагностику различных заболеваний, своевременно проводить дифференциальную диагностику и осуществлять контроль эффективности терапии. Они незаменимы в пренатальной диагностике наследственных заболеваний, позволяют проводить геномную дактилоскопию по следам крови, спермы и других тканей (выявление личности, отцовства и др.). Дополнительные возможности открываются при использовании методов генодиагностики для определения совместимости тканей по HLA-типированию первого и второго классов, значительно превосходящие по своим возможностям HLA — серотипирование лейкоцитов доноров и реципиентов. Активное развитие методов ДНК-диагностики и внедрение их в практику позволяют предположить, что недалек тот момент, когда эти методы значительно сузят круг задач более традиционных диагностических исследований, какими являются методы цитогенетики, а может, и вытеснят их из практической медицины в научную сферу.
В настоящее время имеется два направления ДНК-диагностики: гибридизационный анализ нуклеиновых кислот и диагностика с использованием полимеразной цепной реакции.
Слайд 4 Полимеразная цепная реакция — это изящный метод, имитирующий
естественную репликацию ДНК и позволяющий обнаружить и многократно копировать с помощью термофильной ДНК-полимеразы определенный фрагмент ДНК.
Открытие метода полимеразной цепной реакции стало одним из наиболее выдающихся событий в области молекулярной биологии за последние 20 лет.
Впервые состав компонентов, входящих в реакционную смесь для постановки ПЦР, и основные принципы использования праймеров (коротких, искусственно синтезированных молекул ДНК) для получения копий ДНК были описаны Kleppe с соавт. в 1971 г. Однако не была подчеркнута основная особенность ПЦР — экспоненциальное увеличение количества копий фрагмента исходной ДНК.
Открытие метода полимеразной цепной реакции стало одним из наиболее выдающихся событий в области молекулярной биологии за последние 20 лет.
Впервые состав компонентов, входящих в реакционную смесь для постановки ПЦР, и основные принципы использования праймеров (коротких, искусственно синтезированных молекул ДНК) для получения копий ДНК были описаны Kleppe с соавт. в 1971 г. Однако не была подчеркнута основная особенность ПЦР — экспоненциальное увеличение количества копий фрагмента исходной ДНК.
Слайд 5
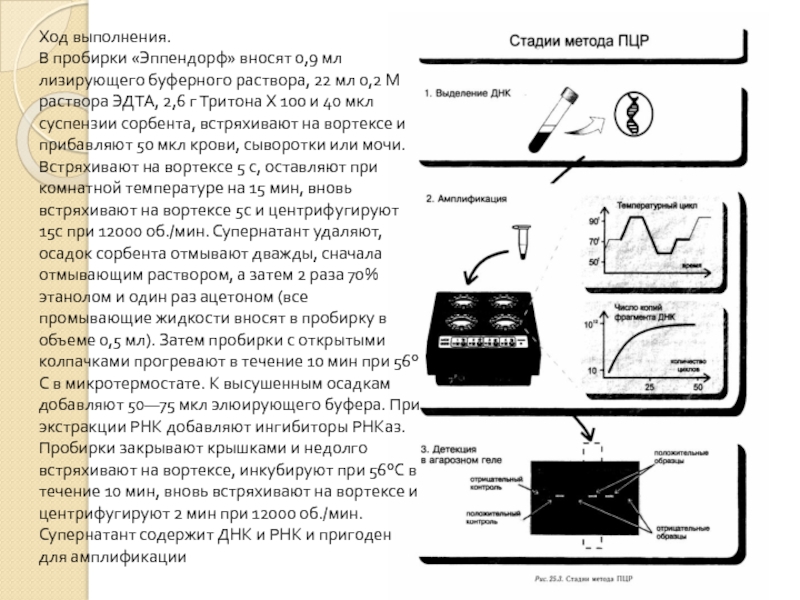
Ход выполнения.
В пробирки «Эппендорф» вносят 0,9 мл лизирующего буферного раствора, 22
мл 0,2 М раствора ЭДТА, 2,6 г Тритона X 100 и 40 мкл суспензии сорбента, встряхивают на вортексе и прибавляют 50 мкл крови, сыворотки или мочи. Встряхивают на вортексе 5 с, оставляют при комнатной температуре на 15 мин, вновь встряхивают на вортексе 5с и центрифугируют 15с при 12000 об./мин. Супернатант удаляют, осадок сорбента отмывают дважды, сначала отмывающим раствором, а затем 2 раза 70% этанолом и один раз ацетоном (все промывающие жидкости вносят в пробирку в объеме 0,5 мл). Затем пробирки с открытыми колпачками прогревают в течение 10 мин при 56°С в микротермостате. К высушенным осадкам добавляют 50—75 мкл элюирующего буфера. При экстракции РНК добавляют ингибиторы РНКаз. Пробирки закрывают крышками и недолго встряхивают на вортексе, инкубируют при 56°С в течение 10 мин, вновь встряхивают на вортексе и центрифугируют 2 мин при 12000 об./мин. Супернатант содержит ДНК и РНК и пригоден для амплификации
Слайд 6 Гибридизация нуклеиновых кислот. Принципы гибридизации нуклеиновых
кислот
Обычно последовательность-мишень является членом гетерогенной популяции разных нуклеиновых кислот. В качестве зондов могут использоваться как ДНК, так и РНК, а пометить их можно радиоактивными изотопами или нерадиоактивными молекулами-свидетелями, используя химические или ферментативные методы. ДНК-зонды обычно являются двухцепочечными молекулами и перед гибридизацией их необходимо денатурировать, например тепловым способом.
РНК-зонды — это, как правило, одноцепочечные молекулы и их денатурация в принципе необязательна, хотя и желательна, поскольку это приводит к разрушению вторичной структуры РНК и увеличению числа способных к гибридизации фрагментов. При гибридизации в растворе оптимальной для ренатурации нуклеиновых кислот является температура примерно на 25 С ниже температуры плавления (Тт) гибридной молекулы. Тт двухцепочечной молекулы (она определяется как температура, при которой денатурировано 50% молекул) зависит от GC-содержания дуплекса (в %), его длины (в п.н.), концентрации (в М) моновалентных катионов (например, Na+) и концентрации формамида (в %) в реакционной смеси.
Эту зависимость можно представить следующей эмпирической формулой:
Тт - 81,5 + 16,6 log М + 0,41 (% G + С) - 0,72 (% формамида) - 500/Размер (п.н.).
Данная формула дает лишь примерное значение Тт. Точную ее величину необходимо определять экспериментально, поскольку она зависит не только от количества остатков гуанина и цитозина, но и от их распределения в молекуле. Необходимо внести поправку и на образование неполностью комплементарных (несовершенных) гибридов: обычно при наличии 1 % неспаренных нуклеотидов Тт снижается на 0,5—1,5 С.
В зависимоти от жесткости условий, в которых проводятся гибридизация и отмывание препаратов после гибридизации, задается доля образующихся и сохраняющихся несовершенных гибридов. Гибридизацию обычно проводят в относительно мягких условиях (например, при температуре на 25 °С ниже Тт для полностью комплементарных гибридов), при которых могут образовываться гибриды между частично гомологичными последовательностями. Отмывают препараты в жестких условиях, обеспечивающих сохранение только более совершенных гибридов.
Обычно последовательность-мишень является членом гетерогенной популяции разных нуклеиновых кислот. В качестве зондов могут использоваться как ДНК, так и РНК, а пометить их можно радиоактивными изотопами или нерадиоактивными молекулами-свидетелями, используя химические или ферментативные методы. ДНК-зонды обычно являются двухцепочечными молекулами и перед гибридизацией их необходимо денатурировать, например тепловым способом.
РНК-зонды — это, как правило, одноцепочечные молекулы и их денатурация в принципе необязательна, хотя и желательна, поскольку это приводит к разрушению вторичной структуры РНК и увеличению числа способных к гибридизации фрагментов. При гибридизации в растворе оптимальной для ренатурации нуклеиновых кислот является температура примерно на 25 С ниже температуры плавления (Тт) гибридной молекулы. Тт двухцепочечной молекулы (она определяется как температура, при которой денатурировано 50% молекул) зависит от GC-содержания дуплекса (в %), его длины (в п.н.), концентрации (в М) моновалентных катионов (например, Na+) и концентрации формамида (в %) в реакционной смеси.
Эту зависимость можно представить следующей эмпирической формулой:
Тт - 81,5 + 16,6 log М + 0,41 (% G + С) - 0,72 (% формамида) - 500/Размер (п.н.).
Данная формула дает лишь примерное значение Тт. Точную ее величину необходимо определять экспериментально, поскольку она зависит не только от количества остатков гуанина и цитозина, но и от их распределения в молекуле. Необходимо внести поправку и на образование неполностью комплементарных (несовершенных) гибридов: обычно при наличии 1 % неспаренных нуклеотидов Тт снижается на 0,5—1,5 С.
В зависимоти от жесткости условий, в которых проводятся гибридизация и отмывание препаратов после гибридизации, задается доля образующихся и сохраняющихся несовершенных гибридов. Гибридизацию обычно проводят в относительно мягких условиях (например, при температуре на 25 °С ниже Тт для полностью комплементарных гибридов), при которых могут образовываться гибриды между частично гомологичными последовательностями. Отмывают препараты в жестких условиях, обеспечивающих сохранение только более совершенных гибридов.
Слайд 7
Первоначальные способы не автоматизированного секвенирования ДНК
В 1977 году Максам и Гилберт предложили совершенно иной, оригинальный метод решения проблемы секвенирования. Им удалось найти химическую реакцию, которая расщепляла молекулу ДНК по месту расположения одного определенного нуклеотида. Они помечали радиоактивной меткой первый нуклеотид исследуемого однонитевого (после денатурации) фрагмента ДНК, представленного, разумеется, огромным количеством копий. Затем проводили реакцию расщепления в таких условиях, что подавля-ющее большинство нитей ДНК разрывалось только в одном из множества мест, где стоял избранный нуклеотид (а все эти места равноправны). После этого продукты расщепления направлялись для анализа методом электрофореза в ПААГ. Ауторадиография геля выявляла следующую картину.
Отрезки ДНК всех возможных размеров, считая от начала молекулы до известного (подвергшегося химической атаке) нук-леотида, разделились и обнаружили себя полосами почернения рентгеновской пленки. Самые короткие отрезки (в 2, 3 и даже один первый нуклеотид) ушли в геле далеко вперед. Более длинные отрезки отстали тем сильнее, чем они были длиннее. Степень почернения полос оказалась разная, поскольку число молекул ДНК, разорвавшихся в каждом из возможных мест было случайным. Но при достаточном количестве исходного материала все они были хорошо видны. «Отрезанные» части молекул, напротив, ничем себя в геле не проявляли, так как не содержали меченого нуклеотида.
Отрезки ДНК всех возможных размеров, считая от начала молекулы до известного (подвергшегося химической атаке) нук-леотида, разделились и обнаружили себя полосами почернения рентгеновской пленки. Самые короткие отрезки (в 2, 3 и даже один первый нуклеотид) ушли в геле далеко вперед. Более длинные отрезки отстали тем сильнее, чем они были длиннее. Степень почернения полос оказалась разная, поскольку число молекул ДНК, разорвавшихся в каждом из возможных мест было случайным. Но при достаточном количестве исходного материала все они были хорошо видны. «Отрезанные» части молекул, напротив, ничем себя в геле не проявляли, так как не содержали меченого нуклеотида.
Слайд 8 Автоматическое секвенирование (принцип)
Переход к автоматическому секвенированию требовал в первую очередь проведения электрофореза всех четырех семейств отрезков ДНК в одном треке. Как уже отмечалось, установление относительного расположения четырех полос, расположенных в разных треках и отличающихся по длине всего на один нуклеотид, затруднительно..
Между тем в обоих методах переход к электрофорезу в одном треке с использованием радиоактивной метки невозможен. Для идентификации значения каждой полосы потребовалось бы четыре различных радиоактивных изотопа. Допустим, что это были бы доступные для биологических применений ^^ 14C, ^S и 32?. Различие этих изотопов может проявить себя только в степени почернения рентгеновской пленки. Но, во-первых, энергия р-излучения двух из этих изотопов (^С и ^S) почти одинаковы, а, во-вторых, степень почернения будет зависеть еще от одного, вовсе неизвестного фактора -- количества отрезков ДНК, оказавшихся случайно одинаковыми по длине и потому суммирующих свое излучение в одной полосе. (Не забудем, что исходно для секвенирования мы имеем не один, а великое множество одинаковых фрагментов ДНК, независимо друг от друга копируемых в условиях случайных обрывов этого процесса.)
Разрешение проблемы было найдено использованием для идентификации полос в геле флюоресценции вместо радиоактивности. На основе дихлорородамина были разработаны четыре флюоресцентных красителя разных цветов, с максимами излучения при 544, 569, 597 и 622 тц, лежащими в зеленой, желто-зеленой, оранжевой и красной областях спектра и легко разделимыми в спектрофотометре. Авторам удалось связать эти красители с четырьмя дидезоксирибонуклетидами. Таким образом при лазерном облучении геля каждая полоса в методе Сенджера при электрофорезе в одном треке заявляла о своей специфичности соответствующим цветом излучения.
Разумеется, каждая полоса в геле, в силу своей конечной ширины и некой кривой распределения вещества по этой ширине, испускала свет флюоресценции тоже в виде некоего колоколообразного пика интенсивности света, растянутого в направлении электрофореза. В нижних своих частях эти пики могли перекрываться (как перекрывались своими границами и соответствующие полосы в геле). Но вершины пиков хорошо отделялись друг от друга, и это позволяло прямо по этим вершинам определять порядковый номер каждого нуклеотида. А его индивидуальность -- по цвету пика.
Между тем в обоих методах переход к электрофорезу в одном треке с использованием радиоактивной метки невозможен. Для идентификации значения каждой полосы потребовалось бы четыре различных радиоактивных изотопа. Допустим, что это были бы доступные для биологических применений ^^ 14C, ^S и 32?. Различие этих изотопов может проявить себя только в степени почернения рентгеновской пленки. Но, во-первых, энергия р-излучения двух из этих изотопов (^С и ^S) почти одинаковы, а, во-вторых, степень почернения будет зависеть еще от одного, вовсе неизвестного фактора -- количества отрезков ДНК, оказавшихся случайно одинаковыми по длине и потому суммирующих свое излучение в одной полосе. (Не забудем, что исходно для секвенирования мы имеем не один, а великое множество одинаковых фрагментов ДНК, независимо друг от друга копируемых в условиях случайных обрывов этого процесса.)
Разрешение проблемы было найдено использованием для идентификации полос в геле флюоресценции вместо радиоактивности. На основе дихлорородамина были разработаны четыре флюоресцентных красителя разных цветов, с максимами излучения при 544, 569, 597 и 622 тц, лежащими в зеленой, желто-зеленой, оранжевой и красной областях спектра и легко разделимыми в спектрофотометре. Авторам удалось связать эти красители с четырьмя дидезоксирибонуклетидами. Таким образом при лазерном облучении геля каждая полоса в методе Сенджера при электрофорезе в одном треке заявляла о своей специфичности соответствующим цветом излучения.
Разумеется, каждая полоса в геле, в силу своей конечной ширины и некой кривой распределения вещества по этой ширине, испускала свет флюоресценции тоже в виде некоего колоколообразного пика интенсивности света, растянутого в направлении электрофореза. В нижних своих частях эти пики могли перекрываться (как перекрывались своими границами и соответствующие полосы в геле). Но вершины пиков хорошо отделялись друг от друга, и это позволяло прямо по этим вершинам определять порядковый номер каждого нуклеотида. А его индивидуальность -- по цвету пика.
Слайд 93.Список литературы:
1.Курашвили Л.В., Васильков В.Г., Келина Н.Ю. Функция печени и
состояние липидного обмена у больных до и после оперативного вмешательства на желудочно-кишечном тракте. //Анестезиология и реаниматология. - 1996. - N 3. - С.21-25.
2.Курашвили Л.В., Васильков В.Г., Келина Н.Ю. Состояние метаболизма и гемодинамики печени у больных с хирургической абдоминальной патологией в процессе интенсивной терапии. - IX Европейский конгресс. - 1996. - Глазго.
2.Курашвили Л.В., Васильков В.Г., Келина Н.Ю. Состояние метаболизма и гемодинамики печени у больных с хирургической абдоминальной патологией в процессе интенсивной терапии. - IX Европейский конгресс. - 1996. - Глазго.