- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Презентация открытогоурока химии в 8 классе на тему: Простые вещества – неметаллы. Аллотропия учителя химии и биологии МАОУ Средняя общеобразовательная школа №1 Тихоновой Натальи Сергеевны. презентация
Содержание
- 1. Презентация открытогоурока химии в 8 классе на тему: Простые вещества – неметаллы. Аллотропия учителя химии и биологии МАОУ Средняя общеобразовательная школа №1 Тихоновой Натальи Сергеевны.
- 2. Тема урока: «Простые вещества – неметаллы. Аллотропия»
- 3. Цели урока: Получить представление о простых веществах
- 4. Проверка домашнего задания. 1. Где в периодической системе находятся элементы, соответствующие простым веществам металлам?
- 5. 2. Каковы общие физические свойства металлов?
- 6. 3. По каким физическим свойствам различаются металлы?
- 7. 4. Какое из веществ названных в приведённом
- 8. Изучение новой темы. «Простые вещества – неметаллы. Аллотропия»
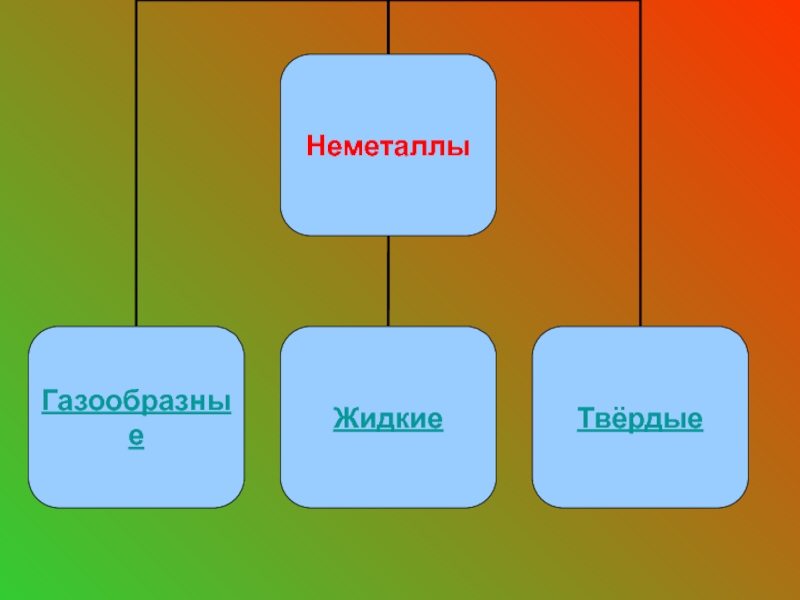
- 9. Неметаллы - это химические элементы, которые образуют
- 10. Периодическая система химических элементов Д.И. Менделеева
- 12. Газообразные вещества неметаллы: О2 -
- 13. N2 Cl2 F2 В начало
- 14. благородные газы: He - Ne -
- 15. Строение внешнего электронного слоя атомов гелия и
- 16. Применение гелия, неона и аргона.
- 17. Единственное жидкое вещество - Br2.
- 18. Твердые вещества: S – P
- 19. Аллотропия – способность атомов одного химического элемента
- 20. Аллотропия кислорода. Кислород и озон
- 21. Модификации кислорода. О2- кислород; бесцветный газ; не
- 22. Аллотропия фосфора. Красный и белый фосфор Р
- 23. Аллотропия углерода. Графит Алмаз
- 24. Аллотропия серы. Кристаллическая, пластическая и моноклинная
- 25. Пограничное положение между металлами и неметаллами. Белое олово металл Серое олово неметалл
- 26. Почему химически неверно поэтическое выражение: «В воздухе пахло грозой»?
- 27. Экспедиция полярного исследователя Р. Скотта к Южному
- 28. Какой тип химической связи должен быть в металлическом водороде?
- 29. Выполните задание. 1 вариант О2 – кислород,
- 30. Проверь ответы. 1 вариант О2 – кислород,
- 31. Критерии оценок 8 правильных ответов – «5»;
- 32. Спасибо за внимание!
Слайд 1Презентация открытого урока химии в 8 классе на тему: «Простые вещества –
Слайд 3Цели урока:
Получить представление о простых веществах – неметаллах;
Познакомиться с общими физическими
Научиться определять принадлежность веществ к неметаллам;
Слайд 4Проверка домашнего задания.
1. Где в периодической системе находятся элементы, соответствующие простым
Слайд 74. Какое из веществ названных в приведённом ниже стихотворении, не относится
Семь металлов создал Свет
По числу семи планет:
Медь, железо, серебро…
Дал нам Космос на добро.
Злато, олово, свинец…
Сын мой, сера - их отец.
А ещё ты должен знать:
Всем им ртуть – родная мать.
Слайд 9Неметаллы - это химические элементы, которые образуют в свободном виде простые
Слайд 14благородные газы:
He -
Ne -
Ar -
Kr -
Xe -
Rn -
Инертные газы
Каждая молекула
Покажите как распределяются электроны в атомах гелия и неона.
Слайд 19Аллотропия – способность атомов одного химического элемента образовывать несколько простых веществ.
Причины
Различное число атомов в молекуле;
Образование различных кристаллических форм.
Слайд 21Модификации кислорода.
О2- кислород;
бесцветный газ;
не имеет запаха;
плохо растворим в воде;
температура кипения-182,9 С;
устойчивая
О3 – озон;
газ голубого цвета;
имеет резкий запах;
растворяется в 10 раз лучше, чем кислород;
температура кипения -111,9 С;
не устойчивая молекула.
Слайд 27Экспедиция полярного исследователя Р. Скотта к Южному полюсу в 1912 году
Слайд 29Выполните задание.
1 вариант
О2 – кислород, газ;
Р4 –
I2 –
Si –
бетта Sn
He –
H2 –
F2 -
2 вариант
О3 –озон, газ;
P –
C –
альфа Sn –
Ne –
N2 –
Cl2 –
Br2 –
Слайд 30Проверь ответы.
1 вариант
О2 – кислород, газ;
Р4 – белый фосфор,твёрдый;
I2 – йод,
Si – кремний, твердый
бетта Sn – белое олово, металл, твёрдое;
He – гелий, благородный газ;
H2 – водород, газ;
F2 – фтор, газ.
2 вариант
О3 –озон, газ;
P – красный фосфор, твёрдый;
C – углерод, твёрдый;
альфа Sn – серое олово, неметалл, порошок;
Ne – неон,благородный газ;
N2 – азот, газ;
Cl2 – хлор, газ;
Br2 – бром, жидкость.
Слайд 31Критерии оценок
8 правильных ответов – «5»;
7,6 првильных ответов – «4»;
5,4 правильных
Менее 4 правильных ответов – «2»;