- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Пострегистрационные исследования безопасности лекарственных средств презентация
Содержание
- 1. Пострегистрационные исследования безопасности лекарственных средств
- 2. Качества идеального лекарства Улучшает самочувствие
- 3. «Нет безопасных лекарств, все лекарственные средства
- 4. Содержание Источники информации о безопасности лекарственных
- 5. Источники информации о безопасности лекарственных средств
- 6. Клинические Исследования золотой стандарт для
- 7. Ограничения исследований I – III фаз
- 8. Сбор информации по безопасности после
- 9. Все пациенты разные
- 10. Недостатки спонтанных сообщений недостаточное число сообщений
- 11. Пострегистрационные исследования (1) Исследования, проводимые компаниями производителями,
- 12. Пострегистрационные исследования (2) Популяция пациентов ограничивается только
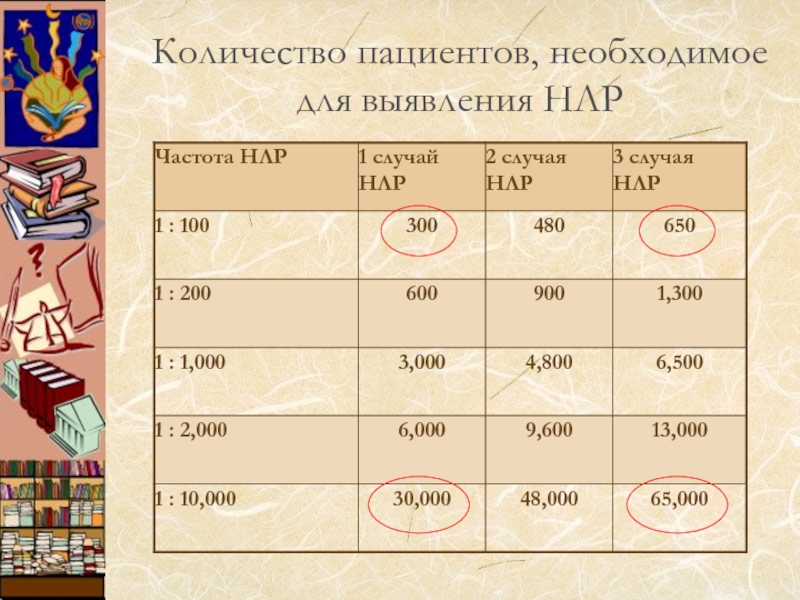
- 13. Количество пациентов, необходимое для выявления НЛР
- 14. Пострегистрационные исследования (3) В большинство исследований включается
- 15. Пострегистрационные исследования (4) Клинические исследования IV фазы,
- 16. Исследование-наблюдение (non-interventional trial): The EU
- 17. Директива по планированию и проведению «Клинических исследований
- 18. Проведение исследований наблюдений в Европейских странах
- 19. Фармакобезопасность в пострегистрационных исследованиях Исследования определенного лекарственного
- 20. Фармакобезопасность в пострегистрационных исследованиях (2) Исследования, в
- 21. Фармакобезопасность в пострегистрационных исследованиях (3) Исследования, в
- 22. Трудности в сборе информации по безопасности в
- 23. Окончательный тест безопасности лекарственного средства – его
- 24. Ответственность компаний производителей Разработка исследований, которые обеспечат
- 25. Спасибо за внимание!
Слайд 1Пострегистрационные исследования безопасности лекарственных средств
Ольга Ермишина, 16 мая 2006
Слайд 2Качества идеального лекарства
Улучшает самочувствие
Увеличивает продолжительность жизни
Не имеет Побочных
Экономит средства
Усиливает потенцию
Увеличивает озоновый слой
Слайд 3
«Нет безопасных лекарств, все лекарственные средства имеют токсические эффекты, которые должны
Слайд 4Содержание
Источники информации о безопасности лекарственных средств
Недостатки и преимущества
клинических исследований I-III
спонтанных сообщений,
пострегистрационных исследований
Особенности сбора информации по безопасности в пострегистрационных исследованиях
Слайд 5Источники информации о безопасности лекарственных средств
Токсикологические и фармакологические исследования на
Клиническая фармакология
Клинические исследования I-III фаз
Пострегистрационные исследования
Спонтанные сообщения от врачей, пациентов, органов здравоохранения
Слайд 6Клинические Исследования
золотой стандарт для оценки эффективности лекарственного средства
предварительная
Слайд 7Ограничения исследований
I – III фаз
высокоселективные популяции пациентов
(критерии включения, исключения)
(среднее количество пациентов, формирующее базу данных по безопасности нового лекарства – 1,528)
ограниченная длительность воздействия препарата,
(максимальная длительность наблюдения – 6 мес)
искусственно созданная ситуация
(напр. ограничения в сопутствующей терапии)
Слайд 8
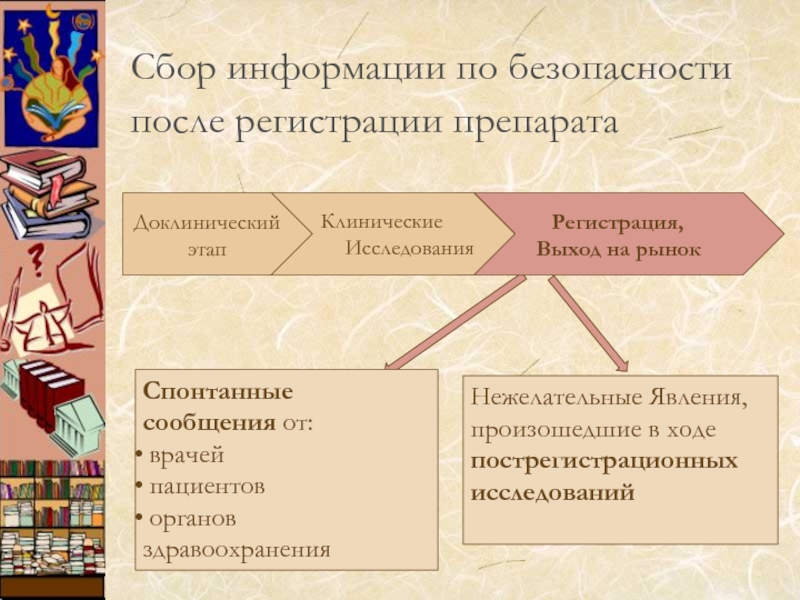
Сбор информации по безопасности после регистрации препарата
Спонтанные сообщения от:
врачей
органов здравоохранения
Нежелательные Явления,
произошедшие в ходе
пострегистрационных
исследований
Слайд 10Недостатки спонтанных сообщений
недостаточное число сообщений
трудности решения вопроса о причинной
плохое качество сообщений с недостаточным количеством данных
трудности в сравнении лекарственных субстанций
отсутствие описаний лекарственных взаимодействий
Слайд 11Пострегистрационные исследования (1)
Исследования, проводимые компаниями производителями, целью которых является дополнительный сбор
Слайд 12Пострегистрационные исследования (2)
Популяция пациентов ограничивается только противопоказаниями
(инструкция по применению препаратов)
Ознакомление
Играют важную роль в дальнейшем понимании профиля безопасности лекарственных средств
Слайд 14Пострегистрационные исследования (3)
В большинство исследований включается от 500 до 30,000 пациентов,
Планируются и проводятся локально в определенной стране
В общую базу данных по безопасности поступает достаточное количество случаев для анализа редких и очень редких НЛР.
Слайд 15Пострегистрационные исследования (4)
Клинические исследования IV фазы, проводящиеся согласно принципам GCP
Исследования наблюдения
(non-interventional trials)
Когортные исследования наблюдения – нацеленные на определенные лекарственные средства
Регистры – нацеленные на определенные показания к применению препаратов или на определенную патологию
Слайд 16Исследование-наблюдение
(non-interventional trial):
The EU Clinical Trials Directive (2001/20/ЕС)
Исследование, в котором:
препарат
назначение препарата четко отделено от решения включить пациента в исследование
пациенту не назначаются дополнительные методы обследования
✗
Слайд 17Директива по планированию и проведению «Клинических исследований медицинских продуктов, включая многоцентровые
Область действия Директивы
The EU Clinical Trials Directive (2001/20/ЕС)
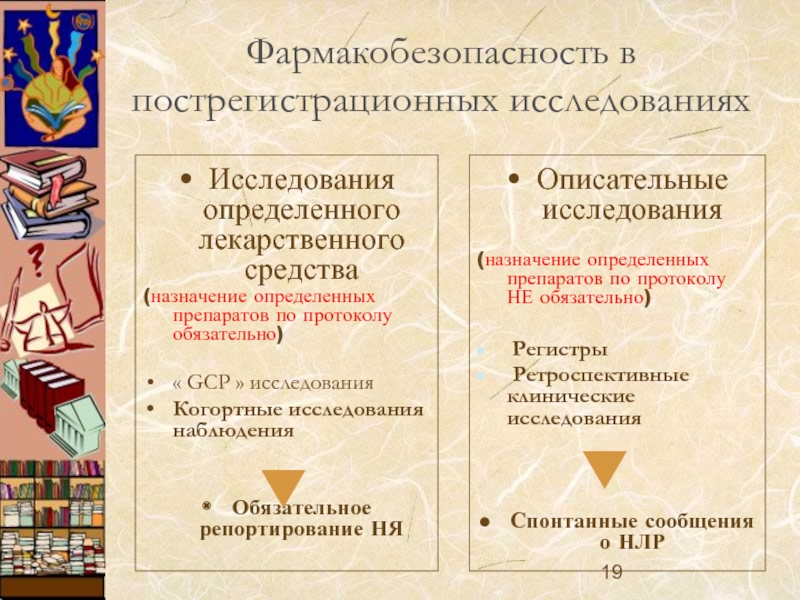
Слайд 19Фармакобезопасность в пострегистрационных исследованиях
Исследования определенного лекарственного средства
(назначение определенных препаратов по протоколу
« GCP » исследования
Когортные исследования наблюдения
Обязательное репортирование НЯ
Описательные исследования
(назначение определенных препаратов по протоколу НЕ обязательно)
Регистры
Ретроспективные клинические исследования
Спонтанные сообщения о НЛР
Слайд 20Фармакобезопасность в пострегистрационных исследованиях (2)
Исследования, в которых назначение определенных препаратов по
ИРК обязательно должна
содержать
форму сообщения о НЯ и
форму сообщения о СНЯ
Репортирование НЯ по правилам GCP
Слайд 21Фармакобезопасность в пострегистрационных исследованиях (3)
Исследования, в которых назначение определенных препаратов по
ИРК не содержит форм сообщения о НЯ и СНЯ
Исследователь должен сообщать о подозреваемой НЛР
компании производителю
(Форма НЛР, разработанная компанией),
в Российские органы здравоохранения
(«… разработана и утверждена Минздравом России специальная форма-извещение, которая … должна быть … направлена в Научный Центр экспертизы и государственного контроля лекарственных средств Минздрава России»
Письмо 291-22/91 от 26 июля 2001 г.)
Слайд 22Трудности в сборе информации по безопасности в пострегистрационных исследованиях наблюдениях на
Отсутствие локальных директив по планированию и проведению таких исследований
Не знание и не заинтересованность Исследователей в передаче информации по безопасности
Пациенты зачастую консультируются одновременно у нескольких врачей, назначают себе препараты самостоятельно
Слайд 23Окончательный тест безопасности лекарственного средства – его выход на лекарственный рынок
Пострегистрационные
позволяют разработать более управляемый и продуманный подход для получения информации по безопасности на широкой популяции
способствуют выявлению редких и отсроченных НЛР